HPLC法测定乳饮料中纽甜含量的研究
2017-04-11郭跃平石梦迪徐广伟韦何雯董晓尉
郭跃平,石梦迪,徐广伟,韦何雯,董晓尉
(金华市食品药品检验检测研究院,浙江金华321000)
HPLC法测定乳饮料中纽甜含量的研究
郭跃平,石梦迪,徐广伟,韦何雯,董晓尉
(金华市食品药品检验检测研究院,浙江金华321000)
建立快速、准确测定乳饮料中纽甜含量的高效液相色谱检测方法。样品以20%乙腈水溶液为提取液,硫酸锌和亚铁氰化钾为沉淀剂进行前处理,采用ZORBAXSB-C18(250mm×4.6mm,5μm)色谱柱,200 nm检测波长,磷酸氢二铵(0.020mol/L,pH 3.5~4):乙腈=(70∶30)为流动相进行等度洗脱分离。纽甜在0.2μg/m L~50.0μg/mL范围内线性良好,在0.8mg/kg~5.0mg/kg加标范围内,回收率为90.1%~96.1%,RSD值为1.7%~2.1%,最低定量限为0.30mg/kg。
高效液相色谱法;乳饮料;纽甜
纽甜是一种新型功能性甜味剂,系阿斯巴甜的衍生物[1],甜度约为蔗糖的8 000倍~13 000倍[2],蔗糖的40倍以上,是一种强力甜味剂,甜味纯正,甜味协和,稳定性好,价格低廉,纽甜作为甜味调节剂广泛应用于乳饮料、糕点、调味品等各类食品中。研究表明,过量食用甜味剂会对人体健康造成危害,因此国家食品添加剂使用标准也对其作出了严格规定[3]。
当前食品中纽甜的检测方法主要有高效液相色谱法、高液液相色谱串联质谱联用法等分析方法[4-5]。目前国标方法[6]通过提取、固相萃取等前处理过程对样品进行净化,再利用高效液相色谱进行梯度洗脱,能够获得较好的分离度,但由于过程复杂、操作繁琐,并且仪器分析时间长,不利于日常检测。乳饮料中含有较多的蛋白质等大分子成分,如前处理过程去除不充分,不但会影响色谱分离度,而且极易堵塞色谱柱,缩短色谱柱的寿命。本试验参考相关研究[7-10],在样品前处理过程中加入硫酸锌和亚铁氰化钾作为沉淀剂,有效地去除了样品中蛋白等杂质,并建立了一种采用等度洗脱的高效液相色谱法测定乳饮料中的纽甜含量,该法操作简单、快速、重复性好、回收率高。
1材料与方法
1.1样品
从超市中购买不同厂家的乳饮料样品,共计样品数量20份。
1.2主要试剂
纽甜标准品(质量分数≥98.0%)、甲醇(色谱纯)、乙腈(色谱纯):购自上海安谱科学仪器有限公司;磷酸氢二铵(分析纯)、硫酸锌(分析纯)、亚铁氰化钾(分析纯):购自国药集团化学试剂有限公司。
1.3主要仪器与设备
1200高效液相色谱仪:美国Agilent公司;KH-600DB型超声波清洗器:昆山禾创超声仪器有限公司;Direct-Q5UV超纯水机:美国密理博公司。
1.4方法
1.4.1色谱条件
检测波长:200 nm;色谱柱:Agilent ZORBAX SBC18(250mm×4.6mm,5μm);流速:1.0mL/min;进样量:50μL;柱温:30℃;流动相为A(0.020mol/L磷酸氢二铵,pH 3.5~4):B(乙腈)=(70∶30)。
1.4.2样品前处理方法
称取10 g乳饮料样品(精确至0.001 g)于100mL容量瓶中,加入5mL硫酸锌溶液(240 g/L)和5mL亚铁氰化钾溶液(106 g/L),再加入20%乙腈水溶液并定容至刻度,充分混匀,振荡3min,放入超声波清洗器中超声40min,后经滤纸过滤,滤液再经0.45μm滤膜过滤,供高效液相色谱检测。
2结果与分析
2.1色谱条件的优化
2.1.1检测波长的选择
利用二极管阵列检测器(DAD)对纽甜标准品溶液在波长190 nm~400 nm范围内进行扫描,结果显示,纽甜在的最大吸收值在195 nm~205 nm之间,因此本研究选择200 nm作为检测波长,纽甜光谱扫描图见图1。

图1 纽甜紫外可见分光光谱图Fig.1 Absorption spectrum of neotame
2.1.2流动相及洗脱条件的选择
本文对不同的流动相体系进行了研究,乙腈-离子对试剂缓冲液(辛烷磺酸钠)、甲醇-乙酸铵(0.020mol/L)、乙腈-磷酸氢二钠(0.020mol/L)、乙腈-磷酸氢二铵(0.020mol/L),结果表明乙腈-磷酸氢二铵(0.020mol/L)具有较好的分离效果,能满足检测要求。
将乙腈与磷酸氢二铵(0.020mol/L)在不同体积比的条件下对纽甜标准品进行等度洗脱(检测波长200nm,柱温箱30℃),纽甜在各自体系中的保留时间见表1。
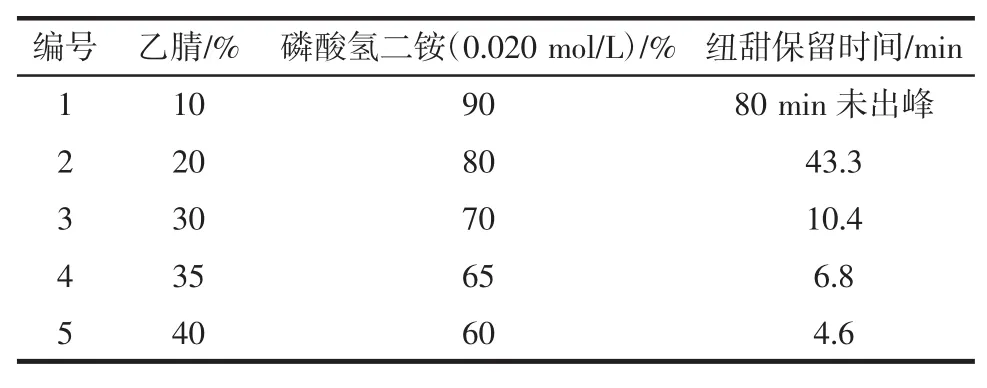
表1 流动相中乙腈与磷酸氢二铵不同比例下的纽甜保留时间Table1 Retention timeof neotame in them obilephasew ith different proportion of acetonitrileand diammonium hydrogen phosphate
从表1可以看出,乙腈与磷酸氢二铵(0.020mol/L)的体积比为10∶90时,纽甜标准品在80min内都未出峰,体积比为20∶80时,纽甜的出峰时间为43.3min,效率比较低,当体积比为30∶70、35∶65和40∶60时,出峰时间分别为10.4、6.8、4.6min。出峰时间过快,易造成分离度不好,影响纽甜的出峰,因此选择乙腈与磷酸氢二铵(0.020mol/L)的体积比为30∶70。
2.1.3色谱条件的确定
通过试验,确定色谱条件:检测波长200 nm,进样体积50μL,柱温30℃,流动相为乙腈与磷酸氢二铵(0.020mol/L)(体积比为30∶70),流速1mL/min。在此色谱条件下,纽甜标准品的色谱图如图2。

图2 纽甜标准溶液色谱图Fig.2 Chrom atogram of neotame standard solution
2.2样品前处理方法的优化
2.2.1沉淀剂的选择
由于所检测的样品为乳饮料,样品中含有较多的蛋白质及其添加了稳定剂,如果样品处理过程中不加入沉淀剂,那么供液相测定的滤液中含有较多的杂质,严重影响分离效果,以及会缩短色谱柱使用寿命,因此比较了硫酸锌、亚铁氰化钾以及同时加入硫酸锌和亚铁氰化铁作为沉淀剂去除杂质的效果。试验表明,同时加入硫酸锌和亚铁氰化钾,沉淀效果较好,而且没有干扰峰,最终确定硫酸锌和亚铁氰化钾作为沉淀剂。
2.2.2提取液的选择及提取液中不同组分比例的确定
本研究对纯水、30%甲醇水溶液、30%乙腈水溶液作为提取液进行了比较,试验表明,纯水作为提取液回收率不高,而30%甲醇水溶液和30%乙腈水溶液作为提取液均具有较高的回收率,这可能是因为纽甜更易溶于甲醇和乙腈,同时甲醇和乙腈可作沉淀剂,能更好地去除样品中的杂质,由于乙腈是流动相,把乙腈水溶液作为提取液,能获得更好的色谱分离度,因此选择乙腈水溶液作为提取液。
分别将10%乙腈水溶液、20%乙腈水溶液、30%乙腈水溶液、40%乙腈水溶液、50%乙腈水溶液作为提取液进行比较,试验表明20%~50%乙腈水溶液具有很高的回收率,10%乙腈水溶液回收率略低,从环境友好的角度考虑,最终选择20%乙腈水溶液作为提取液。
2.3线性回归方程、线性范围和定量限
准确称取纽甜标准物质,用20%乙腈水溶液配制成6种浓度的标准溶液,6种浓度分别为0.2、0.5、1.0、10.0、20.0、50.0μg/mL,按1.4.1中色谱条件进行分析,以质量浓度作为横坐标,以峰面积作为纵坐标绘制标准曲线。以阴性样品中加入目标化合物,采用1.4.2的前处理方法,1.4.1中色谱条件分析,以10倍信噪比(S/ N=10)确定定量限。纽甜的线性范围、回归方程、相关系数以及定量限如表2所示。

表2 线性范围、回归方程和定量限Table2 Regression equation,linear rangesand detection lim its
2.4检测方法回收率和精密度
在阴性样品中加入一定量的纽甜标准溶液,利用1.4.2的方法进行前处理,利用1.4.1的色谱分析条件进行仪器分析,考察方法的回收率和精密度,对不同的加标量进行平行试验,每组做6个平行。试验显示,加标范围在0.80mg/kg~5.0mg/kg之间,纽甜的回收率为90.1%~96.1%,RSD值为1.7%~2.1%,结果如表3所示。
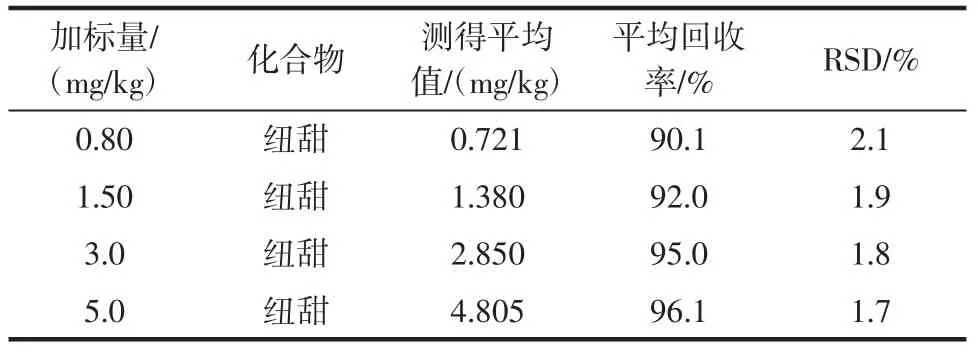
表3 方法回收率和精密度(n=6)Tab le3 Recovery and p recision(n=6)
2.5实际样品检测结果
采用该方法对市售的20份乳饮料产品进行检测,结果表明,有3份样品有纽甜检出,其中一份阳性样品的色谱图见图3。
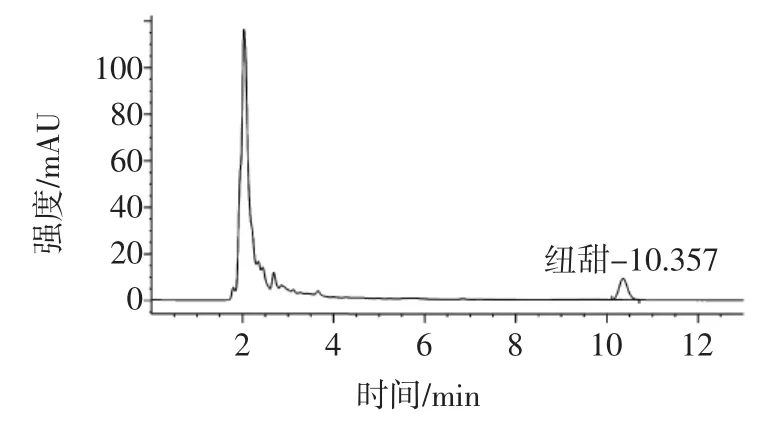
图3 阳性样品色谱图Fig.3 Chromatogram of positive sample
3结论
本文建立了测定乳饮料中纽甜含量的高效液相色谱法。选择磷酸氢二铵(0.020mol/L,pH 3.5~4):乙腈=(70∶30)为流动相,200 nm为波长,获得了较好的分离度和响应值,样品前处理过程中,以硫酸锌和亚铁氰化钾为沉淀剂,以20%乙腈水溶液为提取液,杂质去除效果好,并且回收率高。同时,该方法前处理简单快捷、精密度好、准确度高,克服了国标方法过程复杂、操作繁琐和回收率不稳定的劣势,适合大批量样品的测定,具有较强的实用价值。
[1]张金峰,沈寒晰,张存社,等.甜味剂纽甜合成新工艺[J].食品研究与开发,2011,32(4):73-75
[2]张金峰,沈寒晰,张存社.新型甜味剂纽甜研究进展[J].应用化工, 2010,39(10):1574-1577
[3]中国国家标准化管理委员会.GB2760-2014食品安全国家标准食品添加剂使用标准[S].北京:中国标准出版社,2014:16-18
[4]王齐,朱伟伟,杨俊.高效液相色谱法快速筛查与测定葡萄酒中纽甜[J].食品科学,2013,34(4):154-156
[5]刘晓霞,丁利,刘锦霞,等.高效液相色谱-串联质谱法测定食品中6种合成甜味剂[J].色谱,2010,28(11):1020-1025
[6]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23378-2009食品中纽甜的测定方法高效液相色谱法[S].北京:中国标准出版社,2009:1-4
[7]曹峰,许霞.高效液相色谱法测定莱芜姜酒中的纽甜含量[J].食品科学技术学报,2014,32(4):77-80
[8]蒋晓彤,陈国松,姜玲玲,等.高效液相色谱法同时检测6中甜味剂[J].食品科学,2011,32(6):165-168
[9]稽超,孙艳艳,李秀琴,等.饮料中4种人工合成甜味剂同时测定的超高效液相色谱快速检测方法[J].色谱,2009,27(1):111-113
[10]刘婷,吴道澄.食品中甜味剂的检测方法[J].中国调味品,2011, 36(3):1-12
Determ ination of Neotame in M ilk Drinks by H igh Perform ance Liquid Chrom atography
GUOYue-ping,SHIMeng-di,XUGuang-wei,WEIHe-wen,DONGXiao-wei
(Institute for Food and Drug Controlof Jinhua City,Jinhua 321000,Zhejiang,China)
Toestablish an analysismethod for the determination ofneotame inmilk drinksby High Performance Liquid Chromatography(HPLC).Sampleswereextracted by 20%acetonitrilewatersolution asextraction solution,zinc sulfate and potassium ferrocyanide asprecipitating agent,and the purified solutionswere analyzed by HPLC with a ZORBAX SB-C18 column(250 mm×4.6 mm,5μm)using diammonium hydrogen phosphate(0.02mol/L,pH 3.5-4)-acetonitrilesolution(70∶30)as themobile phase in equaldegree program,thedetectionwavelengthwas200 nm.The standard curvesofneotame in the rangeof0.2μg/mL-50.0μg/mL showed good linearity.The average recoveriesofneotamewas90.1%-96.1%in range of0.8mg/kg-5.0mg/kg addition,and the relative standard deviationwas1.7%-2.1%.The limitsofquantitation forneotamewas0.30mg/kg.
HPLC;milk drinks;neotame
10.3969/j.issn.1005-6521.2017.05.039
2016-06-14
郭跃平(1984—),男(汉),工程师,硕士,研究方向:食品质量与安全。
