硫酸化黑木耳多糖的辐射防护作用研究
2017-04-11胡俊飞张华曲航王振宇王雪耿林
胡俊飞,张华,曲航,王振宇,*,王雪,耿林
(1.哈尔滨工业大学化工学院,黑龙江哈尔滨150090;2.德之馨(上海)有限公司,上海201206;3.哈尔滨工业大学材料科学与工程学院,黑龙江哈尔滨150001)
硫酸化黑木耳多糖的辐射防护作用研究
胡俊飞1,张华1,曲航1,王振宇1,*,王雪2,耿林3
(1.哈尔滨工业大学化工学院,黑龙江哈尔滨150090;2.德之馨(上海)有限公司,上海201206;3.哈尔滨工业大学材料科学与工程学院,黑龙江哈尔滨150001)
为考察硫酸化黑木耳多糖对60Co-γ射线辐射损伤小鼠的防护作用。以硫酸化黑木耳多糖为受试物,用60Co-γ射线对小鼠进行一次性全身辐射,对小鼠的免疫指标,血清中SOD活力、MDA含量,骨髓DNA含量和骨髓微核率进行测定。结果表明:硫酸化黑木耳多糖对60Co-γ射线辐射损伤小鼠的单核细胞吞噬能力、血清SOD活性有明显的促进作用,并且能够增加小鼠免疫器官指数和骨髓DNA含量,减少血清MDA含量和骨髓微核率,减轻辐射诱导机体的氧化损伤。结论证实,硫酸化黑木耳多糖对60Co-γ射线辐射损伤小鼠具有良好的防护作用。
黑木耳多糖;硫酸化;辐射防护
随着科学技术的飞速发展,人类接触到的辐射源日益增多。电离辐射对人体的危害极大,主要通过直接效应和电离水解产生的间接效应诱导机体氧化损伤[1]。研究表明,电离辐射可以直接与生物大分子作用,破坏核酸、蛋白质和酶等具有生命功能的物质,还可以直接与水作用,使水分子辐射分解产生大量自由基,破坏机体氧化还原平衡状态,导致机体抗氧化能力下降,对动物器官、组织以及免疫系统造成严重损伤[2]。
近年来已有大量研究表明,食用菌多糖具有明显的抗辐射[3]作用,可以清除自由基[4],对造血系统[5]、免疫系统[6]和DNA[7]有较好的保护作用,并且能够促进损伤的造血系统和免疫系统恢复功能,经过硫酸化修饰后,多糖的分子量大小、空间立体结构以及取代基发生改变,生物活性也会随之发生改变[8]。与辐射防护药物相比,食用菌多糖具有毒性低、抗辐射效果显著、体内无蓄积、代谢后成为机体营养物质等优点,可以作为有潜在价值的辐射防护药物[9]。本文对硫酸化修饰后的黑木耳多糖的辐射防护进行研究,并与硫酸化修饰前的黑木耳多糖进行对比,旨在为黑木耳多糖抗辐射保健品的研发和广泛应用提供提论基础。
1材料与方法
1.1材料与试剂
黑木耳:哈尔滨市南极批发市场;SOD、MDA试剂盒:南京建成生物工程研究所;氯化钙:天津市东丽区天大化学试剂厂;高氯酸:天津市鑫源化工有限公司;甲醇:天津市富宇精细化工有限公司;胎牛血清Hyclone公司;瑞氏-姬姆萨复合染液:美国Solarbio公司。
昆明小鼠:雄性,体重(20±2)g,哈尔滨医科大学实验动物中心。
1.2仪器与设备
R200D型电子分析天平:德国赛多利斯公司;H2050R型台式高速冷冻离心机:湖南湘仪实验仪器开发有限公司;721型可见分光光度计:天津市普瑞斯仪器有限公司;Model550型酶标仪:日本BIO-RAD公司;CX31型显微镜:日本Olympus公司。
1.3方法
1.3.1多糖制备
原料预处理→料液比1∶80(g/mL)加入水后先胶体磨研磨10min,再进行高压均质提取(均质压力30 MPa,均质时间25min)→4 000 r/min离心20min→上清液(粗多糖溶液)→3%H2O2脱色→80%乙醇醇沉→减压蒸发(除去残留的乙醇)→自来水透析48 h,蒸馏水透析24 h→冷冻干燥→黑木耳多糖(HAAP)。
黑木耳多糖(HAAP)→浓硫酸法修饰(反应时间0.9 h,浓硫酸体积8.0mL,硫酸铵用量130mg)→自来水透析48 h,蒸馏水透析24 h→浓缩→冷冻干燥→硫酸化黑木耳多糖(SHAAP)。
1.3.2动物模型建立
将雄性昆明种小鼠随机分为9组,分别为正常对照组(Normal)、辐射模型组(Model)、阳性对照组(Leucogen,12mg/kg·d)、HAAP低剂量组(HAAP-L,50mg/kg·d)、HAAP中剂量组(HAAP-M,100mg/kg·d)、HAAP高剂量组(HAAP-H,200mg/kg·d)、SHAAP低剂量组(SHAAP-L,50 mg/kg·d)、SHAAP中剂量组(SHAAP-M,100mg/kg·d)、SHAAP高剂量组(SHAAPH,200mg/kg·d),正常对照组和辐射模型组灌服生理盐水,给药组则灌服相应剂量的药物,每天1次,每次2.5mL。连续灌胃14 d后,用60Co-γ射线对除正常对照组外的各组小鼠进行全身性照射,总吸收剂量为6.0Gy,剂量率为1Gy/min,照射后第2天处死动物。
1.3.3免疫指标测定
1.3.3.1免疫器官指数的测定
将小鼠眼球取血后脱颈处死,立即取出胸腺、脾脏、肝脏和心脏,剔除表面脂肪,用预冷的生理盐水冲洗表面所沾的血液后,滤纸吸干脏器表面水分,准确称重,计算器官指数。
1.3.3.2单核细胞吞噬能力的测定
小鼠经辐射处理后24 h,在尾静脉处注射稀释3~4倍后的印度墨水。墨汁注射结束后立即计时,分别在2min(t1)和10min(t2)时用毛细管从小鼠内眦静脉丛取血20μL,加入到2mL 0.1%Na2CO3溶液中,混匀后用紫外分光光度计于600 nm处测定2 min(A1)和10min(A2)时的吸光度值,0.1%Na2CO3溶液作为空白对照。随后将小鼠脱颈处死,迅速取出肝脏和脾脏,用预冷的0.9%生理盐水漂洗,滤纸吸干表面水分,称重,用吞噬指数(α)来表示小鼠的单核细胞吞噬能力。

式中:α为吞噬指数;K为未经校正的吞噬指数;W为小鼠体重,g;M1为小鼠肝重,g;M2为小鼠脾重,g。
1.3.4血清SOD和MDA测定
根据南京建成试剂盒说明书的有关要求,对小鼠血清SOD活力和MDA含量进行测定。
1.3.5骨髓DNA含量测定
小鼠脱颈处死后取左端股骨,用一次性注射器吸取1mL浓度为5mmol/L的CaCl2溶液,插入股骨一段,冲出股骨中全部骨髓细胞,置于灭菌的10mL离心管中,再加入8mLCaCl2溶液,4℃放置30min,取出后3 000 r/min离心10min,弃上清液,加入5mL浓度为0.2mol/L的HClO4溶液,并于90℃条件下水浴加热15min,待冷却至室温后,4 000 r/min离心10min,吸取上清液,在268 nm波长下测定吸光度值。

式中:OD为268 nm波长下的吸光值;B为骨髓细胞DNA含量,μg。
1.3.6骨髓微核实验
小鼠经脱颈处死后,剪取胸骨,并剔除上面的肌肉,用0.9%生理盐水清洗干净后,滤纸擦干,剪去每节骨骺端,并用小型弯头钳子挤出骨髓液,置于预先滴加一滴胎牛血清的载玻片上,充分混匀推片,长度为2 cm~3 cm。骨髓推片经晾干后放入染色缸中,加入甲醇溶液将其固定15min,取出晾干。滴加瑞士-姬姆萨A液至整个涂片被覆盖,染色1min后,滴加瑞士-姬姆萨B液于A液上,用洗耳球吹出微风,使两种液体充分混合,染色10min后自来水冲洗,晾干并进行镜检。在油镜下选择适当区域,观察骨髓细胞涂片中1 000个嗜多染红细胞,对含有微核的嗜多染红细胞进行计数,并计算每组涂片的微核率。
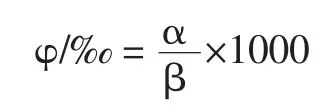
式中:φ为微核细胞率,‰;α为含微核细胞数;β为观察细胞数。
2结果与分析
2.1免疫指标测定
2.1.1免疫器官指数的测定结果
胸腺和脾脏是动物体内最重要的免疫器官,对辐射损伤高度敏感,心脏和肝脏也是动物体内重要的器官,其重量可以反映动物器官发育程度和功能强弱。HAAP和SHAAP对小鼠器官指数的影响见表1。

表1 HAAP和SHAAP对小鼠器官指数的影响Table1 Effectof HAAP and SHAAP on theorgan index ofm ice
由表1可知,辐射组小鼠的器官指数低于正常组小鼠的器官指数,其中胸腺指数和脾脏指数极显著低于正常组(P<0.01),心脏指数和肝脏指数显著低于正常组(P<0.05);与辐射组小鼠相比,阳性对照组、HAAP各剂量组以及SHAAP各剂量组器官指数均有所上升,SHAAP-H组的胸腺指数、心脏指数和肝脏指数均高于辐射模型组,较其它给药组效果更佳,SHAAP-M组的脾脏指数高于其它给药组。由此可见,SHAAP能够有效减少辐射诱导的氧化损伤,增强小鼠机体免疫力,起到辐射防护作用。
2.1.2单核细胞吞噬能力测定
单核细胞是机体防御系统的重要组成部分,能够通过吞噬方式来清除外来病原微生物、坏死细胞、无机颗粒等,发挥非特异性免疫作用。碳廓清试验可用来评价非特异性免疫系统的吞噬活性[10]。HAAP和SHAAP对小鼠单核细胞吞噬能力的影响见表2。
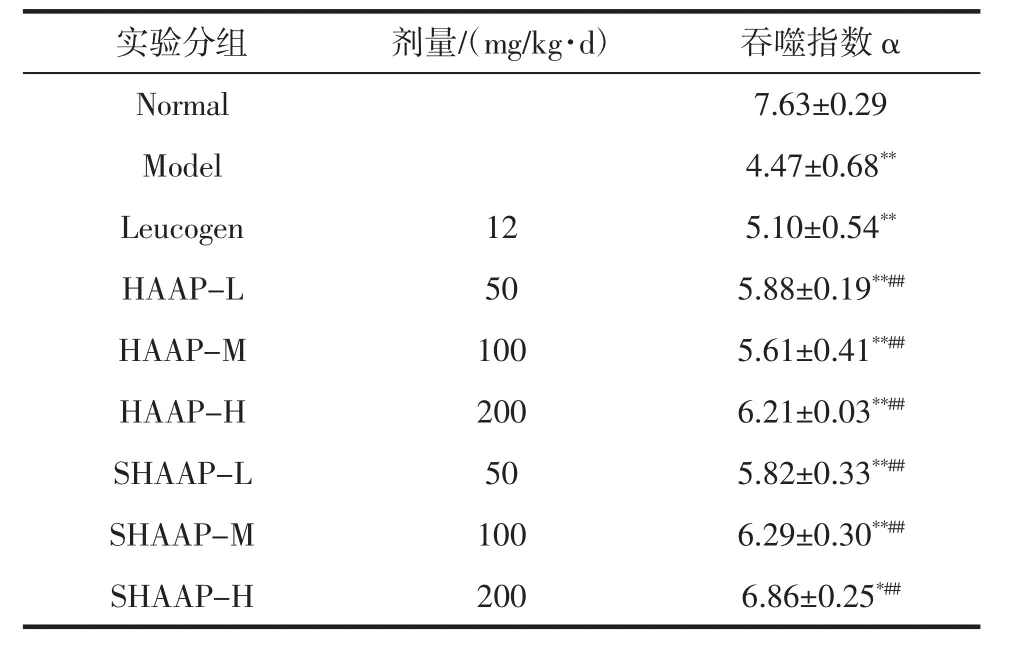
表2 HAAP和SHAAP对小鼠单核细胞吞噬能力的影响Table2 Effectof HAAP and SHAAP on phagocytosisability of monocyteofm ice
表2显示,辐射模型组小鼠的吞噬指数极显著低于正常组,表明辐射模型组小鼠的吞噬活性极显著低于正常组(P<0.01),辐射已经对小鼠免疫系统造成了损伤,使得单核细胞吞噬活性下降。与辐射模型组相比,除利可君组外,其它给药组的吞噬指数均显著增加;与正常组相比,所有给药组的吞噬指数均显著降低,SHAAP-H组差异显著,其它给药组差异极显著。结果表明,SHAAP能够有效增强小鼠单核细胞吞噬能力,提高小鼠机体免疫活性,减少辐射造成的氧化损伤,但是与正常小鼠相比,机体免疫活性较弱,无法恢复到正常水平。
2.2血清SOD和MDA含量的测定
2.2.1血清SOD活力测定
电离辐射诱导机体产生过量活性氧自由基,引发自由基链式反应,破坏机体抗氧化系统的稳态,SOD是生物体内一种重要的抗氧化酶,能够催化O2-生成H2O2和O2,SOD活力的高低能够反映机体清除氧自由基的能力。对小鼠血清总SOD活力的研究结果如图1所示。
与正常组相比,辐射模型组小鼠血清SOD活性显著下降(P<0.01);与辐射模型组相比,各给药组的SOD活力显著增强(P<0.01),利可君组、HAAP以及SHAAP各剂量组可以不同程度地增强小鼠体内SOD活力,其中SHAAP-H组小鼠血清SOD高于其它给药组,结果表明SHAAP能够通过增强小鼠体内SOD活力有效清除对机体有害的超氧阴离子,辐射防护作用最佳。
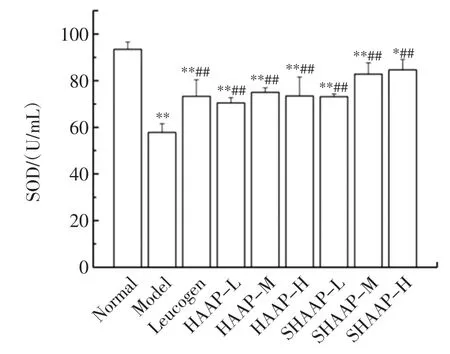
图1 HAAP和SHAAP对小鼠血清中SOD活力的影响Fig.1 Effectof HAAP and SHAAP on SOD in serum ofm ice
2.2.2血清MDA含量测定
电离辐射诱导机体产生大量自由基,攻击生物膜而引发脂质过氧化,加重辐射损伤。MDA是脂质过氧化的主要产物,其含量高低可以反映机体辐射损伤的程度。对雄性小鼠血清MDA水平的研究结果如图2所示。

图2 HAAP及SHAAP对小鼠血清中MDA含量的影响Fig.2 Effectof HAAP and SHAAP on MDA in serum ofm ice
与正常组相比,辐射模型组雄性血清MDA含量显著增加(P<0.01);给药各剂量组MDA含量均有不同程度的下降,除阳性对照组、HAAP-M组以及SHAAP-L组与正常组相比差异显著外,其它各给药组则无明显差异,HAAP-L、HAAP-H、SHAAP-M和SHAAP-H组对于辐射诱导氧化损伤的防护作用较强,且SHAAP组优于HAAP相应剂量组。结果表明,SHAAP均可以有效抑制辐射诱导产生的氧化损伤,降低小鼠机体内MDA水平,起到辐射防护作用。
2.3骨髓DNA含量和骨髓微核率测定
2.3.1骨髓DNA含量测定
电离辐射引发DNA单双链断裂,使细胞DNA降解,细胞中DNA含量减少[11]。HAAP和SHAAP对小鼠骨髓细胞DNA含量的影响见表3。

表3 HAAP和SHAAP对小鼠骨髓细胞DNA含量的影响Tab le3 Effectof HAAP and SHAAP on bonem arrow DNA contentofm ice
表3显示,与正常组相比,辐射模型组小鼠骨髓细胞DNA含量明显下降(P<0.01);与辐射组相比,各给药组小鼠骨髓DNA含量不同程度增加,差异极显著(P<0.05)。HAAP和SHAAP各剂量组对小鼠骨髓DNA含量的增加呈浓度依赖关系,随着给药浓度的增加,DNA含量升高,并且SHAAP组的辐射防护作用优于HAAP组,其中SHAAP-H组小鼠的骨髓DNA含量最高,对DNA的辐射防护作用最强。结果表明,电离辐射造成小鼠DNA损伤,骨髓细胞DNA含量下降;辐射前连续给药SHAAP,对电离辐射诱导产生的DNA损伤有抑制作用,即对电离辐射诱导的DNA损伤具有防护作用。
2.3.2骨髓微核率的测定
电离辐射导致基因突变和染色体损伤,使染色体断裂或者纺锤丝受损伤而产生断片。细胞有丝分裂时,这些断片遗留在细胞质中形成微核,微核率能够反映染色体的损伤程度,因此采用骨髓微核率评价天然活性物质的辐射防护作用[12]。HAAP和SHAAP对小鼠骨髓微核率的影响见表4。
表4显示,与正常组相比,辐射模型组小鼠骨髓微核率明显增加(P<0.01);与辐射模型组相比,HAAP和SHAAP各剂量组小鼠的骨髓微核率明显下降,且呈浓度依赖关系,随着给药浓度的增加,骨髓微核率降低,高剂量组的效果最佳,说明HAAP和SHAAP均能够有效抑制辐射诱导产生的染色体损伤,起到辐射防护作用;与HAAP组相比,SHAAP各剂量组的骨髓微核率更低,效果更显著。实验结果表明辐射能够诱导小鼠染色体发生畸变,使骨髓微核率增加;辐射前连续给药SHAAP,可以有效抑制辐射诱导小鼠机体产生的染色体损伤,降低骨髓微核率,起到辐射防护作用。

表4 HAAP和SHAAP对小鼠骨髓微核率的影响Table4 Effectof HAAP and SHAAP on bonemarrow m icronuclei ofm ice
3结论
电离辐射通过直接或间接作用危害机体,使氧化还原平衡系统受到破坏,导致器官组织损伤、DNA降解、染色体损伤、自由基过量、脂质过氧化,结果与文献报道[1]一致。研究结果显示,黑木耳多糖和硫酸化黑木耳多糖能够促进免疫器官指数以及单核细胞吞噬能力的回升,增强血清SOD活性,增加骨髓DNA含量,并降低血清MDA含量与骨髓微核率,对辐射诱导的氧化损伤有一定的防护作用,且与黑木耳多糖相比,硫酸化黑木耳多糖的辐射防护效果更佳。由实验结果可知,硫酸化黑木耳多糖主要通过增强机体免疫力、促进抗氧化酶系活性以及防止DNA损伤3个途径对辐射进行防护,这为黑木耳多糖的深入研究以及黑木耳多糖抗辐射保健品的开发提供了理论基础。
[1]贺许良,卢先州,陈枚,等.免疫器官辐射损伤与防护的研究进展[J].现代生物医学进展,2014(5):997-1000
[2]徐德鲲.黄芩苷对辐射损伤小鼠保护作用的研究[D].长春:吉林大学,2007
[3]LiX,Wang Z,Wang L.PolysaccharideofHohenbuehelia serotinaas a defenseagainst damage bywhole-body gamma irradiation ofmice [J].Carbohydrate polymers,2013,94(2):829-835
[4]TadayoniM,Sheikh-Zeinoddin M,Soleimanian-Zad S.Isolation of bioactive polysaccharide from acorn and evaluation of its functional properties[J].International journal of biological macromolecules, 2015,72:179-184
[5]王宏芳,林晓晨,李雪静,等.松茸多糖对X射线照射小鼠造血功能的保护作用[J].吉林大学学报:医学版,2008,34(5):751-754
[6]Zhang L,ZhangW,Wang Q,etal.Purification,antioxidantand immunological activities of polysaccharides from Actinidia Chinensis roots[J].International journal of biologicalmacromolecules,2015, 72:975-983
[7]汪维云.灰树花多糖的抗辐射作用研究[J].安徽农业大学学报, 2003,30(2):210-212
[8]KulickeWM,Lettau A I,Thielking H.Correlation between immunological activity,molar mass,and molecular structure of different (1->3)-beta-D-glucans[J].Carbohydrate Research,1997,297(2): 135-143
[9]于纯淼,于栋华,国立东,等.食用菌多糖抗辐射损伤作用研究进展[J].食用菌,2015,37(3):1-5
[10]Bhatia S,Rathee P,Sharma K,et al.Immuno-modulation effect of sulphated polysaccharide(porphyran)from Porphyra vietnamensis [J].International journal of biological macromolecules,2013,57: 50-56
[11]Yokoya A,Shikazono N,Fujii K,etal.DNA damage induced by the directeffectof radiation[J].Radiation Physicsand Chemistry,2008, 77(10):1280-1285
[12]Reiter R J,MeltzM L,Herman TS.Melatonin:possiblemechanisms involved in its‘radioprotective’effect[J].Mutation Research/Fundamental and Molecular MechanismsofMutagenesis,1998,404(1): 187-189
Radioprotection Effects of Sulfated Auricularia auricular Polysaccharides
HU Jun-fei1,ZHANGHua1,QUHang1,WANGZhen-yu1,*,WANGXue2,GENG Lin3
(1.SchoolofChemicalEngineeringand Technology,Harbin Instituteof Technology,Harbin 150090,Heilongjiang,China;2.Symrise(Shanghai)Co.,Ltd.,Shanghai201206,China;3.SchoolofMaterials Science and Engineering,Harbin Institute of Technology,Harbin 150001,Heilongjiang,China)
In order to investigate the protective effectof sulfated Auricularia auricular polysaccharides on injuredmice induced by60Co-γ.Sulfated Auricularia auricular polysaccharideswere orally administered to groups ofmice.After being exposed wholely to60Co-γ,immune parameters,SOD and MDA in serum,DNA andmicronuclear rates inmarrow were examined.Results showed that sulfated Auricularia auricular polysaccharides could increase the phagocytosis ability ofmonocyte and SOD activity in serum,decrease the formation ofmicronucleiin bonemarrow and MDA in serum and reduce the oxidative damage ofbody induced by radiation.The conclusion of thisexperimentverified the fact thatsulfated Auricularia auricular polysaccharideshas protective effecton damagedmale induced by60Co-γ.
Auriculariaauricular polysaccharides;sulfation;radioprotection
10.3969/j.issn.1005-6521.2017.05.002
2016-05-06
国家自然科学青年基金(31401483);黑龙江省博士后基金(LBH-Z14098);中央高校基本科研业务费专项资金资助(hit.nsrif. 2017025)
胡俊飞(1992—),女(汉),研究生,研究方向:天然产物分离、纯化及活性。
*通信作者:王振宇(1957—),男,教授,博士生导师。
