分心木多酚提取工艺及其抗氧化活性研究
2017-04-11陈冠林刘学文韩门娣骆春霞陈松根
陈冠林,刘学文,韩门娣,骆春霞,陈松根,*
(1.佛山市职业病防治所,广东佛山528000;2.广东省生物工程研究所,广东广州510316)
分心木多酚提取工艺及其抗氧化活性研究
陈冠林1,刘学文2,韩门娣1,骆春霞1,陈松根1,*
(1.佛山市职业病防治所,广东佛山528000;2.广东省生物工程研究所,广东广州510316)
以分心木为材料,辅助超声波技术提取多酚研究,结合单因素和正交试验,确定多酚提取的最佳工艺组合为料液比1∶40(g/mL),乙醇浓度30%,超声15min,提取温度为50℃。用FRAP、DPPH和ABTS3种方法测定了分心木多酚的抗氧化能力并用Folin-Ciocalteu法测定其总酚含量。结果表明分心木多酚在抗氧化能力和总酚含量方面是很好的抗氧化剂来源。
分心木;多酚;抗氧化性
分心木(Diaphragma juglandis Fructus),别名胡桃衣、胡桃夹、胡桃隔、核桃芯,为胡桃科胡桃属植物胡桃(Juglans regia L.)。中医认为,本品性味苦、涩、平,入脾、肾经,有健脾固肾、利尿清热,治淋病尿血、暑热泻痢等功效,适用于治疗遗溺、崩中下血、耳聋、治遗精、尿频、带下等[1]。我国的核桃资源非常丰富,2010年我国核桃年产量为128万t,面积和产量均为世界第一[2],分心木的产量也极其丰富。长期以来,我们只关注核桃仁的开发和利用,而对分心木的关注甚少,虽然一些学者对分心木进行了相关的研究[1,3-6],但对分心木多酚提取条件的优化研究较少,而对分心木多酚的抗氧化性也缺少系统的研究,为了充分利用分心木资源以及减少能源、溶剂等生产成本的消耗,本文对分心木多酚提取条件进行优化,采用超高效液相(UPLC)测定其成分含量,并系统地研究其抗氧化活性,为进一步开发利用该资源提供依据。
1材料与方法
1.1材料与试剂
1.1.1材料
分心木:购于广东省佛山市某市场。分心木干燥后用粉碎机粉碎,过20目筛,超声波辅助乙醇浸提备用。
1.1.2试验试剂
乙腈(色谱纯):德国Merck公司;乙醇(色谱纯):上海安谱科学仪器有限公司;Trolox(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,水溶性维生素E)、ABTS(2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid,2,2'-联氨-双-3-乙基-苯并噻唑啉-6-磺酸)、福林-酚试剂(Folin-Ciocalteu reagent):购自美国Sigma公司;TPTZ(2,4,6-tris-2,4,6-tripiridyl-2-triazine,三吡啶三吖嗪)、DPPH(1,1-diphenyl-2-picrylhydrazyl,1,1-二苯基-2-三硝基苯肼):购自阿拉丁公司;FeCl3、HCl、乙酸钠、过硫酸钾、没食子酸、乙醇,均为分析纯,由天津化学试剂厂生产。
1.2仪器与设备
UV-9600紫外/可见分光光度计:北京瑞利分析仪器有限公司;LEO-150S超声清洗仪:昆山力波超声波设备有限公司;ACQUITY UPLCH-CLASS超高效液相色谱仪:美国Waters公司;HD-100高速多功能粉碎机:诸暨市海道机械有限公司;SY2000旋转蒸发器、SHZ-Ⅲ型循环水真空泵:上海亚荣生化仪器厂。
1.3方法
1.3.1单因素试验
依据溶剂浸提理论,确定影响提取条件的主要因素有乙醇浓度、料液比、提取温度以及提取时间,通过测定提取液中的分心木多酚的质量分数来确定各因素的最佳提取条件。
1.3.2正交试验
在单因素试验的基础上,针对各因素的影响规律,利用四因素三水平进行正交试验,对影响多酚提取效果的各因素进行优化。
1.3.3总酚含量的测定
取0.10mL待测样品,加入2.50mLFolin-Ciocalteu试剂中,反应4min后,加入2.00mL 75 g/L的Na2CO3溶液,置室温下反应120min,于760 nm下测定吸光度。结果以没食子酸当量(gallic acid equivalents,GAE)表示,单位为mgGAE/g[7-8]。
1.3.4 UPLC色谱条件
色谱柱:ACQUITY UPLCHSST3(50mm×2.1mm,1.8μm);柱温:30℃;进样量:1μL;流速:0.3mL/min;流动相:乙腈-甲酸水溶液(0.2%甲酸),梯度洗脱(洗脱程序:0min,7%乙腈;4min,16%乙腈;6min,40%乙腈;7min,7%乙腈;10min,7%乙腈)[9],结果以μg/g DW(dryweight)表示。
1.3.5 FRAP法测定抗氧化活性
FRAP试剂由10mmol/L的TPTZ(溶于40mmol/L盐酸)、20mmol/L的三氯化铁、300mmol/L的乙酸钠缓冲液(pH3.6)以1∶1∶10(体积比)的比例混合而成。取100μL待测样品,加入3mLFRAP溶液中充分混合,反应120min后于593 nm处测定吸光度。以Trolox溶液为标样作标准曲线,样品的抗氧化活性用μmol Trolox/g表示[10-11]。
1.3.6 DPPH法测定抗氧化活性
取0.1mL待测样品,加入0.06mmol/LDPPH 80%乙醇溶液3.9mL,振荡15 s,放置暗处反应2 h后,于515 nm处测定吸光度,按以下公式计算清除率:

以3.9mLDPPH+0.1mL 80%乙醇作对照,空白为80%乙醇,以Trolox溶液为标样作标准曲线,样品的抗氧化活性用Trolox当量表示,单位为μmolTrolox/g[12]。
1.3.7 ABTS法测定抗氧化能力
将7mmol/L的ABTS(用pH为4.5、20mmol/L的乙酸钠配制)和2.45mmol/L的过硫酸钾等体积混合,室温下避光反应12 h~16 h,形成ABTS+·储备液。使用前用20mmol/L乙酸钠(pH4.5)将ABTS+·储备液稀释成为工作液,使其在734 nm处吸光度为0.700±0.005。取100μL待测样品,加入3mLABTS+·工作液,室温下反应2 h后,在734 nm处测定吸光度。以20mmol/L乙酸钠(pH4.5)为空白,ABTS+·为对照,以Trolox溶液为标样作标准曲线,样品的抗氧化样品的抗氧化活性用TEAC(trolox equivalentantioxidant capacity)表示[10],单位为μmol Trolox/g。
2结果与分析
2.1料液比
料液比对分心木多酚提取效率的影响见图1。

图1 料液比对分心木多酚提取效率的影响Fig.1 Effectof the ratio ofmaterial to extraction solventon extraction of phenolic contentsobtained from Diaphragma juglandis Fructus
由图1可知,随着溶剂用量的增加,分心木多酚的提取含量有所增加,但溶剂用量达到一定程度时,再增加溶剂用量不仅不能增加提取量,反而会增加生产成本。因此确定料液比为1∶30(g/mL)。
2.2乙醇浓度
不同浓度的乙醇对分心木多酚提取效率的影响见图2。
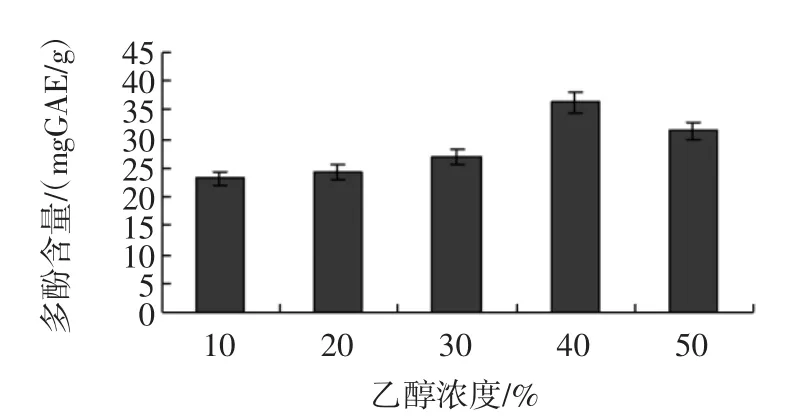
图2 不同浓度的乙醇对分心木多酚提取效率的影响Fig.2 Effectof ethanolconcentration on extraction rateof phenolic contentsobtained from Diaphragma juglandis Fructus
由图2可知,随着乙醇浓度的增加,提取含量增加,乙醇浓度在40%时提取效率最高,当乙醇浓度再增加时提取效率降低,乙醇量的增大也会增加生产成本。因此确定乙醇浓度为40%。
2.3提取时间
提取时间对分心木多酚提取效率的影响见图3。
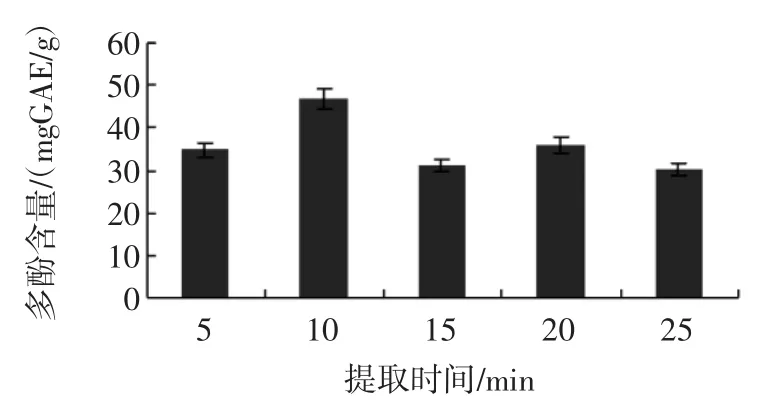
图3 提取时间对分心木多酚提取效率的影响Fig.3 Effectof extraction tim eon extraction rateof phenolic contentsobtained from Diaphragma juglandis Fructus
从图3可以看出,随着时间的延长提取效率有所增加,但10min后提取效率反而下降,提取时间过短则提取不完全,提取时间过长则耗时。因此确定10min为最佳的提取时间。
2.4提取温度
提取温度对分心木多酚提取效率的影响见图4。
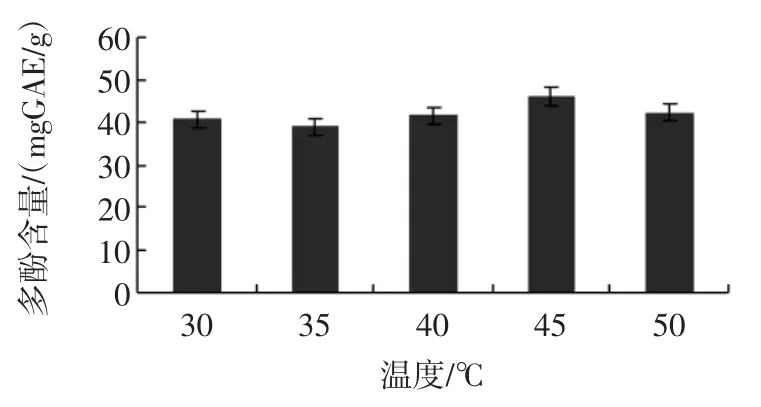
图4 提取温度对分心木多酚提取效率的影响Fig.4 Effectof temperatureon extraction rateof phenolic contents obtained from Diaphragma juglandis Fructus
从图4可以看出,随着温度的升高提取效率有所增加,但45℃后提取效率反而下降,提取温度过低则提取不完全,提取温度过高则耗能。因此确定45℃为最佳的提取温度。
2.5分心木多酚提取的正交试验分析
利用分心木多酚水解过程的单因素结果,确定料液比、乙醇浓度、超声时间和提取温度为4个主要的影响因素,并选定每个因素最佳范围的3个水平(表1),然后设计L9(34)正交试验,试验结果见表2。
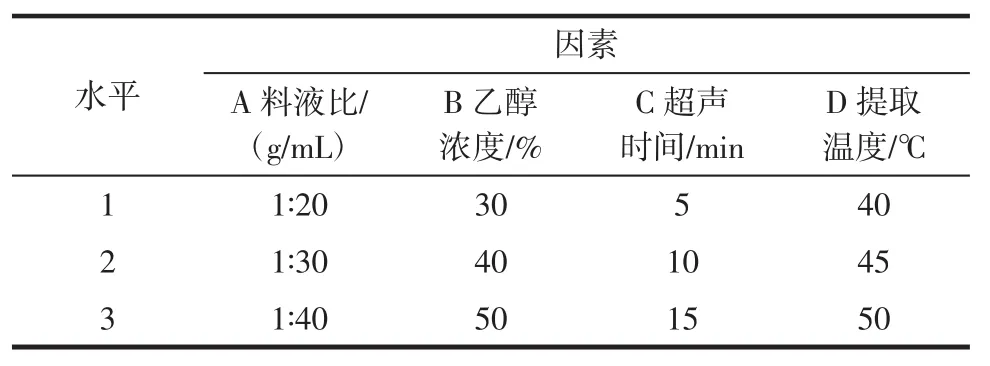
表1 正交试验因素水平表Tab le1 Factorsand levels in theorthogonalarray design
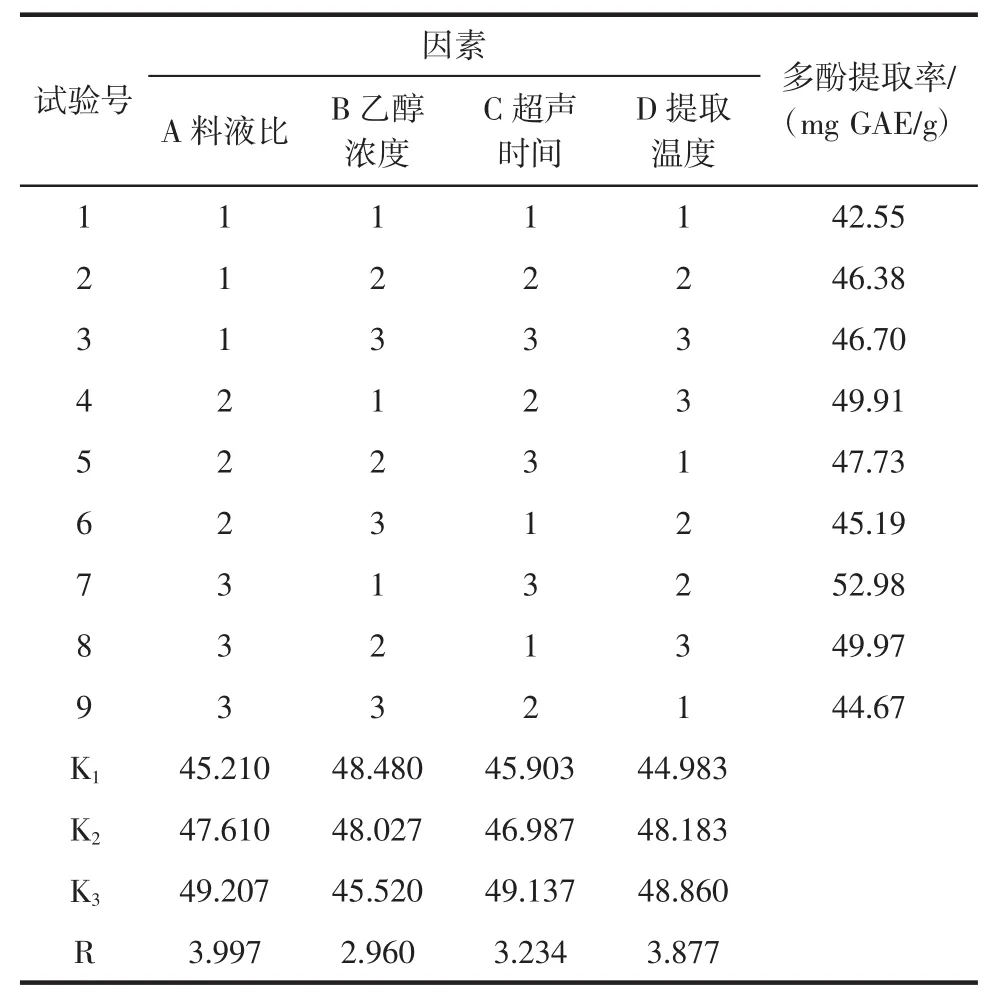
表2 正交试验结果Table2 Orthogonalarray designm atrix and experimental results
从表2可知,影响分心木中多酚物质提取效果的因素排列顺序为:A>D>C>B,即料液比>提取温度>超声时间>乙醇浓度,说明料液比对多酚的提取效果影响最大,其次是提取温度,再次是超声时间,而乙醇浓度对多酚的提取效果影响最小。4个因素的最佳组合方案时A3B1C3D3,即料液比1∶40(g/mL),乙醇浓度30%,超声15min,提取温度为50℃。经验证试验得,在该条件下从1 g分心木中可提取得多酚物质为56.46mgGAE。
2.6 UPLC分析结果
分心木多酚是分心木中含有多个苯环并且结合多个羟基的化学物质的总称,主要包括酚酸类和黄酮类两大部分,其色谱图见图5。
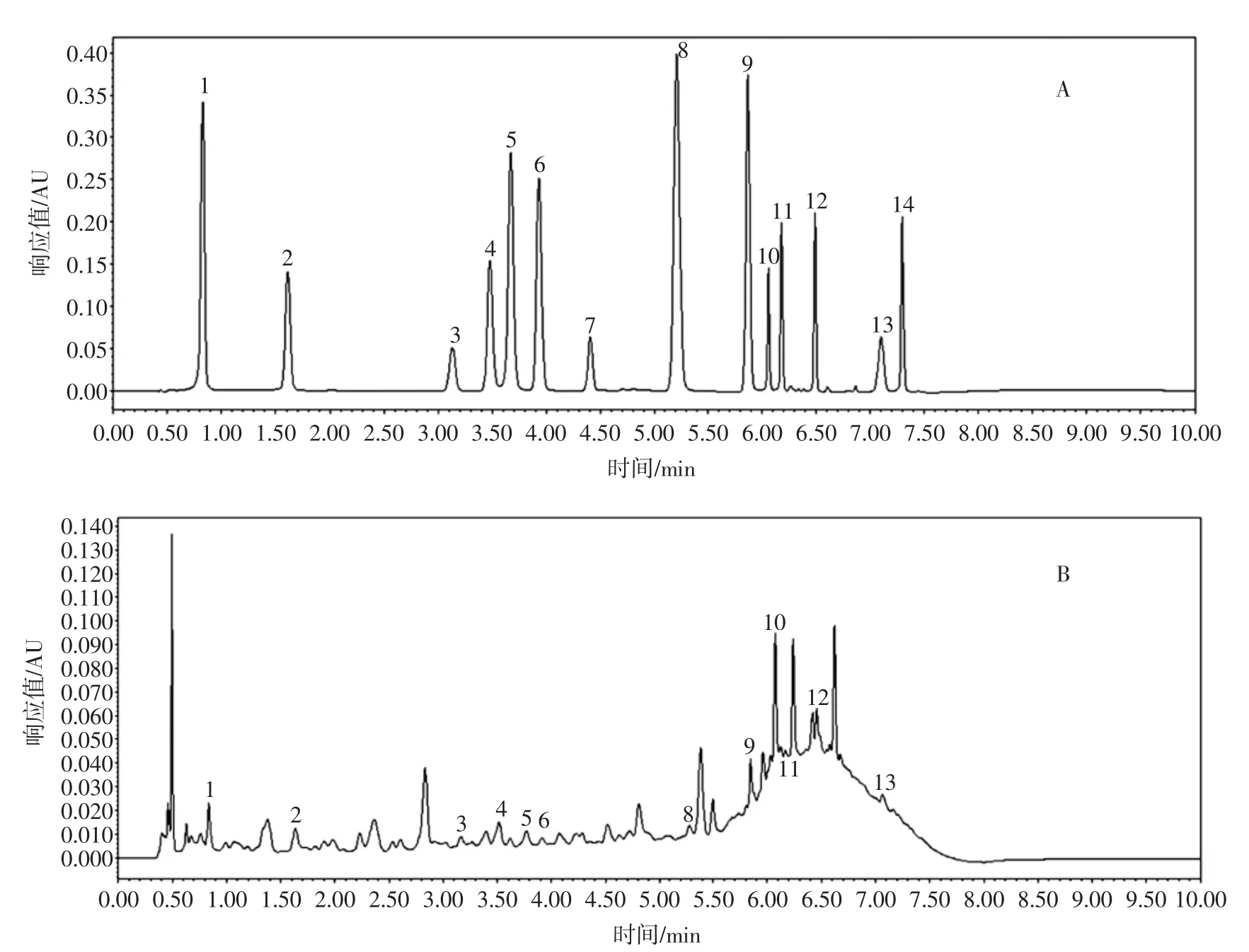
图5 对照品(A)和分心木(B)的高效液相色谱图Fig.5 UPLC chromatogram of standard(A)and Diaphragma juglandis Fructus(B)
由UPLC法测得的每克分心木中多酚的质量分数结果见表3。
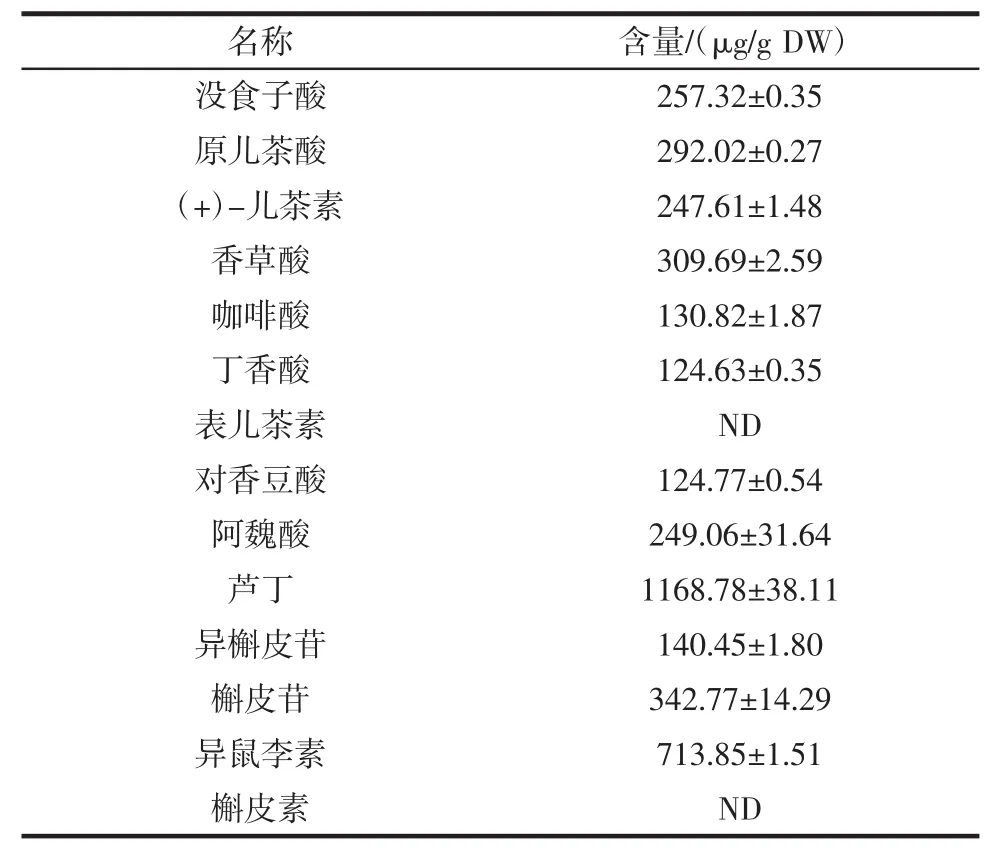
表3 分心木多酚含量Table3 M ain phenolic com poundsand their contentsof Diaphragma juglandis Fructus
由表3可知,在现有的标准中,分心木中芦丁的含量最高,其含量为1 168.78μg/g DW;其次是异鼠李素,其含量为713.85μg/g DW;丁香酸和对香豆酸的含量较低,分别为124.63、124.77μg/g DW。研究发现,纯的酚酸和黄酮类化合物可以抑制铜诱导的低密度脂蛋白胆固醇的氧化,在众多的羟基酸中,咖啡酸对低密度脂蛋白胆固醇氧化的抑制效果最好而对香豆酸和阿魏酸的抑制效果较差[13-16]。然而,其他的研究发现对香豆酸,没食子酸,咖啡酸,儿茶素,表儿茶素等对低密度脂蛋白胆固醇的氧化有很好的抑制作用[13,16-17],且混合酚类对低密度脂蛋白胆固醇氧化的抑制作用更好[18]。酚类化合物对低密度脂蛋白胆固醇氧化的抑制作用可能是酚类对自由基的清除或者与金属离子螯合有关[19]。对除此以外,儿茶素和表儿茶素对N-二硝基亚硝胺和N-亚硝基哌啶诱导DNA损伤的肝癌细胞有保护作用[20]。
2.7抗氧化活性试验
清除活性氧簇(reactive oxygen species,ROS)的研究中,DPPH,FRAP以及ABTS法是研究提取物抗氧化能力常用的方法。因此,本文采用FRAP、DPPH和ABTS法测定核桃壳多酚的抗氧化性,结果见图6。
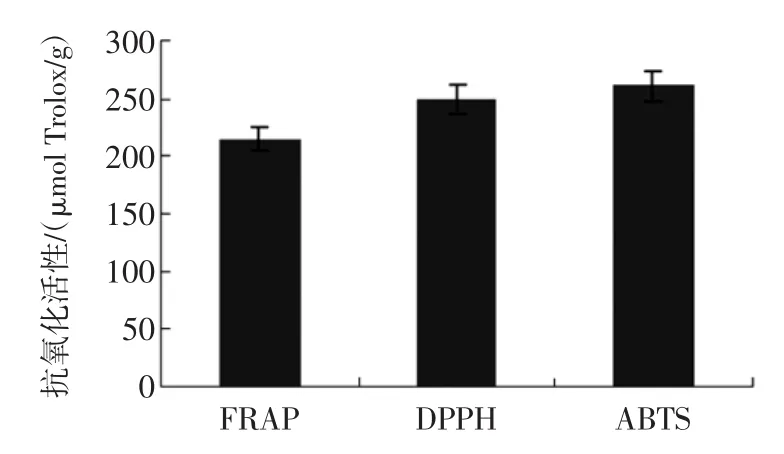
图6 多酚物质的抗氧化活性研究Fig.6 Antioxidant capacitiesof phenolic contents
由图6可知,FRAP、DPPH和ABTS法测得核桃壳多酚的抗氧化性分别为214.62、248.86和260.98μmol Trolox/g,表明分心木多酚的FRAP、DPPH·和ABTS+·抗氧化活性都比较强。Chen[21]等对33中水果抗氧化能力进行了研究,结果发现三华李的抗氧化能力最强,其对Fe3+还原能力为15.57μmol Trolox/g,对ABTS+·的清除能力为12.61μmol Trolox/g,但低于分心木多酚的抗氧化能力。与水果[22]、野生花[23]、蔬菜[24]以及谷类[25]等抗氧化能力相比较,分析木多酚的抗氧化能力均高于上述物质,但其抗氧化活性低于芍药花以及桂花[9]。在对ABTS+·的清除能力研究中,分心木多酚的抗氧化活性低于龙眼核[26]、瞿麦等[27]中药。研究发现,总酚含量与其抗氧化能力相关,总酚含量高,则其抗氧化能力强,酚类对预防氧化应激相关疾病有重要的作用[9]。原儿茶酸与ABTS以及DPPH的相关性较强;对香豆酸与ABTS以及FRAP的相关性较强;咖啡酸与FRAP的相关性较强;儿茶素与ABTS、DPPH以及FRAP的相关性较强;表儿茶素则与FRAP的相关性较强;槲皮素与ABTS、DPPH以及FRAP的相关性较强[9]。
3结论
通过单因素和正交试验得出了分心木多酚提取的优化工艺条件为:料液比1∶40(g/mL),乙醇浓度30%,超声15min,提取温度为50℃。通过FRAP、DPPH以及ABTS 3种抗氧化活性方法测定分心木多酚的抗氧化能力,结果显示分心木多酚是很好的抗氧化剂来源。
[1]杨明珠,田新雁,肖朝江,等.核桃分心木化学成分与生物活性研究[J].天然产物研究与开发,2012(12):1707-1711
[2]周晔,王伟,王成章,等.核桃属(Juglans)植物多酚类物质研究进展[J].南京林业大学学报(自然科学版),2013(5):146-152
[3]毕肯·阿不得克里木,韩艳春,阿依吐伦·斯马义.核桃分心木化学成分的预试验研究[J].新疆医科大学学报,2010(9):1044-1046
[4]王艳梅,高莉,刘梦,等.核桃隔膜化学成分定性研究[J].食品工业科技,2008(12):123-124
[5]高莉,王艳梅,帕提古丽·马合木提.核桃分心木粗提物抑菌活性的研究[J].食品科学,2008(11):69-71
[6]高莉,王强,帕提古力·玛合木提.核桃隔膜多糖的分离纯化及单糖组成分析[J].食品科学,2010(21):182-185
[7]SINGLETON V L,ROSSIJA.Colorimetry of Total Phenolicswith Phosphomolybdic-Phosphotungstic Acid Reagents[J].American Journalof Enology and Viticulture,1965,16(3):144-158
[8]SONG FL,GANR Y,ZHANG Y,etal.Total phenolic contentsand antioxidant capacitiesof selected chinesemedicinal plants[J].Int J MolSci,2010,11(6):2362-2372
[9]CHENG,CHEN S,XIE Y,et al.Total phenolic,flavonoid and antioxidantactivity of 23 edible flowers subjected to in vitro digestion [J].Journalof Functional Foods,2015,17:243-259
[10]OZGEN M,REESE R N,TULIO A Z,et al.Modified 2,2-Azinobis-3-ethylbenzothiazoline-6-sulfonic Acid(ABTS)Method to Measure AntioxidantCapacity of Selected Small Fruitsand Comparison to Ferric Reducing Antioxidant Power(FRAP)and 2,2‘-Diphenyl-1-picrylhydrazyl(DPPH)Methods[J].Journalof Agriculturaland Food Chemistry,2006,54(4):1151-1157
[11]BENZIE IFF,STRAIN JJ.The Ferric Reducing Ability of Plasma (FRAP)asaMeasure of“AntioxidantPower”:The FRAPAssay[J]. AnalyticalBiochemistry,1996,239(1):70-76
[12]CAIY,SUN M,CORKE H.Antioxidant activity of betalains from plants of the amaranthaceae[J].JAgric Food Chem,2003,51(8): 2288-2294
[13]MEYER A S,HEINONENM,FRANKELEN.Antioxidant interactions of catechin,cyanidin,caffeic acid,quercetin,and ellagic acid on human LDLoxidation[J].Food Chemistry,1998,61(1/2):71-75
[14]CIRICOTL,OMAYEST.Additiveorsynergetic effectsofphenolic compoundson human low density lipoprotein oxidation[J].Food and Chemical Toxicology,2006,44(4):510-516
[15]MEYER A S,HEINONENM,FRANKELEN.Antioxidant interactions of catechin,cyanidin,caffeic acid,quercetin,and ellagic acid on human LDLoxidation[J].Food Chemistry,1998,61(1/2):71-75
[16]DECAMARGO A C,REGITANO-D ARCEM A B,BIASOTOA C T,etal.Low MolecularWeightPhenolicsofGrape Juiceand Winemaking Byproducts:Antioxidant Activitiesand Inhibition of Oxidation of Human Low-Density Lipoprotein Cholesterol and DNA Strand Breakage[J].Journal of Agricultural and Food Chemistry, 2014,62(50):12159-12171
[17]AYOUB M,DE CAMARGO A C,SHAHIDI F.Antioxidants and bioactivities of free,esterified and insoluble-bound phenolics from berryseedmeals[J].Food Chemistry,2016,197:221-232
[18]NARDINIM,D'AQUINOM,TOMASSIG,etal.Inhibition ofhuman low-density lipoprotein oxidation by caffeic acid and other hydrox-ycinnamic acid derivatives[J].Free Radical Biology and Medicine, 1995,19(5):541-552
[19]CHANDRASEKARA A,SHAHIDIF.Bioactivities and Antiradical PropertiesofMilletGrainsand Hulls[J].Journal of Agricultural and Food Chemistry,2011,59(17):9563-9571
[20]DELGADOM E,HAZA A I,GARCÍA A,etal.Myricetin,quercetin, (+)-catechin and(-)-epicatechin protectagainstN-nitrosaminesinduced DNA damage in human hepatoma cells[J].Toxicology in Vitro,2009,23(7):1292-1297
[21]CHEN G,CHEN S,ZHAO Y,et al.Total phenolic contents of 33 fruitsand their antioxidantcapacitiesbefore and after in vitro digestion[J].IndustrialCropsand Products,2014,57:150-157
[22]FU L,XU B,XU X,et al.Antioxidant capacities and total phenolic contentsof62 fruits[J].Food Chemistry,2011,129(2):345-350
[23]LIA,LIS,LIH,etal.Total phenolic contents and antioxidant capacitiesof51edibleandwild flowers[J].Journalof Functional Foods, 2014,6:319-330
[24]DENGG,LIN X,XU X,etal.Antioxidantcapacitiesand total phenolic contentsof56 vegetables[J].Journalof Functional Foods,2013, 5(1):260-266
[25]DENGG,XUX,GUOY,etal.Determination of antioxidantproperty and their lipophilic and hydrophilic phenolic contents in cereal grains[J].Journalof Functional Foods,2012,4(4):906-914
[26]CHENG,CHEN S,CHEN F,etal.Nutraceutical potential and antioxidantbenefits of selected fruit seeds subjected to an in vitro digestion[J].Journalof Functional Foods,2016,20:317-331
[27]LIS,LIS,GAN R,et al.Antioxidant capacities and total phenolic contentsof infusions from 223medicinal plants[J].IndustrialCrops and Products,2013,51:289-298
Study on the Extraction and Antioxidant Activity of Phenolic Contents in Diaphragma juglandis Fructus
CHENGuan-lin1,LIUXue-wen2,HANMen-di1,LUOChun-xia1,CHEN Song-gen1,*
(1.Foshan Institute ofOccupationalDisease Prevention and Control,Foshan 528000,Guangdong,China;2.Guangdong Provincial Bioengineering Institute,Gaungzhou 510316,Guangdong,China)
This paper reported the use of single-factor and orthogonalarray designmethods to optimize the integrated ultrasonicassisted extraction ofphenolic contents in Diaphragma juglandis Fructus.The optimal technological conditions for extracting phenolic contents in Diaphragma juglandis Fructuswere as follows:the ratio of material to solventwas1∶40(g/mL),ethanol concentrationwas30%,extraction timewas15min,and extraction temperaturewas50℃.FRAP,DPPH and ABTSmethodswere used to determine the antioxidantactivities of phenolic contents in Semen juglandis,and Folin-Ciocaheumethod was used to determine the total phenolic contents.Results indicated that phenolic contents in Diaphragma juglandis Fructuswere significant sources of antioxidants in termsof theirantioxidantactivitiesand totalphenolic contents.
Diaphragma juglandis Fructus;totalphenolic contents;antioxidantactivity
10.3969/j.issn.1005-6521.2017.05.015
2016-06-12
广东省医学科学技术研究基金项目(A2015617)
陈冠林(1984—),男(汉),医师,硕士,研究方向:职业卫生、营养与食品卫生。
*通信作者:陈松根(1965—),男,主任医师。
