莪术二酮转化为莪术醇的方法优化
2017-04-11胡立宏
周 阳,陈 平,雷 敏,胡立宏
(1.武汉轻工大学 生物与制药工程学院,湖北 武汉430023;2.中国科学院上海药物研究所 中药现代化中心,上海 201203)
莪术二酮转化为莪术醇的方法优化
周 阳1, 2,陈 平1,雷 敏2,胡立宏2
(1.武汉轻工大学 生物与制药工程学院,湖北 武汉430023;2.中国科学院上海药物研究所 中药现代化中心,上海 201203)
本文对莪术二酮转化为莪术醇的方法进行了系统优化研究,采用HPLC外标法测定不同反应条件下莪术醇的产率,考察溶剂、温度、时间、底物浓度对反应产率的影响。实验发现以N,N-二甲基甲酰胺为溶剂,加热回流7 h,莪术二酮浓度为20 mg.mL-1时莪术醇产率最高,分离收率达80.5%,产物经重结晶纯度可达98%(HPLC)。
莪术醇;莪术二酮;转化;回流
1 引言
莪术醇(1)是从莪术药材中提取分离的药用单体成分。从上个世纪七十年代起莪术醇已作为治疗宫颈癌的药物,近年来也有文献报道其具有抗菌、抗病毒[1]、抗炎[2]、抗癫痫[3]及抗乳腺癌[4]、肝癌[5]、肠癌[6]的药理活性。但莪术醇在莪术药材中含量较低,在蓬莪术(Curcuma phaeocaulis Val.)、广西莪术(Curcuma kwangsiensis S. G. Lee et C. F. Liang)、温郁金(Curcuma wenyujin Y. H. Chen et C. Ling)中含量分别在0.02—0.05 mg·g-1、0.06—0.09 mg·g-1、0.19—0.24 mg·g-1[ 7]。但是,与莪术醇具有生源合成关系的莪术二酮(2)在三种莪术药材中含量相对较高,在蓬莪术、广西莪术中含量分别为0.3—1.5 mg·g-1、0.3—1.5 mg·g-1,而温郁金药材中莪术二酮含量高达15—18 mg·g-1[ 8]。由于莪术醇在莪术药材中含量较低,采用传统的水蒸气蒸馏的方法提取挥发油,柱层析或分馏的方法分离纯化的效率不高[9,10];且莪术药材中其他成分不能充分利用,导致药材资源的浪费。而存在的这种资源问题严重限制了莪术醇的药理、临床的深入研究。1985年计志忠、曾昭钧发现莪术药材中含量较高的莪术二酮在封管条件下[11]及高压反应釜中[12]能转化为莪术醇,通过实验发现,封管反应产率较低,高压反应釜存在一定安全隐患;1988年该课题组又报道称莪术二酮可以在AlCl3催化条件下定量转化成莪术醇,我们按照该方法制备的产物,经质谱、碳谱、氢谱鉴定产物不是莪术醇,而是莪术内酯(3)[13,14]。鉴于莪术醇在药学领域良好的应用前景及传统获取方法的局限性,本文着重探讨了一种在回流条件下莪术二酮转化为莪术醇的方法以解决莪术醇资源供应问题,以满足莪术醇的后续开发利用。

图1 莪术二酮(1)、莪术醇(2)、莪术内酯(3)的结构
2 实验部分
2.1 仪器与试剂
Waters2996高效液相色谱仪,Waters2695检测器(USA),ELSD-6000检测器;Waters SQD MS/SQD液质联用仪(USA);IKA C-MAG HS7磁力搅拌器(广州);EYELA N-1100旋转蒸发仪,EYELA OSB-2100恒温水浴锅,EYELA CA-1111冷却水循环仪(上海),SHB-Ⅲ循环水式多用真空泵(郑州);ZF-1三用紫外分析仪(上海)。
莪术醇、莪术二酮由本实验室从温郁金药材中提取分离得到,经HPLC-UV检测纯度大于98%;乙腈(色谱纯Adamas-beta);甲酸(色谱纯Aladdin);纯净水(娃哈哈);其他反应溶剂均为国药分析纯试剂。
2.2 方法
两口烧瓶中加入莪术二酮(1.0 g,4.23 mmol)和50 mL N,N-二甲基甲酰胺(DMF),搅拌升温至回流,记录时间,TLC跟踪反应进程(10%香草醛硫酸溶液显色),7 h后取出放冷至室温,减压旋蒸去除溶剂得淡黄色粗品,用石油醚和二氯甲烷重结晶得透明针状莪术醇固体,莪术醇分离收率80.5%。1H NMR (400 MHz, CDCl3) δ: 4.87 (d, J=2.5 Hz, 2H), 2.61-2.47 (m, 3H), 2.22-2.09 (m, 2H), 2.01-1.82 (m, 2H), 1.81-1.62 (m, 3H), 1.55-1.39 (m, 2H), 1.28-1.12 (m, 1H), 1.00 (dd, J=6.6, 4.7 Hz, 6H), 0.86 (d, J=6.5 Hz, 3H).
13C NMR (100 MHz, CDCl3) δ: 144.71, 112.88, 104.50, 88.07, 56.43, 54.48, 39.37, 38.77, 34.71, 30.91, 28.72, 28.24, 23.06, 21.48, 12.36.
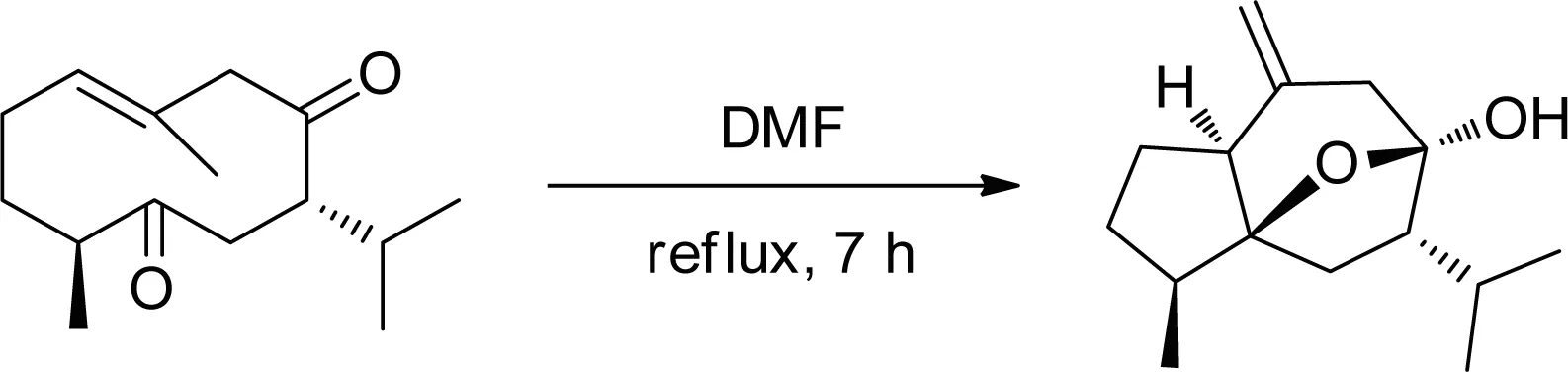
图2 反应路线
2.3 性能测试
2.3.1 色谱条件
色谱柱Waters C18色谱柱(4.6×150 mm,5 μm);流动相 乙腈-0.1%甲酸水溶液(45:55)等度洗脱;柱温 30℃;流速 1 mL·min-1;检测波长 200 nm;进样量 10 μL。
2.3.2 标准曲线的绘制
分别精密称取莪术醇2.2 mg,4.2 mg,6.0 mg,8.1 mg,12.2 mg用甲醇定容至5 mL。按2.3.1项下色谱条件分别进样二次记录峰面积,取平均值,以峰面积(Y)为纵坐标,浓度(X,mg·mL-1)为横坐标进行线性回归,得莪术醇标准曲线(Y=1826000X + 2317590,r2= 0.9991,n = 5)。在0.44—1.62 mg.mL-1范围内线性关系良好。
2.3.3 供试品溶液制备及反应产率的计算
将莪术二酮(80 mg,0.34 mmol)按一定浓度溶于溶剂中,搅拌升温至溶剂回流,记录反应时间。反应完毕后取出放冷,减压旋蒸去除溶剂,用甲醇溶解并定容至50 mL容量瓶中。按2.3.1项下色谱条件进样二次记录峰面积,取平均值,按2.3.2项下标准曲线计算莪术醇产率。
3 结果与讨论
3.1 不同反应溶剂对反应产率的影响
反应条件同2.2,考察了不同反应溶剂对莪术醇产率的影响,结果见表1
表1 溶剂对反应产率的影响
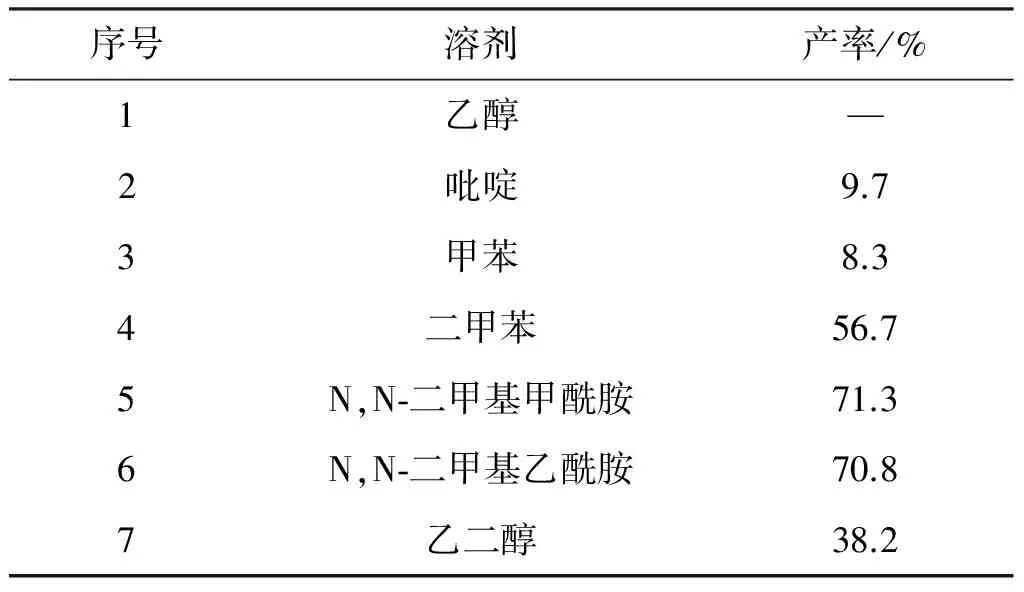
序号溶剂产率/%1乙醇—2吡啶9.73甲苯8.34二甲苯56.75N,N⁃二甲基甲酰胺71.36N,N⁃二甲基乙酰胺70.87乙二醇38.2
由表1可知,无论是低沸点还是高沸点的质子性溶剂都不利于反应的进行,通过TLC以及LC-MS检测发现反应较杂。于是考察了不同沸点的非质子性溶剂,随着溶剂沸点的升高,产率有较大的提升且产物单一。分析原因莪术二酮转化为莪术醇属于热重排反应,需要较高的温度,因此,以高沸点溶剂如DMF、N,N-二甲基乙酰胺(DMAC)作反应溶剂时反应产率较高,但由于DMAC价格较高,不利于工业化生产,故选择DMF作为反应溶剂。
3.2 不同反应温度对反应产率的影响
反应条件同2.2,以DMF作溶剂考察了不同反应温度对莪术醇产率的影响,结果见表2。
表2 温度对反应产率的影响

序号温度/℃产率/%11001.9212012.3314033.4416066.85回流72.1
由表2可知,随温度的升高产率逐渐升高,较高的温度是反应进行的必要条件。加热至回流产率达到最高。实验中发现回流条件下反应5 h莪术二酮仍有剩余,考虑通过延长反应时间进一步提高产率。
3.3 不同反应时间对反应产率的影响
反应条件同2.2,在DMF作溶剂,加热回流条件下考察了不同反应时间对产率的影响,结果见表3。
表3 反应时间对产率的影响

序号反应时间/h产率/%1362.62469.63571.34677.25779.76871.77970.8
由表3可知,在一定范围内,延长反应时间产率升高,延长至8—9 h时,产率有所降低。反应时间7 h产率达到最高。
3.4 不同浓度对反应产率的影响
反应条件同2.2,在DMF作溶剂,加热回流,反应时间7 h条件下考察了不同浓度对产率的影响,结果见表4。
表4 浓度对产率的影响

序号浓度/mg.mL-1产率/%1576.321077.532082.944081.558077.1
由表4可知,不同的浓度对反应产率影响较小,考虑反应后处理以及放大反应的经济性,可以选择较高的浓度比以减少溶剂的用量。
4 结论
我们成功地开发了一种由量丰莪术二酮生产莪术醇的方法。该方法简便易行,为莪术醇的制备提供参考。以DMF为溶剂,浓度20 mg·mL-1搅拌加热至回流7 h莪术二酮以82.9%的产率转化为莪术醇。减压旋蒸回收溶剂,石油醚和二氯甲烷重结晶,莪术醇收率80.5%,纯度98%。
[1] Dong J Y, Ma X Y, Cai X Q. et al. Sesquiterpenoids from Curcuma wenyujin with anti-influenza viral activities [J]. Phytochemistry, 2013, 85: 122-128.
[2] Chen X, Zong C J, Gao Y. et al. Curcumol exhibits anti-inflammatory properties by interfering with the JNK-mediated AP-1 pathway in lipopolysaccharide-activated RAW264.7 cells [J]. Eur.J.Pharmacol., 2014, 723: 339-345.
[3] Ding J, Wang J J, Huang C. et al. Curcumol from Rhizoma Curcumae suppresses epileptic seizure by facilitationof GABA(A) receptors [J]. Neuropharmacology, 2014, 81: 244-255.
[4] Ning L, Ma H, Jiang Z Y. et al. Curcumol Suppresses Breast Cancer Cell Metastasis by Inhibiting MMP-9 Via JNK1/2 and Akt- Dependent NF-κB Signaling Pathways [J]. Integr.Cancer.Ther., 2016,15: 216-225.
[5] Chen G, Wang Y H, Li M Q. et al. Curcumol induces HSC-T6 cell death through suppression of Bcl-2: Involvement of PI3K and NF-κB pathways [J].Eur.J.Pharm.Sci,2014, 65: 21-28.
[6] Wang J, Huang F X, Bai Z. et al. Curcumol Inhibits Growth and Induces Apoptosis of Colorectal Cancer LoVo Cell Line via IGF-1R and p38 MAPK Pathway [J]. Int.J.Mol.Sci, 2015, 16: 19851-19867.
[7] Deng C H, Ji J, Li N. et al. Fast determination of curcumol, curdione and germacrone in three species of Curcuma rhizomes by microwave- assisted extraction followed by headspace solid-phase microextraction and gas chromatography- mass spectrometry [J]. J.Chromatogr.A, 2006, 1117: 115-120.
[8] Yang F Q, Wang Y T, Li S P. Simultaneous determination of 11 characteristic components in three species of Curcuma rhizomes using pressurized liquid extraction and high-performance liquid chromatography [J]. J.Pharmaceut.Biomed, 2007,43: 73-82.
[9] 孟昭珂,付美珍.莪术醇的提取工艺:中国,CN 1712400 A[P].2005-12-28.
[10] 朱伟. 一种分子蒸馏法提取莪术醇的工艺:中国,CN 105061449 A[P].2015-11-18.
[11] Li X,Wu L J,Ji Z Z.Curcumol and its one-step formation from curdione[J].J.Heterocyclic.Chem, 1988,25: 1403-1405.
[12] 计志忠,曾昭钧.莪术二酮定量异构化为莪术醇的新方法[J]. 沈阳药学学报, 1988, 2(5): 107-109.
[13] Bin Q,Li Y X, Meng L X. et al. “Mirror- Image” Manipulation of Curdione Stereoisomer Scaffolds by Chemical and Biological Approaches: Development of a Sesquiterpenoid Library [J]. J.Nat.Prod, 2015, 78: 272-278.
[14] Seiichi L, Gao J F, Kenzo H. et al. The absolute configuration of curdione and the stereostructure of cureumalactone from curcuma wenyujin [J]. Chem.Pharm.Bull, 1985, 33(5): 2179-2182.
The optimization on transformation from Curdione to Curcumol
ZHOUYang1,2,CHENPing1,LEIMin2,HULi-hong2
(1. School of Biological and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China; 2. Shanghai Research Center for Modernization of Traditional Chinese Medicine, Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China)
The method of transformation from curdione to curcumol was optimized. HPLC with external standard method was used to measure the reaction yield under different solvent, temperature, time and concentration. A optimized result was obtained with N,N-Dimethylformamide as solvent, under refluxing for 7 hours, and 20 mg.mL-1curdione, the best yield of curcumol was up to 80.5% and purity was over 98%.
curcumol; curdione; transformation; reflux
2017-2-13
周阳(1991-),男,硕士研究生,E-mail:774806463@qq.com
胡立宏(1969-),研究员, E-mail:lhhu@simm.ac.cn; 陈平(1958-),女,教授,E-mail:chenpingvip24@163.com
2095-7386(2017)01-0030-04
10.3969/j.issn.2095-7386.2017.01.006
TS 252
A
