水体微生物污染指示菌在不同营养水平下的稳定性
2017-04-11贾乐华吴仁人陈中颖李开明张一敏武汉理工大学资源与环境工程学院湖北武汉30070环境保护部华南环境科学研究所广东广州510655武汉科技大学资源与环境工程学院湖北武汉30081华南理工大学生物科学与工程学院广东广州510006广东省水与大气污染防治重点实验室广东广州510655
张 杨,贾乐华,吴仁人,陈中颖,李开明,张一敏(1.武汉理工大学资源与环境工程学院,湖北 武汉 30070;2.环境保护部华南环境科学研究所,广东 广州 510655;3.武汉科技大学资源与环境工程学院,湖北 武汉 30081;.华南理工大学生物科学与工程学院,广东 广州 510006;5.广东省水与大气污染防治重点实验室,广东广州 510655)
水体微生物污染指示菌在不同营养水平下的稳定性
张 杨1,2,贾乐华4,吴仁人2,5*,陈中颖2,5,李开明2,5,张一敏1,3(1.武汉理工大学资源与环境工程学院,湖北 武汉 430070;2.环境保护部华南环境科学研究所,广东 广州 510655;3.武汉科技大学资源与环境工程学院,湖北 武汉 430081;4.华南理工大学生物科学与工程学院,广东 广州 510006;5.广东省水与大气污染防治重点实验室,广东广州 510655)
微生物污染指示菌在水体中的稳定性直接影响到定量的准确性及应用的适应性.通过建立水环境模拟反应器,以实时荧光定量 PCR方法探究鸡粪中大肠埃希氏菌(EC)、拟杆菌(GB)及鸡源特异性基因(CB)等指示微生物在不同营养水平的水环境的稳定性及衰减特征.结果表明:所选微生物衰减较好的符合一级动力学模型.对照组和含有营养物质实验体系中指示微生物的衰减系数 k分别为 EC(0.135,0.134;前者为对照组,下同),GB(0.415,0.457),CB(0.425,0.437),说明营养物质对EC、GB、CB的衰减未有显著影响.有氧水环境中,GB、CB呈现快速衰减趋势,EC则变化相对缓慢.不同营养水平下3种微生物的衰减具有显著正相关性(P<0.05),均可作为良好指示菌以评价水体的微生物污染程度,但特征各异.
微生物污染源解析;指示微生物;衰减;营养;溶解氧
近年来,因畜禽粪便和生活污水引起的水源性传染疾病频发[1].粪便中的致病菌往往是水源传染性疾病的根源.世界各国通常将粪大肠菌群或大肠埃希氏菌作为指示微生物(indicator),以反映水体微生物污染状况,但这些传统指标仅能反映出粪便污染的程度,不能识别污染的确切来源,更不能评价不同污染源的各自贡献率[2].水体微生物污染源解析技术通过检测拟杆菌[3]等宿主特异性标记来区分不同的粪便污染源,及时提供粪便污染来源的准确信息以及时有效的进行针对性源头控制[4].
灵敏度和特异性是水体微生物污染源解析的重要指标[5],但宿主特异性标记物的稳定性却一直被忽视,应同样将其作为关键性指标[6].由于与肠道环境有巨大差异,拟杆菌等肠道微生物进入水体后可能有不同程度的衰减[7],宿主特异性标记物的稳定性直接关系到源解析定量的准确性, 其与大肠埃希氏菌等常规指示微生物的相对稳定性也直接影响到不同指标的可比性.已有学者对肠道微生物衰减规律开展了相关研究,如Liang等[8]发现拟杆菌作为专性厌氧菌在进入自然水环境后仅能存活 1~2d甚至几个小时, Fogarty等[9]的研究表明,拟杆菌的 DNA在水体中存在数天乃至数周仍然可以被检测到.水体营养程度、溶解氧含量、温度等环境因素均可能对宿主特异性标记物的稳定性造成明显影响,但现有研究对其阐述仍非常有限.本研究搭建了水体微生物自然变化的模拟反应器,探究水体营养水平对指示微生物及宿主特异性标记物的变化影响,以揭示宿主特异性标记物的稳定性及拟杆菌作为水体微生物污染定量源解析中宿主特异性标记物来源的可行性.
1 材料与方法
1.1 样品及试剂
样品采集:鸡粪样品取自广东省某农科院畜牧养殖试验场.取新鲜鸡粪于灭菌塑料取样瓶中,置于低温冰盒,6h内进行样品处理.
主要仪器:磁力搅拌器(上海司乐仪器公司),核酸蛋白分析仪(DU730,BeckMan Coulter公司),紫外可见分光光度计(DR2800,HACH公司),冷冻离心机(Sigma公司),荧光定量 PCR仪(Light Cycler 480Ⅱ,Roche公司),溶解氧测定仪(Pro20, YSI公司).
主要试剂:水体DNA提取试剂盒(D3145-02, Magen公司),荧光染料SYBR TaqⅡ(TaKaRa公司),琼脂糖(Biowest,电泳级),LB肉汤培养基(环凯生物公司),COD高量程预制试剂(HACH公司).
1.2 水环境模拟反应器
水环境模拟反应器的设计:为模拟微生物在流动水体中的变化,将配制的10L鸡粪混合液装入直径30cm,高为25cm的有机玻璃中,保持室内温度25℃,通过磁力搅拌的方式使得混合液中的微生物及微小颗粒充分混合均匀并起到复氧作用.搅拌器转子长8cm,转速约为170~220r/min.
水环境模拟反应器的建立:试验设置2组反应器(对照组和营养添加组),每组 2个平行,共 4个反应器.称量40g鸡粪置于烧杯中,加入4L灭菌的去离子水,用玻璃棒搅拌 10min,将大颗粒粪便捣碎,再用磁力搅拌器搅拌 90min,使粪便充分混匀.为防止颗粒物随时间溶解造成实验数据波动,将鸡粪混合液通过4层灭菌医用脱脂纱布过滤2次,以去除大颗粒物,再分别用400目和500目滤网各过滤1次以滤去小颗粒物.将滤液均分4份后分别转入各反应器,并在营养添加组的 2个反应器中分别加入 50mL浓度约为 20g/L的LB肉汤培养基,最后各反应器加灭菌的去离子水至 10L,通过磁力搅拌器搅拌使反应器内水体保持混匀.
1.3 分析方法
1.3.1 水体中溶解氧的测定 将溶解氧仪的电极探头用灭菌的去离子水洗净,放入各反应器的中部,保持磁力搅拌器正常搅拌,使罐内水体混合均匀,待溶解氧仪计数稳定后记录数值.在磁力搅拌器的复氧作用下,添加组与对照组的溶解氧均维持在6~8.5mg/L.
1.3.2 样品处理和 DNA的提取 用灭菌注射器分别从各反应器中部取 200mL水样用于COD、氨氮及分子生物学测试.COD的监测使用HACH公司高量程(HR)重铬酸钾法预制试剂,氨氮的监测采用纳氏试剂分光光度法(HJ 535-2009).DNA的提取采用Magen试剂盒,用0.45μm的微孔滤膜抽滤 50mL水样使菌体留在滤膜上,按照说明书提取留在滤膜上的菌体 DNA,放入-20℃冰箱储存.各反应器每天每次提取2份水样的DNA开展平行监测.
1.3.3 引物的选取和qPCR分析 以总细菌、大肠埃希氏菌、拟杆菌以及鸡源特异性基因16S rRNA为靶序列,根据4种细菌的16S rRNA基因高度保守性,选取4对引物.引物序列如表1所示.

表1 特征生物标记引物Table 1 Primers used in qPCR assay

图1 四对引物扩增结果Fig.1 Amplification of 4pairs Premiers in this study条带1: E. coli premier; 条带2: General Bacteroides premier; 条带3:Total Bacteria premier; 条带4: Chicken-specific marker premier;条带5: DNA marker
不同引物的特异性验证:将鸡粪混合液中提取的DNA稀释为10ng/μL并依此为模板,对实验所用 4对引物进行扩增.扩增体系: DNA模板(10ng/μL)1.8μL;引物(10μmol/L)各3.6μL; 2×PCR DSMix 45μL;超纯水 36μL.扩增程序: ①预变性,95℃,5min;②变性,95℃,30s;③退火,60℃,30s;④延伸,72℃,30s,35个循环;⑤终延伸,72℃,5min.扩增结果如图1所示.结果表明,条带1、2、3、4均出现了目的条带,片段大小与文献[10-13]所述一致.说明4种引物都能对鸡源粪便中的目的基因组进行扩增.将4种引物的扩增基因序列提交至 GenBank进行同源性比对,BLAST结果显示(未列出),CB、GB及EC与通用引物互补的序列为3种目标菌株不同株系的16S rRNA基因片段,说明这3种引物有较高的特异性.TB含有变形菌属、不动杆菌等其它多种菌株的核酸序列.
标准曲线的制作:通过表1中的4对引物对提取的基因组 DNA扩增,扩增后的目标产物进行纯化回收,连接到pMD 18-T Vector载体上,转化DH5α感受态细胞,用含有氨苄抗生素的平板培养基挑取阳性克隆,提取质粒 DNA.测定所提取的质粒DNA浓度,计算目的片段的拷贝数.将质粒进行10倍梯度稀释,稀释10-1,10-2,10-3,10-4, 10-5,10-66个梯度,并依此为模板,每个梯度作为标准品设3个重复,进行荧光定量PCR.反应结束后,绘制标准曲线.一般认为相关系数(R2)大于0.98,结果可信.扩增效率(E)通过标准曲线的斜率来确定,两者符合 E=10(-1/Slope)-1,如果一个反应的标准曲线斜率为-3.32,则该反应的扩增效率 E=100%[14].一般认为扩增效率(E)在 80%~120%之间是可接受的. 4对引物标准曲线如表2所示.

表2 各特征引物qPCR标准曲线Table 2 Real-Time PCR standard curve of specific primers
1.3.4 qPCR分析 通过实时荧光定量PCR方法对每天从水样中提取的DNA进行总细菌、大肠埃希氏菌、通用性拟杆菌以及鸡源特异性拟杆菌的定量检测.qPCR扩增体系为 20uL:SYBR®Premix Ex TaqTMII(2×)(购自TaKaRa公司)10uL;灭菌超纯水6.4μL;上下游引物分别为0.8μL(表1所示4种引物);DNA模板2μL.qPCR扩增程序:①预变性,95℃,30s;②变性,95℃,5s;③退火延伸, 60℃,1min.40个循环.扩增体系与程序参照TaKaRa公司SYBR Premix Ex TaqⅡ RR820A说明书.
2 结果与讨论
2.1 营养水平对COD和氨氮的影响
由图2可知,营养添加组中COD和氨氮的初始值为 146,6mg/L.分别比对照组高 108, 3.56mg/L.LB培养基内所含物质为细菌的生长提供了丰富的碳源、氮源、微量元素及维生素等营养物质,可有效促进细菌的生长[15].细菌的降解作用造成有机物质的降解,以致在添加初期COD快速下降,而对照组中COD下降速度较慢(图 2a).同时,两个体系中氨氮浓度均随着时间而逐步上升(图2b).
研究表明,环境水体中氨氮浓度可在有氧条件下快速降低[16],而本试验发现的趋势与之明显相反.本试验中微生物均源自新鲜鸡粪,鸡的肠道微生物以专性厌氧菌为主,且缺少硝化细菌等好氧细菌[17],且在 2个体系内均检测到 NO3--N< 0.3mg/L,含量较低,说明体系未发生明显的硝化反应,从而造成氨氮的不断积累.同时,LB培养基的添加也给水体带来大量的氮源,故有营养添加水体中氨氮的浓度相对较高.

图2 不同营养水平条件下COD和氨氮浓度随时间的变化Fig.2 Variation of concentration of COD and NH3-N as function of time under different levels of nutrition
2.2 营养水平对特征微生物的影响
2.2.1 特征微生物的总体变化 对不同时段的水体进行 qPCR检测,分析总细菌、大肠埃希氏菌、拟杆菌及鸡源特异性基因的拷贝数,结果如图 3所示.在 2组试验中,初始拷贝数均为 TB>GB>EC>CB.初期阶段两个体系的拟杆菌都出现了快速衰减,总细菌数和大肠埃希氏菌则波动较小.虽然LB培养基的添加造成2个体系营养水平有较大差异,但同种微生物(或基因)在不同条件下的衰减趋势大致相同,说明水体中的营养物质并未对拟杆菌、大肠埃希氏菌等指示微生物的衰减趋势带来显著变化.衰减程度方面,将与初始拷贝数相比,总细菌数和大肠埃希氏菌的最终衰减倍数约为 20~40,拟杆菌和鸡源特异性基因最终衰减倍数约为3000~7000.

图3 不同营养水平条件下4种微生物量的变化Fig.3 Change of four microorganisms under different levels of nutrition
2.2.2 大肠埃希氏菌和拟杆菌的变化 利用统计学方法对比不同微生物的衰减规律.表3数据表明,微生物衰减规律较好的符合一级动力学模型,拟合度 R2除添加组拟杆菌(0.765)外,其它均高于0.85.在95%的置信区间上对指示微生物的衰减进行分析,两组试验中衰减系数k分别为大肠埃希氏菌(0.135,0.134,前者为对照组,下同)、拟杆菌(0.415,0.457)及鸡源特异性基因(0.425, 0.437),说明营养水平对指示微生物衰减系数的影响不显著.
粪大肠菌群(FC)是我国唯一的微生物污染监测指标[18],也是目前国际上通行的监测水质受粪便污染的指示菌[19],由于在环境水体中存在自然增值等特征,其对病原微生物的指示存在一定的局限性[20-21].美国等部分发达国家经过大量的流行病学研究后,摒弃了应用已久的粪大肠菌群指标,将大肠埃希氏菌和肠球菌作为淡水的指示微生物[22].本试验结果表明大肠埃希氏菌在水体中衰减较慢且不受水体中营养物质的影响,从可测性和稳定性方面进一步说明其适合作为水体微生物污染的指示菌.也有研究得到不同结论,如Byamukama等[20]在没有已知污染源的热带水体中检测到大肠埃希氏菌,但该研究没有发现其自然增值的直接证据,不排除该区域有野生动物等未知污染源的可能.大肠埃希氏菌作为水体微生物污染指示菌的优劣性仍有待深入研究.
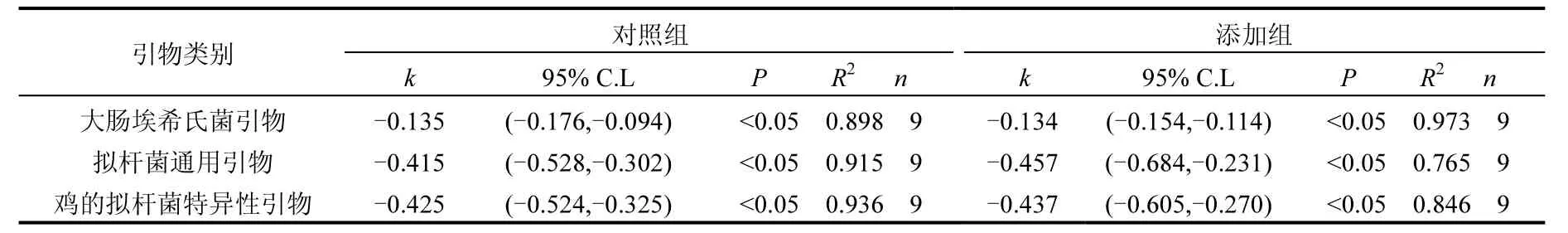
表3 特征微生物一级动力学衰减的线性回归分析Table 3 Decay of first-order kinetics analysis of specific indicator
拟杆菌是肠道厌氧微生物中的主要代表,其在肠道环境中的数量要高于大肠埃希氏菌,作为指示微生物通常比大肠埃希氏菌更灵敏,可以更早的检测出水体受粪便污染情况[23].但拟杆菌作为专性厌氧菌在有氧水体中呈指数级衰减(表3),且衰减系数明显大于兼性厌氧菌大肠埃希氏菌(对照组 0.415,0.135;添加组 0.457,0.134).从图 2还可观察到,拟杆菌在初期衰减最为明显,对照组及添加组中拟杆菌和大肠埃希氏菌拷贝数比例第1d分别为2.06,1.49;而第4d则分别为0.068,0.006,说明拟杆菌在有氧水体中的稳定性较差,仅适合粪便污染的初期监测.同时,对照组及添加组中鸡源特异性基因的拷贝数分别为拟杆菌的1.74%和1.15%,说明只有部分拟杆菌在鸡的肠道环境中产生特异性基因.从拷贝数方面分析,鸡源特异性基因在试验初期约为大肠埃希氏菌的1.72%,而在后期甚至不到 0.01%,拷贝数仅为3000~4000,可知基于特异性基因的微生物污染源解析技术对样品前处理及 qPCR等分析方法要求较高,环境干扰因素也可能对结果产生不可预期的影响.
2.3 不同指示微生物的特征
由表4可见,在不同营养水平的环境条件下,大肠埃希氏菌、拟杆菌及鸡源特异性基因之间都具有很好的相关性(P<0.05),均可作为良好指示菌以评价水体的微生物污染程度,但各自具有不同的特征.大肠埃希氏菌在水环境中较为稳定,可较持久的反映出水体微生物污染水平,由于没有特异性基因而不能识别污染来源.拟杆菌在粪便微生物中丰度较高,在有氧水体中呈现快速衰减趋势,可应用于水体微生物污染事件的时间断定.鸡源特异性基因丰度较低且衰减较快,但因可以准确识别污染来源的特征使其具有不可替代性.
此外,判断指示菌可靠性的另一个重要指标是与病源微生物的关联性[24].已有研究表明,大肠埃希氏菌可较好反映病原微生物的特性[25].而本试验并未检测到沙门氏菌、志贺菌等致病菌的存在,可能原因为致病菌浓度相对较低,且由于存在个体差异使致病菌在健康状态的动物粪便中含量更低[26],以致影响试验测定.该结果也从另外一方面证明了将大肠埃希氏菌、鸡源特异性基因等作为水体微生物污染指示菌的优势与必要性.

表4 不同营养水平条件下指示微生物间的相关性分析Table 4 Correlations analysis of specific indicator in different levels of nutrition
3 结论
3.1 总细菌、大肠埃希氏菌、拟杆菌及鸡源特异性基因衰减规律较好的符合一级动力学模型.与初始拷贝数相比,拟杆菌和鸡源特异性基因最终衰减倍数约为 3000~7000,大肠埃希氏菌为20~40.拟杆菌和鸡源特异性基因相比大肠埃希氏菌在有氧水体中稳定性较差.
3.2 拟杆菌的衰减系数分别为 0.415,0.457(前者为对照组,下同);鸡源特异性基因为 0.425, 0.437;大肠埃希氏菌为 0.135,0.134.营养水平对大肠埃希氏菌、拟杆菌及鸡源特异性基因等指示微生物的衰减系数未产生显著影响
3.3 不同营养水平下,大肠埃希氏菌与拟杆菌(P<0.01)及鸡源特异性基因(P<0.005),拟杆菌与鸡源特异性基因(P<0.001)之间具有显著的相关性,说明3种指示菌均可用于评价水体的微生物污染程度,但特征各异.
[1] 王 强.1996—2006年我国饮用水污染突发公共卫生事件分析[J]. 环境与健康杂志, 2010,(4):328-331.
[2] 郭 萍,李红娜,李 峰,等.MST与水环境生物源污染定量化溯源 [J]. 农业环境科学学报, 2016,(2):205-211.
[3] Mayer R E, Bofill-Mas S, Egle L, et al. Occurrence of human-associated Bacteroidetes genetic source tracking markers in raw and treated wastewater of municipal and domestic origin and comparison to standard and alternative indicators of faecal pollution [J]. Water Research, 2015,90(6):265-276.
[4] Marta G D, Arnau C M, Maite M, et al. Development of new host-specific Bacteroides qPCRs for the identification of fecal contamination sources in water [J]. Microbiologyopen,2016,5(1):83-94.
[5] Boehm A B, Werfhorst L C V D, Griffith J F, et al. Performance of forty-one microbial source tracking methods: A twenty-seven lab evaluation study [J]. Water Research, 2013,47(18):6812-6828.
[6] Brown K I, Boehm A B. Comparative decay of Catellicoccus marimmalium and enterococci in beach sand and seawater [J]. Water Research, 2015,83:377-384.
[7] Brooks Y, Aslan A, Tamrakar S, et al. Analysis of the persistence of enteric markers in sewage polluted water on a solid matrix and in liquid suspension [J]. Water Research, 2015,76:201-212.
[8] Liang Z, He Z, Zhou X, et al. High diversity and differential persistence of fecal Bacteroidales population spiked into freshwater microcosm [J]. Water Research, 2012,46(1):247-257.
[9] Fogarty L R, Voytek M A. Comparison of bacteroides-prevotella 16S rRNA genetic markers for fecal samples from different animal species [J]. Applied & Environmental Microbiology, 2005, 71(10):5999-6007.
[10] Kobayashi A, Sano D, Hatori J, et al. Chicken- and duckassociated Bacteroides-Prevotella genetic markers for detecting fecal contamination in environmental water [J]. Applied Microbiology & Biotechnology, 2013,97(16):7427-7437.
[11] Siefring S, Varma M, Atikovic E, et al. Improved real-time PCR assays for the detection of fecal indicator bacteria in surface waters with different instrument and reagent systems [J]. Journal of Water & Health, 2008,6(6):225-237.
[12] Suzuki M T, Taylor L T, Delong E F. Quantitative Analysis of Small-Subunit rRNA Genes in Mixed Microbial Populations via 5'-Nuclease Assays [J]. Applied & Environmental Microbiology, 2000,66(11):4605-4614.
[13] Chern E C, Siefring S, Paar J, et al. Comparison of quantitative PCR assays for Escherichia coli targeting ribosomal RNA and single copy genes [J]. Letters in Applied Microbiology, 2011, 52(3):298-306.
[14] 王显贵,郭 萍,田云龙,等.利用 qPCR定量检测水体中猪源拟杆菌特异性生物标记的研究 [J]. 农业环境科学学报, 2013, (11):2302-2308.
[15] 刘 莎,王景峰,谌志强,等.促细菌快速生长培养基的研究 [J].环境与健康杂志, 2010,(8):662-665.
[16] Yu Z, Deng H, Wang D, et al. Nitrous oxide emissions in the Shanghai river network: implications for the effects of urban sewage and IPCC methodology [J]. Global Change Biology, 2013,19(10):2999-3010.
[17] Lu J, Domingo J S, Shanks O C. Identification of chickenspecific fecal microbial sequences using a metagenomic approach [J]. Water Research, 2007,41(16):3561-3574.
[18] GB 3838-2002 国家环保总局(2002)地表水环境质量标准 [S].北京:中国环境科学出版社.
[19] United States Environmental Protection Agency. Recreational Water Quality Criteria [Z]. 2012EPA—820-F-12—0612012.
[20] Byamukama D, Mach R L, Kansiime F, et al. Discrimination efficacy of fecal pollution detection in different aquatic habitats of a high-altitude tropical country, using presumptive coliforms, Escherichia coli, and Clostridium perfringens spores [J]. Applied & Environmental Microbiology, 2005,71(1):65-71.
[21] 张崇淼,王晓昌,周进宏,等.城市地表水中肠道病原微生物与粪便污染指示菌的关系研究 [J]. 环境科学学报, 2012(11):2789-2794.
[22] 吴仁人,汪 光,陆俊卿,等.美国水体微生物污染防治经验的探析与启示 [J]. 环境保护, 2015(9):57-59.
[23] Lee D Y, Lee H, Trevors J T, et al. Characterization of sources and loadings of fecal pollutants using microbial source tracking assays in urban and rural areas of the Grand River Watershed, Southwestern Ontario [J]. Water Research, 2014,53(8):123-131.
[24] Mansilha C R, Coelho C A, Reinas A, et al. Salmonella: the forgotten pathogen: health hazards of compliance with European bathing water legislation [J]. Marine Pollution Bulletin, 2010, 60(60):819-826.
[25] Wade T J, Pai N, Eisenberg J N S, et al. Do U.S. Environmental Protection Agency water quality guidelines for recreational waters prevent gastrointestinal illness? A systematic review and meta-analysis [J]. Environmental Health Perspectives, 2003, 111(8):1102-1109.
[26] Soltan M A, Tsai Y L, Lee P Y A, et al. Comparison of electron microscopy, ELISA, real time RT-PCR and insulated isothermal RT-PCR for the detection of Rotavirus group A (RVA) in feces of different animal species [J]. Journal of Virological Methods, 2016, 235:99-104.
Stability analysis of microbial pollution indicators in water under different nutrient levels.
ZHANG Yang1, JIA Le-hua4, WU Ren-ren2,5*, CHEN Zhong-ying2,5, LI Kai-ming2,5, ZHANG Yi-min1,3(1.College of Resources and Environment Engineering, Wuhan University of Technology, Wuhan 430070, China;2.South China Institute of Environmental Sciences, Ministry of Environmental Protection, Guangzhou 510640, China;3.College of Resources and Environment Engineering, Wuhan University of Science and Technology, Wuhan 430081, China;4.School of Bioscience and Bioengineering, South China University of Technology, Guangzhou 510006, China;5.The key Laboratory of Water and Air Pollution Control of Guangdong Province, Guangzhou 510655, China). China Environmental Science, 2017,37(3):1130~1136
Sensitivity and specificity have been used to assess the performance of fecal indicator in microbial source tracking. However, it is also important to characterize the stability of fecal indicators in aquatic habitats. In this study, indicators decay microcosm in aerobic circumstance was deployed. Decay characteristics of Escherichia coli(EC), Bacteroides (GB) and Chicken-specific marker(CB) in different nutrition condition was evaluated based on real-time quantitative PCR assay. The results indicated that decay rate of three indicators was fit to first-order kinetics. In the control group and experimental system that contain high nutrients levels indicates the attenuation coefficient k of EC (0.135vs. 0.134, the former as the control group, below the same as above), GB (0.415vs. 0.457), CB (0.425vs. 0.437) respectively. The effect of nutrition level on the decay rate of EC, GB and CB was inconspicuous. EC decayed gradually when compared with the severe attenuation of BC and CB. Although significant mutual linear correlationship of different indicators was observed, different characteristics of each indicator related to decay rate should specially be taken into consideration for further application.
microbial source tracking;microbial indicator;decay;nutrition;dissolved oxygen
X172,X52
A
1000-6923(2017)03-1130-07
张 杨(1988-),男,宁夏银川人,武汉理工大学与环境保护部华南环境科学研究所联合培养硕士研究生,主要从事环境微生物研究.
2016-07-11
国家自然科学基金项目(41303054);中央级公益性科研院所基本科研业务专项
* 责任作者, 副研究员, wurenren@scies.org
