高效液相色谱法构建定量结构-保留关系预测中药肝肾毒性组分的正辛醇-水分配系数值
2017-04-10项洋洋俞慧敏邓海山陈静雅张爱华池玉梅韩疏影
项洋洋, 俞慧敏, 邓海山, 陈静雅, 张爱华, 池玉梅, 韩疏影
(南京中医药大学, 江苏 南京 210046)
研究论文
高效液相色谱法构建定量结构-保留关系预测中药肝肾毒性组分的正辛醇-水分配系数值
项洋洋, 俞慧敏, 邓海山, 陈静雅, 张爱华, 池玉梅*, 韩疏影*
(南京中医药大学, 江苏 南京 210046)

反相高效液相色谱;摇瓶法;定量结构-保留关系;正辛醇-水分配系数;马兜铃酸;白黎芦醇
近年来,服用中药引起的毒副作用,尤其是其对肝肾的毒性引起了广泛关注[1-4]。目前,研究中药中潜在肝肾毒性组分的方法主要有特异性标志物法、组学(包括基因组学、蛋白质组学、代谢组学)技术、体外试验法等[5-8]。特异性标志物法可在早期发现药物引起的毒性,但缺乏灵敏性、特异性,且需要大量的生物样品[5,9]。组学技术系统阐述了药物的作用机制,但目前分析手段有限,无法对所有代谢产物进行分析,且其数据库不完善,缺乏代谢产物数据的标准值[10-13]。体外试验能控制环境因素,排除相互作用的系统影响,且具有简便、快捷、经济、可直接利用人细胞等优点,但体外试验无法系统模拟体内过程,难以预测物质的慢性毒性[14-16]。无论特异性标志物法、组学技术或体外试验,在确定新化合物毒性时均需借助各种分析技术[17,18],如核磁共振(NMR)、HPLC、超高效液相色谱(UPLC)与质谱联用、气相色谱(GC)与质谱联用等,时间和经济成本较高。定量-构效关系(QSAR)模型是一种借助分子的理化性质或结构参数,以数学和统计学手段定量研究有机小分子和生物大分子之间相互作用,以及有机小分子在生物体内的吸收、分布、代谢、排泄及毒性(ADMET)等生理相关性质的方法,广泛用于西药的合成与设计中,以评价新药物的毒性[19-21]。但是,QSAR甚少用于中药组分的肝肾毒性筛选与评价,目前只有一篇利用QSAR模型筛选中药中肝毒性活性组分的报道[22]。
正辛醇-水分配系数(Kow)作为QSAR模型中常用的重要参数,表征了药物在体内的ADMET过程,因此Kow数据的准确测定对于药物毒性的准确评价至关重要。由于中药材组分复杂,难以分离提取,因此Kow测定的经典方法,如摇瓶法(SFM)[23,24]和慢搅法(SSM)[25,26]难以实现对中药材中各组分Kow的准确快速测定,相关Kow数据稀缺,目前只见摇瓶法测得红景天中红景天苷和酪醇[27]以及九节龙全草提取物九节龙皂苷-Ⅰ的Kow值的报道[28]。Kow还可通过反相高效液相色谱(RP-HPLC)、薄层色谱(TLC)以及逆流色谱(CCC)等间接测定[29-34]。其中,RP-HPLC法应用最广泛。该法通过选取一组与待测化合物结构相似并有准确可靠Kow数据的模型化合物,测定其保留因子(k),建立k与Kow之间的定量关系——定量结构-保留关系(QSRR)模型[35,36];利用此模型,根据保留时间即可简单快速得到待测化合物的Kow值。目前,仅有以RP-HPLC法测定水解丹宁、丹参酮单体组分Kow的报道[37],尚未有对中药材中各复杂组分Kow测定的报道。
本文采用RP-HPLC法,以中性和酸性苯系物为模型化合物构建QSRR模型,快速准确地测定了中药材中的肾毒性组分马兜铃酸A、马兜铃酸B、马兜铃酸内酰胺及白藜芦醇的Kow值。通过此模型,可由保留时间同时快速得到中药材中多种目标组分的Kow值,解决了目标组分难以分离、无法获得Kow值的问题,并为通过QSAR模型实现快速预测中药组分的肝肾毒性提供了可靠的Kow数据支撑。

表 1 16种模型化合物的摇瓶法或慢搅法正辛醇-水分配系数(Kow)及解离常数(pKa)值
* Experimental logKowand pKavalues of model compounds were from ACD/Lab Database; # neutral compounds with no pKavalues.
1 实验部分
1.1 仪器与试剂
Thermo Fisher U3000型高效液相色谱仪(美国Thermo Fisher公司),配有DGP-3600RS双三元泵、WPS-3000TRS自动进样器、TCC-3000柱温箱、DAD-3000RSDAD检测器和Chromeleon 7.10工作站(美国Dionex公司); Sepax GP-C18色谱柱(150 mm×2.1 mm, 5 μm,苏州赛分科技有限公司); ACD/Labs Pro V10.0软件(加拿大ACD公司)用于计算化合物的疏水常数。
表1为实验所用的16种模型化合物(纯度均大于95.0%),均购自上海梯希爱化成工业发展有限公司,用甲醇配制各物质的储备液(1 g/L),储存于4 ℃冰箱中待用。甲醇(色谱纯)购自德国Merck公司;高氯酸(分析纯)购自国药集团化学试剂有限公司;硫脲(分析纯)购自海凌峰化学试剂有限公司;实验用水为超纯水(由Milli-Q系统制得,美国Millipore公司)。
1.2 色谱条件
色谱柱:Sepax GP-C18柱;流动相:甲醇-水(分别用高氯酸调节pH为2.80、3.20、3.60和4.00);流速:0.3 mL/min,进样量:10 μL,检测波长:250 nm,柱温:30 ℃。
1.3 实验方法
1.3.1 化合物100%水相保留因子kw的测定
在每一个水相pH(2.80、3.20、3.60和4.00)下,根据化合物各自疏水性的不同,选择甲醇/水体积比在0.40~0.95之间的4个比例进行等度洗脱。在每个流动相比例下,测定各化合物的保留时间tR及死时间t0(t0由硫脲的甲醇溶液测得),以两点校正法(DP-RTC)对tR及t0进行校正[38,39],由校正过的保留时间计算各化合物在不同流动相比例下的保留因子(k=(tR-t0)/t0)。根据Snyder-Soczewinski方程[40]得到化合物外推至100%水相的保留因子kw。实验中所有化合物的tR均为至少两次独立进样得到的平均值。
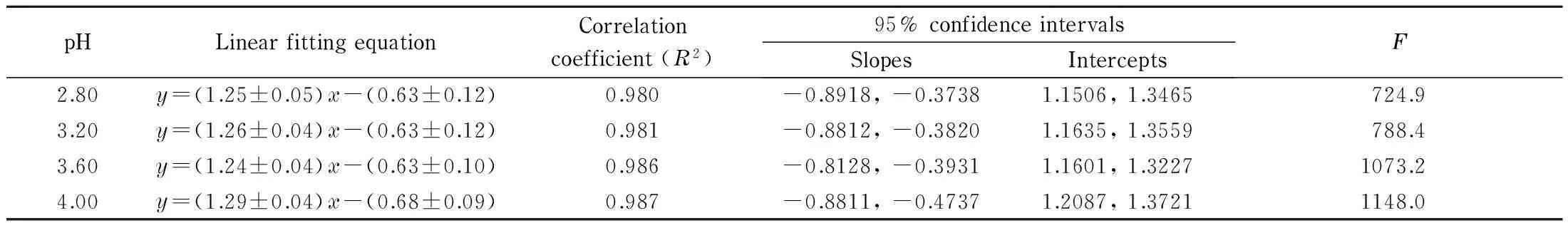
表 2 不同pH值下log Kow″-log kw QSRR线性拟合方程
F: Fister, the value of test statistic.y: logKow″;x: logkw.
1.3.2 化合物Kow的实验测定
采用SFM测定马兜铃酸A、马兜铃酸B、马兜铃酸内酰胺及白藜芦醇的实验Kow值。将上述4种化合物分别溶于水饱和的正辛醇中作为供试品溶液。以体积比1∶1、1∶2及2∶1将水饱和的正辛醇供试品溶液与正辛醇饱和的水溶液两相混合。在每个体积比下,平行处理3份样品,置于恒温振荡器上振摇24 h,静置1 h,以3 000 r/min的速度离心10 min,各取适量两相溶液,按1.2节条件进行测定,记录峰面积。将马兜铃酸A、马兜铃酸B、马兜铃酸内酰胺及白藜芦醇分别用水饱和的正辛醇配制成7个不同浓度的标准溶液,进样分析并绘制浓度与峰面积的标准曲线。采用标准曲线法分别测定两相中各溶质的浓度[23]。按正辛醇-水分配系数计算公式Kow=co/cw(co表示化合物在正辛醇相的浓度,cw表示化合物在水相的浓度)求得各化合物的Kow。
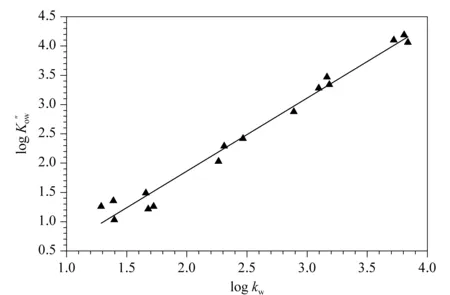
图 1 16种模型化合物的表观正辛醇-水分配系数对数值-100%水相保留因子对数值(log Kow″-log kw) 定量结构-保留关系(QSRR)模型(pH=2.80)Fig. 1 Quantitative structure-retention relationship (QSRR) model of logarithm values of the apparent n-octanol-water partition coefficient-logarithm values of the retention factor of 100% aqueous phase (log Kow″-log kw) (pH=2.80) of 16 model compounds
2 结果与讨论
2.1 logKow″-logkwQSRR模型的建立
对于弱解离化合物,通常将Kow校正为表观正辛醇-水分配系数Kow″,建立logKow″-logkwQSRR模型预测待测化合物的Kow″,再由Kow″值求得其Kow数据[38,39]。本试验选择了16种已知准确Kow实验数据的中性及酸性化合物作为模型化合物组(见表1),建立了logKow″-logkwQSRR模型(见图1)。不同流动相pH下的logKow″-logkw线性拟合方程如表2所示,这些QSRR模型的截距和斜率基本一致且线性关系良好(相关系数R2=0.980~0.987),说明在试验pH范围内,以Kow″对kw建立的QSRR模型基本不受流动相pH变化的影响。同时,试验发现不同pH下拟合得到的QSRR模型的斜率均稍偏离1,可能是溶质与固定相/流动相之间除了疏水作用以外的次级相互作用的结果,如氢键作用、溶质的立体几何结构的影响等;此外,不同流动相pH下得到的QSRR模型的截距均为负值,反映了溶质与反相C18柱固定相之间的结合力比与正辛醇之间的作用力更强[38]。
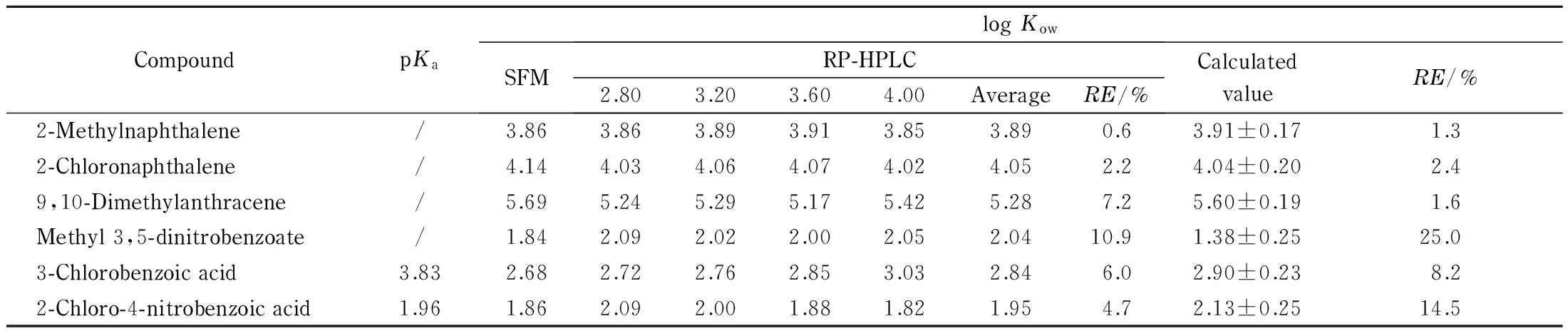
表 3 log Kow″-log kw QSRR模型的外部验证
RE: relative errors; /: neutral compounds without pKavalues.

表 4 4种待测化合物log Kow预测值及其SFM实验值、ACD/Lab计算值的比较
2.2 logKow″-logkwQSRR模型准确性的验证

2.3 logKow″-logkwQSRR模型应用于中药中潜在肾毒性组分Kow值的预测
利用上述QSRR模型测定了中药马兜铃提取物中马兜铃酸A、马兜铃酸B、马兜铃酸内酰胺及虎杖中白藜芦醇的Kow值。如表4所示,马兜铃酸A、马兜铃酸B及白黎芦醇的QSRR预测值与SFM测定值的相对误差很小(分别为0.3%、2.2%和0.7%);而马兜铃内酰胺的QSRR预测值与SFM测定值的相对误差稍大(13.2%)。这可能是由于马兜铃内酰胺为弱碱性化合物,导致本试验以中性和酸性化合物建立的QSRR模型对其Kow预测的准确性降低。
表4还列出了4种待测化合物的软件计算Kow值。可以看出,对于中药中结构复杂的物质,其软件计算值与实验测定值之间偏差较大。马兜铃酸A、马兜铃酸B、马兜铃内酰胺及白藜芦醇的软件计算值与实验测得值的相对误差分别为15.4%、4.4%、14.7%及15.0%。可离解弱酸性化合物马兜铃酸A、马兜铃酸B和白藜芦醇存在分子内、分子间氢键作用等,软件计算很难将这些因素全面考虑;另外,马兜铃内酰胺结构及官能团较复杂,导致软件计算误差也较大。

图 2 (a)3种马兜铃酸类对照品及其在马兜铃药材提取物中和(b)白黎芦醇对照品及其在虎杖药材提取物中的HPLC色谱图Fig. 2 HPLC chromatograms of (a) three aristolochics in mixed references and in Aristolochia extracts and (b) resveratrol reference substance and Polygonum cuspidatum extracts Peaks: 1. aristolochic acid B; 2. aristolochic acid A; 3. aristololactam; 4. resveratrol.
本试验以准确测定待测组分保留时间的方法快速获得其Kow值,对待测组分的纯度要求不高,无需对复杂的中药材进行分离得到各待测组分的单体,只需对含待测组分的中药材直接RP-HPLC进样分析即可,这解决了中药组分复杂难分离,无法通过经典SFM法准确测定其组分Kow值的问题。如图2所示,以含马兜铃酸类组分的马兜铃和含白黎芦醇组分的虎杖药材作为研究对象,对其中的马兜铃酸类组分和白黎芦醇组分进行RP-HPLC分析,同时得到各待测组分的保留时间,以QSRR模型直接预测了马兜铃酸A、马兜铃酸B、马兜铃酸内酰胺及白藜芦醇的Kow值。此法为快速预测中药复杂组分的Kow值提供了可能性。
3 结论
本实验以16种中性及酸性苯系物为模型化合物,建立了Kow″与kw的定量关系(QSRR模型)。采用内部与外部验证法评价了该模型的预测准确性,并成功预测了中药材肾毒性组分马兜铃酸A、马兜铃酸B、马兜铃酸内酰胺及白藜芦醇的Kow值。本文构建的QSRR模型通过RP-HPLC同时得到中药材中各待测组分的保留时间,仅通过保留时间即可得到其Kow数据。这种预测中药中各类复杂组分Kow值的简便策略解决了中药组分难以分离、无法通过经典SFM法准确测定其组分Kow值的问题。其可测定对象范围广(0 [1] Teschke R. J Clin Transl Hepatol, 2014, 2(2): 80 [2] Zhong Y F, Deng Y Y, Chen Y P, et al. Kidney Int, 2013, 84(6): 1108 [3] Frenzel C, Teschke R. Int J Mol Sci, 2016; 17(5): 588 [4] Zhang P, Ye Y G, Yang X Z, et al. Evid-Based Compl Alt, 2016, 2016: 3560812 [5] Larrey D, Faure S. J Hepatol, 2011, 54: 599 [6] Lao Y M, Jiang J G, Yan L. Brit J Pharmacol, 2009, 157(7): 1128 [7] Suo T C, Wang H X, Li Z. Expert Rev Proteomics, 2016, 13(9): 873 [8] Gomez-Lechon M J, Lahoz A, Gombau L, et al. Curr Pharm Des, 2010, 16(17): 1963 [9] Zhou Y, Qin S Z, Wang K. Current Biomarker Findings, 2013, 3: 1 [10] Ji Q, Zhu F S, Liu X, et al. Evid-Based Compl Alt, 2015, 2015: 983139 [11] Liu P, Liu S L, Tian D Z, et al. Evid-Based Compl Alt, 2012, 2012: 945824 [12] Yang M, Chen J L, Shi X F, et al. Mol Pharmaceut, 2015, 12(10): 3691 [13] Nijoukubo D, Tanaka Y, Okuno Y. Chemsphere, 2016, 156: 111 [14] Wang X F, Zhang R W, Gu L Q, et al. PLoS One, 2015, 10(2): e0116601 [16] Wang M, Liu C X, Dong R R, et al. Evid-Based Compl Alt, 2015, 2015: 379586 [17] Huang H L, Liu M, Chen P. Anal Lett, 2014, 47(11): 1835 [18] Wang R, Xiong A Z, Teng Z Q, et al. Int J Mol Sci, 2012, 13(11): 14634 [19] Low Y, Uehara T, Minowa Y, et al. Chem Res Toxicol, 2011, 24(8): 1251 [20] Rodgers A D, Zhu H, Fourches D, et al. Chem Res Toxicol, 2010, 23(4): 724 [21] Cherkasov A, Muratov E N, Fourches D, et al. J Med Chem, 2014, 57(12): 4977 [22] Huang S H, Tung C W, Fülöp F. Food Chem Toxicol, 2015, 78: 71 [23] The OECD Guidelines for the Testing of Chemicals. Test No. 107: Partition Coefficient (n-Octanol/Water): Shake Flask Method. (1995-07-27) [2016-10-01]. http://www.oecd-ilibrary.org/environment/test-no-107-partition-coeffi-cient-n-octanol-water-shake-flask-method_9789264069626-en [24] Purcell W P, Bass G E, Clayton J M. Strategy of Drug Design, New York: Wiley, 1973: 126 [25] Fisk A T, Rostenberg B, Cymbalisty C D, et al. Chemosphere, 1999, 39: 2549 [26] Bruijn J D, Busser F, Seinen W, et al. Environ Toxicol Chem, 1989, 8(6): 499 [27] Lin J Z, Zou L, Fu C M, et al. Chinese Traditional Patent Medicine, 2013, 35(3): 483 林俊芝, 邹亮, 傅超美, 等. 中成药, 2013, 35(3): 483 [28] Cao W Y, Feng B, Cheng L F. Chem Cent J, 2016, 10: 29 [29] Liang C, Han S Y, Lian H Z. J Sep Sci, 2014, 37(22): 3226 [30] Liang C, Lian H Z. TrAC-Trends Anal Chem, 2015, 68: 28 [31] Yu H M, Han S Y, Deng H S, et al. Chinese Journal of Analytical Chemistry, 2016, 44(6): 958 俞慧敏, 韩疏影, 邓海山, 等. 分析化学, 2016, 44(6): 958 [32] Liang C, Qiao J Q, Lian H Z, et al. Chinese Journal of Chromatography, 2016, 34(12): 1240 梁超, 乔俊琴, 练鸿振, 等. 色谱, 2016, 34(12): 1240 [33] Niestroj A, Pyka A, Klupsch J, et al. J Liq Chromatogr Relat Technol, 2004, 27(15): 2449 [34] Bhushan M N, Ito Y, Ma Y. J Liq Chromatogr Relat Technol, 1998, 21(1/2): 217 [35] Giaginis C, Theocharis S, Tsantili-Kakoulidou A. Anal Chim Acta, 2006(573/574): 311 [36] Balogh G T, Szántó Z, Forrai E, et al. J Pharm Biomed Anal, 2005, 39(5): 1057 [37] Shi Z H, He J T, Yao T T, et al. J Liq Chromatogr Relat Technol, 2004, 27(3): 465 [38] Han S Y, Qiao J Q, Zhang Y Y, et al. Talanta, 2012, 97: 355 [39] Han S Y, Liang C, Yu H M, et al. RSC Advance, 2015, 5(36): 28840 [40] Han S Y, Liang C, Qiao J Q, et al. Anal Chim Acta, 2012, 713: 130 Prediction ofn-octanol-water partition coefficients of hepatotoxicity/nephrotoxicity components in traditional herbs using quantitative structure-retention relationship models by high performance liquid chromatography XIANG Yangyang, YU Huimin, DENG Haishan, CHEN Jingya, ZHANG Aihua,CHI Yumei*, HAN Shuying* (NanjingUniversityofChineseMedicine,Nanjing210046,China) reversed-phase high performance liquid chromatography (RP-HPLC); shake-flask method (SFM); quantitative structure-retention relationship (QSRR);n-octanol-water partition coefficients (Kow); aristolochics; resveratrol 10.3724/SP.J.1123.2016.10044 2016-10-22 国家自然科学基金项目(81303311);江苏省自然科学基金项目(BK20130958);江苏省属高校自然科学基金项目(13KJB150030);江苏高校优势学科建设工程项目(PAPD);江苏高校品牌专业建设工程资助项目(PPZY2015A070). Foundation item: National Natural Science Foundation of China (No. 81303311); Natural Science Foundation of Jiangsu Province (No. BK20130958); Jiangsu Provincial University Natural Science Foundation (No. 13KJB150030); Project Funded by the Priority Academic Program Development of Jiangsu Higher Education Institutions (PAPD); Top-Notch Academic Programs Project of Jiangsu Higher Education Institutions (No. PPZY2015A070). O658 A 1000-8713(2017)04-0432-07 * 通讯联系人.Tel:(025)85811053,E-mail:ymchii@njutcm.edu.cn(池玉梅);E-mail:njutcmhsy@163.com(韩疏影).
猜你喜欢
——凹脉马兜铃
