超高效液相色谱-四极杆/静电场轨道阱高分辨质谱检测食品中的牛奶过敏原酪蛋白
2017-04-10詹丽娜古淑青邓晓军
詹丽娜, 陈 沁, 古淑青, 邓晓军
(1. 上海大学生命科学学院食品工程系, 上海 200436; 2. 上海出入境检验检疫局, 上海 200135)
研究论文
超高效液相色谱-四极杆/静电场轨道阱高分辨质谱检测食品中的牛奶过敏原酪蛋白
詹丽娜1, 陈 沁1, 古淑青2*, 邓晓军2
(1. 上海大学生命科学学院食品工程系, 上海 200436; 2. 上海出入境检验检疫局, 上海 200135)
基于超高效液相色谱-四极杆/静电场轨道阱高分辨质谱系统,建立了食品中牛奶过敏原酪蛋白的快速筛查和定量检测方法。样品经缓冲液提取后,采用5 kD超滤膜去除小分子杂质,得到蛋白质提取液。以数据依赖采集(data-dependent acquisition, DDA)方式获得全扫描质谱图,进行蛋白质定性确证,以平行反应监测(parallel reaction monitoring, PRM)技术对目标特征肽段进行定量分析。针对特征肽段,设计并合成了内标肽和内标物质,以降低基质效应和抵消处理过程中的损失。该方法应用于食品中的α-酪蛋白、β-酪蛋白和κ-酪蛋白的快速筛查和定量检测。结果表明,该方法在5~250 μg/L范围内线性关系良好,定量限为0.2~5.5 μg/kg,平均回收率在68.8%~104.4%之间,RSD<6%。该方法可用于果汁饮料、果酱、面包、早餐谷物中牛奶过敏原酪蛋白的快速筛查和定量分析。
超高效液相色谱;四极杆/静电场轨道阱高分辨质谱;酪蛋白;食品
食物过敏是过敏患者对某些食物产生的一种变态免疫反应。食物过敏原是引起过敏反应的抗原性物质,多数为食品中的蛋白质[1]。随着食物过敏人群在全世界范围内的增加,食物过敏已经成为当今社会一个主要的健康问题。目前发现大约有160种以上的食物含有过敏原,而90%以上的过敏反应都是由8大类过敏原引起的,包括:大豆、花生、坚果、奶类、蛋类、小麦、贝类和鱼类[2],其中牛奶是最常见的能够引起普遍过敏反应的食物之一。牛乳中蛋白质含量为3.0%~3.7%,其中酪蛋白约占牛奶蛋白质的80%~82%[3]。牛奶中的酪蛋白是氨基酸、钙和磷等多种有益物质的来源,但同时也是极容易引起过敏的食物过敏原。
目前过敏原检测方法主要有免疫分析法、聚合酶链反应(PCR)法和质谱法。免疫分析法主要是通过特异性抗体检测目标蛋白质,包括免疫印迹法和酶联免疫吸附试验(ELISA)。ELISA方法已经发展成商业试剂盒的形式,但由于食品热加工以及工艺过程会破坏目标蛋白质的结构,使蛋白质不能被特异性抗体识别,导致假阴性反应[4]。并且大多数ELISA试剂盒只能检测单一过敏原,不能同时对复杂食物基质中的多种过敏原进行检测,而且容易发生交叉反应[5]。PCR法对致敏食品中特异的DNA片段进行扩增,目标物质明确,假阳性率降低,但是检测物是DNA而非致敏蛋白质[6]。质谱方法既克服了免疫学方法存在的通量低和交叉反应的弊端,也克服了PCR技术不能直接检测致敏蛋白质的缺点,能够对蛋白质和多肽进行明确鉴定,并且可以同时直接检测多种过敏原[7]。已有多种类型的质量分析器包括三重四极杆质谱(QqQ)、四极杆-线性离子阱质谱(Q/LIT)、四极杆-飞行时间质谱(Q/TOF)等[8]被应用于食品过敏原的检测。
四极杆/静电场轨道阱高分辨质谱(Q/Orbitrap MS)将四极杆质谱和静电场轨道阱高分辨质谱串联,具有高质量分辨率和高灵敏度的优点[9-11],广泛应用于农药、药物、活性物质、致癌物质等的分析[10,12-14]。但将Orbitrap高分辨质谱技术应用于过敏原蛋白质的筛查和定量检测尚未见报道。本文建立了超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(UPLC-Q/Orbitrap MS)同时检测食品中的4种酪蛋白过敏原的方法,并应用于实际样品中酪蛋白过敏原的筛查和定量检测。
1 实验部分
1.1 仪器和试剂
UltiMate液相色谱-3000四极杆-静电场轨道阱质谱(Q Exactive)联用仪(Thermo Fisher, USA);水浴锅(SW22, Julabo,德国);离心机(Allegra X-22R Centrifuge, Beckman Coulter, USA);所有实验用水由Milli-Q超纯水系统(Millipore, USA)制得。碳酸氢铵、二硫苏糖醇(DDT)、碘代乙酰胺(IAA)、氯化钙、牛胰蛋白酶、α-酪蛋白、β-酪蛋白、κ-酪蛋白均购自Sigma公司(USA); 40 mmol/L Tris-HCl(Fluka, USA);甲酸(≥98%, Fluka, USA);乙腈(Thermo Fisher, USA)。超滤离心管(1.5 mL, Sartorius,德国)、低蛋白吸附离心管(1.5 mL, Eppendorf,德国)、低蛋白吸附移液器吸头(0.1 mL/1 mL, Brand,德国)、低蛋白吸附滤膜(0.22 μm, Agela, USA)。用水将各标准蛋白质配制成标准储备液,其中α-酪蛋白标准储备液300 μg/mL(α-S1酪蛋白和α-S2酪蛋白的质量比为79∶21),β-酪蛋白标准储备液250 μg/mL,κ-酪蛋白标准储备液240 μg/mL。实验中使用的特征肽、内标肽及内标物由上海波泰生物科技有限公司合成。取浓度为10 μg/mL的各内标肽段及内标物标准储备液50 μL,加入0.1%(v/v)甲酸溶液定容至1 mL,配制成质量浓度均为0.5 μg/mL的标准工作溶液。面包、早餐谷物、果汁、果酱等样品为市售。
1.2 样品前处理
取1 g固体样品,加入25 mL 40 mmol/L Tris-HCl;或取5 g液体样品加入20 mL 40 mmol/L Tris-HCl。放入水浴锅中,于65 ℃振荡提取2 h。取出后4 000 g下离心5 min,取上清液500 μL,加入100 μL内标物标准工作溶液,混合后转移至5 kD超滤离心管中。于10 000 g下高速离心15 min,超滤浓缩除去小分子杂质得到蛋白质提取液。吸取200 μL蛋白质提取液加入1.5 mL低蛋白吸附离心管中,随后加入150 μL 500 mmol/L的碳酸氢铵,混匀后加入10 μL 500 mmol/L的DDT溶液,混匀,于75 ℃下恒温反应30 min。冷却至室温后加入30 μL 500 mmol/L的IAA溶液,暗处静止30 min。随后加入10 μL 100 mmol/L的氯化钙溶液和50 μL 500 μg/mL的牛胰蛋白酶溶液,混匀后置于37 ℃恒温水浴中酶解2 h。最后加10 μL甲酸终止反应,静置15 min,用水定容至1 mL,过0.22 μm低蛋白吸附滤膜,采用UPLC-Q/Orbitrap MS进行分析。
采用果汁、果酱、面包和麦片作为空白基质,按照5.0、2.0和0.5 mg/L 3个水平进行蛋白质加标回收试验。
1.3 UPLC-Q/Orbitrap MS条件
1.3.1 色谱条件
反相色谱柱:Kinetex XB-C18 (100 mm×2.1 mm, 1.7 μm, Phenomenex, USA)。进样体积:10 μL;柱温:35 ℃。流动相A为0.05%(v/v)甲酸溶液,流动相B为0.05%(v/v)甲酸乙腈溶液。采用梯度洗脱:0~4 min, 97%A; 4~19 min, 97%A~30%A; 19~20 min, 30%A~10%A; 20~24 min, 10%A; 24~25 min, 10%A~97%A; 25~30 min, 97%A。流速:0.2 mL/min。
1.3.2 质谱条件
电喷雾电离(ESI)源采用正离子模式;保护气压力:206.85 kPa(30 psi);辅助气压力:68.95 kPa(10 psi);喷嘴电压:3.5 kV;毛细管温度:320 ℃;辅助气温度:250 ℃;全扫描模式,扫描范围m/z300~2 000;分辨率:35 000。根据参考文献[15-19],每种酪蛋白选择两个特征肽段,并通过MS对酪蛋白酶解肽段的参数进行了优化(见表1)。

表 1 牛奶过敏原酪蛋白酶解肽段MS参数
1.4 标准曲线
为了检测胰蛋白酶酶解后食物样品中的肽段浓度,用含有以上8个合成肽段的标准工作溶液制作标准曲线,在每个浓度的溶液中均加入100 μL内标肽段混合工作溶液。由于不同的食物基质对肽段信号具有增强或抑制的作用,为降低基质效应对酪蛋白定量的影响,采用空白基质提取液配制标准曲线[12]。
2 结果和讨论
2.1 特征肽段的选择
特征肽段的选择对基于胰蛋白酶酶解方法进行定量的蛋白质来说非常重要,一段合适的特征肽段序列对于被分析蛋白质来说必须具有特异性,不易发生蛋白质修饰;易被质谱系统检测;非常稳定;酶解具有较高的重现性,不会发生错切或漏切;6~12个氨基酸长度的肽为优先选择,肽段过短会降低其特异性,肽段过长定量不准确[20]。MRM方法的建立可以基于一个单一的特征肽,但最好每个蛋白质选2~3个肽,以获得更好的特异性。
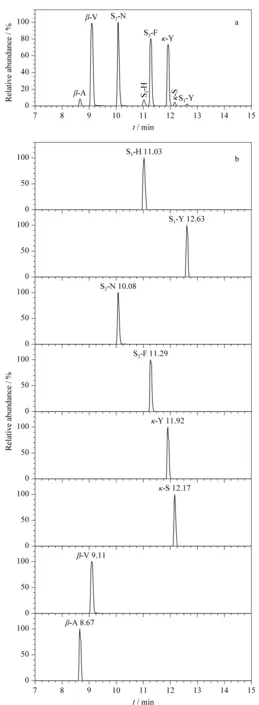
图 1 果汁基质中8种特征肽段的UPLC-MS/MS色谱图Fig. 1 UPLC-MS/MS chromatograms of the eight targeted peptides of casein in juice a. total ion chromatogram(TIC)of the eight targeted peptides; b. extracted chromatograms of the eight targeted peptides.
随着基因组学和蛋白质组学的发展,在蛋白质数据库中可以获得4种酪蛋白完整的氨基酸序列。利用Proteinpilot软件将4种酪蛋白的全扫描数据与其氨基酸序列进行匹配验证,每个蛋白质筛选出2个肽段,结合相关文献[15-19],并经BLAST搜索确认其为该蛋白质的特征肽段(BLAST search, www.blast.ncbi.nlm.nih.gov/Blast.cgi)。空白果汁中添加质量浓度为250 μg/L的标准肽段混合溶液,通过UPLC-MS/MS分析,结果如图1所示。8个特征肽段的响应强度和保留时间均不相同,各肽段在本实验各仪器参数条件下能很好地分开。为了给每种蛋白质选择一个最合适的肽段,对果汁基质进行加标,4种酪蛋白的加标水平均为10 mg/L,通过酶解后进样检测。根据实验结果可知,肽段S1-H、S2-F、κ-S和β-V在酶解后的加标样品中测得的浓度最高,说明这4个肽段较其他肽段性质稳定且在该实验条件下离子化效率较高。综合考虑,选择以上4种肽段分别作为α-S1、α-S2、κ-和β-酪蛋白的特征肽段。
2.2 内标的设计和选择
对MS检测影响最大的是基质效应。样品中目标物的共流出组分会影响样品的离子化效率,使目标物在基质和溶剂中的响应各不相同,从而对结果产生影响。因此需要引入内标来消除基质效应对结果的影响[21,22]。根据内标的选择原则,本文选择与特征肽段相似的氨基酸序列作为内标。采用在特征肽段氨基酸序列中增加或者替代一个氨基酸作为内标物质,增加或替代的氨基酸应满足如下要求:取代氨基酸与原氨基酸应具有相近的极性和化学结构,保证其与特征肽具有相似的色谱行为;两个氨基酸间的相对分子质量相差20 Da以上,以降低与特征肽段间的相互干扰;避免取代或替换氨基酸序列中胰蛋白酶的位点R和K,以免影响酶切效率;避免取代碎片离子两端的氨基酸,以免影响碎片离子的离子化效率。基于此原则合成了8种内标肽段(见表2)。
为考察合成的8种内标肽段和特征肽段之间是否存在干扰,根据肽段的色谱检测条件,将相同浓度的合成内标肽段标准溶液与特征肽段标准溶液混合后进样。
内标肽段的主要作用是用来消除因基质效应影响造成的实验结果误差,要求内标肽段与特征肽段的性质较为相近。鉴于此,需要对合成的8个内标肽段的色谱行为以及质谱行为进行比较。色谱行为主要由保留时间体现,由图2可知,各内标肽段与各蛋白质特征肽段保留时间均不相同,其中S1-2、S2-2、κ-1和β-1的保留时间与各酪蛋白特征肽段保留时间最为接近,表明其在反相色谱柱上的行为与各蛋白质特征肽段最为相近。
接下来进行质谱行为的比较。质谱行为主要体现在离子化效率上,离子化行为相近则其质谱行为亦相近,而离子化效率由灵敏度体现出来。为研究各物质的离子化效率,将各内标肽段及酪蛋白特征肽段配制成浓度为5、25、50、100、150 nmol/L的系列标准溶液,经进样分析后,以浓度为横坐标、面积为纵坐标做线性拟合,得各内标肽段和各酪蛋白特征肽段的线性方程和曲线(见图3)。内标肽段S1-2、S2-2、κ-1和β-1的斜率和各自酪蛋白特征肽段斜率最为接近,即在相同浓度范围内,内标肽段与对应的酪蛋白特征肽段的响应值较为接近,也说明其离子化效率较为相近。综合上述两者的比较,选择内标肽段S1-2、S2-2、κ-1和β-1作为各酪蛋白的内标肽段。
选定内标肽段后,根据这4个酪蛋白的氨基酸序列,在内标肽段两端加上与特征肽段相同的10个氨基酸,以保证在酶解过程中内标物与蛋白质具有相同的酶解位点。考察所合成的内标物是否合适,主要看其是否和蛋白质具有相同的酶解效率。取浓度为50 nmol/L的蛋白质和内标物混合后,按1.2节步骤酶解、进样;另外,将内标肽段和特征肽段配制成与上步相同浓度的标准工作液,进样。以酪蛋白特征肽段的峰面积为分母、酪蛋白酶解所得肽段的峰面积为分子,计算蛋白质的酶解效率;以内标肽段峰面积为分母、内标物酶解所得肽段的峰面积为分子,计算内标物的酶解效率;并计算二者百分比。α-S1、α-S2、κ-和β-酪蛋白由内标物计算所得的酶解效率分别为90%、78%、94%和96%;由蛋白质计算所得的酶解效率分别为88%、80%、90%和95%。两者相近,说明本实验中所合成的内标物与各自酪蛋白之间有相同的酶解效率和色谱行为,可以消除酶解效率对实验的影响。
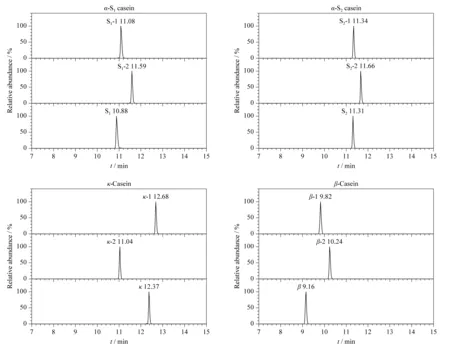
图 2 果汁中酪蛋白特征肽段与合成内标肽段的色谱图Fig. 2 Chromatograms of the casein signature peptides and synthetic internal standard peptides in juice
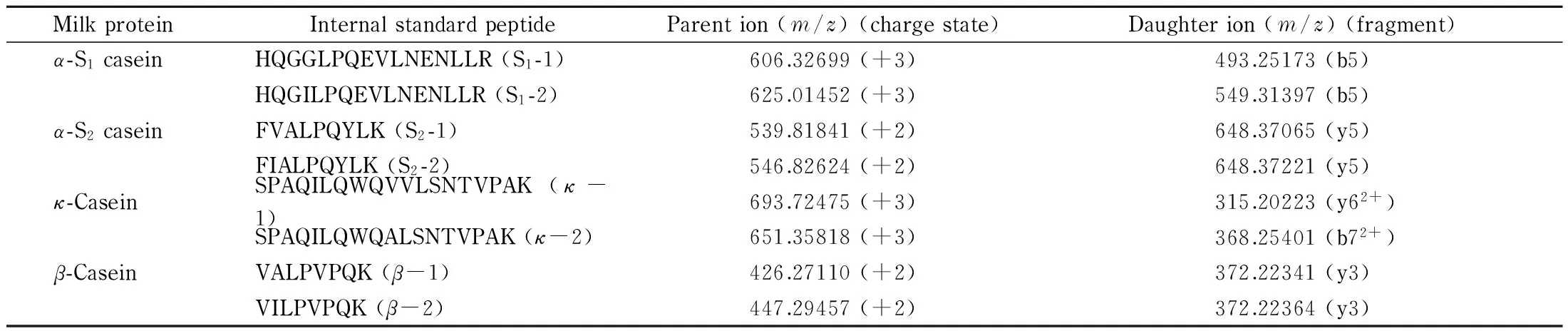
MilkproteinInternalstandardpeptideParention(m/z)(chargestate)Daughterion(m/z)(fragment)α-S1caseinHQGGLPQEVLNENLLR(S1-1)606.32699(+3)493.25173(b5)HQGILPQEVLNENLLR(S1-2)625.01452(+3)549.31397(b5)α-S2caseinFVALPQYLK(S2-1)539.81841(+2)648.37065(y5)FIALPQYLK(S2-2)546.82624(+2)648.37221(y5)κ-CaseinSPAQILQWQVVLSNTVPAK(κ-1)693.72475(+3)315.20223(y62+)SPAQILQWQALSNTVPAK(κ-2)651.35818(+3)368.25401(b72+)β-CaseinVALPVPQK(β-1)426.27110(+2)372.22341(y3)VILPVPQK(β-2)447.29457(+2)372.22364(y3)
2.3 样品前处理方法的优化
最佳酶解时间:在果汁中加入酪蛋白标准溶液,蛋白质的质量浓度为10 mg/L。按照1.2节样品前处理步骤进行酶解,酶解时间分别设定为1、2、3、4、5 h和过夜(约16 h),每个时间点进样3次,结果见图4。根据蛋白质和肽段的等物质的量的关系,可以计算出各酪蛋白的含量。当酶解时间为2 h时,各酪蛋白特征肽的检测浓度达到最高值,由此推算出酶解的酪蛋白的浓度也达到最高值,因此本实验中酶解时间定为2 h。
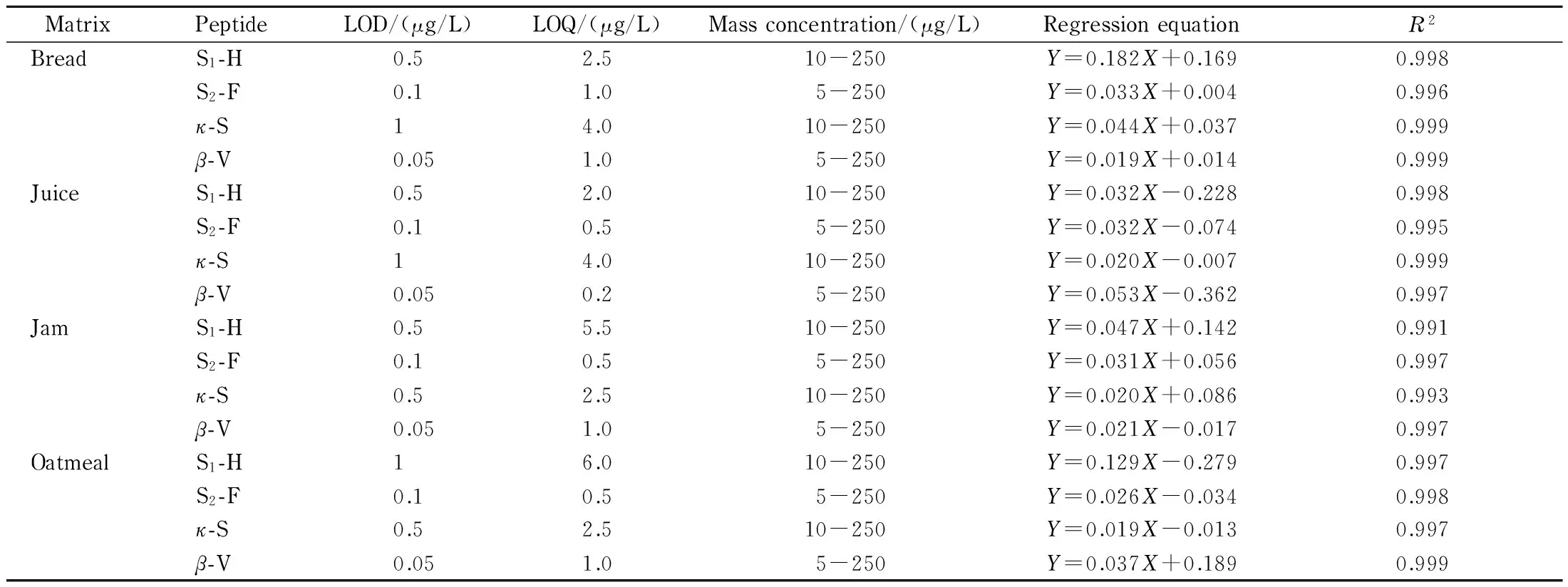
表 3 空白基质中过敏原酪蛋白特征肽段的LOD、LOQ和线性关系(n=5)
Y: peak area;X: mass concentration, μg/L.

图 3 4种酪蛋白特征肽段与合成内标肽段的线性响应Fig. 3 Linear response of four casein signature peptides and internal standard peptides
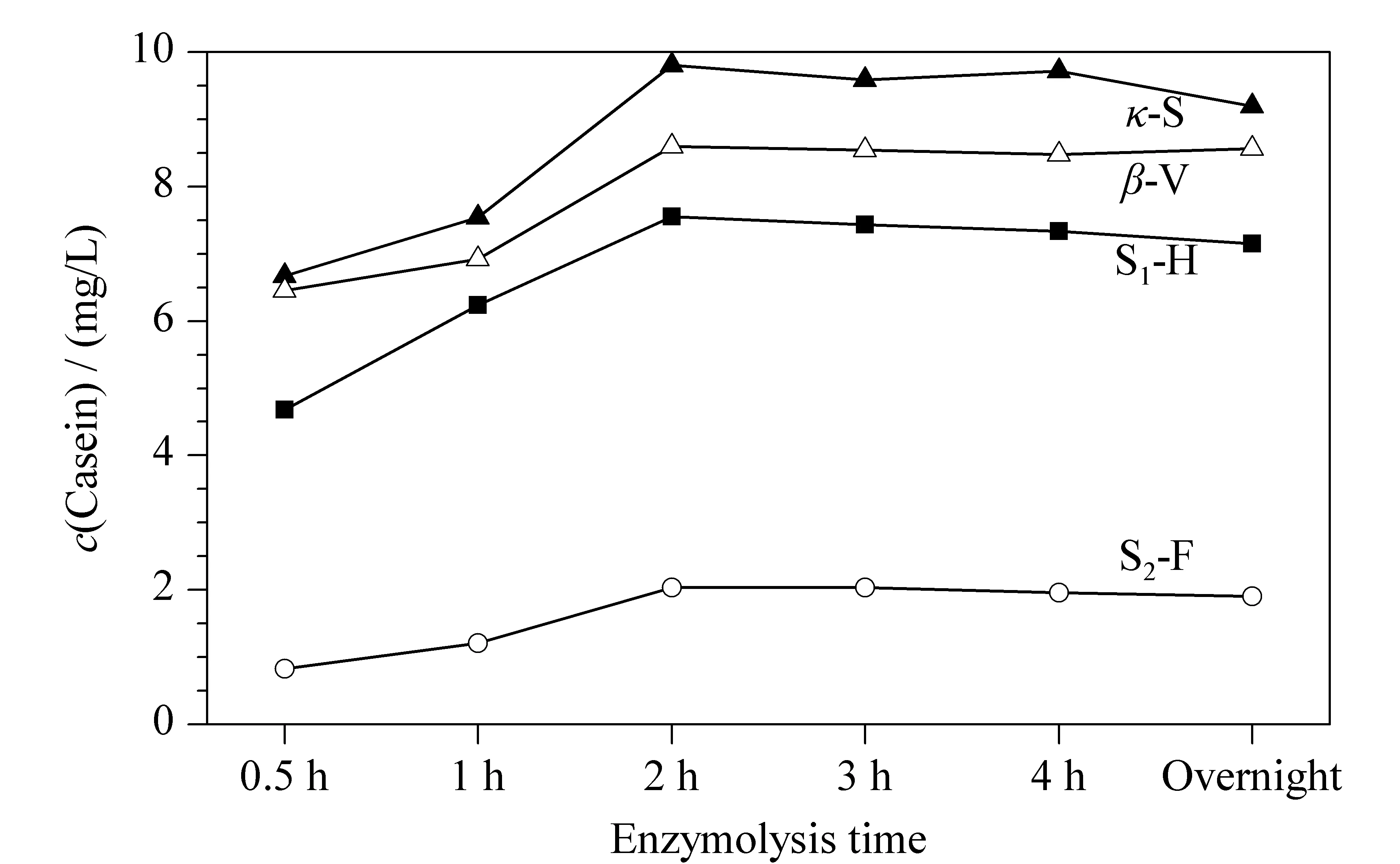
图 4 4种酪蛋白的酶解浓度随酶解时间的变化Fig. 4 Enzymatic concentrations of four types of caseins along with the enzymatic hydrolysis times
2.4 方法的线性关系、LOD和LOQ
在4种样品中分别找出一个不含有牛奶的样品作为空白,采用空白基质提取液配制标准曲线,每个浓度点均加入100 μL对应的内标肽段标准工作溶液。最终肽段S1-H和к-S的质量浓度为10、25、50、100和250 μg/L;肽段S2-F和β-V的质量浓度为5、25、50、100和250 μg/L。在空白基质提取液中,添加低浓度水平的标准溶液,获得每个肽段信噪比(S/N)为3时的质量浓度,作为该特征肽段的LOD,S/N=10时的质量浓度为LOQ,结果见表3。
2.5 加标回收率
在4种样品的提取液中加入标准蛋白质和内标物,根据蛋白质和特征肽段的等物质的量的关系计算加标回收率。蛋白质的添加水平分别为5.0、2.0和0.5 mg/L(n=6)。如表4所示,α-S1酪蛋白回收率在68.8%~95.5%之间,RSD≤5.7%;α-S2酪蛋白回收率在86.0%~99.5%之间,RSD≤4.6%;κ-酪蛋白回收率在79.5%~104%之间,RSD≤5.5%;β-酪蛋白回收率在70.8%~92.4%之间,RSD≤5.6%。
2.6 精密度
精密度通过所测加标基质的RSD反映。因此,在空白面包基质中分别添加3个水平的酪蛋白进行精密度计算。按1.2节样品前处理步骤进行酶解。日内精密度:每个空白基质取9份,每个水平单独加标3次,按照样品前处理步骤进行酶解后,每份样品进样检测3次;日间精密度:连续3天中,样品每个水平加标一次,酶解后,每个样品平行检测3次。添加水平及检测结果见表5。
2.7 实际样品检测
为了验证所建立分析方法的实用性,在市场上找了28种果汁、果酱、面包和麦片样品,所有样品都按1.2节样品前处理步骤进行酶解,最后采用UPLC-MS/MS检测其中的4种酪蛋白过敏原含量,结果见表6。虽然所选样品的标签上都没有标明产品中含有牛奶过敏原,但是仍在一些样品中发现了酪蛋白。面包样品中的酪蛋白含量最高,因为面包加工过程中加入牛奶可以改善面包的风味,保持面包表面光滑并具有较好的保水性。
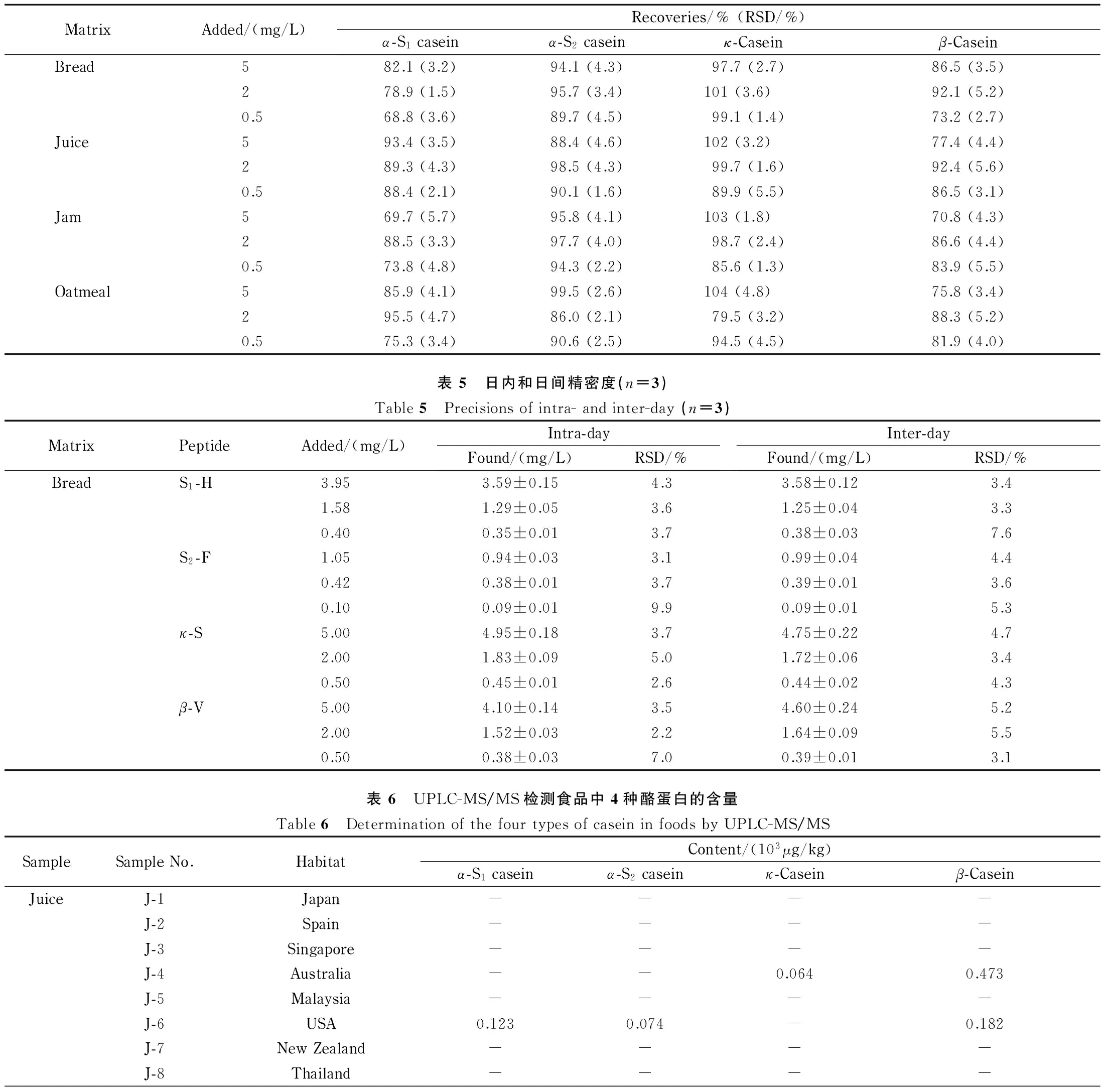
表 4 4种基质中酪蛋白的加标回收率和RSD(n=6)
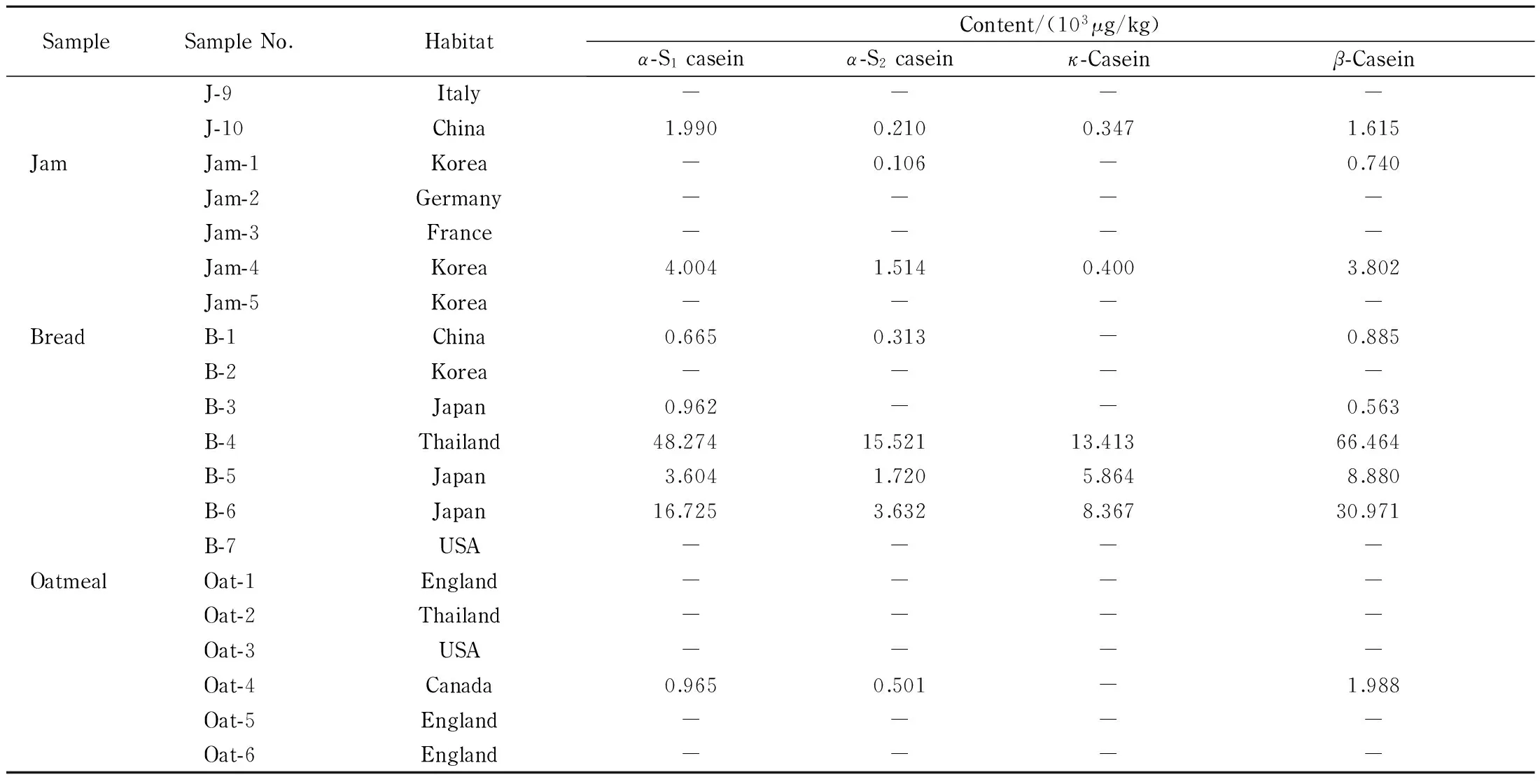
表 6 (续)
-: not detected.
3 结论
本方法采用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱检测食品中的牛奶过敏原酪蛋白,样品前处理步骤简单,酶解时间短,且有较高的灵敏度和回收率。设计的内标物降低了复杂样品中的基质干扰,显著提高了定性和定量分析结果的准确性,能满足面包、饼干、果汁、果酱等食品中酪蛋白过敏原的快速筛查和定量分析。
[1] Heick J, Fischer B, Kerbach S, et al. J AOAC Int, 2011, 94(4): 1060
[2] Monaci L, Visconti A. TrAC-Trends Anal Chem, 2009, 28(5): 581
[3] Zhang Y, Hu Z H, Lai Y P. Chinese Journal of Food Science, 2009, 30(14): 31
张艳, 胡志和, 赖宜萍. 食品科学, 2009, 30(14): 31
[4] Ansari P, Stoppacher N, Rudolf J, et al. Anal Bioanal Chem, 2011, 399: 1105
[5] Feng X Y, Zhang J, Lü M L, et al. Chinese Journal of Chromatography, 2013, 31(6): 510
冯小燕, 张津, 吕美玲, 等. 色谱, 2013, 31(6): 510
[6] Heick J, Ficher M, Popping B. J Chromatogr A, 2011, 2(18): 938
[7] Gu S Q, Zhao C M, Cheng J, et al. Chinese Journal of Chromatography, 2016, 43(7): 639
古淑青, 赵超敏, 程甲, 等. 色谱, 2016, 43(7): 639
[8] Wang X, Wang S, Cai Z. TrAC-Trends Anal Chem, 2013, 52: 170
[9] Mamone G, Picariello G, Caira S, et al. J Chromatogr A, 2009, 1216: 7130
[10] Ye X W, Peng Y, Niu Z Y, et al. Chinese Journal of Chromatography, 2015, 33(4): 377
叶曦雯, 彭燕, 牛增元, 等. 色谱, 2015, 33(4): 377
[11] Stefano V D, Avellone G, Bongiorno D, et al. J Chromatogr A, 2012, 1259: 74
[12] Zhao S Z, Yi X H, Shi Y J, et al. Chinese Journal of Chromatography, 2016, 34(4): 397
赵善贞, 伊雄海, 时逸吟, 等. 色谱, 2016, 34(4): 397
[13] Du Y S, Li Q, Wu C M, et al. Chinese Journal of Chromatography, 2015, 33(4): 371
杜彦山, 李强, 吴春敏, 等. 色谱, 2015, 33(4): 371
[14] Zhang X G, Zheng Y J, Cao Y T, et al. Chinese Journal of Chromatography, 2015, 33(6): 583
张协光, 郑彦捷, 曹泳艇, 等. 色谱, 2015, 33(6): 583
[15] Mattarozzi M, Milioli M, Bignardi C, et al. Food Control, 2014, 38: 82
[16] Newsome G A, Scholl P F. J Agric Food Chem, 2013, 61(24): 5659
[17] Zhang W, He Y, Liu W, et al. Chinese Journal of Analytical Chemistry, 2013, 41(10): 1493
张伟, 贺艳, 刘伟, 等. 分析化学, 2013, 41(10): 1493
[18] Monacia L, Lositob I, Palmisanob F, et al. J Chromatogr A, 2010, 1217(26): 4300
[19] Lutter P, Parisod V, Weymuth H. J AOAC Int, 2011, 94(4): 1043
[20] Koeberl M, Clarke D, Lopata A L. J Proteome Res, 2014, 13(8): 3499
[21] Zhang J S. [PhD Dissertation]. Hangzhou: Zhejiang University, 2012
张京顺. [博士学位论文]. 杭州: 浙江大学, 2012
[22] Zhang J S, Lai S Y, Zhang Y, et al. Anal Chim Acta, 2012, 727: 47
Determination of milk allergen caseins in foods by ultra performance liquid chromatography-quadrupole/ electrostatic field orbitrap high resolution mass spectrometry
ZHAN Lina1, CHEN Qin1, GU Shuqing2*, DENG Xiaojun2
(1.DepartmentofFoodEngineering,SchoolofLifeScience,ShanghaiUniversity,Shanghai200436,China;2.ShanghaiEntry-ExitInspectionandQuarantineBureau,Shanghai200135,China)
Based on ultra performance liquid chromatography-quadrupole/electrostatic field orbitrap high resolution mass spectrometry (UPLC-Q/Orbitrap MS) system, a rapid screening and quantitative detection method for milk allergen caseins was developed. After the sample was extracted with protein extraction buffer, a 5 kD ultrafiltration membrane was used to remove small molecule impurities. The extracted protein was then digested by trypsin. The full-scan mass spectra obtained by the data-dependent acquisition (DDA) mode were used for protein identification, and parallel reaction monitoring (PRM) technique was used for quantitative analysis of the target signature peptide. The internal standard peptide and the internal standard substances for every signature peptide were designed and synthesized to reduce the matrix effect and eliminate the loss in sample pretreatment. The proposed method showed a good linear relationship in the range of 5-250 μg/L. The limits of quantitation were in the range of 0.2-5.5 μg/kg. The observed recoveries ranged from 68.8% to 104.4%, and the RSDs were lower than 6%. This method can be used for rapid screening and quantitative analysis of milk allergen casein in juice, jam, bread and breakfast cereals.
ultra performance liquid chromatography (UPLC); quadrupole/electrostatic field orbitrap high resolution mass spectrometry (Q/Orbitrap MS); casein; foods
10.3724/SP.J.1123.2016.10034
2016-10-11
上海市自然科学基金项目(14ZR1450000);长三角科技联合攻关领域项目(15395810101,16395810101);国家质检总局科技项目(2016IK222).
Foundation item: Shanghai Natural Science Foundation (No. 14ZR1450000); Science and Technology Joint Project of the Yangtze River Delta (Nos. 15395810101, 16395810101); Scientific and Technological Project of the General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China (No. 2016IK222).
O658
A
1000-8713(2017)04-0405-08
* 通讯联系人.E-mail:gushuqing@sina.cn.
