液相色谱-大气压化学电离串联质谱法测定婴幼儿配方奶粉中的维生素D
2017-04-10严丽娟李文斌洪煜琛徐敦明林立毅顾春燕
严丽娟, 李文斌, 洪煜琛, 吴 敏, 徐敦明*, 林立毅, 顾春燕
(1. 厦门出入境检验检疫局技术中心, 福建 厦门 361026; 2. 北京迪马科技有限公司, 北京 100029)
研究论文
液相色谱-大气压化学电离串联质谱法测定婴幼儿配方奶粉中的维生素D
严丽娟1, 李文斌2, 洪煜琛1, 吴 敏1, 徐敦明1*, 林立毅1, 顾春燕2
(1. 厦门出入境检验检疫局技术中心, 福建 厦门 361026; 2. 北京迪马科技有限公司, 北京 100029)
建立了婴幼儿配方奶粉中维生素D的液相色谱-大气压化学电离串联质谱(LC-APCI-MS/MS)分析方法。样品经正己烷和甲基叔丁基醚混合溶液提取,ProElut VDC固相萃取柱净化,Kinetex C18色谱柱分离,采用大气压化学电离(APCI)源、正离子扫描和多反应监测(MRM)模式对维生素D2和维生素D3进行检测,内标法定量。结果表明维生素D2和维生素D3在5~5 000 μg/L范围内均具有良好的线性关系,检出限为2 μg/kg,定量限为5 μg/kg。在5、10和100 μg/kg添加水平下,维生素D2和维生素D3的回收率为85.2%~105.3%,相对标准偏差为4.7%~8.1%。该方法简便准确,灵敏度高,适用于婴幼儿奶粉中维生素D的测定。
液相色谱-大气压化学电离串联质谱;维生素D;婴幼儿配方奶粉
维生素D为固醇类衍生物,是一种重要的脂溶性维生素。维生素D参与人体内分泌系统对骨骼和无机盐的代谢调节,对于人体健康有诸多益处,具有预防佝偻病和调节人体钙吸收的作用,还能起到有效治疗软骨病的功效。维生素D是一种激素的前体,可由人体皮肤合成,合成量具有波动性,维生素D家族成员中最重要的成员是维生素D2(麦角钙化醇)和维生素D3(胆钙化醇)。在阳光充足的情况下,人体自身可以合成维生素D3。婴幼儿是维生素D缺乏的潜在高危人群,维生素D缺乏易患佝偻病,引起生长迟缓和骨骼变形,童年时保证摄入足够的维生素D能降低成年后患骨质疏松症的风险。婴幼儿奶粉中维生素D允许使用的添加形式为维生素D2或维生素D3[1]。
目前乳制品中维生素D的检测过程通常是先将样品进行皂化处理,然后用有机溶剂进行液液萃取,采用液相色谱法[2-7]或液相色谱-质谱联用法[8-14]分析。由于样品中维生素D含量低,基质干扰严重,且前处理过程繁琐,维生素D损失较大,很难对维生素D进行准确的定性和定量检测。本文改进了婴幼儿配方奶粉中维生素D的测定方法,样品未经皂化,直接提取,然后通过ProElut VDC固相萃取柱净化,用高效液相色谱-串联质谱法进行测定,同位素内标法定量,有效地降低了基质干扰,操作过程简单,为婴幼儿奶粉中维生素D的检测提供了更为简便有效的方法。
1 实验部分
1.1 仪器与试剂
Agilent 1290高效液相色谱仪(美国安捷伦公司); QTRAP 6500质谱仪,配有大气压化学电离(APCI)源(美国AB SCIEX公司);硅胶、N-丙基乙二胺(PSA)、弗罗里硅土(Florisil)和ProElut VDC(2 g/12 mL)固相萃取柱(北京迪马公司)。Allegra 64R型高速冷冻离心机(美国Beckman Coulter公司);旋涡混合器(德国IKA公司); N-1000旋转蒸发仪(日本EYELA公司); Fotector-06自动固相萃取仪(厦门睿科公司);自动氮吹浓缩仪(美国Capiler Life Sciences公司); UV-2450紫外分光光度计(日本岛津公司); CP225D电子分析天平(德国Sartorius公司)。
甲醇、乙腈、无水乙醇、正己烷、乙酸乙酯和二甲基亚砜均为色谱纯(美国Merck公司);甲基叔丁基醚和柠檬酸均为分析纯(国药集团化学试剂有限公司)。维生素D2(纯度99.1%)和维生素D3(纯度99.9%)标准品均购自德国Dr. Ehrenstorfer公司,同位素内标d3-维生素D3(纯度97%)购自美国IsoSciences公司。Phenomenex Kinetex C18色谱柱(100 mm×4.6 mm,粒径2.6 μm)购自美国菲罗门公司。实验用水由Milli-Q系统(美国Millipore公司)制得。
准确称取适量标准品,分别用无水乙醇溶解并定容至100 mL棕色容量瓶中。维生素D2和维生素D3标准储备液配制后需要通过紫外吸光值进行校正,具体步骤同GB 5413.9-2010附录A。移取各标准储备溶液,用无水乙醇稀释成质量浓度为10.0 mg/L的混合标准中间溶液,于-18 ℃下避光保存。根据需要用乙醇逐级稀释,配成适当质量浓度的混合标准溶液,现用现配。
1.2 样品前处理
称取2.0 g样品于50 mL离心管中,加入15 μL 10 mg/L d3-维生素D3内标,再加入5 mL质量分数为20%的柠檬酸水溶液,充分混匀,加入8 mL二甲基亚砜和10 mL甲醇,振荡提取5 min。然后加入15 mL正己烷-甲基叔丁基醚(1∶1, v/v),振荡提取5 min,以6 000 r/min的速度离心2 min,收集上清液。再向残渣中加入10 mL正己烷-甲基叔丁基醚(1∶1, v/v),重复提取一次,合并上清液。最后将上清液在35 ℃下减压蒸馏至近干,加入5 mL正己烷,待净化。
自动固相萃取流程:依次用10 mL乙酸乙酯和10 mL正己烷活化ProElut VDC固相萃取柱,待净化液过柱后,弃去流出液;依次加入10 mL正己烷和10 mL乙酸乙酯-正己烷(1∶9, v/v)淋洗,弃去流出液;再加入20 mL乙酸乙酯-正己烷(1∶9, v/v)洗脱,收集流出液。将洗脱液在35 ℃下减压蒸馏至近干,用甲醇定容至1 mL,经0.22 μm滤膜过滤后,供液相色谱-质谱分析。
1.3 液相色谱与质谱条件
1.3.1 色谱条件
色谱柱:Phenomenex Kinetex C18色谱柱;柱温:35 ℃;流速:1.0 mL/min;进样量:5 μL;流动相:水(A相)和乙腈(B相)。梯度洗脱程序:0~4.0 min, 90%B; 4.1~8.0 min, 100%B; 8.1~12.0 min, 90%B。
1.3.2 质谱条件
离子源:APCI;扫描方式:正离子扫描;检测方式:多反应监测(MRM);喷雾气(GS1)压力:448 kPa;气帘气(CUR)压力:207 kPa;碰撞气(CAD): medium;离子源温度:350 ℃;电流(NC): 3.0 μA;入口电压(EP): 10 V;出口电压(CXP): 10 V;驻留时间(dwell time): 50 ms。MRM监测离子对、化合物保留时间、去簇电压(DP)和碰撞能量(CE)等参数列于表1。

表 1 MRM扫描模式下维生素D2和维生素D3的质谱参数
* Quantitative ion. RT: retention time; Q1: precursor ion; Q3: product ion; DP: declustering potential; CE: collision energy.
2 结果与讨论
2.1 提取溶剂的选择
通常使用包被技术来提高婴幼儿配方奶粉中添加的维生素D的抗氧化性能,但这也给维生素D的提取和检测带来了较大的难度。文献[5]报道的破壁技术主要有酶解法、酸水解法、皂化法和有机溶剂法。酶解法和皂化法需要的实验时间长,过程繁琐,而维生素D本身不稳定,不宜用酸水解法。由于二甲基亚砜具有极强的穿透性,加入柠檬酸水溶液和二甲基亚砜作为破壁溶液,可破坏维生素D外层的包被物质,加速维生素D的溶出,同时加入甲醇以提高奶粉样品和破壁溶液的互溶性,以正己烷和甲基叔丁基醚混合溶剂作为提取试剂,可获得满意的回收率。

表 2 维生素D2和维生素D3的线性范围、线性方程、相关系数(r)、检出限和定量限
y: peak area ratio;x: mass concentration, μg/L.
2.2 固相萃取条件的优化
比较了硅胶、PSA、弗罗里硅土(Florisil)、ProElut VDC等固相萃取柱,发现硅胶、PSA、Florisil等固相萃取柱对奶粉样品的净化效果不佳,不能去除奶粉中的油脂和其他干扰物。ProElut VDC固相萃取柱由PSA和硅胶两种吸附剂按照一定的比例分层填装而成。PSA吸附剂通过弱阴离子交换作用和氢键作用吸附样品中的有机酸类、蛋白质、油脂和碳水化合物等杂质,实现样品的净化,同时通过金属螯合作用,吸附提取液中微量的重金属,可对样品基质进一步净化。硅胶吸附剂通过弱阳离子交换作用和氢键作用,吸附样品中的蛋白质等含碱性基团的化合物,同时硅胶表面的硅羟基可与维生素D2和维生素D3形成氢键,在一定极性的有机溶剂洗脱条件下,实现样品与杂质的分离净化。
比较了体积分数为5%、10%和20%的乙酸乙酯正己烷作为淋洗液和洗脱液对维生素D回收率的影响。试验发现,当乙酸乙酯的体积分数低于10%时,维生素D均不能被完全洗脱下来;而当乙酸乙酯的体积分数高于10%时,旋蒸瓶中会出现油,并且在淋洗步骤就已经把维生素D洗脱下来,导致回收率偏低,因此最终使用10 mL体积分数为10%的乙酸乙酯正己烷淋洗,再用20 mL体积分数为10%的乙酸乙酯正己烷洗脱。
2.3 质谱条件的优化
脂溶性维生素极性较小,没有质子化位点,较难在溶液中形成质子化的离子或去质子化离子,在电喷雾电离(ESI)模式下的检测灵敏度较差,因此本试验采用APCI模式检测维生素D,可获得较高的灵敏度。采用针泵连续进样,在正离子模式下,分别对0.1 mg/L维生素D2和维生素D3标准溶液进行一级质谱扫描,确定较强的峰[M+H]+为其母离子,优化各母离子的去簇电压。然后分别对其子离子进行二级质谱扫描,选择丰度较高、干扰较小的两对子离子为定性离子,丰度最高的离子作为定量离子,然后优化其碰撞能量。优化后的质谱参数见表1。
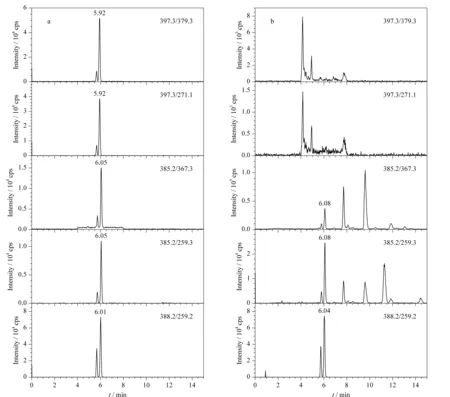
图 1 (a)维生素D2和维生素D3混合标准溶液和(b)实际奶粉样品的MRM色谱图Fig. 1 MRM chromatograms of (a) vitamin D2 and vitamin D3 mixed standard solution (b) and real formula sample
2.4 线性范围和检出限
取质量浓度为5、50、500、1 000和5 000 μg/L的系列混合标准溶液进行测定,以维生素D与同位素内标色谱峰的峰面积比值为纵坐标,以系列混合标准溶液的质量浓度为横坐标(单位μg/L),分别绘制维生素D2、维生素D3的标准曲线。如表2所示,在5~5 000 μg/L范围内,维生素D2和维生素D3的质量浓度与对应的峰面积比值呈现良好的线性关系,相关系数均大于0.999。在空白奶粉样品中添加混合标准溶液,分别以3倍和10倍信噪比来确定方法的检出限和定量限,维生素D2和维生素D3的检出限为2 μg/kg,定量限为5 μg/kg。本方法测定维生素D的线性范围宽,灵敏度高。图1为优化的色谱和质谱条件下,维生素D2和维生素D3混合标准溶液和实际奶粉样品的MRM色谱图。
2.5 回收率试验
在空白奶粉样品中分别添加5、10和100 μg/kg维生素D2和维生素D3混合标准溶液,按本文所述方法进行提取、净化和测定,每个添加水平重复3次。如表3所示,维生素D2和维生素D3的平均回收率为85.2%~105.3%,相对标准偏差为4.7%~8.1%。该方法可获得较满意的回收率和精密度。
2.6 实际奶粉样品的测定
取3个不同品牌婴幼儿配方奶粉样品,按照上述方法处理样品并测定,计算待测样品溶液中维生素D2和D3的浓度。各奶粉样品中均未检出维生素D2,维生素D的测定结果见表4。

表 3 空白奶粉中添加维生素D2和D3的平均
ND: not detected.
3 结论
本实验建立了婴幼儿配方奶粉中维生素D的测定方法,可操作性强,采用固相萃取小柱净化的方法,大大缩短了分析时间,并具有较好的回收率和重复性,有较高的实际应用价值。对比GB 5413.9-2010,本方法不需要两台液相色谱完成维生素D的净化和检测,用PrElut VDC固相萃取柱代替国标中的硅胶色谱柱进行净化,简化了前处理步骤,降低了检测成本,并能有效去除油脂等杂质,保证了实验结果的准确性。
[1] GB 14880-2012
[2] GB 5413.9-2010
[3] Blanco D, Fernandez M P, Gutierrez M D. Analyst, 2000, 125(3), 427
[4] Kaushik R, Sachdeva B, Arora S, et al. Food Chem, 2014, 151, 225
[5] Zhao R, Xue Y, Wu G H, et al. Chinese Journal of Chromatography, 2008, 26(1): 113
赵榕, 薛颖, 吴国华, 等. 色谱, 2008, 26(1): 113
[6] Zhang Y H, Qibule H, Jin Y, et al. Chinese Journal of Chromatography, 2015, 33(3), 291
张艳海, 其布勒哈斯, 金燕, 等. 色谱, 2015, 33(3), 291
[7] Zhang Y H, Zhu X Y, Cao G Z, et al. Chinese Journal of Analytical Chemistry, 2013, 41(5): 771
张艳海, 朱晓艳, 曹国洲, 等. 分析化学, 2013, 41(5): 771
[8] Trenerry V C, Plozza T, Caridi D, et al. Food Chem, 2011, 125(4): 1314
[9] Heudi O, Trisconi M J, Blake C J. J Chromatogr A, 2004, 1022: 115
[10] Cao H, Chen X Z, Wang J, et al. Journal of Chinese Mass Spectrometry Society, 2012, 33(4): 232
曹慧, 陈小珍, 王瑾, 等. 质谱学报, 2012, 33(4): 232
[11] Kwak B M, Jeong I S, Lee M S, et al. Food Chem, 2014, 165, 569
[12] Huo Y M, Wang J, Duan W Z, et al. Journal of Instrumental Analysis, 2016, 35(3): 327
霍艳敏, 王骏, 段文增, 等. 分析测试学报, 2016, 35(3): 327
[13] Gomes F P, Shaw P N, Whitfield K, et al. Anal Chim Acta, 2015, 891: 211
[14] Zhao K X, Lou T T, He J, et al. Journal of Instrmental Analysis, 2015, 34(12): 1372
赵孔祥, 娄婷婷, 何佳, 等. 分析测试学报, 2015, 34(12): 1372
Determination of vitamin D in infant formula using liquid chromatography-atmospheric pressure chemical ionization tandem mass spectrometry
YAN Lijuan1, LI Wenbin2, HONG Yuchen1, WU Min1,XU Dunming1*, LIN Liyi1, GU Chunyan2
(1.TechnologyCenterofXiamenEntry-exitInspectionandQuarantineBureau,Xiamen361026,China;2.BeijingDikmaTechnologiesInc.,Beijing100029,China)
A method using liquid chromatography-atmospheric pressure chemical ionization tandem mass spectrometry (LC-APCI-MS/MS) was developed for the determination of vitamin D in infant formula. The milk powder sample was extracted with hexane and tert-butyl methyl ether followed by clean-up with ProElut VDC cartridge. The LC separation was performed on Kinetex C18column (100 mm×4.6 mm, 2.6 μm) by a gradient elution using water and acetonitrile as the mobile phases with a flow rate of 1.0 mL/min. Identification of vitamin D2and vitamin D3was achieved by APCI-MS/MS using multiple reaction monitoring (MRM). The quantification analysis was performed by internal standard method. The calibration curves showed a good linearity in the range of 5-5 000 μg/L. The limits of detection (LODs) for vitamin D2and vitamin D3in the formula were 2 μg/kg. The limits of quantification (LOQs) for vitamin D2and vitamin D3in the formula were 5 μg/kg. The average recoveries of vitamin D from milk powder spiked at 5, 10 and 100 μg/kg levels were between 85.2% and 105.3%, and the relative standard deviations were between 4.7% and 8.1%. The simple, accurate and sensitive method is suitable for the determination of vitamin D in infant formula.
liquid chromatography-atmospheric pressure chemical ionization tandem mass spectrometry (LC-APCI-MS/MS); vitamin D; infant formula
10.3724/SP.J.1123.2016.10036
2016-10-12
福建省自然科学基金项目(2016J01071,2014J01057);长三角科技合作项目(15395810100,16395810100).
Foundation item: Natural Science Foundation of Fujian Province (Nos. 2016J01071, 2014J01057); Yangtze River Delta Science and Technology Cooperation Project (Nos. 15395810100, 16395810100).
O658
A
1000-8713(2017)04-0427-05
* 通讯联系人.Tel:(0592)7250900,E-mail:xudm@xmciq.gov.cn.
