微流控芯片流体剪切力和肿瘤坏死因子-α共同作用对大鼠软骨细胞表型的影响
2017-04-10李洪敬秦建华
石 杨, 盛 坤, 张 敏, 李洪敬*, 秦建华*
(1. 中国科学院大连化学物理研究所, 辽宁 大连 116023; 2. 大连医科大学第一附属医院, 辽宁 大连 116000)
研究论文
微流控芯片流体剪切力和肿瘤坏死因子-α共同作用对大鼠软骨细胞表型的影响
石 杨1, 盛 坤2, 张 敏1, 李洪敬2*, 秦建华1*
(1. 中国科学院大连化学物理研究所, 辽宁 大连 116023; 2. 大连医科大学第一附属医院, 辽宁 大连 116000)
流体剪切力是生物体内普遍存在的一种生物力学形式,是细胞微环境的重要组成部分,对细胞多种生物学行为有重要调节作用。该研究以微流控芯片技术为基础,建立了一种基于流阻原理能同时产生4个不同大小流体剪切力的微流控芯片平台,用以研究低流速的流体剪切力对大鼠原代软骨细胞表型维持的影响。结果表明,流体剪切力可促进软骨细胞的表型维持。还加入了肿瘤坏死因子-α(TNF-α),考察流体剪切力和TNF-α共同作用对软骨细胞表型的影响。结果表明,在剪切力和TNF-α共同作用下,软骨细胞的Ⅱ型胶原和蛋白多糖表达明显下调。该研究为软骨组织工程和骨性关节炎的疾病研究提供有力的研究平台,为骨关节疾病治疗和防治提供了理论依据。
微流控芯片;流体剪切力;肿瘤坏死因子-α;软骨表型
关节软骨是人体内重要的组织结构,能够承接和传递外力,维持关节结构的稳定[1]。关节软骨的主要成分为透明软骨[2],主要由软骨细胞和细胞外基质组成。细胞外基质主要作用为维持软骨组织的机械性能和组织的完整性[3]。在透明软骨的细胞外基质中,Ⅱ型胶原约占基质胶原总量的90%以上[4]。Ⅱ型胶原和蛋白多糖的主要功能是减少外力对软骨组织的冲击力,起到保护关节的作用。由于软骨组织缺少神经、血管和淋巴组织的有效支配[5],代谢过程中的营养吸收和废物排泄主要通过关节运动时滑膜滑液的流动完成。因此,软骨细胞长时间处于流体剪切力、压缩力和牵张力等机械力作用下,处于复杂的生物力学微环境中。
流体剪切力是生物体内普遍存在的一种生物力学形式,是细胞微环境的重要组成部分,对于细胞的多种生物学行为,包括维持形态、增殖、凋亡、分泌等具有重要调节作用[6]。现阶段,流体剪切力对于细胞层面的研究主要集中于血管模拟、骨组织及其微环境的模拟等方面[7,8]。人体内的组织间隙流剪切力范围约在10-6至102dyne/cm2之间。生理条件下,软骨组织浸泡于滑膜组织分泌的滑液中。当关节运动时,滑液随着作用力会对软骨组织产生剪切力的刺激。体外研究模型中,软骨细胞处于静态平面培养条件下,软骨细胞特异性的细胞外基质由Ⅱ型胶原逐渐转变为Ⅰ型胶原,失去软骨特异性功能。而在流体剪切力存在的条件下,可一定程度地恢复软骨细胞的特征性表型,对于软骨细胞表型维持具有重要作用。然而,流体剪切力对软骨细胞微环境影响的作用机制尚不完全明了,亟须建立合适的体外研究模型,进一步确认流体剪切力对软骨细胞影响的机制。同时,研究生物力学因素对软骨细胞的作用机制对于骨关节炎等疾病的预防和治疗具有重要意义。
微流控技术被认为是21世纪重要的科学技术之一,因其具有同细胞大小相匹配的微米尺寸构件、同生理环境接近的封闭环境、传质传热快和高通量等特点,已成为细胞生物学研究的重要平台,也为开展生物物理因素细胞微环境构建,特别是为生物力学中流体剪切力研究提供了一种全新的思路[9,10]。
本实验利用流体阻力原理构建模仿软骨细胞生物力学微环境的微流控芯片,建立了能够同时产生4个不同大小流体剪切力的微流控芯片平台,用以研究低流速流体剪切力对软骨细胞表型的影响。同时,还加入了肿瘤坏死因子-α(TNF-α)来考察多种因素的共同作用下软骨细胞表型的维持和变化情况。
1 实验部分
1.1 仪器与试剂
Steri-Cycle CO2培养箱(Thermo Electron公司),IX71倒置荧光显微镜(Leica公司),L600台式低速自动平衡离心机(湖南湘仪公司),数显水浴恒温振荡器(金坛市华峰仪器有限公司),匀胶机、烘胶机(北京创威纳科技有限公司),紫外光刻机(Thermo Oriel公司),等离子体机(Harrick公司),聚四氟乙烯管(Microchem公司),微量精确注射泵(Microchem公司)。
DMEM/F-12(Dulbecco’s Modified Eagle Media/Nutrient Mixture F-12)培养基,美国Hyclone公司),胎牛血清、体积分数为0.25%的胰蛋白酶(美国Gibco公司),青霉素-链霉素溶液100×(上海碧云天生物技术公司), Ⅱ型胶原酶(美国Worthington公司),兔抗鼠Ⅰ型胶原单克隆抗体、兔抗鼠Ⅱ型胶原单克隆抗体和兔抗鼠蛋白多糖单克隆抗体(武汉博士德公司),细胞骨架蛋白抗体(F-actin,美国Acris公司),异硫氰酸荧光素(FITC)标记的山羊抗兔免疫球蛋白G(IgG)、罗丹明(TRITC)标记的山羊抗兔IgG、封闭血清和抗体稀释液(中杉金桥公司),细胞核蓝色染料(DAPI,美国Sigma公司), live/dead细胞染色试剂盒(美国Invitrogen公司), Sylgard 184聚二甲基硅氧烷(PDMS)单体及引发剂(美国Dow Coring公司), SU-8 3035光刻胶(美国Micochem公司)。其他试剂均为国产分析纯。
1.2 软骨原代细胞的提取和培养
根据文献[11],取体重100~120 g雄性SD洁净大鼠断颈处理后,放入75%(体积分数)酒精中浸泡15 min消毒。用脱脂棉球消毒大鼠皮肤表面。分离出股骨,取出关节腔内的股骨头,用磷酸缓冲盐溶液(PBS)多次冲洗,在培养皿中分离软骨组织和软骨下骨,将软骨组织剪成1×1×1 mm3大小的组织块,转移至离心管中,以1 500 r/min的速度离心5 min,去上清。用体积分数为0.25%的胰蛋白酶在37 ℃水浴消化30 min。终止消化后,离心去上清,加入质量体积分数为0.15%的Ⅱ型胶原酶,于37 ℃摇床中水浴振荡消化过夜(约16 h)。次日,经200目筛网过滤后收集细胞悬液,以800 r/min的速度离心3 min,用培养基重悬,接种在细胞瓶内。观察软骨细胞的形态以及贴壁的情况。待细胞融合度达到80%~90%,进行消化传代(1∶3),采用3~6代的细胞进行实验。
1.3 微流控芯片的制作
在匀胶机上以1 000 r/min的速度在玻璃片上甩负性光刻胶SU-8 3035(30 s)。在95 ℃的烘胶机上进行20 min前烘;室温冷却后将掩膜背面放置于光刻胶玻璃片上,紫外曝光30 s,取下芯片掩膜,于95 ℃的烘胶机上后烘20 min,冷却,避光。再使用乳酸乙酯使芯片SU-8 3035模板显影,使用氮气迅速吹干,在180 ℃坚膜1 h,得到SU-8 3035模板。以10∶1的体积比混合PDMS单体与引发剂,混合均匀后将混合体倒在SU-8 3035模板上,抽真空20 min,取出置于烘箱中的水平台上于85 ℃加热30 min,固化。分离PDMS块和SU-8 3035模板,将PDMS和清洗过的玻璃片放于等离子体中照射60 s,进行芯片与玻璃的不可逆封接。
1.4 软骨细胞在微流控芯片上的培养
将封接好的芯片浸泡于PBS中,高压灭菌。灌注细胞悬液前用DMEM/F-12培养基润洗,细胞悬液密度为5×106cells/mL,细胞悬液用量为70 μL。待细胞均匀铺满各个细胞培养池后,于37 ℃培养箱孵育,5~6 h后细胞贴壁,次日用于灌流实验。灌注液体前于入口处放置四氟管,与精密注射泵相连,以流速24 μL/h进行灌流,出口处连接废液口。
1.5 软骨细胞在微流控芯片上培养的活性鉴定
大鼠软骨细胞在静态和流体剪切力条件下培养24 h后,进行细胞活性鉴定。用PBS冲洗2次,用live/dead细胞染色试剂盒染色,避光,于37 ℃孵育30 min; PBS冲洗2次后,进行荧光数据采集。
1.6 软骨细胞的细胞免疫荧光染色
对培养于培养皿中和芯片中的软骨细胞进行免疫荧光染色,分别检测F-actin、Ⅰ型胶原、Ⅱ型胶原、蛋白多糖的表达情况。吸去培养液,用PBS冲洗3次,用质量体积分数为4%的多聚甲醛固定细胞15 min,用PBS冲洗3次,每次3~5 min。用质量体积分数为0.2%的Triton X-100常温孵育15 min,用PBS冲洗3次。加入封闭血清200 μL,于4 ℃冰箱保存1~2 h。吸去封闭血清,加入100 μL一抗工作液(按体积比1∶100稀释),于4 ℃孵育18~24 h。次日,吸去一抗工作液,用PBS冲洗3次,加入稀释的二抗工作液,避光孵育1 h。用PBS冲洗3次,每次3~5 min。吸去PBS,加入100 μL DAPI溶液,孵育15 min。用PBS冲洗3次,荧光显微镜下拍照。
1.7 统计学处理
实验数据采用软件进行统计。所有数据用均数±标准差(means±SD)表示。组间比较采用单因素方差分析(ANOVE)。p<0.05具有统计学意义。
2 结果与讨论
2.1 微流控芯片的设计与制备
微流控芯片设计如图1所示,芯片包含4个细胞培养池(CH1、CH2、CH3和CH4)、1个灌流液入口、2个细胞进样口(细胞接种)和3个废液排出口。当细胞接种后需使用橡胶塞塞住细胞进样口,防止细胞悬液外流和保持灌流时芯片内部流体的连续性。每个细胞培养池连接不同长度的阻力通道。每个细胞培养池的长、宽、高分别为4 264.6、1 264.6和100 μm。各出口的直径大小均为1 mm。芯片为PDMS和玻璃的杂交芯片,其中上层为包含有流体通道、细胞进样口、细胞培养池、灌流口、废液口的PDMS芯片,下层为玻璃材质的基片。

图 1 多梯度流体剪切力微流控芯片设计图Fig. 1 Design drawing of the microfluidic device with multi fluid shear stress
2.2 极低流体剪切力的形成原理与数值模拟
传统方法中对细胞施加流体剪切力一般采用平行平板流动小室进行研究。平行平板流动小室技术是根据流变学原理研制的一种细胞加力装置,其基本原理是利用流动的培养液对附着在培养基底上的细胞产生剪切力。实验中利用微流控技术流体控制原理也可以简便地实现这种细胞加力方式。本试验利用不同宽度与长度微通道形成不同流体阻力的原理,成功地在同一个芯片中的不同区域同时形成多个强度的流体剪切力。该芯片平台包含了微通道网络和4个细胞培养池,通过微流控芯片流路设计,4个细胞培养池中的细胞能够同时受到4个不同大小的流体剪切力的作用。在圆柱形细胞微培养池中,Poiseuille流体模型能够直接评估微细胞培养池壁上的剪切力大小。微流控网络的3D流场可以通过微装置出入口处的已知压力和CFD(计算流体力学)模拟获得。位于细胞微池中的流体是层流(雷诺系数Re<1),因此能够在电路中类推出微流控的网络结构,得到方程式如下:
(1)
其中Ri是细胞培养池不同位置的水阻力(单位Pa5s/m2),η代表动态液体的黏度(单位Pa5s),L、h、w分别代表细胞培养池的长度、高度和宽度(单位m)。微流控芯片网络和电路的类比存在这样一个等式:
ΔP=ΔRtotQtot
(2)
此等式中ΔP表示出入口之间的压力损耗(单位Pa),Qtot表示当出入口被液体灌满时液体的流速(单位mL/s)。ΔRtot为入口与出口之间的流阻(单位Pa5s/m2)。由于出口处常与置于空气中的废液相连接,出口处的标准压力常被认为是0。当芯片入口的流速大小设定为24 μL/h时,细胞培养池1~4的平均底部流体剪切力大小为0.576、0.127、0.031和0.005 dyne/cm2。细胞培养池中流体剪切力大小的理论模拟结果如图2所示。通过在细胞进样口中加入细胞悬液,使细胞停留在细胞培养池中。待细胞贴壁后(一般为24 h),用精密注射泵由灌流进液口施加液流刺激,贴壁后的细胞将受到流经细胞培养池的液体所造成的流体剪切力。流体剪切力模拟图(见图2)显示,在细胞培养池内,除靠近液体进口和出口的位置及矩形细胞培养池边缘处的区域流体剪切力有所改变外,培养池内其他区域的流体剪切力差别不明显,具体数值见图2b。

图 3 大鼠原代软骨细胞在静态和流体剪切力条件下的细胞活性Fig. 3 Activities of rat primary chondrocytes under the static and fluid shear stress (FSS) conditionsGreen represents for living cells and red represents for dead cells.

图 2 微流控芯片流体剪切力大小的理论模拟结果Fig. 2 Theoretical simulation result of fluid shear stress on microfluidic device a. theoretical simulation of computational fluid dynamics (CFD); b. calculated value of fluid shear stress on microfluidic chip.
2.3 微流控芯片上大鼠原代软骨细胞在流体剪切力作用下的细胞形态学鉴定
软骨细胞是一种力效应细胞,在力学刺激下可能会产生多种生物学行为的变化。本试验研究了大鼠原代软骨细胞的存活与增殖、细胞形态及表型维持。流体剪切力作用下细胞的存活是进行其他生物学行为研究的基础。为考察流体剪切力对软骨细胞活性的影响,采用live/dead细胞染色试剂盒检测软骨细胞的活性。如图3所示,细胞在不同的流体剪切力刺激24 h后,细胞活性均保持在90%以上,说明本试验设计的流体剪切力梯度并不影响细胞的活性。F-actin是细胞维持特定形态的重要蛋白,考察了流体剪切力存在与否情况下,F-actin的表达强度与分布情况对软骨细胞形态变化的影响。结果如图4所示,随着剪切力的增加,大鼠原代软骨细胞的F-actin表达呈现上升趋势。在施加大小为0.127 dyne/cm2的流体剪切力刺激后,细胞F-actin的表达有明显增强,且细胞面积增大。结果表明,一定程度的流体剪切力可促进F-actin的表达,促进细胞的黏附。有研究[12-15]表明,一定程度的流体剪切力能够刺激F-actin的表达,增加细胞的黏附效应,本试验结果与已有报道相符。

图 4 大鼠原代软骨细胞在静态和流体剪切力条件下细胞骨架蛋白的表达Fig. 4 F-actin protein expression of rat primary chondrocytes under the static and FSS conditionsFSS treated for 24 h. Green represents for the F-actin and blue represents for the nucleus.
2.4 流体剪切力对大鼠原代软骨细胞表型的影响

图 6 大鼠原代软骨细胞Ⅱ型胶原的蛋白质水平表达Fig. 6 Expression of collagen Ⅱ in rat primary chondrocytes at protein level a. expression of collagen Ⅱ in rat primary chondrocytes under static, different FSS and FSS with TNF-α conditions. Red represents for collagen Ⅱ and blue represents for the nucleus; b. quantitative expression of collagen Ⅱ in rat primary chondrocytes under static condition and in CH4; c. quantitative expression of collagen Ⅱ in rat primary chondrocytes under different FSS (CH1, CH2, CH3 and CH4) conditions; d. quantitative expression of collagen Ⅱ in rat primary chondrocytes under FSS and FSS with TNF-α conditions. The concentration of TNF-α was 10 μg/L and cells were treated for 24 h. The other conditions were the same as those in Fig. 5.
适宜大小的流体剪切力有益于软骨细胞的增殖[16]、蛋白多糖和胶原含量的稳定[17]。Ⅰ型胶原、Ⅱ型胶原和蛋白多糖是软骨表型维持的重要标志,同时也是检验软骨细胞维持特异功能的标准。本试验考察了在不同流体剪切力刺激下,软骨细胞Ⅰ型胶原、Ⅱ型胶原和蛋白多糖的蛋白质表达。如图5所示,在静态条件下,Ⅰ型胶原的平均荧光强度为24.7;在0.576、0.127、0.031和0.005 dyne/cm2不同流体剪切力作用下,Ⅰ型胶原的荧光强度分别为32.6、31.3、29.0和27.6(CH1~CH4)。结果表明,随着流体剪切力强度的增大,与静态条件相比,Ⅰ型胶原的蛋白表达呈现出上升的趋势。在静态条件下,Ⅱ型胶原蛋白表达荧光强度为14.7;在不同强度的流体剪切力作用下,荧光强度强度分别为21.5、20.0、19.1和15.6(见图6)。结果表明,随着流体剪切力强度的增大,与静态条件相比,Ⅱ型胶原的蛋白质表达呈现出上升的趋势,除CH4与静态条件下没有明显的差异外,其他强度的流体剪切力组都表现出明显的差异。进一步研究了软骨细胞的另一种特异性标志蛋白多糖的表达。结果(见图7)表明,静态条件下,软骨细胞蛋白多糖的荧光表达强度为28.3;而在流体剪切力作用下,CH1~CH4的荧光表达强度分别为50.4、46.4、39.8和40.0,与静态条件组呈现出显著性差异,并且在高强度的流体剪切力组中表现出近2倍表达量的差异。结果表明,流体剪切力的刺激能够在一定程度上促进蛋白多糖的表达。由此可见,随着流体剪切力的变化,蛋白多糖的表达趋势与Ⅱ型胶原一致。流体剪切力有利于大鼠软骨细胞软骨表型的维持,软骨细胞处于受力的状态下更容易维持特异性的功能。
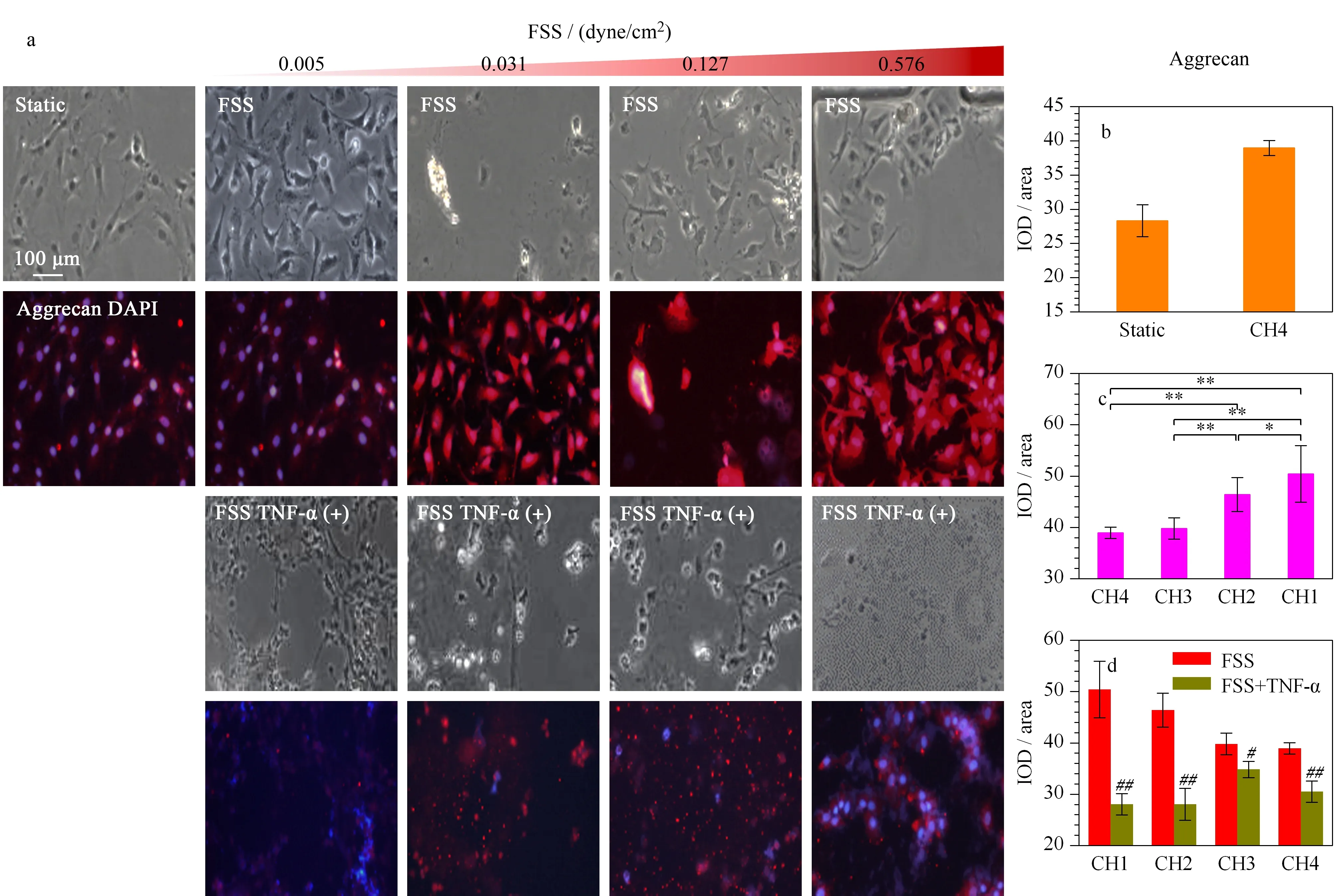
图 7 大鼠原代软骨细胞Aggrecan的蛋白质水平表达Fig. 7 Expression of aggrecan in rat primary chondrocytes at protein level a. expression of aggrecan in rat primary chondrocytes under static, different FSS and FSS with TNF-α conditions. Red represents for aggrecan and blue represents for the nucleus; b. quantitative expression of aggrecan in rats primary chondrocytes under static condition and in CH4; c. quantitative expression of aggrecan in rat primary chondrocytes under different FSS (CH1, CH2, CH3 and CH4) conditions; d. quantitative expression of aggrecan in rat primary chondrocytes under FSS and FSS with TNF-α conditions. The concentration of TNF-α was 10 ng/mL and cells were treated for 24 h. The other conditions were the same as those in Fig. 5.
2.5 流体剪切力与TNF-α共同作用对大鼠原代软骨细胞表型维持的影响
当软骨组织受到创伤时,周围细胞分泌的细胞因子参与介导损伤部位发生的一系列炎症反应。其中,TNF-α在细胞外基质的降解过程中发挥了重要作用[18],是体内重要的炎症因子之一。TNF-α具有刺激关节软骨周围滑膜细胞分泌前列腺素E2(PGE2)和胶原酶的作用,造成软骨组织的损伤[19]。前文已证实,低流速流体剪切力条件下,随着剪切力的增大,软骨细胞特异性表型Ⅱ型胶原表达增加。但是加入炎性因子TNF-α后,随着剪切力的增大,Ⅱ型胶原的荧光表达下调,与FSS同组比较有明显的差异。同时,蛋白多糖的表达量进一步下调,并与FSS数据组显现出明显的差异。而且,剪切力越小,Ⅱ型胶原和蛋白多糖的表达量越明显。但是,对于Ⅰ型胶原而言,加入TNF-α后,剪切力越小,去分化(失去软骨表型)的程度越明显。在两种因素同时存在的条件下,一方面,随着剪切力的降低,Ⅱ型胶原的维持程度越好;另一面,随着剪切力的降低,软骨细胞去分化的程度越明显。相比与流体剪切力促进大鼠软骨表现的维持,TNF-α的削弱能力更加明显,它能够加速大鼠软骨细胞Ⅱ型胶原和蛋白多糖的分解,使软骨细胞失去组织表型与功能。
3 结论
本文建立了一种可以同时产生4个不同大小流体剪切力的微流控芯片,用以研究低流速流体剪切力对于软骨细胞表型的影响。结果表明,流体剪切力可以维持大鼠软骨细胞的特异性表型,促进软骨细胞Ⅱ型胶原和蛋白多糖的表达。TNF-α能够加速大鼠软骨细胞Ⅱ型胶原和蛋白多糖的分解,使软骨细胞失去组织表型与功能。利用微流控技术可以模拟构建细胞多条件、多因素的生物力学和化学微环境,所构建的细胞微环境更接近于体内细胞所处的生物环境,为软骨组织工程和骨性关节炎等多个研究领域开展生物力学研究提供了有力的研究平台,对于骨关节疾病治疗和防治具有重要意义。
[1] Hasler E M, Herzog W, Wu J Z, et al. Crit Rev Biomed Eng, 1999, 27: 415
[2] Zhao B. Orthopaedic Biomechanics Materials and Clinical Study, 2007, 4(6): 25
赵斌. 生物骨科材料与临床研究, 2007, 4(6): 25
[3] Buckwalter J A, Mankin H J. Instr Course Lect, 1998, 47: 477
[4] Plumb D A, Ferrara L, Torbica T, et al. PLoS One, 2011, 6(12), e29422
[5] Kang S W, Yoo S P, Kim B S. Biomed Mater Eng, 2007, 17: 269
[6] Brown T D. J Biomech, 2000, 33(1): 3
[7] Ingber, D E. Circ Res, 2002, 91(10): 877
[8] Park J Y, White J B, Walker N, et al. Biomicrofluidics, 2011, 5(2): 022211
[9] Park J Y, Yoo S J, Patel L, et al. Biorheology, 2010, 47(3/4): 165
[10] Yan W, Xu D S, Zha Y F. Chinese Journal of Chromatography, 2016, 34(11): 1043
严伟, 徐德顺, 查赟峰. 等. 色谱, 2016, 34(11): 1043
[11] Gosset M, Berenbaum F, Thirion S, et al. Nat Protoc, 2008, 3: 1253
[12] Leclerc E, David B, Griscom L, et al. Biomaterials, 2006, 27(4): 586
[13] Lu H, Ko Y G, Kawazoe N, et al. Biomed Mater, 2011, 6(4): 045011
[14] Gao X H, Zhang X, Xu H, et al. Biomicrofluidics, 2014, 8: 052008
[15] Chau L, Doran M, Cooperwhite J J. Lab Chip, 2009, 9(13): 1897
[16] Pan H L. Medical Recapitulate, 1999, 5(11): 517
潘海乐. 医学综述, 1999, 5(11): 517
[17] Domm C, Schunke M, Christesen K, et al. OARSI, 2002, 10: 13
[18] Bothascheepers S, Watt I, Slagboom E. Ann Rheum Dis, 2007, 67(8): 1165
[19] Zou J. China Healthcare Innovation, 2008, 3(10): 12
邹建. 中国医疗前沿, 2008, 3(10): 12
Effects of combined the fluid shear stress and tumor necrosis factor-α on cartilage phenotype in a dynamic microfluidic chip
SHI Yang1, SHENG Kun2, ZHANG Min1, LI Hongjing2*, QIN Jianhua1*
(1.DalianInstituteofChemicalPhysics,ChineseAcademyofSciences,Dalian116023,China;2.FirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116000,China)
Fluid shear stress as a common form of biomechanics plays an important role in maintaining cell morphology, cell secretion and function in microenvironment. Herein, we proposed a microfluidic platform which could generate four different intensities of fluid shear to study the cellular effects of fluid shear stress on chondrocyte phenotype under low flow condition. Under low flow condition, the primary chondrocytes could keep good activity and morphology. With the increase of shear force, the expressions of collagen type Ⅱ and aggrecan in primary chondrocyte were up-regulated. At the same time, the expressions of collagen type Ⅰ increased. These results indicated that fluid shear stress could improve chondrocyte phenotype maintaining. Moreover, increase of the shear force also accelerated the dedifferentiation of chondrocytes. Tumor necrosis factor-α (TNF-α) plays a negative role in maintaining chondrocyte phenotype. The interaction effect of fluid shear stress and TNF-α on chondrocyte phenotype was investigated on this platform. The results showed that under the combined effects of the shear force and TNF-α, the expressions of collagen type Ⅱ and aggrecan of chondrocytes were significantly down-regulated. This method provided a powerful platform for cartilage tissue engineering and osteoarthritis disease research, and gave a theoretical basis for the joint disease treatment and prevention.
microfluidic chip; fluid shear stress; tumor necrosis factor-α (TNF-α); cartilage phenotype
10.3724/SP.J.1123.2016.11004
2016-11-03
国家自然科学基金项目(81603075);中国博士后科学基金项目(2016M591463).
Foundation item: National Natural Science Foundation of China (No. 81603075); China Postdoctoral Science Foundation (No. 2016M591463).
O658
A
1000-8713(2017)04-0458-08
* 通讯联系人.E-mail:jhqin@dicp.ac.cn(秦建华);E-mail:hongjingl@hotmail.com(李洪敬).
