Guttiferone K抑制胰腺癌的体内外活性研究*
2017-04-10陈小琼李洋张伊婧吴蓉席志超谭红胜
陈小琼,李洋,张伊婧,吴蓉,席志超,谭红胜**
(1.上海中医药大学中药学院上海201203;2.中药创新药物研发上海高校工程研究中心上海201203)
Guttiferone K抑制胰腺癌的体内外活性研究*
陈小琼1,2,李洋1,2,张伊婧1,2,吴蓉1,2,席志超1,2,谭红胜1,2**
(1.上海中医药大学中药学院上海201203;2.中药创新药物研发上海高校工程研究中心上海201203)
目的:本文主要探讨从藤黄属植物云南藤黄Garcinia yunnanensis中提取分离得到的化合物Guttiferone K(GUTK)抑制人胰腺癌增殖的体内外作用。方法:用MTT法检测GUTK对5株人胰腺癌细胞增殖的抑制作用;利用免疫印迹法检测凋亡相关蛋白Caspase-3、多聚二磷酸腺苷核糖聚合酶(Poly Adenosinediphosphate-Ribose Polymerase,PARP)和Bcl-xL蛋白水平的变化;将人胰腺癌细胞MIA PaCa-2接种到裸鼠胰腺上,腹腔注射GUTK进行干预,隔天给药,4周后摘取小鼠胰腺肿瘤并检测瘤体积和瘤重;通过免疫组化法检测cleaved Caspase-3在各组肿瘤组织中表达水平的差异。结果:GUTK在低浓度时能有效抑制5种人胰腺癌细胞的增殖;GUTK呈时间及剂量依赖地诱导Caspase-3和PARP剪切,并下调Bcl-xL的表达;体内实验表明GUTK能显著抑制胰腺癌裸鼠原位移植瘤的生长,并诱导cleaved Caspase-3在肿瘤组织中的表达。结论:GUTK在体内外均能诱导胰腺癌细胞的凋亡,具有潜在的抗胰腺癌作用,有望开发成治疗胰腺癌的药物。
云南藤黄Guttiferone K胰腺癌凋亡
藤黄属植物主产于越南、缅甸、印度和中国西南地区,其中在中国分布有22种[1]。近年来本课题组一直专注于藤黄属Garcinia L.植物抗肿瘤活性成分的提取分离及作用机理的研究,目前已经从17种中国产藤黄属植物中发现了多个具有抗肿瘤活性的化合物[2-6]。在前期活性筛选发现GUTK对5株人胰腺癌细胞均具有较强的细胞毒活性,提示GUTK可能具有抑制胰腺癌的作用。本研究基于以上发现,进一步评价GUTK抑制胰腺癌的体内外活性,并对其作用机理进行初步的研究。
1 材料与方法
1.1 材料
1.1.1 细胞株
胰腺癌细胞株MIA PaCa-2、BxPC-3、SW1990、Capan-1细胞,人胰腺上皮样癌PANC-1细胞均购自于美国ATCC细胞库。
1.1.2 药品与试剂
Guttiferone K(GUTK)是从云南藤黄果实中提取得到,纯度为98%;DMEM与RPMI1640(美国Sigma化工公司,批号:8117011、8116506),胎牛血清(美国Hyclone公司,批号:sh30068.02),Trypsin(JiNuo生物科技有限公司,批号:2016092102),PBS(美国Corning公司,批号:16110102),MTT(美国Sigma化工公司,批号:M5655),二甲基亚砜(DMSO,美国Sigma公司,批号:RNBF4512),RIPA裂解液、蛋白酶抑制剂三联试剂盒、BCA蛋白浓度试剂盒和ECL发光液(上海威奥生物科技有限公司);PARP兔多克隆抗体(美国CST公司,批号:13),Caspase-3兔单克隆抗体(美国CST公司,批号:6),Bcl-xL兔多克隆抗体(美国CST公司),cleaved Caspase-3兔多克隆抗体(美国CST公司),GAPDH兔单克隆抗体(英国Abcam公司,批号:GR90965-16);二抗采用羊抗兔IgG(H+L)多克隆抗体(美国seracare公司,批号:474-1506);聚偏氟乙烯膜(PVDF,美国Millipore公司,批号:R6BA9402C)。
1.2 仪器
细胞培养箱(美国Themo公司,型号:3541),光学倒置显微镜(日本OLYMPUS公司,型号:SZ51/SZ61),离心机(美国Beckman公司,型号:Allegra X-12R),Countstar自动细胞计数仪(艾立特国际贸易有限公司,型号:IC1000),全波长酶标仪(美国Bio-Tek公司,型号:PowerWave XS2),LASMINI 4000化学发光仪器(美国GE公司,型号:ImageQuant LAS4000mini)。
1.3 方法
1.3.1 细胞培养与处理
MIA PaCa-2、BxPC-3、Capan-1、PANC-1和SW 1990分别用含10%FBS、100 U·mL-1青霉素和100μg·mL-1链霉素的RPMI 1640培养基或DMEM培养基培养,置于37℃、5%CO2培养箱中;当细胞长至70%-80%时,用PBS洗后加入含0.25%胰酶-EDTA溶液消化细胞,按合适的比例将细胞种于培养皿中。
1.3.2 MTT筛选
将MIA PaCa-2、BxPC-3、Capan-1、PANC和SW 1990细胞以4×103个/孔的浓度接种于96孔板中;次日分别加入1.25、2.50、5.00、10.00、20.00μM的GUTK,100μL/孔,放置于37℃、5%CO2培养箱培养,72 h后加入10μL/孔的MTT(5mg·mL-1),孵育4 h后弃培养基,每孔加入100μL的DMSO,避光振摇10min,使甲臢结晶充分溶解,于酶标仪上570 nm波长下检测各孔OD值。细胞生长抑制率(%)按如下方程计算:抑制率/%=(对照组-给药组)/对照组×100%。IC50值:能抑制50%肿瘤细胞增殖的药物浓度。
1.3.3 蛋白免疫印迹检测Caspase-3、PARP、Bcl-xL的表达
将MIA PaCa-2细胞以4×105个/mL种于培养皿中,次日分别加入0、1、3、5、10μM的GUTK处理,24、48 h后将细胞消化、离心收集于1.5mL的EP管中;将按100∶1∶1∶1比例混合好的细胞裂解液、蛋白酶抑制剂、磷酸酶抑制剂和PMSF加入细胞样品中吹打混匀,置冰上裂解30min;于4℃,14 000 rpm离心20min,取上清,用BCA法测定样品的蛋白浓度,将蛋白样品与上样缓冲液混匀,于99℃金属浴上加热8min。然后进行蛋白电泳,转膜,牛奶封闭,TBST洗膜3次并孵育一抗,置于4℃的摇床上孵育过夜;回收一抗,TBST洗膜3次,置摇床上孵育二抗90min;TBST洗膜3次后,将ECL液的A液与B液按1∶1比例混合,将膜浸渍混合液后拿出置于曝光仪下曝光、摄片。采用ImageJ1.46软件对条带进行灰度定量分析。
1.3.4 动物实验
BALB/c裸鼠,雌性,5周龄,体质量16-18 g,购于中国科学院上海实验动物中心;将裸鼠饲养于上海中医药大学SPF级动物房,饲养一周后进行实验;饲养条件为12 h光暗循环,22±1℃,湿度为55±5%。饲料和水均在消毒后由小鼠自由摄取;动物实验的程序已获得动物伦理委员会批准,所有动物均按照国家和上海中医药大学动物中心动物实用管理条例进行实验设计和实施。
将人胰腺癌细胞MIA PaCa-2消化计数,PBS重悬后将细胞浓度调整至2×107个/mL,置于冰上备用。腹腔注射2%的戊巴比妥钠麻醉小鼠,腹腔开小口,将100μL肿瘤细胞混悬液从胰腺尾部注入胰腺组织,切口缝合后,待小鼠苏醒放回笼中。一周后,将小鼠随机分为三组,对照组隔天腹腔注射生理盐水,给药组隔天腹腔注射GUTK(10mg·kg-1),阳性药对照组每周两次腹腔注射gemcitabine(20mg·kg-1),小鼠给药4周后进行解剖,取肿瘤组织,用游标卡尺测量肿瘤的长径和短径;肿瘤体积=ab2/2,a、b代表肿瘤的长径和短径。
1.3.5 免疫组织化学
将裸鼠处死后,取下胰腺癌组织,立即用10%的中性多聚甲醛固定,置于4℃摇床上过夜,依次经过50%乙醇-75%乙醇-85%乙醇-95%乙醇-无水乙醇脱水,每次1 h,放置于石蜡与二甲苯(1:1)的混合液中浸渍30min,在转移至石蜡液中浸渍2次,每次2 h,待组织表面的蜡液凝固,后迅速冷却;将包埋好的组织蜡块切成4μM,贴于载玻片上,60℃烤片,存于通风处;经抗原修复后孵育一抗cleaved Caspase-3抗体,一抗浓度为1∶500,4℃过夜;弃一抗,洗片3次,孵育二抗,30min;弃二抗,洗片3次,孵育HRP生物标志链30min;弃生物标志链,洗片,DAB显色后蒸馏水冲洗10min,苏木素染色10 min,盐酸乙醇分化,蒸馏水冲洗至泛蓝20min;脱水后用中性树脂封闭固定;显微镜下观察、拍照。采用Image-Pro Plus6.0软件进行定量分析。每只动物选取切片3张,每张选取细胞分布均匀的3个视野进行观察,记录400倍镜下cleaved Caspase-3呈阳性的细胞个数,3个视野取均值做统计。
1.3.6 统计分析方法
实验数据用平均值±标准差(xˉ±s)表示,使用SPSS 11.5统计软件进行分析,各实验组之间的差异采用One-Way ANOVA进行方差分析,P<0.05,P<0.01或P<0.001表示具有显著或极显著统计学差异。
2 结果
2.1 GUTK具有抑制胰腺癌细胞增殖的作用
首先,我们采用MTT法分别在5株人胰腺癌细胞MIA PaCa-2、PANC-1、BxPC-3、SW 1990和Capan-1上检测了GUTK(结构式如图1所示)抑制细胞增殖的作用。结果如表1所示,在GUTK作用72 h后,对5株人胰腺癌细胞均表现出一定的增殖抑制作用,其中GUTK在MIA PaCa-2、BxPC-3和PANC-1细胞上的IC50均在5μM左右,具有较强的细胞毒作用。
2.2 GUTK诱导M IA PaCa-2细胞发生线粒体途径的凋亡
为进一步阐明GUTK对胰腺癌细胞株产生的细胞毒作用,本文运用蛋白免疫印迹法观察GUTK处理前后,MIA PaCa-2细胞中凋亡相关蛋白表达水平的变化。如图2所示,在10μM GUTK处理24 h和5μM GUTK处理48 h后均出现明显的cleaved Caspase-3和cleaved PARP条带,表明GUTK可以诱导Caspase-3和PARP的剪切,使细胞不能修复DNA的损伤,而发生细胞凋亡。随后本文进一步检测了Bcl-2家族中抗凋亡蛋白Bcl-xL的变化,发现随着药物浓度的增加,Bcl-xL有下降趋势,并呈一定的时间依赖性。这些结果说明GUTK能激活Caspase-3级联反应,诱导MIA PaCa-2细胞发生线粒体途径的细胞凋亡。
2.3 GUTK具有抑制人胰腺癌裸鼠原位移植瘤生长的作用
体外实验结果表明GUTK能诱导人胰腺癌细胞MIA PaCa-2发生线粒体途径的凋亡,进而发挥抑制胰腺癌细胞增殖的作用。为了进一步探讨GUTK可否在体内抑制胰腺癌的生长,本文采用裸鼠原位移植人胰腺癌MIA PaCa-2细胞的动物模型,一周后腹腔注射GUTK(10mg·kg-1)进行治疗,隔天给药,阳性药对照组每周两次腹腔注射gemcitabine(20mg·kg-1)。结果如图3所示,在给药4周后,与对照组相比,GUTK组的瘤重和瘤体积均有明显减小的趋势(P<0.01),并且效果与阳性药相当,表明GUTK在体内具有较好地抑制胰腺癌生长的作用。

图1 云南藤黄中提取的化合物Guttiferone K的结构式
表1 化合物Guttiferone K(GUTK)在人胰腺癌细胞株上的IC50/μM(±s)
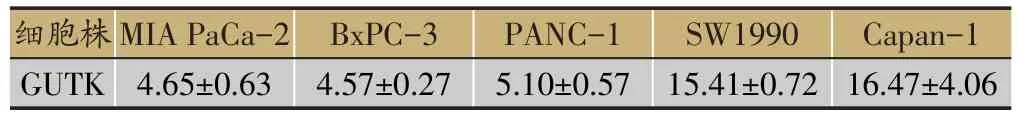
表1 化合物Guttiferone K(GUTK)在人胰腺癌细胞株上的IC50/μM(±s)
细胞株GUTK MIA PaCa-2 4.65±0.63 BxPC-3 4.57±0.27 PANC-1 5.10±0.57 SW1990 15.41±0.72 Capan-1 16.47±4.06
2.4 GUTK诱导裸鼠原位移植人胰腺癌瘤细胞凋亡
本文进一步通过免疫组织化学染色的方法来检测肿瘤组织中cleaved Caspase-3的变化水平。结果如图4所示,GUTK组和gemcitabine组的cleaved Caspase-3蛋白表达水平均明显高于对照组,具有统计学意义(P<0.001)。说明GUTK通过诱导人胰腺癌裸鼠原位移植瘤发生细胞凋亡,进而发挥其体内抗肿瘤的效果,且这一作用机理与体外实验结果相吻合。
3 讨论
酮(xanthones)和PPAP是中国藤黄属植物中最主要的两类次生代谢物的化学成分,具有广泛的生物活性,尤其是抗肿瘤活性较为突出,其中从云南藤黄果实中提取分离的PPAP类化合物Guttiferone K(GUTK)是典型的代表,具有多种抗肿瘤活性。在营养缺乏条件下,GUTK能通过抑制Akt、mTOR的磷酸化来诱导细胞自噬,并通过诱导细胞内活性氧(Reactive Oxygen Species,ROS)的积累和升高JNK激酶的磷酸化水平诱导人宫颈癌细胞Hela细胞的凋亡[7];能通过升高PFN1蛋白的表达水平影响肌动蛋白的功能,从而抑制肝癌转移和侵袭[8];可降低cyclins D1、cyclins D3及CDK4、CDK6蛋白的表达水平诱导人结肠癌HT-29细胞发生细胞周期阻滞,亦可调控HT-29细胞中JNK通路影响细胞Caspase-3表达活性,进而诱导细胞凋亡[9]。在静止期前列腺癌肿瘤复发模型中,能够通过稳定FBXW7蛋白,调控c-MYC蛋白的泛素化降解途径,具有潜在的抑制前列腺癌复发的作用[10]。综上,GUTK能通过诱导凋亡、细胞周期阻滞、诱导自噬、抑制转移及静止期癌细胞激活等作用来发挥其抗肿瘤活性,提示GUTK抑制癌症的作用具有多靶点的特征。
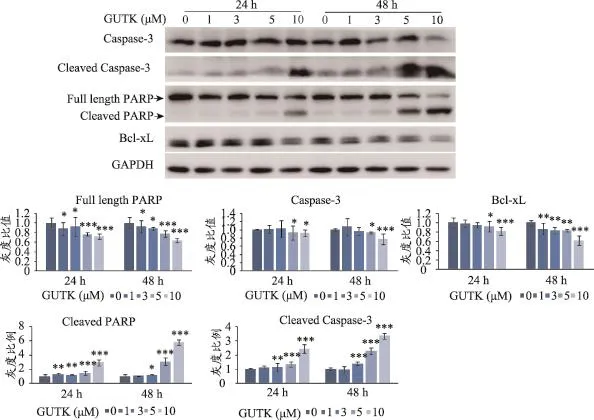
图2 蛋白免疫印迹法检测GUTK处理MIA PaCa-2细胞后Caspase-3、cleaved Caspase-3、PARP、cleaved PARP和Bcl-xL蛋白的表达水平
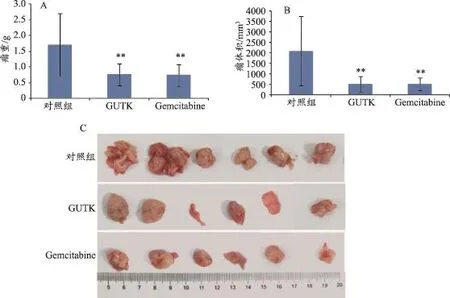
图3 GUTK对裸鼠原位移植人胰腺癌MIA PaCa-2细胞的生长抑制作用(n=6)
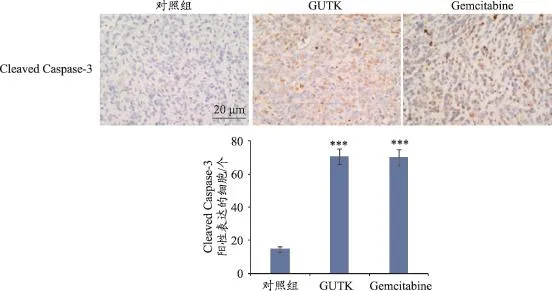
图4 免疫组织化学检测肿瘤组织中cleaved Caspase-3蛋白的表达水平(标尺=20μm,n=3)
本课题组前期对GUTK在多种人源肿瘤细胞中的抗癌活性进行了筛选,得出GUTK对于胰腺癌、前列腺癌、肝癌、结肠癌、宫颈癌等均具有良好的抑制作用,提示其具有广谱的抗癌作用。其中,GUTK对胰腺腺癌BxPC-3细胞、胰腺癌MIA PaCa-2细胞具有较强的细胞毒性,胰腺癌素有“癌中之王”之称,这一发现对于开发治疗胰腺癌的药物具有重要意义。为探究GUTK对于胰腺癌各亚型是否具有广谱抑制能力,本实验进一步检测了GUTK对5株人胰腺癌细胞MIA PaCa-2、Bx-PC-3、SW1990、Capan-1和PANC-1的细胞毒作用。结果显示,GUTK在MIA PaCa-2、BxPC-3和PANC-1 3株胰腺癌细胞中的IC50均在5mM左右,抑制作用较强。这3株癌细胞都源自于人胰腺组织,分别是胰腺癌导管癌细胞、人原位胰腺癌细胞,以及导管癌细胞。而对于肝转移的Capan-1细胞和脾转移的SW1990胰腺癌细胞的IC50在15mM左右。基于以上结果分析,GUTK对原位胰腺癌细胞的生长抑制作用强于发生转移的胰腺癌细胞,提示GUTK更适合开发成为对原位胰腺癌进行早期干预的药物。
本研究还采用人胰腺癌裸鼠原位移植瘤的动物模型对GUTK体内抑癌活性进行研究,发现GUTK可以有效地抑制胰腺癌原位移植瘤的生长,并诱导肿瘤组织发生细胞凋亡。与之前已报道的GUTK体内抑癌研究的动物模型相比,原位接种移植瘤的动物模型更能模拟临床肿瘤生长的环境[11],考查药物到达靶器官的能力,更加准确的评估GUTK体内抑制胰腺癌的药效。
综上所述,本文通过对GUTK体内和体外抑制胰腺癌的活性进行研究,发现GUTK可以诱导人胰腺癌细胞发生线粒体途径的凋亡,从而发挥其抑癌作用,且无明显的毒副作用。提示GUTK有望开发成为对原位胰腺癌进行早期干预的治疗药物,但其作用机理需进行更加深入的研究和探讨。
1李西林,张红梅,谭红胜,等.中国藤黄属植物的资源分布、分类与可持续利用.世界中医药,2016,11(7):1176-1178.
2 Wang X,Lao Y,Xu N,et al.Oblongifolin C inhibitsmetastasis by upregulating keratin 18 and tubulins.SciRep,2015,5:10293.
3 Lao Y,Wan G,Liu Z,etal.The natural compound oblongifolin C inhibits autophagic flux and enhances antitumor efficacy of nutrient depriva-tion.Autophagy,2014,10(5):736-749.
4 LiX,Lao Y,Zhang H,etal.The natural compound Guttiferone F sensitizes prostate cancer to starvation induced apoptosis via calcium and JNK elevation.BMCCancer,2015,15:254.
5 Xu L,Lao Y,Zhao Y,et al.Screening active compounds from Garcinia species native to China reveals novel compounds targeting the STAT/ JAK signaling pathway.Biomed Res Int,2015,2015:910453.
6 XuW,Cheng M,Lao Y,etal.DNA damage and ER stress contribute to oblongifolin C-induced cell killing in Bax/Bak-deficient cells.Biochem BiophysResCommun,2015,457(3):300-306.
7 Wu M,Lao Y,Xu N,et al.Guttiferone K induces autophagy and sensitizes cancer cells to nutrient strss-induced cell death.Phytomedicine,2015,22 (10):902-910.
8 Shen K,XiZ,Xie J,etal.Guttiferone K suppresses cellmotility andmetastasis of hepatocellular carcinoma by restoring aberrantly reduced profiling1.Oncotarget,2016,7(35):56650-56663.
9 Kan W L,Yin C,Xu H X,et al.Antitumor effects of novel compound, guttiferone K,on colon cancer by p21Waf1/Cip1-mediated G(0)/G(1) cell cyclearrestand apoptosis.Int JCancer,2013,132:707-716.
10 Xi Z,Yao M,Li Y,et al.Guttiferone K impedes cell cycle re-entry of quiescent prostate cancer cell via stabilization of FBXW 7 and subsequentc-MYC degradation.CellDeath Dis,2016,7(6):e2252.
11赵然,刘羽,高丽丽,等.HepG2细胞系皮下接种与肝原位接种成瘤的比较研究.哈尔滨医科大学学报,2010(3):205-207,211.
TheActivity Study of Pancreatic Cancer Inhibited by Guttiferone K both in vitro and in vivo
Chen Xiaoqiong1,2,LiYang1,2,Zhang Yijing1,2,Wu Rong1,2,XiZhichao1,2,Tan Hongsheng1,2
(1.SchoolofPharmacy,ShanghaiUniversity ofTraditionalChineseMedicine,Shanghai201203,China; 2.Engineering Research CenterofShanghaiCollegesfor TCM New Drug Discovery,Shanghai201203,China)
This study aimed atexploring the effects of Guttiferone K(GUTK),a compound isolated from G.yunnanensis, on inhibiting the proliferation of pancreatic cancer cells both in vitro and in vivo.MTT assay was used to detect the inhibitory effects of GUTK on the proliferation of five human pancreatic cancer cell lines.Western blotwas adopted to detect the apoptosis-related protein expressions of Caspase-3,poly adenosinediphosphate-ribose polymerase(PARP) and Bcl-xL.For in vivo study,the human pancreatic cancer cell MIA PaCa-2 was orthotopically injected into the pancreatic tail of the orthotopicmice.One week later,GUTK was administered by intraperitoneal(i.p.)injection every other day for 4 weeks.The volume and weightof the tumor tissueweremeasured.The protein expression levelof cleaved caspase-3 in tumor tissue ofall the groupswas quantified by immunohistochemistry.As a result,itwas found thatGUTK effectively inhibited the proliferation of the five human pancreatic cancer cell lines at a low concentration.GUTK induced caspase-related apoptosisby triggering a seriesofevents in MIA PaCa-2 cells including cleaved Caspase-3 and PARPactivation,Bcl-xL down-regulation,and eventually cell death in a time and dose dependentmanner.Furthermore, in vivo study revealed that intraperitoneal injection of GUTK significantly suppressed the growth of pancreatic cancer cells in the orthotopic mouse models,and the protein level of cleaved caspase-3 was increased in the GUTK and gemcitabine treated groups.Itwas concluded thatGUTK induced apoptosis in human pancreatic cancer both in vitro and in vivo,and waspotential to develop intoa clinicalanticanceragent.
Garcinia yunnanensis,Guttiferone K,pancreatic cancer,apoptosis
10.11842/wst.2017.02.009
R28
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2017-02-20
修回日期:2017-02-20
*中国博士后科学基金会第60批中国博士后科学基金面上项目(2016M601641):藤黄属PPAPs类化合物抑制前列腺癌复发的活性研究,负责人:席志超
**通讯作者:谭红胜,博士,副研究员,主要研究方向:中药活性成分研究及中药新药研发。
