溶栓治疗对心肌梗死患者Th17及Treg细胞的影响
2017-04-10郑三福陈宇翔郭伟溪
郑三福 陈宇翔 郭伟溪 王 羽
(厦门大学附属第一医院杏林院区内科,厦门361003)
溶栓治疗对心肌梗死患者Th17及Treg细胞的影响
郑三福 陈宇翔①郭伟溪②王 羽③
(厦门大学附属第一医院杏林院区内科,厦门361003)
目的:观察心肌梗死患者溶栓前后体内Th17、Treg细胞及相关因子含量,从而探讨三者的相关性。 方法:提取外周血单个核细胞,流式细胞术检测Th17及Treg含量,ELISA方法检测上清IL-17及TGF-β含量变化,实时定量PCR检测RORγT及Foxp3含量。 结果:与对照组相比,实验组患者在溶栓前、后体内Th17细胞,IL-17及RORγT含量均显著升高;Treg细胞、TGF-β及Foxp3含量显著降低(P<0.05)。与实验组患者溶栓前相比,溶栓后7 d体内Th17细胞,IL-17及RORγT含量显著降低;Treg细胞、TGF-β及 Foxp3含量显著升高(P<0.05)。结论:与对照组相比,心肌梗死患者体内中存在Th17及相关因子升高,Treg及相关因子降低,溶栓治疗后可使Th17及相关因子降低,Treg及相关因子升高。
Th17;Treg;溶栓治疗;心肌梗死
急性心肌梗死为冠脉血管斑块破裂形成血管急性堵塞,从而导致血流急性中断,越来越多的研究表明免疫在心梗发病机制中的重要作用,而临床中的溶栓治疗也是急性心肌梗死的有效措施之一[1,2]。Th17及Treg细胞是近年来新近研究和发现的免疫细胞,其在调节免疫稳态中起着重要作用。已有研究发现,Th17及Treg细胞参与急性心肌梗死疾病的发生发展[3],然而国内对此两种细胞是否参与心肌梗死溶栓治疗的机制研究较少,因此本研究选取我院心内科接受溶栓治疗的心肌梗死患者,观测Th17/Treg的变化,来探讨Th17/Treg的在疾病发生及治疗中的意义。
1 材料与方法
1.1 材料
1.1.1 一般资料
(1)实验组:选取2013年7月到2014年12月在我院心内科就诊的心肌梗死患者50例,其中男性20例,女性30例,年龄为50~71,平均(57.1±9.4)岁。患者均符合WHO制定的急性心肌梗死诊断标准[4],且均接受溶栓治疗,治疗后根据相关诊断[4]判定为冠脉再通,排除自身存在风湿性关节炎、系统性血管炎等其他风湿性免疫性疾病的患者。(2)对照组:选取健康志愿者50例,其中男性21例,女性29例,年龄为51~72,平均(58.2±9.5)岁。健康志愿者不存在心梗的临床症状,并且影像学检查未见异常,心肝功能基本正常。排除标准同实验组。实验组与对照组在性别、年龄等方面差异不存在统计学意义(P>0.05),具有可比性。本调查程序符合本单位的伦理学标准并得到批准,且已得到患者与家属的知情同意。
1.1.2 主要试剂 流式抗体CD3抗体、CD4单抗、CD25单抗、IL-17A单抗、Foxp3单抗及Th17专用固定剂,Th17专用透膜剂,Foxp3专用固定透膜剂、IL-17A ELISA试剂盒及TGF-β ELISA试剂盒均购于Ebioscience公司。TRIZOL裂解液、PrimeScriptTMRT reagent Kit (Perfect Real Time)及TaKaRa SYBR® Premix Ex TaqTMⅡ试剂盒均购于TaKaRa公司。佛波酯(PMA)及离子霉素均购于Sigma公司。
1.1.3 标本采集 分别收集对照组及实验组溶栓前、溶栓后3、5、7 d血液标本9 ml,肝素抗凝。
1.2 方法
1.2.1 血清细胞因子检测 将3 ml血液标本高速离心后取上清-80℃保存,批量检测。IL-17A及TGF-β的含量采用酶联免疫吸附双抗体夹心法(ELISA)检测,操作步骤严格按照说明书进行。
1.2.2 PBMC的分离培养 将6 ml血液标本与PBS缓冲液倍比稀释混匀,严格按照说明书进行操作,将混合液轻轻置于淋巴细胞分离液上,4℃,3 000 r/min,离心30 min。轻轻取出离心管,此时会出现分层,将第二层白膜细胞洗出置于另一离心管中,加入PBS清洗,获得PBMC单个核细胞备用。用RPMI1640培养液调整PBMC密度为3×106ml-1,取2 ml/孔置于6孔板中培养,加入PMA(25 ng/ml)、离子霉素(1 μg/ml)共培养5 h。收集细胞进行流式检测及mRNA 表达检测。
1.2.3 Th17细胞分析 取刺激后的PBMC,PBS反复洗涤,配置成100 μl的单细胞悬液,向上述悬液中加入抗CD4单抗10 μl,避光染色30 min。经PBS洗涤1次后,加入Th17专用固定剂,室温孵育15 min,PBS混匀洗涤后,应用透膜剂,室温避光孵育20 min,PBS重悬洗涤进行胞内染色。向流式管内加入APC标记的抗IL-17A单抗及同种型抗体10 μl,混匀后室温避光孵育30 min,经PBS洗涤一次后,加入300 μl溶液,斡旋混匀后,上FAC Scan流式细胞仪检测,应用FlowJo软件分析。
1.2.4 Treg细胞分析 取刺激后的PBMC,PBS反复洗涤,配置成100 μl的单细胞悬液,向上述悬液中加入抗CD4及CD25单抗10 μl,避光染色30 min。经PBS洗涤一次后,加入新鲜的Foxp3专用固定透膜剂,4℃避光孵育30 min,孵育后,加入新鲜配置的专用缓冲液重悬细胞,然后加入抗Foxp3单抗及同种型抗体10 μl,混匀后室温避光孵育30 min,经PBS洗涤一次后,加入300 μl溶液,斡旋混匀后,上FAC Scan流式细胞仪检测,应用FlowJo软件分析。
1.2.5 mRNA 表达检测 实验所需器械均经高压去RNA酶处理,并经0.1%的焦碳酸二乙酯(DEPC)水处理,且实验均在冰块上操作,降低温度对结果的影响。取PBMC,加入1 ml TRIZOL裂解5 min,一次加入三氯甲烷、异丙醇及75%乙醇进行获取RNA,10 μl DEPC水溶解RNA沉淀,紫外分光光度仪测定浓度及纯度。应用TaKaRa逆转录试剂盒PrimeScriptTMRT reagent Kit (Perfect Real Time),严格按照说明书,将提取的RNA逆转录为cDNA,并应用TaKaRa SYBR® Premix Ex TaqTMⅡ试剂盒,进行PCR体系的扩增及反应。其中,引物序列为:β-actin: 5′-GATCATTGCTCCTCCTGAGC-3′和5′-TGTGGACTTGGGAGAGGACT-3′;Foxp3:5′-GCACAAGTGCTTTGTGCGAGT-3′和5′-TGTCTGTGGTTGCAGAC-GTTAT-3′;RORγT: 5′-GCAGCGCTCCAACATCTTCT-3和5′-ACGTACTGAATGGCCTCGGT-3′试验时每个样本和基因做2个相同的复孔。

2 结果
2.1 各组对象体内Th17/Treg亚群分析 与对照组相比,实验组患者在溶栓前,溶栓后3、5及7 d体内CD4+IL-17+T细胞(即Th17细胞)表达量显著升高,CD4+CD25+Foxp3+T细胞(即Treg细胞)表达量显著降低,各组差异均存在统计学意义(P<0.05);与实验组患者在溶栓前相比,溶栓后7d体内Th17细胞表达量显著降低,Treg细胞表达量显著升高,差异有统计学意义(P<0.05),具体见表1及图1、2。
2.2 各组对象体内细胞因子分泌 与对照组相比,实验组患者在溶栓前,溶栓后3、5及7 d体内IL-17含量显著升高,TGF-β含量显著降低,各组差异均存在统计学意义(P<0.05);与实验组患者在溶栓前相比,溶栓后5 d及7 d体内IL-17含量显著降低,TGF-β含量显著升高,各组差异均存在统计学意义(P<0.05),具体见表2。

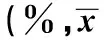

GroupsCD4+IL-17+CD4+CD25+Foxp3+Experimentalgroup-beforethrombolysis15.7±5.71)5.9±3.01)Afterthrombolysis3d14.4±5.11)6.4±3.41)Afterthrombolysis5d12.4±5.31)6.9±3.11)Afterthrombolysis7d10.1±5.51)2)7.8±2.91)2)Normalcontrolgroup7.9±5.29.7±3.0
Note:Vs normal control group,1)P<0.05;vs before thrombolysis,2)P<0.05.

图1 各组对象体内Th17亚群分析Fig.1

图2 各组对象体内Treg亚群分析Fig.2
2.3 各组对象体内细胞因子分泌 各组对象转录因子表达与对照组相比,实验组患者在溶栓前,溶栓后3、5及7 d体内RORγT含量显著升高,Foxp3含量显著降低,各组差异均存在统计学意义(P<0.05);与实验组患者溶栓前相比,溶栓后5 d及7 d体内RORγT含量显著降低,溶栓后7 d体内Foxp3含量显著升高,各组差异均存在统计学意义(P<0.05),具体见图3。
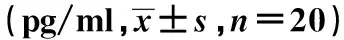
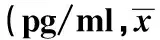

GroupsIL-17TGF-βExperimentalgroup-Beforethrombolysis311.7±15.71)123.8±11.11)Afterthrombolysis3d313.5±14.31)132.7±10.91)Afterthrombolysis5d267.8±11.31)2)224.8±11.71)2)Afterthrombolysis7d220.7±13.21)2)260.5±12.11)2)Normalcontrolgroup160.8±14.5312.3±12.6
Note:Vs normal control group,1)P<0.05;vs before thrombolysis,2)P<0.05.
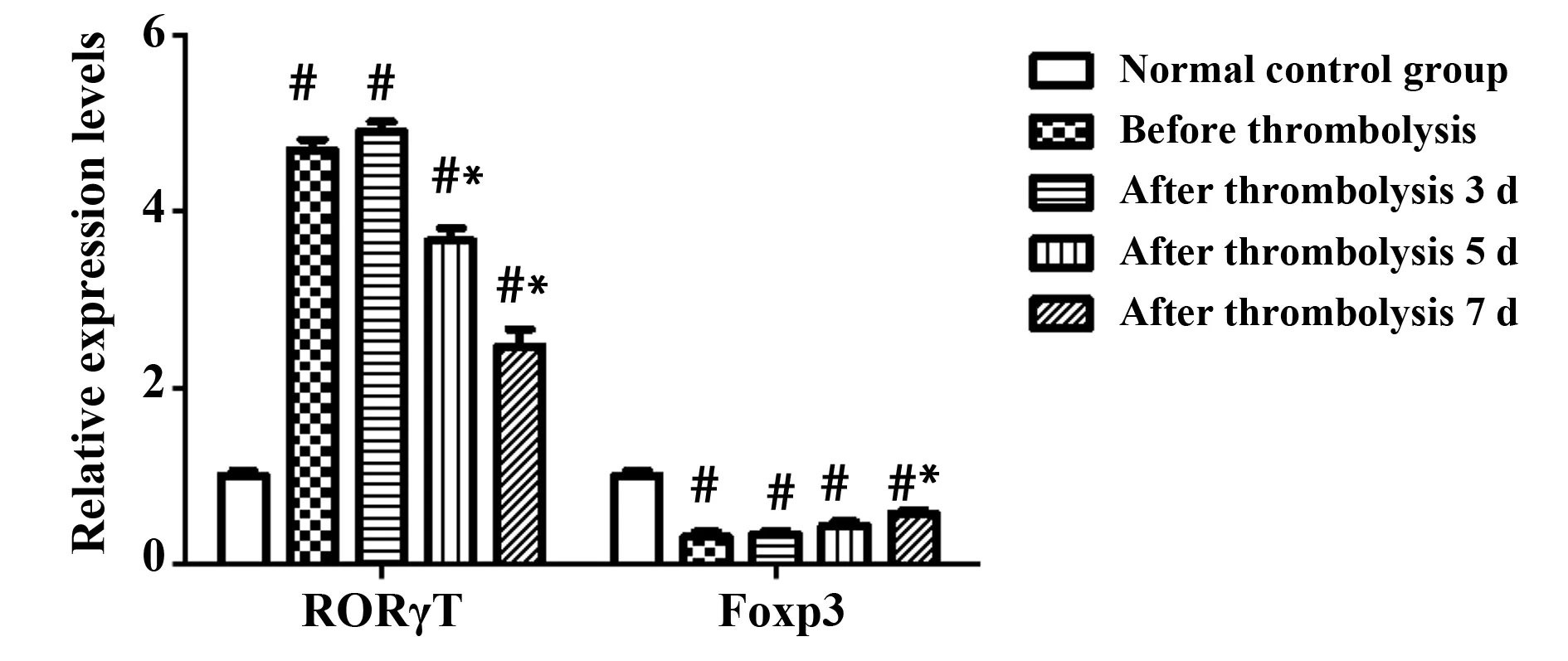
图3 各组对象转录因子表达Fig.3 Relative transcription factor expression level in each groupNote: Vs normal control group,#.P<0.05;vs before thrombolysis,*.P<0.05.
3 讨论
急性心肌梗死是心肌的急性缺血坏死,是在冠脉病变的基础上,发生的冠脉血液的急性减少或中断,从而造成心肌的急性损伤。作为一种严重危害人类健康的疾病,多种致病因素均可诱导其发病,免疫因素已被越来越多的研究证明与心梗发生发展密切相关。其中,免疫学方面有关发病机制的研究主要包括以下几点:①多种因素导致的炎症和免疫细胞的趋化和浸润,如补体系统的激活;②多种细胞因子的共同作用;③病理性自身免疫应答参与的心肌损伤,多种因素共同作用导致心肌组织的坏死与损伤[5,6]。然而,确切病因及免疫调节因素至今未明。
Th17及Treg细胞是近年来发现的新型免疫细胞,具有独立的分化和调节机制,且互相抑制,Th17的产生可抑制Treg的分化及发育,两者可通过多种途径影响和参与机体稳态的构建。在机体正常情况下,Th17及Treg细胞保持动态平衡,以利于机体多种免疫反应的进行[7,8]。Th17/Treg比例失衡则导致炎性反应过度,参与多种心血管疾病的发生。已有研究表明[9,10],在动脉粥样硬化患者外周血中存在Th17/Treg比例失衡,Th17和Treg细胞对急性心肌梗死不稳定性斑块的早期形成具有重要作用[11],尤其IL-17在冠状动脉平滑肌细胞中可以引起炎症反应,促进了动脉粥样斑块的形成,加速冠状动脉粥样硬化性心脏病的发生和发展[12,13]。本研究选取我院心内科接受溶栓治疗的心肌梗死患者进行分析,观测Th17/Treg的变化,来探讨Th17/Treg在疾病发生及治疗中的意义。
本研究可以看出,与对照组相比,实验组患者在溶栓前、后体内Th17细胞,IL-17及RORγT含量显著升高,Treg细胞,TGF-β及Foxp3含量显著降低,各组差异均存在统计学意义(P<0.05);针对实验组患者,与溶栓前相比,溶栓后7 d体内Th17细胞,IL-17及RORγT含量显著降低,Treg细胞,TGF-β及Foxp3含量显著升高(P<0.05)。以上结果均说明溶栓改善疾病病情的机制与调节Th17/Treg比例有密切关系。Th17细胞及Treg细胞在免疫调节功能中互相拮抗与制约,两者平衡状态决定了疾病的发展方向。已有研究发现,IL-17可通过分泌多种物质重构心室,刺激纤维胶原和细胞外基质分泌,同时还可与其他因子协同反应加大炎性反应。其中Treg细胞保护疾病的机制可能与分泌的TGF-β密切相关,其可抑制炎性反应,调控免疫的耐受性,抑制金属蛋白酶活性,调节细胞外基质的形成,从而促进组织的修复[14]。我们的研究结果与这些研究[9,10]基本吻合,同时临床研究也发现,急性心梗患者体内外周血存在Th17及IL-17的增高,以及与Treg平衡的打破,均说明了Th17细胞及其分泌的细胞因子具有促进疾病发生发展,而Treg细胞具有减缓疾病发生发展的作用。因此调节Th17/Treg的比值在治疗疾病中具有重要意义,因此临床和科研可通过调节两者的比例来治疗与改善疾病。
综上所述,相对于对照者,心肌梗死患者体内存在Th17及相关因子的增高,Treg及相关因子的降低,Th17及Treg细胞参与了疾病的发生发展,而溶栓治疗后可缓解这一状况,提示免疫因素在疾病的发病及治疗中具有重要作用。
[1] Separham A,Ghaffari S,Najafi H,etal.The impact of allopurinol on patients with acute ST elevation myocardial infarction undergoing thrombolytic therapy[J].J Cardiovasc Pharmacol,2016,68(4):265-268.
[2] Miljkovic D,Psaltis A,Wormald PJ,etal.T regulatory and Th17 cells in chronic rhinosinusitis with polyps [J].Int Forum Allergy Rhinol,2016,6(8):826-834.
[3] Ramjee V,Li D,Manderfield LJ,etal.Epicardial YAP/TAZ orchestrate an immunosuppressive response following myocardial infarction[J].J Clin Invest,2017,127(3):899-911.
[4] 陈爱文,彭 娜,钟思干,等.急性心肌梗死溶栓前后血浆NT-proBNP与hs-CRP水平的变化[J].广东医学,2011,32(2):218-220.
[5] Ghourbani Gazar S,Andalib A,Hashemi M,etal.CD4+Foxp3+Treg and its ICOS subsets in patients with myocardial infarction[J].Iran J Immunol,2012,9(1):53-60.
[7] Rocha JA,Ribeiro SP,França CM,etal.Increase in cholinergic modulation with pyridostigmine induces anti-inflammatory cell recruitment soon after acute myocardial infarction in rats[J].Am J Physiol Regul Integr Comp Physiol,2016,310(8):R697-R706.
[8] Carvalheiro T,Velada I,Valado A,etal.Phenotypic and functional alterations on inflammatory peripheral blood cells after acute myocardial infarction[J].J Cardiovasc Transl Res,2012,5(3):309-320.
[9] Matsumoto K,Ogawa M,Suzuki J,etal.Regulatory T lymphocytes attenuate myocardial infarction-induced ventricular remodeling in mice[J].Int Heart J,2011,52(6):382-387.
[10] Sardella G,De Luca L,Francavilla V,etal.Frequency of naturally-occurring regulatory T cells is reduced in patients with ST-segment elevation myocardial infarction[J].Thromb Res,2007,120(4):631-634.
[11] Liu R,Guo C,Yang C,etal.VEGF165 attenuates the Th17/Treg imbalance that exists when transplanting allogeneic skeletal myoblasts to treat acute myocardial infarction[J].Inflamm Res,2013,62(1):69-79.
[12] Wang G,Kim RY,Imhof I,etal.The immunosuppressant FTY720 prolongs survival in a mouse model of diet-induced coronary atherosclerosis and myocardial infarction[J].J Cardiovasc Pharmacol,2014,63(2):132-143.
[13] Dong Z,Gong K,Huang D,etal.Myocardial infarction accelerates glomerular injury and microalbuminuria in diabetic rats via local hemodynamics and immunity [J].Int J Cardiol,2015,179:397-408.
[14] Weirather J,Hofmann UD,Beyersdorf N,etal.Foxp3+CD4+T cells improve healing after myocardial infarction by modulating monocyte/macrophage differentiation[J].Circ Res,2014,115(1):55-67.
[收稿2016-07-13 修回2016-08-26]
(编辑 倪 鹏)
Thrombolytic therapy on function of Th17 and Treg in patients with myocardial infarction
ZHENGSan-Fu,CHENYu-Xiang,GUOWei-Xi,WANGYu.
DepartmentofMedicine,theFirstAffiliatedHospitalXianmenUniversityXinglinBranch,Xiamen361003,China
Objective:To investigate Th17,Treg and related factors before and after myocardial infarction,and explore the correlations among them.Methods: Extracted mononuclear cell in peripheral blood,and used fluorescence-activated cell sorting analysis to detect the contect of Th17 and Treg.Enzyme-linked immunosorbent assay was used to detect cytokine production of IL-17 and TGF-β;real-time PCR was used to detect the contect of RORγT and Foxp3.Results: Compared with the control group,experimental group (both before and after thrombolysis) had increased expressions of Th17,IL-17 and RORγT(P<0.05);the expressions of Treg,TGF-β and Foxp3 had decreased(P<0.05).Compared with the group of before thrombolysis,the group of after thrombolysis 7 d had decreased expressions of Th17,IL-17 and RORγT(P<0.05);increased expressions of Treg,TGF-β and Foxp3(P<0.05).Conclusion: Compared with the control group,patients with myocardial infarction have the high levels of Th17 and the related factors,the decreased levels of Treg and the related factors.Thrombolytic therapy can decrease the levels of Th17 and the related factors,and increase levels of Treg and the related factors.
Th17;Treg;Thrombolytic therapy;Myocardial infarction
10.3969/j.issn.1000-484X.2017.03.027
郑三福(1979年-),男,硕士,主治医生,主要从事血管内科方面研究。
R541.4
A
1000-484X(2017)03-0441-04
①厦门大学附属第一医院检验科,厦门361003。
②厦门大学附属第一医院普外科,厦门361003。
③厦门大学附属第一医院超声影像科,厦门361003。
