过敏性紫癜患者血清IL-34水平的变化及意义
2017-04-10夏海龙
王 娟 夏海龙
(安徽医科大学第一附属医院血液科,合肥230022)
过敏性紫癜患者血清IL-34水平的变化及意义
王 娟 夏海龙
(安徽医科大学第一附属医院血液科,合肥230022)
目的:探讨过敏性紫癜(Henoch-Schoenlein purpura,HSP)患者急性期血清中IL-34的表达及意义。方法:选取HSP患者38例,同期匹配的健康人21例作为对照组,采用酶联免疫吸附法(ELISA)及化学发光法检测血清中IL-34、IL-6、TNF-α表达水平;采用相关分析法分析IL-34与患者临床资料指标的关系以及与IL-6、TNF-α表达的相关性。结果:HSP患者急性期血清IL-34、IL-6、TNF-α水平均较正常对照组增高,差异具有统计学意义(P<0.001);血清IL-34和超敏C反应蛋白(hs-CRP)、IL-6水平之间呈正相关(分别是r=0.453,P=0.004;r=0.469,P=0.003)。结论:IL-34可能参与过敏性紫癜的致病过程;可能与过敏性紫癜促炎因子的异常表达有关,促进血管炎症的发生发展。
紫癜,过敏性;白细胞介素-34;细胞因子类
过敏性紫癜(Henoch-Schoenlein purpura,HSP)是一种较常见的以小血管坏死性炎症为主要特征的疾病,常累及皮肤、胃肠道、关节、肾脏,病程可呈自限性,易反复发作[1]。近年来发病率呈上升趋势,确切病因及发病机制仍不清楚[2]。Yang等[3]研究提示HSP患者急性期的血清可刺激人脐静脉内皮细胞分泌合成IL-8、TNF-α等炎症因子,另有研究发现HSP患者急性期IL-6、TNF-α、IL-17等促炎因子及趋化因子表达异常[4,5];以上提示细胞因子和白介素炎症介质在HSP发病中发挥重要作用。
IL-34是近年来新发现的细胞因子,其生物学功能主要是刺激单核细胞-巨噬细胞的增殖与分化、诱导多种细胞因子和趋化因子生成和释放,具有促炎、促进破骨细胞形成的作用[6,7];同时还具有诱导免疫耐受的潜能[8,9]。可见,IL-34是一种多功能性细胞因子。IL-34是否参与HSP血管损伤过程、在HSP疾病发病中的作用以及与其他炎症因子在HSP发病中的相互关系,目前尚无定论。本研究通过检测HSP患者急性期血清IL-34、IL-6、TNF-α水平,并分析IL-34与患者临床资料指标、IL-6、TNF-α的关系,旨在探讨IL-34在HSP发病中的作用。
1 材料与方法
1.1 一般资料 选取2015年11月至2016年3月我院儿科及血液科收治的过敏性紫癜急性期患者38例(包括单纯型16例、腹型7例、关节型4例、肾型11例),其中男18例,女20例,年龄4~19岁,平均(10.66±4.04)岁;所有病例组均符合2006 年欧洲抗风湿联盟及美国风湿病学会共同制定的HSP诊断标准,急性期为发病2 周内未使用糖皮质激素、抗组胺药及其他免疫抑制剂。随机选择同期在本院健康体检者(均排除过敏及自身免疫性疾病、近期感染病史)21例作为对照组,其中男11例,女10例,年龄5~19岁,平均(10.33±3.86)岁。纳入的受试对象在性别、年龄一般资料方面差异无统计学意义(χ2=0.136,P=0.712;F=0.058,P= 0.765),具有可比性。本研究获得本院医学伦理委员会批准,所有入选实验对象及家属均已签订知情同意书。
1.2 标本采集和实验方法 采集受试对象晨起空腹静脉血5 ml,其中3 ml立刻置枸橼酸钠抗凝试管中混匀,以3 000 r/min,离心15 min,分离后收集血浆,于EP管分装后置于-80℃冰箱待检;另2 ml置于普通生化管。采用双抗体夹心酶联免疫吸附试验(ELISA)测定血浆IL-34、TNF-α表达水平,ELISA试剂盒购于武汉Elabscience公司,操作步骤严格按试剂盒说明书进行。血浆IL-6水平检测采用化学发光法检测,试剂盒由德国西门子公司提供,血清hs-CRP水平检测采用颗粒增强免疫透射比浊法,试剂盒由德国德赛公司提供。血清IgA、IgG、IgE、IgM水平检测均采用免疫散射比浊法测定,试剂盒由德国罗氏公司提供。检测仪器为罗氏Modular全自动化生化仪。

2 结果
2.1 IL-34、TNF-α、IL-6的水平测定结果及比较 IL-34 、TNF-α、IL-6三种细胞因子在过敏性紫癜患者急性期血清中表达较正常对照组显著增高,差异均有统计学意义(P<0.001)见表1;同时,按照临床表现将HSP病例组进行分组比较,发现不同组间IL-34水平的差异无统计学意义(P=0.105,表中未列出)。
2.2 HSP患者急性期IL-34水平和临床各指标相关性分析 将HSP患者急性期血清IL-34水平和临床病例资料进行相关性分析,发现IL-34和炎症参数超敏C反应蛋白(hs-CRP)存在显著的相关性(r=0.453,P=0.004),与血沉ESR未见明显相关性见图1、表2;与年龄、补体及4种免疫球蛋白未见明显相关性(见表2);同时将HSP病例组按照性别将其分成2组,2组患者外周血清IL-34表达水平无统计学差异(P=0.231,表中未列出)。
2.3 HSP患者急性期IL-34水平与TNF-α、IL-6相关性分析 HSP患者急性期血清IL-34水平与TNF-α、IL-6相关性分析,我们发现IL-34与IL-6表达水平具有一定的相关性(r=0.469,P=0.003),见图1与TNF-α水平均无显著相关性(r=0.123,P>0.05)未列出。
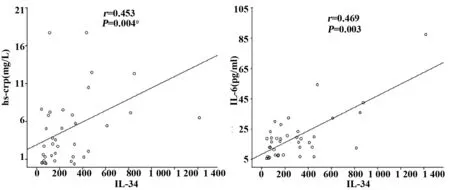
图1 IL-34表达水平与hs-CRP、IL-6的相关性Fig.1 Correlation between expression level of IL-34 and hs-CRP,IL-6 in acute HSP
表1 HSP病例组和对照组血清中IL-34、IL-6、TNF-α表达水平的比较
Tab.1 Detection of serum levels of IL-34,IL-6 and TNF-α in patients with acute HSP and in healthy controls

GroupsnIL-34(pg/ml)IL-6(pg/ml)TNF-α(pg/ml)HSPgroup38174.96(84.01-416.70)1)16.70(7.93-23.35)1)248.84(157.32-360.25)1)Controlgroup2159.11(42.79-104.45)3.41(3.11-5.54)103.76(60.95-161.15)Zvalue-4.195-5.763-2.713Pvalue<0.001<0.0010.007
Note:1)vs control group.
表2 HSP病例组中IL-34表达与临床病例资料的相关性
Tab.2 Correlation analysis for serum IL-34 and clinical data in patients with acute HSP
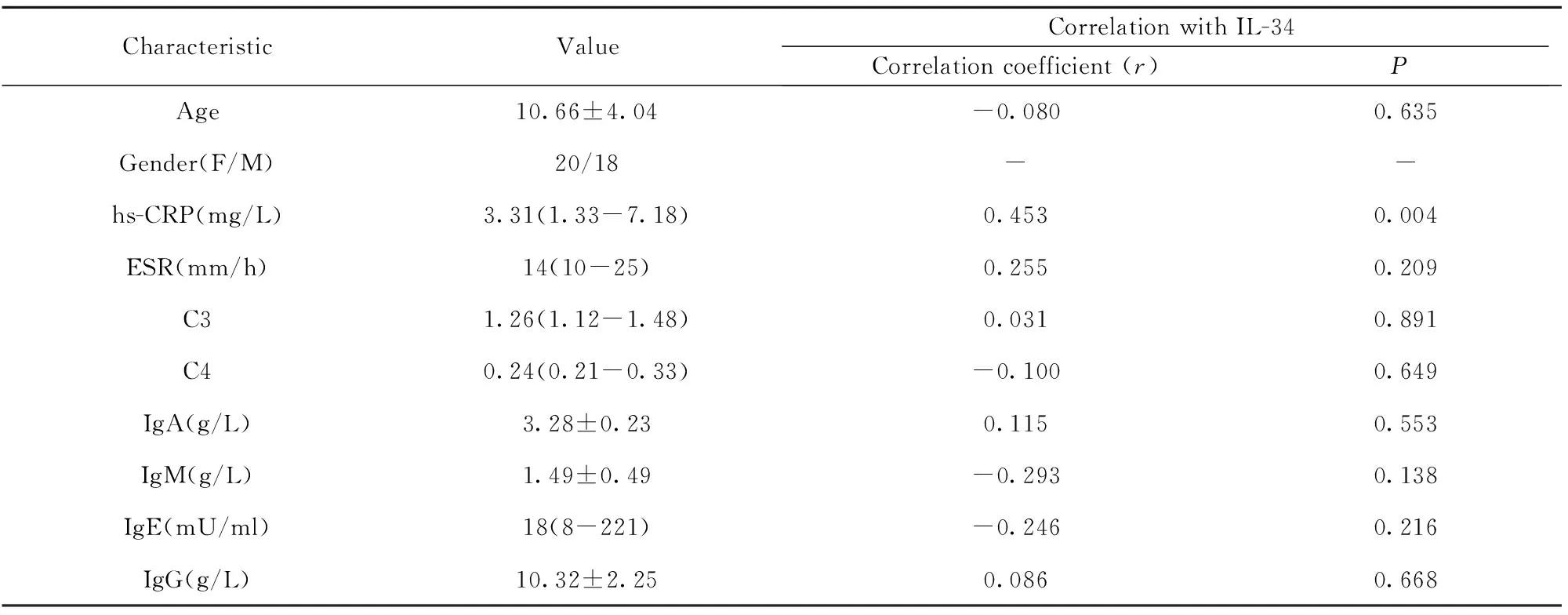
CharacteristicValueCorrelationwithIL-34Correlationcoefficient(r)PAge10.66±4.04-0.0800.635Gender(F/M)20/18--hs-CRP(mg/L)3.31(1.33-7.18)0.4530.004ESR(mm/h)14(10-25)0.2550.209C31.26(1.12-1.48)0.0310.891C40.24(0.21-0.33)-0.1000.649IgA(g/L)3.28±0.230.1150.553IgM(g/L)1.49±0.49-0.2930.138IgE(mU/ml)18(8-221)-0.2460.216IgG(g/L)10.32±2.250.0860.668
Note:C3 means complement 3;C4 means complement 4.
3 讨论
研究表明细胞因子异常表达、补体异常激活、IgA1分子异常糖基化、遗传易感性因素、外界环境因素等参与了HSP血管炎的发病过程,多种细胞因子表达异常在HSP血管壁损伤机制中起重要作用[10]。
IL-34是一种新型的细胞因子,由241个氨基酸组成二聚体蛋白,巨噬细胞、内皮细胞、成纤维细胞、神经、肝脏、上皮细胞及Treg细胞在特定的条件下均可分泌IL-34。在心、肝、脑、脾等多种组织中均可表达,尤其在脾脏中呈高表达[6,9]。IL-34与巨噬细胞集落刺激因子(M-CSF)相似,通过与集落刺激因子1受体(CSF-1R)结合,使细胞外信号调节激酶-1及激酶-2磷酸化,刺激单核-巨噬细胞系统增殖与分化,但二者无氨基酸序列同源性,信号激活途径和生物活性也不尽相同[11]。近年来研究表明IL-34和多种自身免疫性疾病以及炎症性疾病密切相关,如类风湿关节炎、溃疡性结肠炎、干燥综合征、冠状动脉炎等[12-15]。尤其在类风湿关节炎中研究较为深入。Tian等[12]研究表明在类风湿关节炎患者血清IL-34的表达水平明显增高;且和类风湿因子以及自身抗体—抗环状瓜氨酸(CCP)抗体表达量呈正相关,提示IL-34可能类风湿关节炎中自身抗体生成有关。过敏性紫癜是常见的微血管炎之一,本研究结果显示HSP患者急性期血清IL-34水平明显高于健康对照组(P<0.001),故推测IL-34可能参与过敏性紫癜的致病过程。我们推测IL-34在HSP中可能通过诱导单核巨噬细胞增殖与分化;同时促进多种细胞因子如IL-6、IL-8和单核细胞趋化蛋白1(MCP-1)等的生成和分泌[16],参与HSP微血管炎症反应的发生发展。值得注意的是,既往研究表明在HSP急性期调节性CD4+CD25+T 细胞亚群(Treg细胞)比例明显降低[5]。IL-34具有诱导人巨噬细胞向调节T细胞分化的潜能[9],IL-34是否与HSP急性期CD4+T细胞亚群失调有关,还有待于进一步研究。
促炎性细胞因子TNF-α和IL-6,在机体炎症与免疫应答反应发挥重要的作用。既往有研究表明在HSP患者皮肤病损处可见TNF-α、IL-6均呈细颗粒状浸润[17];HSP患者急性期血清中TNF-α、IL-6水平较异常增高的现象[18],同本研究结果一致。可见,二者参与过敏性紫癜中血管炎的病理损伤过程已明确。TNF-α可促进IL-1、TGF-β等炎症因子的生成,促进炎症反应,加重组织损伤;可诱导血管内皮细胞间黏附分子表达上调,诱导及加重炎症反应;同时结合Tian等[12]研究表明类风湿性关节炎行TNF-α抑制剂治疗后IL-34表达水平明显降低;Eda等[19]研究表明在破骨细胞中TNF-α通过JNK和NF-κB信号通路促进IL-34 的表达,推测在HSP中IL-34可能是作为TNF-α的下游效应器介导组织炎症的发生与发展。IL-6可促进B细胞增殖分化和分泌抗体,形成免疫复合物沉积于血管壁,激活补体级联反应,破坏血管壁的完整性;促进IL-17、IL-8等促炎因子的表达[20];刺激肝脏合成一种急性时相蛋白—hs-CRP,参与血管内皮损伤及炎症反应[21]。Eda等[16]研究表明IL-34诱导大量细胞因子IL-6的生成和释放,参与炎症反应。这一点 Franzè等[22]在溃疡性结肠炎疾病中也得出相同结论。结合本研究结果提示HSP急性期血清IL-34与hs-CRP、 IL-6水平均呈直线关系,并呈正相关(r分别为0.453、 0.469,P均<0.05),与TNF-α水平未见明显相关性(r=0.123,P=0.510)。我们推测在HSP急性期IL-34可能通过体内复杂的体液免疫或细胞免疫网络促进促炎因子IL-6、hs-CRP表达上调,促进HSP血管炎症的发生发展。目前其确切调控机制尚不清楚,有待于进一步研究。
综上所述,HSP患者可能存在IL-34、IL-6、TNF-α的高表达,且IL-34的表达水平和IL-6、hs-CRP呈正相关,提示IL-34在HSP免疫应答中发挥促炎的重要作用;可能是促进HSP系统性血管炎发生的关键性细胞因子。本研究为寻求治疗HSP新策略打下良好的基础,为临床治疗寻找新的突破点。由于本研究样本量偏小,未能根据临床类型分组进行组间比较以及尚未研究组织中IL-34表达情况,有待扩大样本量及进行相关基础实验,以进一步研究IL-34在HSP发病机制中的作用。
[1] 张 琴,鹿 玲,林 达.儿童过敏性紫癜血清IgA1和皮肤小血管IgA1的沉积及意义[J].中华皮肤科杂志,2008,41(1):55-56.
[2] Yang YH,Hung CF,Hsu CR,etal.A nationwide survey on epidemiological characteristics of childhood Henoch-Schönlein purpura in Taiwan[J].Rheumatology (Oxford),2005,44(5):618-622.
[3] Yang YH,Lai HJ,Huang CM,etal.Sera from children with active Henoch-Schönlein purpura can enhance the production of interleukin 8 by human umbilical venous endothelial cells[J].Ann Rheum Dis,2004,63(11):1511-1513.
[4] Jen HY,Chuang YH,Lin SC,etal.Increased serum interleukin-17 and peripheral Th17 cells in children with acute Henoch-Schönlein purpura[J].Pediatr Allergy Immunol,2011,22(8):862-868.
[5] 张 玲.过敏性紫癜患儿外周血Th17细胞与Treg细胞失衡的研究[J].中国免疫学杂志,2015,31(10):1404-1406.
[6] Lin H,Lee E,Hestir K,etal.Discovery of a cytokine and its receptor by functional screening of the extracellular proteome[J].Science,2008,320(5877):807-811.
[7] Chen Z,Buki K,Vääräniemi J,etal.The critical role of IL-34 in osteoclastogenesis[J].PLoS One,2011,6(4):e18689.
[8] Foucher ED,Blanchard S,Preisser L,etal.IL-34 induces the differentiation of human monocytes into immunosuppressive macrophages.antagonistic effects of GM-CSF and IFNγ[J].PLoS One,2013,8(2):e56045.
[9] Bézie S,Picarda E,Ossart J,etal.IL-34 is a Treg-specific cytokine and mediates transplant tolerance[J].J Clin Invest,2015,125(10):3952-3964.
[10] Park SJ,Suh JS,Lee JH,etal.Advances in our understanding of the pathogenesis of Henoch-Schönlein purpura and the implications for improving its diagnosis[J].Expert Rev Clin Immunol,2013,9(12):1223-1238.
[11] Chihara T,Suzu S,Hassan R,etal.IL-34 and M-CSF share the receptor Fms but are not identical in biological activity and signal activation[J].Cell Death Differ,2010,17(12):1917-1927.
[12] Tian Y,Shen H,Xia L,etal.Elevated serum and synovial fluid levels of interleukin-34 in rheumatoid arthritis:possible association with disease progression via interleukin-17 production[J].J Interferon Cytokine Res,2013,33(7):398-401.
[13] Zwicker S,Martinez GL,Bosma M,etal.Interleukin 34:a new modulator of human and experimental inflammatory bowel disease[J].Clin Sci (Lond),2015,129(3):281-290.
[14] Ciccia F,Alessandro R,Rodolico V,etal.IL-34 is overexpressed in the inflamed salivary glands of patients with Sjogren's syndrome and is associated with the local expansion of pro-inflammatory CD14(bright)CD16+ monocytes[J].Rheumatology (Oxford),2013,52(6):1009-1017.
[15] Li Z,Jin D,Wu Y,etal.Increased serum interleukin-34 in patients with coronary artery disease[J].J Int Med Res,2012,40(5):1866-1870.
[16] Eda H,Zhang J,Keith RH,etal.Macrophage-colony stimulating factor and interleukin-34 induce chemokines in human whole blood[J].Cytokine,2010,52(3):215-220.
[17] Besbas N,Saatci U,Ruacan S,etal.The role of cytokines in Henoch Schonlein purpura[J].Scand J Rheumatol,1997,26(6):456-460.
[18] Kimura S,Takeuchi S,Soma Y,etal.Raised serum levels of interleukins 6 and 8 and antiphospholipid antibodies in an adult patient with Henoch-Schönlein purpura[J].Clin Exp Dermatol,2013,38(7):730-736.
[19] Eda H,Shimada H,Beidler DR,etal.Proinflammatory cytokines,IL-1β and TNF-α,induce expression of interleukin-34 mRNA via JNK-and p44/42 MAPK-NF-κB pathway but not p38 pathway in osteoblasts[J].Rheumatol Int,2011,31(11):1525-1530.
[20] Camporeale A,Poli V.IL-6,IL-17 and STAT3:a holy trinity in auto-immunity[J].Front Biosci (Landmark Ed),2012,17:2306-2326.
[21] Howren MB,Lamkin DM,Suls J.Associations of depression with C-reactive protein,IL-1,and IL-6:a meta-analysis[J].Psychosom Med,2009,71(2):171-186.
[22] Franzè E,Monteleone I,Cupi ML,etal.Interleukin-34 sustains inflammatory pathways in the gut[J].Clin Sci (Lond),2015,129(3):271-280.
[收稿2016-06-14 修回2016-10-10]
(编辑 张晓舟)
Expression and significance of interleukin-34 level in patients with Henoch-Schoenlein purpura
WANGJuan,XIAHai-Long.
DepartmentofHematology,theFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230022,China
Objective:To investigate the serum level of IL-34 in patients with acute phase Henoch-Schoenlein purpura (HSP) and its potential significance.Methods: 38 HSP patients were recruited,together with 21 healthy volunteers as control.The serum level of IL-34,IL-6 and TNF-α were determined using enzyme-linked immunosorbent assay (ELISA) or chemiluminescence.The correlation analysis was performed to explore the correlation of IL-34 with clinical parameters and the serum level of IL-6,TNF-α.Results: The serum levels of IL-34,IL-6 and TNF-α in HSP patients were significantly higher as compared to the control group (P<0.001).The serum level of IL-34 was positively correlated with that of high sensitive C-reactive protein (hs-CRP) and IL-6 (r=0.453,P=0.004 andr=0.469,P=0.003,respectively).Conclusion: IL-34 might be involved in the pathogenesis of HSP,and the potential mechanisms of action is associated with the aberrant expression of pro-inflammatory factors in HSP,which promote the development of inflammation in the vascular system.
Purpura,Henoch-Schoenlein;Interleukin-34;Cytokines
10.3969/j.issn.1000-484X.2017.03.025
王 娟(1990年-),女,硕士,主要从事过敏性紫癜免疫紊乱发病机制的研究,E-mail:879997378@qq.com。
及指导教师:夏海龙(1964年-),男,博士,主任医师,硕士生导师,主要从事过敏性紫癜发病机制的研究,E-mail:xhl1999cn@163.com。
R554.6
A
1000-484X(2017)03-0433-04
