系统性红斑狼疮患者外周血单核细胞PD-L2分子的表达及其临床意义①
2017-04-10吴萍萍郭云娣张雅琴傅丰庆刘翠平
吴萍萍 沈 冬 郭云娣 张雅琴 傅丰庆 刘翠平 孙 静
(苏州卫生职业技术学院,苏州市检验医学重点实验室,苏州215009)
系统性红斑狼疮患者外周血单核细胞PD-L2分子的表达及其临床意义①
吴萍萍 沈 冬②郭云娣 张雅琴 傅丰庆③刘翠平③孙 静
(苏州卫生职业技术学院,苏州市检验医学重点实验室,苏州215009)
目的:分析系统性红斑狼疮患者外周血单核细胞PD-L2分子的表达及其与疾病活动程度的相关性。方法:收集26例系统性红斑狼疮患者及38例健康对照组外周血,Ficoll分离单个核细胞后,TRIZOL抽提总RNA,定量PCR分析PD-L2 基因的表达,流式细胞仪检测CD14、PD-L2分子的表达。统计学分析其相关性及与疾病活动程度之间的关联。结果:定量PCR结果提示系统性红斑狼疮患者外周血单核细胞PD-L2基因表达高于健康对照组(P<0.05),流式发现单核细胞上PD-L2高表达(P<0.05),且活动期患者表达高于稳定期,并且与疾病的评分(SLEDAI)呈正相关(P<0.05)。结论:免疫分子PD-L2可能参与系统性红斑狼疮疾病的进程并可能成为疾病预防及治疗的潜在分子。
系统性红斑狼疮;PD-L2;SLEDAI
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是一种以自身抗体和免疫复合物产生为特征的自身免疫性疾病,其主要表现为免疫系统活性增强,临床以高γ球蛋白血症、免疫复合物形成和补体系统激活为主要特征,其产生的自身抗体对自身抗原有着高度的特异性反应。患者免疫系统中免疫活性细胞包括T细胞和抗原递呈细胞的异常活化是导致免疫紊乱的基础[1]。
免疫活性细胞之间的信号转导主要通过细胞间的共刺激分子完成。研究已证明淋巴细胞的活化需要识别双信号系统,第一信号由TCR与抗原肽-MHC分子复合物特异性结合提供,第二信号由APC与T细胞表面的共刺激分子相互作用提供。正性共刺激分子(CD28、ICOS、ICAM-1、LFA-3等)和负性共刺激分子(CTLA4、BTLA、PD-1等)形成了一个复杂的信号网络,综合调节免疫反应,在免疫活化和耐受中起关键作用[2-5]。
PD-L2是B7家族第5个被发现的新成员,于2001年Tseng[6]和Mueller[7]在研究PD-L1的功能时发现并报道。PD-1(Programmed death-1)是PD-L1和PD-L2的共同受体[2],正如B7-CD28信号通路一样,PD-L1/PD-L2-PD-1信号通路在外周耐受和自身免疫病的发病机制中同样起着重要的作用。有关PD-L1在自身免疫性疾病中的作用机制已有众多研究报道,但尚未见有关PD-L2分子与自身免疫性疾病特别是SLE间的相关报道。本研究拟通过Real-time PCR及流式细胞术分析PD-L2分子在SLE外周血单核细胞的分布,并与健康对照组相比较,为研究该发分子的生物学功能及探讨其在SLE发病中的机制奠定生物学基础。
1 对象与方法
1.1 研究对象 26例SLE患者的外周血来自2014年10月至2015年7月苏州市中医医院风湿科。所有病人至少符合4个美国风湿病学会对SLE的诊断标准,并且病人在半年内均未接受过任何的激素或者免疫治疗。在研究开展前,标本收集得到了单位伦理委员会的同意。32例健康对照组的外周血来自2015年5月参加健康体检的正常者。
1.2 方法
1.2.1 Real-time PCR检测PD-L2的表达 Ficoll梯度分离外周血单个核细胞(Peripheral blood mononuclear cell,PBMC), TRIZOL抽提其总RNA(TaKaRa,大连),Oligo-dT反转录成cDNA后冻存在-20℃以备用。内参引物为β-actin,序列为:上游5′-ATC TGG CAC CAC ACC TTC TAC C-3′;下游5′-GAT AGC ACA GCC TGG ATA GCA A3′ 。PD-L2引物序列为:上游5′-GTC AGA TGG AAC CCA GGA CC-3′;下游5′-TAG GCT CCA GAG GTG AGT CC-3′。Real-time PCR中所用的SYBR购自QIGEN公司(德国),使用PCR两步法进行实验,具体为95℃10 s,60℃ 30 s,45个循环,结果用Cycel threshold(CT,单个PCR反应达到的对数扩增期的循环数)来表示。将目的基因PD-L2的CT值减去内参的CT值得到ΔCT来反映基因的表达量。
1.2.2 流式细胞术检测PD-L2的表达 利用流式细胞术评价外周血T细胞、B细胞及单核细胞上PD-L2的表达。1.2.1中利用Ficoll分离的PBMC经PBS洗涤后配置成1×106单细胞悬液,取50 μl分别与3 μl FITC标记CD14抗体(美天旎公司,德国)以及APC标记的PD-L2(BD公司,美国)抗体共孕30 min,PBS洗涤后上机检测。检测前注意避光保存,检测仪器为BD公司Accuri C6型号。

2 结果
2.1 PD-L2在SLE患者外周血PBMC中高表达 TRIZOL抽提SLE患者及健康对照组的总RNA反转录后,PCR可从中扩增出PD-L2基因,所用引物扩增的产物大小约为130 bp(见图1B)。为检测患者与健康人群中PD-L2的表达差异,我们通过荧光定量PCR扩增PD-L2基因。SLE患者组中PD-L2基因CT均值为29.79,相对内参β-actin基因ΔCT值为-0.98;健康人群组中PD-L2基因CT均值为32.04,相对内参β-actin基因ΔCT值为-4.42。SLE患者组中PD-L2基因表达明显高于健康对照组。(图2,P=0.0337)。
2.2 PD-L2在SLE患者外周血单核细胞上高表达 已有的研究报道发现PD-L2在静息的淋巴细胞包括T细胞、B细胞、单核细胞等上均不表达,而在活化的单核细胞上有表达,为分析SLE患者单核细胞上PD-L2的表达情况,我们用FITC标记的CD14抗体标记单核细胞同时用PE标记的PD-L2进行双染。结果发现SLE患者单核细胞上PD-L2表达明显高于健康对照组。SLE患者单核细胞上PD-L2的表达为10.3%,健康对照组上表达率为6.76%。两者具有显著统计学差异(P<0.05),见图3。
2.3 PD-L2的表达与SLE疾病活动程度密切相关 为分析PD-L2的表达与SLE疾病活动度是否存在相关性。我们分析了PD-L2的表达与疾病活动程度之间的相关性。疾病活动程度根据系统性红斑狼疮疾病活动度评分(SLEDAI),SLEDAI<6 者判定为稳定期病例,SLEDAI>6者判定为活动期病例。活动期SLE患者外周血PD-L2表达明显高于稳定期,且其表达水平与SLEDAI评分间有一定相关性(图4)。

图1 SLE患者外周血中β-actin 基因 及PD-L2基因的表达Fig.1 Expression of PD-L2 and β-actin in peripheral blood of SLE patientsNote: A.The expression of β-actin in PBMC of SLE patients;B.The expression of SLE PD-L2 in PBMC of SLE patients.
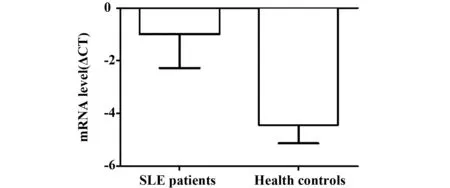
图2 定量PCR检测SLE患者与健康对照组外周血中PD-L2的表达Fig.2 Expression of PD-L2 through Real-time PCR analysis in PBMC of SLE and healthy controls
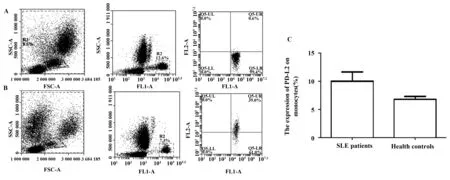
图3 系统性红斑狼疮患者外周血单核细胞上PD-L2表达明显高于健康对照组Fig.3 Increased PD-L2 expression on monocytes in peripheral blood of SLE patientsNote: A.Representative flow cytometry of PD-L2 expression on monocytes in the PBMC of healthy controls;B.Representative flow cytometry of PD-L2 expression on monocytes in the PBMC of SLE grougp;C.The average percent of PD-L2 expression on monocytes.
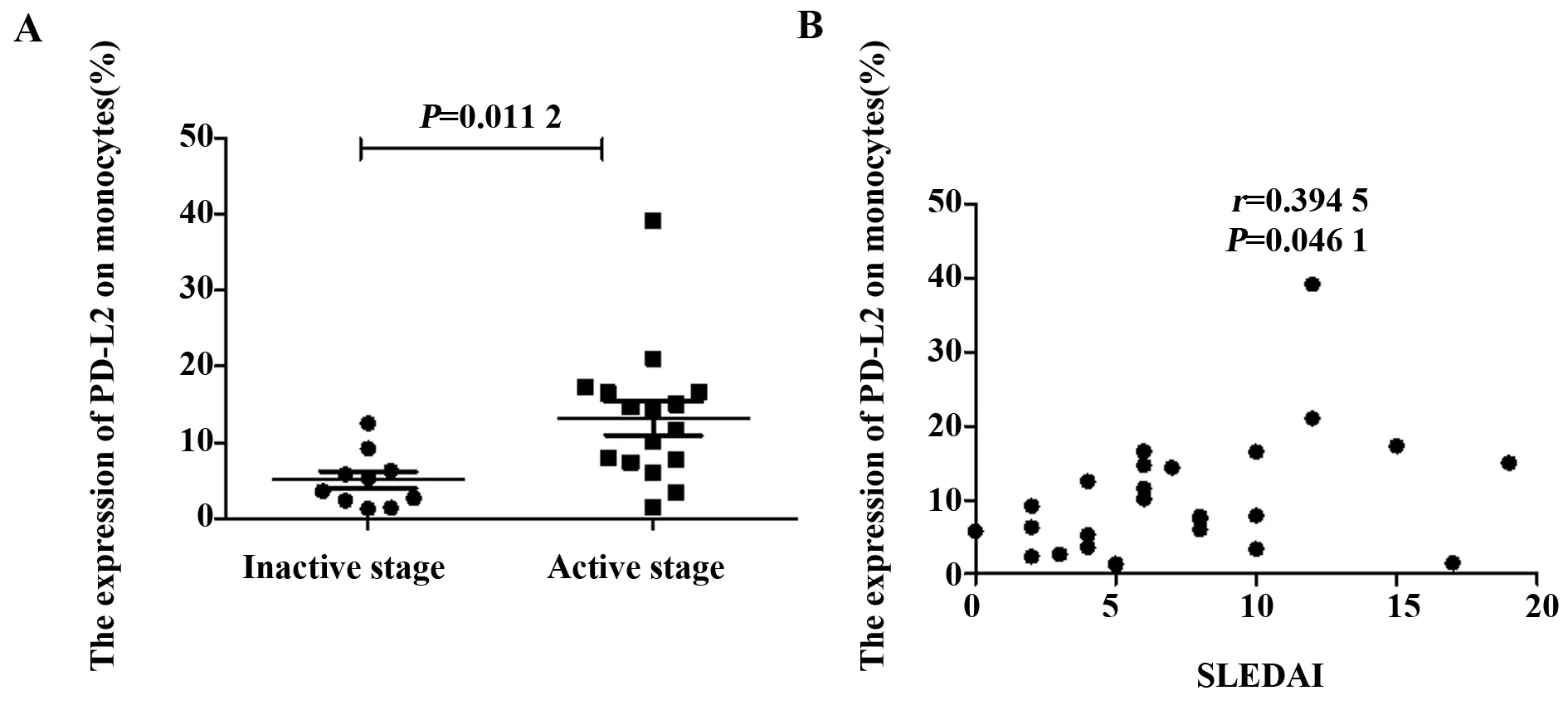
图4 系统性红斑狼疮外周血单核细胞上PD-L2的表达与疾病活动相关Fig.4 Correlation of PD-L2 expression on monocytes in SLE and degree of disease activity Note: A.The percentage of PD-L2 positive cells is plotted for RA patients with active disease(n=16) and patients in catabasis(n=10).PD-L2 expression was statistically higher in the active stage than in catabasis(P=0.011 2);B.The percentage of PD-L2 positive cells in SLE patients correlates with their disease activity score(SLEDAI)(P=0.046 1).
3 讨论
共刺激分子在免疫应答中具有重要作用,其决定了T细胞活化后的去向:增殖、无能或凋亡[8]。正负信号形成复杂的免疫网络调节免疫反应,发挥免疫效应或是维持免疫耐受。在这其中PD-L1和PD-L2及其受体PD-1的信号途径被认为与移植排斥反应、自身免疫性疾病、慢性病毒感染、肿瘤等疾病密切相关,因此探讨该途径在疾病中的功能是目前研究的热点[9-11]。
SLE是一类以全身免疫异常而导致多器官受累为特征的疾病,病理表现为大量自身抗体产生和免疫复合物的沉积。机体产生针对核成分的自身抗体,能与许多自身成分形成免疫复合物,并在局部激活补体系统,吸引中性粒细胞浸润,造成局部组织的炎症损伤。已有部分研究报道发现SLE患者外周血中PBMC存在表达PD-1及PD-L1异常[12,13],发现PD-1受体在患者体内表达下降导致机体免疫耐受功能受到影响产生大量自身抗体,而有关PD-1另一配体PD-L2在SLE患者体内的表达及生物学功能机制至今尚未清楚。
为探讨PD-L2分子在SLE患者中的中的表达情况,我们通过荧光定量PCR方法及流式细胞术分析该基因在SLE患者外周血PBMC中的表达情况。研究结果发现PD-L2在SLE患者体内相对于健康人群明显高表达,且活动期患者表达水平明显高于稳定期。PD-1/PD-L信号通路作为经典的T细胞抑制性信号,近年来也发现其对T细胞的活化具有一定作用,因此PD-L2在自身免疫病SLE患者外周血中高表达也具备可能性,若条件允许后期工作应进一步扩大样本含量来验证实验结果,此工作可能为进一步探讨PD-L2分子的生物学功能,为研究SLE 发病机制以及寻找分子诊断标志和药物靶标提供线索。
[1] Raziuddin S,Nur MA,Wabel AA,etal.Increased circulating HLA-DR+CD4+T cells in systemic lupus erythematosus:alterations associated with prednisolone therapy[J].Scand J Immunol,1990,31(2):139-145.
[2] Sharpe AH,Wherry EJ,Ahmed R,etal.The function of programmed cell death 1 and its ligands in regulating autoimmunity and infection[J].Nat Immunol,2007,8(3):239-245.
[3] Foell JL,Diez-Mendiondo BI,Diez OH,etal.Engagement of the CD137(4-1BB)costimulatory molecule inhibits and reverses the autoimmune process in collagen-induced arthritis and establishes lasting disease resistance[J].Immunology,2004,113(1):89-98.
[4] Podojil JR,Miller SD.Molecular mechanisms of T-cell receptor and costimulatory molecule ligation/blockade in autoimmune disease therapy[J].Immunol Rev,2009,229(1):337-355.
[5] 张学光.共刺激分子及其调节网络在特异性免疫应答中的作用及机制 [J].中国免疫学杂志,2006,20(1):26-32.
[6] Tseng SY,Otsuji M,Gorsaki K,etal.B7-DC,a new dendritic cell molecule with potent costimulatory properties for T cell [J].J Exp Med,2001,193(7):839-845.
[7] Mueller DL.T cells:Aproliferation of costimulatory molecules[J].Curr Biol,2000,10(6):227-230.
[8] Sharpe AH.Mechanisms of costimulation[J].Immunol Rev,2009,229(1):5-11.
[9] Kristjansdottir H,Steinsson K,Gunnarsson I,etal.Lower expression levels of the programmed death 1 receptor on CD4+CD25+T cells and correlation with the PD-1.3A genotype in pat ients with systemic lupus erythematosus [J].Arthritis Rheum,2010,62(6):1702-1711.
[10] Liu MF,Weng CT,Weng MY.Variable increased expression of program death-1 and program death-1 ligands on peripheral mononuclear cells is not impaired in patients with systemic lupus erythematosus[J].J Biomed Biotechnol,2009,10(1115):406136.
[11] Muenst S,Soysal S D,Tzankov A,etal.The PD-1/PD-L1 pathway:biological background and clinical relevance of an emerging treatment target in immunotherapy[J].Exp Opin Ther Targets,2015,19(2):201-211.
[12] Luo Q,Huang Z,Ye J,etal.PD-L1-expressing neutrophils as a novel indicator to assess disease activity and severity of systemic lupus erythematosus[J].Arthritis Res Ther,2016,18(47):1-1.
[13] Ou JN,Wiedeman AE,Stevens AM.TNF-α and TGF-β counter-regulate PD-L1 expression on monocytes in systemic lupus erythematosus[J].Scientific Reports,2012,2(295):295-295.
[收稿2016-10-20 修回2016-11-08]
(编辑 倪 鹏)
Expression and clinical significance of PD-L2 molecule on monocytes of peripheral blood in systemic lupus erythematosus
WUPing-Ping,SHENDong,GUOYun-Di,ZHANGYa-Qin,FUFeng-Qing,LIUCui-Ping,SUNJing.
SuzhouVocationalHealthTechnology,SuzhouKeyLaboratoryofLaboratoryMedicine,Suzhou215009,China
Objective:To analyze PD-L2 expression on monocytes of peripheral blood cells in systemic lupus erythematosus(SLE) and it′s correlation with the degree of disease activity.Methods: Peripheral blood of 26 cases of SLE patiens and 38 cases of healthy controls were collected.Peripheral blood mononuclear cells(PBMC) were isolated and realtime PCR was carried on to analyze the PD-L2 gene expression.At the same time flow cytometry was performed to analyze the CD14 and PD-L2 expression.Results: PD-L2 was significantly up-regulated on monocytes in RA patients than in healthy controls and had correlation with the disease activity and the SLEAI score.Conclusion: These findings help to clarify the function of PD-L2,including its potential role as a biomarker for SLE.
Systemic lupus erythematosus;PD-L2;SLEDAI
10.3969/j.issn.1000-484X.2017.03.020
①本文受国家自然科学基金资助项目(31170836)和江苏省高校优秀科技创新团队项目(自身免疫病抗体的挖掘和应用)的资助。
吴萍萍(1987年-),女,实验员,主要从事分子免疫和临床免疫学方面的研究。
及指导教师:孙 静(1981年-),女,博士,副教授,主要从事肿瘤免疫和自身免疫病方向研究,E-mail:jsun@szhct.edu.cn
R392.11
A
1000-484X(2017)03-0414-04
②苏州科技城医院,苏州2151530。
③苏州大学附属第一医院临床免疫研究所,苏州215007。
