CEA迷你肽表位基因疫苗诱导小鼠抗肿瘤免疫的研究①
2017-04-10魏海峰米旭光李首庆方艳秋
魏海峰 谭 岩 李 丹 刘 磊 米旭光 李首庆 方艳秋
(吉林省人民医院医学诊治实验中心,长春130021)
CEA迷你肽表位基因疫苗诱导小鼠抗肿瘤免疫的研究①
魏海峰 谭 岩 李 丹②刘 磊 米旭光 李首庆 方艳秋
(吉林省人民医院医学诊治实验中心,长春130021)
目的:利用含有CEA625-667基因的单倍体疫苗pcDNA-CEA625-667及三串联体的DNA疫苗pcDNA-triCEA625-667免疫小鼠后,观察其诱导的抗肿瘤免疫效应。方法:采用4~6周纯系BALB/c小鼠,肌肉注射法分pc-DNA3.0、pcDNA-CEA625-667、pcDNA-triCEA625-667三组免疫小鼠,对其激发的机体特异性及非特异性免疫反应进行研究。流式细胞术检测免疫小鼠脾细胞的T细胞亚群和CD4+/CD8+比值;3H-TdR 掺入法检测免疫小鼠的特异性淋巴细胞增殖;Western blot杂交及ELISA法检测免疫小鼠血清中的CEA特异性抗体;ELISA法检测免疫动物脾细胞体外诱导IFN-γ、IL-4、GM-CSF的分泌水平。结果:实验组与对照组的CD4+/CD8+比值差异无统计学意义;经过基因疫苗免疫的小鼠与天然小鼠相比,其脾细胞在体外与短肽共孵育之后,会在更短的时间内出现更明显的细胞增殖;免疫了CEA迷你基因串联体肿瘤疫苗的小鼠血清中可以产生低滴度的抗体,提示HTL的活化;免疫小鼠脾细胞上清中IFN-γ的含量明显高于对照组,而pc-DNA3.0,pcDNA-CEA625-667,pcDNA-triCEA625-667各组IL-4的含量均很低,差异无统计学意义;迷你基因三倍体疫苗所引发的增殖效应以及释放细胞因子的水平均高于迷你基因一倍体,说明我们所采用将目的基因多倍串联的抗原改造的方式起到了增强免疫效应的作用。结论:CEA迷你肽表位基因单倍体及三倍体疫苗均不能显著改变动物体内CD4/CD8比值,但均能诱导HTL活化,使被免疫机体T细胞趋向于Th1效应且三倍体疫苗的免疫原性强于单倍体疫苗。
癌胚抗原;迷你基因;基因疫苗;肿瘤生物治疗
癌胚抗原(Carcinoembryonic antigen,CEA)作为肿瘤相关抗原,因其在正常组织中极有限的表达,以及广泛出现在上皮源性肿瘤细胞的过量表达而成为肿瘤生物治疗研究的热点[1,2]。目前以CEA为基础的肿瘤生物治疗分为主动免疫和被动免疫治疗,主动免疫主要指DNA疫苗,被动免疫包括多肽疫苗和抗体治疗。其中DNA疫苗因其具有良好的安全性,且作用持久、设计简便、产量大、较经济等特点而备受研究者关注[3]。本研究组前期成功构建了含有CEA625-667基因单倍体疫苗pcDNA-CEA625-667及三串联体的DNA疫苗pcDNA-triCEA625-667。本次实验拟将此重组DNA疫苗免疫小鼠,对其激发的体液免疫和细胞免疫进行研究。
1 资料与方法
1.1 实验材料 重组真核表达质粒pcDNA-CEA625-667及pcDNA-triCEA625-667(本室制备并保存);FITC标记的羊抗鼠单克隆抗体、生物素标记的马抗小鼠IgG及辣根过氧化物酶标记亲和素(北京鼎国生物公司);小鼠IFN-γ ELISA试剂盒、小鼠白介素-4 ELISA试剂盒、小鼠单核-巨噬细胞克隆刺激因子ELISA试剂盒(武汉博士德生物工程有限公司);IMDM培养基(美国Sigma公司);胎牛血清(Gibcobrl公司);3H-TdR(3H-胸腺嘧啶,中国原子能研究所);双色荧光抗体FITC(异硫氰酸荧光素)和PE(藻红蛋白)标记的羊抗鼠单克隆抗体CD3/CD4、CD3/CD8(深圳达科为生物技术有限公司);6~8周龄雄性BALB/c小鼠购自吉林大学基础医学院动物室。
1.2 实验方法
1.2.1 动物分组和免疫 4~6周龄雌性BALB/c小鼠随机分为3组,每组6只:pcDNA3.0组; pcDNA-CEA625-667组;pcDNA-triCEA625-667组。肌肉注射法免疫动物。浓度为0.95 μg/μl的质粒与终浓度3%氢氧化铝胶悬液1∶1(V∶V)混合,每只小鼠每次接种100 μg质粒(溶于0.1 ml氢氧化铝胶中与质粒混合后总体积0.2 ml)。分两侧注射与小鼠大腿内侧肌群,每隔10 d免疫1次,共免疫4次。
1.2.2 收集免疫动物血清 最后一次免疫后10 d,取小鼠眼血,37℃放置30 min,1 000 r/min离心10 min,取上清-20℃保存。
1.2.3 免疫动物脾细胞的收集 最后一次免疫后10 d,断颈处死小鼠,无菌取脾。将脾浸入含10%小牛血清的IMDM细胞培养液中,轻轻研磨,纱布过滤后用玻璃试管收集脾细胞。离心、破红、重悬、洗涤后并进行细胞计数。根据细胞计数结果,用一定体积的完全细胞培养液混悬细胞,使浓度为1×107ml-1。
1.2.4 小鼠T细胞亚群检测 各免疫组小鼠每个样本取1×106小鼠脾细胞加入管内,用0.1 mol/L、pH7.0 PBS洗涤2次,分别加入荧光标记抗体10 μl,振荡混匀后室温避光作用20 min。用PBS洗2次后,再加入0.5 ml PBS混匀,上机检测CD3、CD4、CD8阳性表达率。
1.2.5 Western blot检测免疫动物血清中的CEA625-667抗体 取10 μl浓度为0.95 mg/ml的纯化短肽CEA625-667行SDS-PAGE电泳,利用半干式转移电泳仪将蛋白质转移至硝酸纤维素膜,进行Western blot,一抗为各免疫组小鼠的1∶100稀释血清。
1.2.6 ELISA方法检测免疫动物脾细胞上清中IFN-γ、IL-4、GM-CSF的含量 各免疫组小鼠每个样本设2复孔,各取脾细胞1×106孔-1,加入96孔板,事先每孔中加入终浓度为10 μg/ml的CEA625-667短肽(对照孔中不加),并用IMDM完全培养基,将每孔总体积调为200 μl,置37℃ 5%CO2培养箱中培养72 h后,收集细胞培养上清,置-70℃冰箱中保存待测。IFN-γ、IL-4、GM-CSF的ELISA检测方法按试剂盒说明进行操作。
1.2.73H-TdR掺入法检测免疫动物特异性淋巴细胞增殖水平 各免疫组小鼠每个样本设3复孔,各取脾细胞1×106孔,加入96孔板,事先每孔中加入终浓度为10 μg/ml的CEA625-667短肽(对照孔中不加),并用IMDM完全培养基,将每孔总体积调为200 μl,置37℃ 5%CO2培养箱中培养96 h后,加入3H-TdR 1.0 Ci/孔,再培养16 h,用多头细胞收集仪将细胞收集于玻璃纤维滤纸上,烤干后将滤纸放入闪烁杯中,液闪仪计数。
1.3 统计学处理 应用SPSS19.0统计学软件进行统计学分析。数据经方差齐性检验,若方差齐则采用样本均数比较的方差检验(LSD-t检验);若方差不齐则采用非参数检验(秩和检验),P<0.05认为差异有统计学意义。
2 结果
2.1 免疫小鼠T细胞亚群检测结果 pcDNA-CEA625-667、pcDNA-triCEA625-667组和空质粒pc-DNA3.0组免疫小鼠的CD3+、CD4+、CD8+T细胞数和CD4+/CD8+值比较差异均无统计学,见表1。
2.2 免疫小鼠血清中CEA625-667抗体的Western blot检测结果 空质粒对照组在6.7 kD处未见阳性蛋白带,pcDNA-CEA625-667和pcDNA-triCEA625-667免疫组血清在1∶500稀释度下,与重组CEA短肽结合,在6.9 kD处可见阳性蛋白带,见图1。
2.3 免疫小鼠脾细胞体外诱导细胞因子的分泌 免疫小鼠脾细胞在体外用CEA短肽刺激72 h后,检测IFN-γ、GM-CSF及IL-4的分泌,结果见表2。CEA短肽刺激可明显诱导释放IFN-γ及GM-CSF的水平升高,与不用CEA短肽刺激组相比,差异具有统计学意义(P<0.001)。免疫小鼠脾细胞上清中IFN-γ的含量明显高于对照组(P<0.001),pcDNA-triCEA625-667诱导释放IFN-γ的水平均高于pcDNA-CEA625-667,两者比较差异有统计学意义(P<0.05)。小鼠脾细胞培养上清中GM-CSF的含量在pc-DNA3.0、pcDNA-CEA625-667、pcDNA-triCEA625-667组测量值依次增高,但差异无统计学意义。所有实验组和对照组均未检测到IL-4分泌。
2.4 免疫动物的特异性淋巴细胞增殖水平 末次免疫后10 d,取免疫组小鼠脾细胞与10 μmol/L CEA625-667短肽共孵育96 h后,测细胞增殖。淋巴细胞增殖反应结果见表3。经统计学分析,各实验组间差异有显著统计学意义。


GroupsCD3+(%)CD4+(%)CD8+(%)CD4+/CD8+pcDNA-3.052.25±3.0524.57±2.4112.44±3.032.05±0.31pcDNA-CEA625-66753.01±3.7823.45±4.2811.18±3.352.18±0.30pcDNA-triCEA625-66758.72±3.2125.87±3.3114.28±3.501.87±0.24
GroupsConcentrationofIFN-γ(pg/ml)WithpeptideNopeptideConcentrationofGM-CSF(pg/ml)WithpeptideNopeptidepcDNA-3.053.33±6.5265.00±8.25198.50±16.871)23.83±5.05pcDNA-CEA625-667 213.17±13.251)2)147.24±6.79228.17±12.351)18.67±5.53pcDNA-triCEA625-667 335.17±42.761)2)3)190.53±4.98240.67±13.981)15.83±5.21
Note:1)P<0.001 vs no peptide;2)P<0.001 vs pcDNA-3.0 group; 3)P<0.05 vs pcDNA-CEA625-667group.

图1 免疫小鼠血清中CEA625-667抗体的Western blot检测结果Fig.1 Western blot for CEA625-667 hybridized by serum from immuned miceNote: 1.The standard protein marker;2.Recombinant CEA625-667 protein;3.The western blot of pcDNA-3.0 group;4.The Western blot of pcDNA-CEA625-667 group;5.The Western blot of pcDNA-triCEA625-667 group.

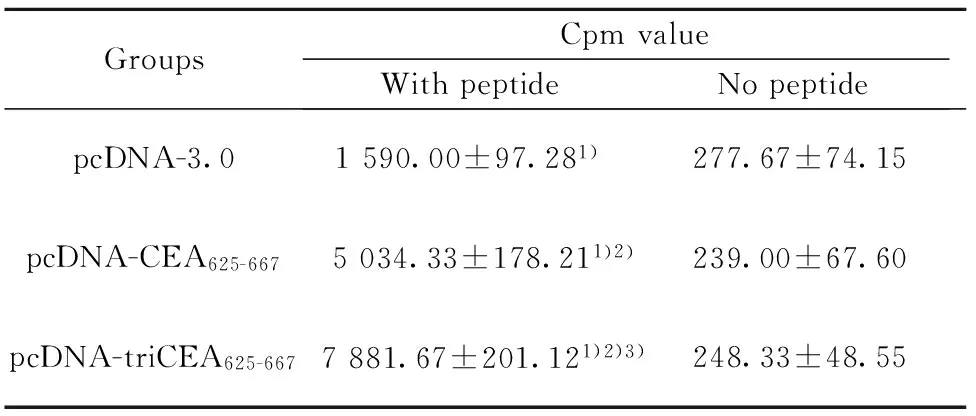
GroupsCpmvalueWithpeptideNopeptidepcDNA-3.01590.00±97.281)277.67±74.15pcDNA-CEA625-667 5034.33±178.211)2)239.00±67.60pcDNA-triCEA625-667 7881.67±201.121)2)3)248.33±48.55
Note:1)P<0.001 vs no peptide;2)P<0.001 vs pcDNA-3.0 group;3)P<0.01 vs pcDNA-CEA625-667group.
3 讨论
免疫细胞可通过分泌细胞因子或直接接触,进行细胞间的相互作用,从而对免疫应答进行直接或间接的调节,当机体的免疫系统被某种异种抗原激活后,会表现出CD4+/CD8+比值上升,提示免疫应答的正调节占优势。在本实验中疫苗免疫小鼠后,实验组与对照组的CD4+/CD8+比值无统计学差异,得到这种结果的原因可能是多方面的,以往认为,CD4+T细胞具有调节免疫反应活性,辅助B细胞产生抗体,分泌细胞因子的作用,而CD8+T细胞则有免疫抑制和细胞毒性作用。但目前人们已经确认存在CD4+杀伤性T细胞[4],因而不能说CD4+T细胞一定发挥上调作用;而且最近研究表明,抑制免疫应答的T细胞亚群确实存在,但这些细胞不是CD8+T细胞,而是CD4+T细胞[5]。CD8+T细胞中也还有一类显示反抑制活性的细胞,在免疫应答中发挥上调作用[6]。当然,也不能除外我们所构建的以表位为基础的疫苗无法达到全基因疫苗一样激活整个免疫系统的免疫效力,或DNA疫苗在体内提呈不完全等情况。
本实验应用细胞增殖实验以及抗体和细胞因子的检测来反映免疫小鼠的HTL效应,经过DNA免疫的小鼠与天然小鼠相比,其脾细胞在体外与短肽共孵育之后,会在更短的时间内出现更明显的细胞增殖。通过对抗体的检测,我们发现免疫了CEA迷你基因串联体肿瘤疫苗的小鼠血清中可以产生低滴度的抗体,进一步证实了CEA迷你肽表位基因疫苗可有效诱导HTL效应,激发机体的特异性免疫。有实验证明CD4+T细胞的激活需要抗原递呈细胞通过MHC classⅡ提供抗原表位,其标志性的改变是B细胞分泌抗原表位特异性的IgG抗体[7]。由于Th1/Th2类细胞因子含量体现了Th细胞辅助其他淋巴细胞发挥免疫活性的功能,随后我们通过对免疫小鼠脾细胞上清中细胞因子的检测,对Th1/Th2类细胞的活化趋势做了进一步的探讨。实验结果表示免疫小鼠脾细胞上清中IFN-γ的含量明显高于对照组,而pc-DNA3.0、pcDNA-CEA625-667、pcDNA-triCEA625-667各组IL-4的含量均很低,提示了本研究所选用的高亲和力Th表位使被免疫机体T细胞趋向于Th1效应。这与Ahlers[8]的实验结果相吻合,可能是由于高亲和力的Th表位可以产生一个更强的CD40L信号传导来激活树突状细胞产生IL-12,而得到一个更加极性化的抗原提呈细胞,这对诱导出能够产生IFN-γ的CD4+T细胞可能是必要的[9]。
与全序列基因疫苗比较,迷你基因疫苗能够针对特异性抗原表位诱导免疫反应,而避免了无关抗原表位的影响。本研究结果表明,迷你基因三倍体疫苗所引发的增殖效应以及释放细胞因子的水平均高于迷你基因一倍体,两者比较有统计学差异,说明我们所采用的将目的基因多倍串联的抗原改造方式起到了增强免疫效应的作用。本研究为有关CEA短小目的基因串联疫苗的研制与临床前实验奠定了基础。
[1] Ahn E,Kim H,Han KT,etal.A loss of antitumor therapeutic activity of CEA DNA vaccines is associated with the lack of tumor cells' antigen presentation to Ag-specific CTLs in a colon cancer model[J].Cancer Lett,2015,356(2):676-685.
[2] Bilusic M,Heery CR,Arlen PM,etal.Phase I trial of a recombinant yeast-CEA vaccine (GI-6207) in adults with metastatic CEA-expressing carcinoma[J].Cancer Immunol Immunother,2014,63(3):225-234.
[3] Khalili S,Rahbar MR,Dezfulian MH,etal.In silico analyses of Wilms′ tumor protein to designing a novel multi-epitope DNA vaccine against cancer[J].J Theor Biol,2015,379:66-78.
[4] Mi JQ,Manches O,Wang J,etal.Development of autologous cytotoxic CD4+T clones in a human model of B-cell non-Hodgkin follicular lymphoma[J].Br J Haematol,2006,135(3):324-335.
[5] Qiao M,Thornton AM,Shevach EM.CD4(+)CD5(+)regulatory T cellsrender naive CD4(+)CD25(-)T cells anergic and suppressive[J].Immunology,2007,120(4):447-455 .
[6] Wang C,Liu X,Li Z,etal.CD8(+) NK T-like cells regulate the immune response by killing antigen-bearing DCs[J].Sci Rep,2015,5:14124.
[7] Barbosa MD,Celis E.Immunogenicity of protein therapeutics and the interplay between tolerance and antibody responses[J].Drug Discov Today,2007,12(15):674-681.
[8] Ahlers JD,Belyakov IM,Thomas EK,etal.High-affinity T helper epitope induces complementary helper and APC polarization,increased CTL,and protection against viral infection[J].J Clin Invest,2001,108(11):1677-1685.
[9] Ahlers JD,Belyakov IM,Matsui S,etal.Signals delivered through TCR instruct IL-12R expression: IL-12 and TNF-α synergize for IL-12R expression at low antigen dose[J].Int Immunol,2001,13(11):1433-1442.
[收稿2016-12-09]
(编辑 许四平)
Study on antitumor effect of minigene DNA vaccine derived from Carcinoembryonic Antigen (CEA) gene in mice
WEIHai-Feng,TANYan,LIDan,LIULei,MIXu-Guang,LIShou-Qing,FANGYan-Qiu.
CenterforMedicalTreatmentandDiagnosis,JilinProvincePeople′sHospital,Changchun130021,China
Objective:To observe the immunological activity of haploid vaccine and three tandem repeats of minigene DNA vaccine derived from Carcinoembryonic Antigen (CEA) gene.Methods: The immunoreaction was induced by intramuscular injection with pc-DNA3.0,pcDNA-CEA625-667and pcDNA-triCEA625-667in BALB/c.Four weeks after injection,the spleen cells and serum were separated respectively from the mice for the in vitro assessment.Changes of the T lymphocytes subset was analyzed by flow cytometry.Lymph proliferation responses were tested by3H-TdR incorporation,IFN-γ,IL-4 and GM-CSF in their cultural supernatants were detected with ELISA and seral IgG antibody against CEA were detected with Western blot and ELISA.Results: The difference of the ratio of CD4+/CD8+of the mice immuned by pc-DNA3.0,pcDNA-CEA625-667or pcDNA-triCEA625-667was not significant.Lymph proliferation responses were more significant in the mice immuned by pcDNA-CEA625-667and pcDNA-triCEA625-667in a shorter time by contrast with naïve mice.Low tilter IgG antibody against CEA was detected in the antiserum of the mice immuned by repeats of minigene DNA vaccine,which suggested the activation of helper T-cell.ELISA showed that the level of IFNγ in the 3 days culture of the splenocytes was relatively higher in the groups of minigene DNA vaccination than in the control groups,while IL-4 expression was absent in all groups.The immune response level elicited by three tandem repeats of minigene DNA vaccine pcDNA-triCEA625-667was superior to that elicited by pcDNA-CEA625-667,which showed that any immunogenic inadequacies in minigene presentation can be rectified by linking itself in a string-of-beads vaccine.Conclusion: The haploid vaccine and three tandem repeats of minigene DNA vaccine derived from CEA gene both can not change the ratio of CD4+/CD8+but can induce the activation of helper T-cell and skew T cells toward Th1 response.The immune response level elicited by three tandem repeats of minigene DNA vaccine was superior to that elicited by haploid vaccine.
Carcinoembryonic antigen;Minigene;DNA vaccine;Tumor biological therapy
10.3969/j.issn.1000-484X.2017.03.014
①本文受吉林省科技厅国际合作项目(20140414043GH)、吉林省科技厅中青年科技创新领军人才及团队项目(20140519018JH)、吉林省人社厅省人才开发资金(2016年度)和吉林省科技厅重点实验室项目(20122113)资助。
魏海峰(1978年-),男,博士,助理研究员,主要从事肿瘤基础及临床研究,E-mail:whfweb@163.com。
及指导教师:方艳秋(1968年-),女,博士,教授,主任医师,硕士生导师,主要从事肿瘤生物治疗基础与临床研究,E-mail:yq.fang@163.com。
R392 R730.5
A
1000-484X(2017)03-0384-04
②吉林大学第一医院呼吸内科,长春130021。
