黄芪总苷对TGF-β1诱导下足细胞TRPC6表达的影响①
2017-04-10黄海庭吴好好覃幼玲尤燕舞郭鹏威汤春荣
黄海庭 吴好好 覃幼玲 林 栩 尤燕舞 郭鹏威 汤春荣
(右江民族医学院附属医院肾内科,百色533000)
·中医中药与免疫·
黄芪总苷对TGF-β1诱导下足细胞TRPC6表达的影响①
黄海庭 吴好好 覃幼玲 林 栩 尤燕舞 郭鹏威 汤春荣
(右江民族医学院附属医院肾内科,百色533000)
目的:通过观察黄芪总苷对TGF-β1诱导足细胞TRPC6表达的影响,探讨黄芪总苷对足细胞保护作用。方法:体外培养小鼠肾小球足细胞,将成熟的足细胞分为5组:正常对照组、TGF-β1干预组、TGF-β1干预+低剂量黄芪总苷组、TGF-β1干预+中剂量黄芪总苷组、TGF-β1干预+高剂量黄芪总苷组,48 h后MTT检测各组细胞增殖抑制率,Western blot及RT-PCR检测TRPC6蛋白及mRNA表达水平。结果:TGF-β1干预使足细胞足突回缩、甚至消失,抑制足细胞的增殖(P<0.05),提高TRPC6 mRNA和蛋白表达(P<0.05),黄芪总苷能逆转上述变化,对足细胞具有保护作用并且存在一定的量效关系。结论:TPRC6在TGF-β1干预下足细胞损伤作用中起重要作用,黄芪总苷可能通过下调足细胞TRPC6的表达实现对足细胞的保护作用。
足细胞;转化生长因子-β1;TRPC6;黄芪总苷
黄芪总苷(Astragalosides,AST)是黄芪的主要有效成分,以往的体外及动物实验显示,黄芪组方或黄芪甲苷对肾病综合征、糖尿病肾病等具有良好保护作用,其机制可能与减少足细胞凋亡、维持足细胞裂孔隔膜完整性有关[1-3],提示黄芪总苷对足细胞可能具有保护作用,但至今未见关于其对足细胞损伤保护作用机制的相关研究。
TRPC6是足细胞裂孔隔膜重要组成成分之一,众多研究表明TRPC6表达升高是足细胞损伤的重要因素。黄芪总苷对足细胞具有保护作用,其机制是否与调节TRPC6表达有关,至今未见报道。本研究采用TGF-β1诱导足细胞损伤模型,检测黄芪总苷干预后对TGF-β1诱导足细胞增殖抑制和TRPC6表达的影响,探讨黄芪总苷对足细胞的可能保护作用机制,为寻找足细胞特异性保护作用药物提供理论依据。
1 材料与方法
1.1 材料 肾小球足细胞株(MPC5)购于上海复旦大学细胞中心;RNA提取试剂盒(爱思进 AxyPrep);RPMI1640培养液(Gibco)、MTT(武汉博士德);胎牛血清(海克隆);重组人TGF-β1和黄芪总苷标准品(ProSpec-Tany)、SuperQuickRT MasterMix、UltraSYBR MixturePCR(康为世纪);TRPC6和内参(GAPDH)一抗及HRP标记的二抗(美国Abcam)。
1.2 方法
1.2.1 足细胞培养及实验分组 用含10%胎牛血清的RPMI1640培养液,在5%CO2、37℃培养箱中传代培养。本课题组的前期研究已经证实该细胞株具有分化成熟足细胞的典型特征[4],且经过预实验我们得出TGF-β1对足细胞的半抑制率(IC50)为12 ng/ml,干预48 h,因此本实验中我们将选择这个浓度和干预时间进行实验。实验将细胞分为5组:正常对照组、TGF-β1干预组(TGF-β1终浓度为12 ng/ml)、TGF-β1干预+低剂量黄芪总苷组(黄芪总苷终浓度为40 mg/ml)、TGF-β1干预+中剂量黄芪总苷组(黄芪总苷终浓度为80 mg/ml)、TGF-β1干预+高剂量黄芪总苷组(黄芪总苷终浓度为120 mg/ml)。
1.2.2 2,5-二苯基四氮唑溴盐法(MTT法)检测细胞增殖 将细胞按1×104个/孔接种于96孔板,每孔终体积为200 μl;培养4 h,待细胞贴壁后分别加入不同浓度的TGF-β1和黄芪总苷(使TGF-β1终浓度均为12 ng/ml,黄芪总苷终浓度分别为40、80、120 mg/ml)处理足细胞,每一浓度设置4个副孔,并设空白对照孔(只加培养基),继续培养48 h;干预48 h 后,每孔加入15 μl MTT溶液(浓度为5 mg/ml),37℃ 5%CO2培养箱中继续培养4 h;小心吸去每孔全部培养基,加入150 μl二甲基亚飒,37℃摇床孵育15 min;在酶标仪上测定570nm的吸亮度值,吸亮度值的强弱与活细胞数量成正比,代入公式:抑制率=(1-实验组OD值)/对照组OD值×100%计算各组增殖率。
1.2.3 Real-time RT-PCR检测肾小球足细胞TRPC6 mRNA表达 TRPC6 mRNA表达模型建立后按 RNA提取试剂盒提取各组细胞总RNA,检测其浓度和纯度后,取1 μg RNA放入PTC-200中进行逆转录得到cDNA。引物序列采用Primer Premier3.0程序设计,引物序列见表1。反应总体系20 μl,反应条件:95℃预变性10 min,95℃变性15 s,60℃退火/延伸60 s,循环40次,同时设熔解曲线55~95℃ 10 s 共81个循环。目标基因相对于内参基因进行相对定量,采用2-ΔΔCt法进行mRNA相对表达量的比较。PCR扩增产物经1.5%琼脂糖凝胶电泳检测基因特异性。为减少误差,每个样品均设3个复孔,每组重复 3次。
1.2.4 Western blot法检测肾小球足细胞TRPC6蛋白表达 TRPC6蛋白表达模型建立后各组细胞用4℃预冷的PBS洗2次,加入150 μl预冷PI裂解液,冰浴5 min,用刮勺收集细胞至1.5 ml EP管中,4℃ 12 000 r/min离心10 min,取上清,以二喹琳甲酸(BCA)法测定各组蛋白质浓度。每个样本取30 μg蛋白加入5×SDS上样缓冲液煮沸变性后进行SDS-PAGE凝胶电泳,湿式电印迹法300 mA恒流、80 min转至PVDF膜,3%BSA室温封闭0.5 h,用1×TBST洗涤3次,10 min/次,加入一抗(兔抗TRPC6多克隆抗体,稀释度1∶200;兔抗GAPDH,稀释度1∶500),4℃冰箱摇床孵育过夜。1×TBST洗膜3次,10 min/次,加入羊抗兔多克隆二抗(稀释度1∶5 000),室温孵育1 h,1× TBST洗膜3次,20 min/次,ECL化学发光法进行显影。利用SensiAnsys图像分析系统进行灰度值分析,以目的蛋白条带与GAPDH蛋白条带的灰度值的比值表示其相对含量。

2 结果
2.1 足细胞形态学观察 正常足细胞呈不规则形或多边形,自胞体伸出少量伪足,核清晰,呈椭圆形(图1A),12 ng/ml TGF-β1干预48 h时部分足细胞萎缩,足突融合、回缩或消失(图1B)。当予黄芪总苷干预后随着药物浓度的增加足细胞形态逐渐趋向正常(图1C、D、E)。
2.2 黄芪总苷对TGF-β1干预足细胞增殖的影响 从表2可以看出,与正常对照组相比,TGF-β1干预组对足细胞增殖抑制率明显升高(P<0.05),给予黄芪总苷干预后,足细胞增殖抑制率有所下降,黄芪总苷中剂量组的抑制率明显比黄芪总苷低、高剂量组低(P<0.05)。
表1 荧光定量PCR引物序列
Tab.1 Primers of Real-time RT-PCR

NameForwardprimer(5'-3')Reverseprimer(5'-3')GAPHD5'-GCACCGTCAAGGCTGAGAAC-3'5'-TGGTGAAGACGCCAGTGGA-3'TRPC65'-ACATCGGCTACGTTCTGTATGGTG-3'5'-CAATTTGGCCCTTGCAAACTTC-3'

图1 足细胞形态学观察Fig.1 Morphological appearance of podocytesNote: A.Control group;B.Group of 12 ng/ml TGF-β1;C.Group of TNF-β1 and 40 μg/ml ATS;D.Group of TGF-β1 and 40 μg/ml AST;E.Group of TGF-β1 and 40 μg/ml AST.

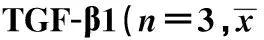

GroupsODvalueInhibitionrate(%)Controlgroup0.48±0.070.00±0.00TGF-β1treatmentgroup0.26±0.011)48.4±0.121)TGF-β1+low-doseASTgroup0.29±0.0239.8±0.12TGF-β1+medial-doseASTgroup0.43±0.032)10.9±0.082)TGF-β1+high-doseASTgroup0.36±0.033)33.2±0.073)
Note:1)P<0.01,comparing with the control group;2)P<0.01,3)P<0.05,comparing with TGF-β1 treatment group.
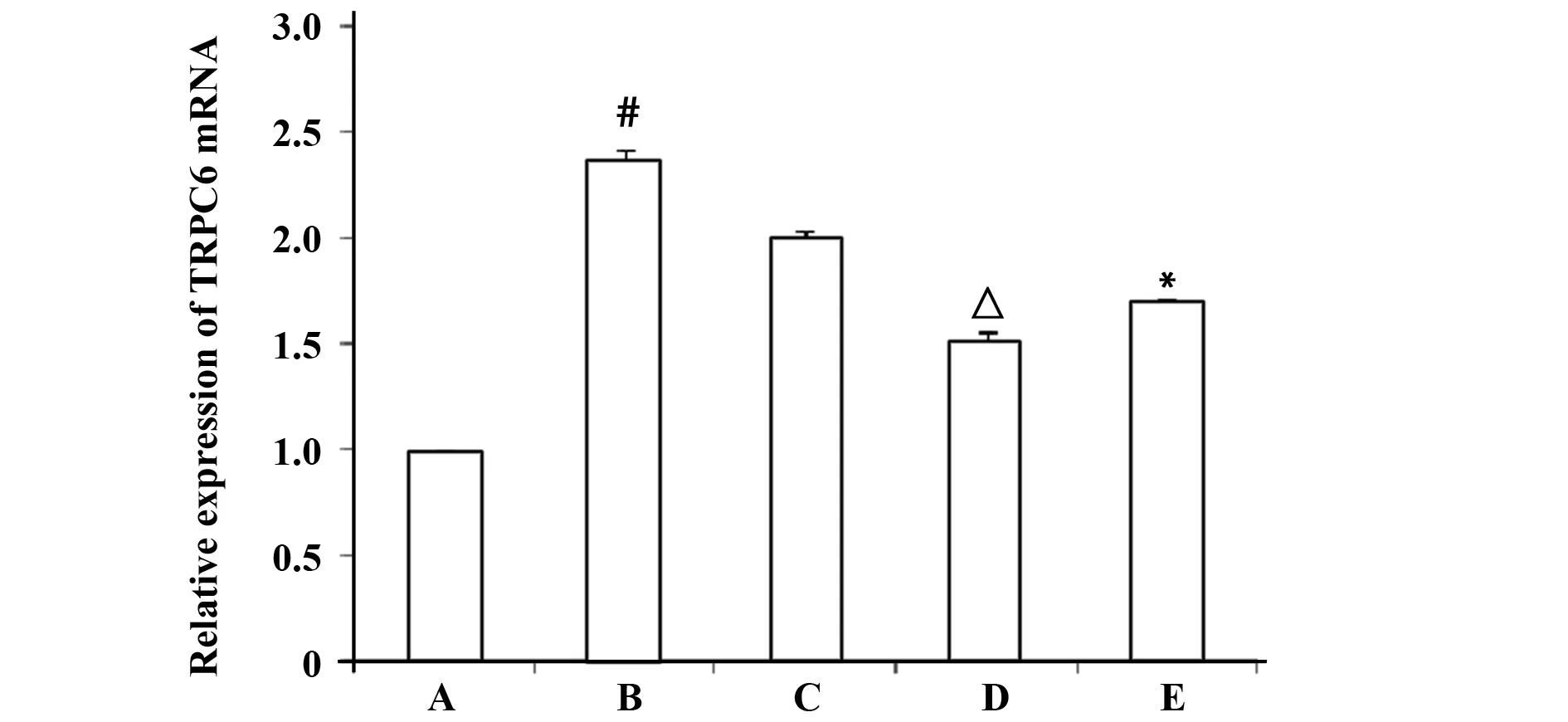
图2 黄芪总苷对TGF-β1干预下足细胞TRPC6 mRNA表达的影响Fig.2 Effects of AST on TRPC6 mRNA expression induced by TGF-β1Note: #.P<0.01,comparing with the control group;△.P<0.01,*.P<0.05,comparing with TGF-β1 treatment group.A.control group;B.TGF-β1 treatment group;C.TGF-β1+ low-dose AST group;D.TGF-β1+ medial-dose AST group;E.TGF-β1+ high-dose AST group.
2.3 黄芪总苷对TGF-β1干预足细胞TRPC6 mRNA表达的影响 与正常对照组相比,TGF-β1干预48 h后足细胞TRPC6 mRNA表达水平明显升高(P<0.05),黄芪总苷干预则可以逆转上述变化,使足细胞TRPC6 mRNA表达量减少,并且存在量效关系,黄芪总苷中剂量组TRPC6 mRNA减少量比低、高剂量组明显,见图2。

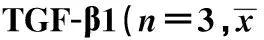

GroupsTRPC6/GAPDHgrayvalueControlgroup0.16±0.02TGF-β1treatmentgroup0.49±0.031)TGF-β1+low-doseASTgroup0.34±0.052)TGF-β1+medial-doseASTgroup0.18±0.023)TGF-β1+high-doseASTgroup0.29±0.032)
Note:1)P<0.01,comparing with the control group;2)P<0.05,3)<0.01,comparing with TGF-β1 treatment group.
2.4 黄芪总苷对TGF-β1干预足细胞TRPC6蛋白表达的影响 与正常对照组相比,TGF-β1干预48 h后足细胞TRPC6蛋白表达水平明显升高(P<0.01),黄芪总苷干预则可以逆转上述变化,使足细胞TRPC6蛋白表达量减少,且呈量效关系,即黄芪总苷中剂量组TRPC6蛋白减少量比低、高剂量组明显,见表3。
3 讨论
足细胞是肾脏高度终末分化期肾小球上皮细胞,增殖能力极差,一旦损伤或丢失就很难再生。在多种遗传性和获得性肾小球疾病中均发现足细胞有不同程度的损伤,足细胞损伤是导致蛋白尿和肾小球硬化症的关键因素,也是肾脏疾病治疗的难点[5]。免疫抑制剂如糖皮质激素、钙调磷酸酶抑制剂(环抱素、他克莫司)、血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体拮抗剂、维生素D具有保护和修复足细胞损伤的作用[6-9],但缺乏特异性,且有一定的副作用,因此,积极寻找对足细胞具有特异性保护作用的药物成为研究热点。
黄芪总苷是中药黄芪的主要有效成分之一。既往研究发现,黄芪具有抗应激、抗氧化和免疫调节等多种药理作用。关于黄芪组方或黄芪提取物在泌尿系统[3]、心脑系统系疾病的治疗研究报道较多[10,11],且疗效显著,但尚未见系统研究黄芪总苷对足细胞是否具有保护作用及其机制的研究报道。
Yao等[12]通过研究黄芪总苷对实验性糖尿病动物肾脏保护作用及其机制研究发现,黄芪总苷对于糖尿病大鼠、高糖培养人肾小球系膜细胞具有保护作用,其机制之一可能与提高系膜细胞 TRPC6 表达水平有关。Yao等[12]发现黄芪甲苷通过下调足细胞TRPC6表达减少高糖诱导的足细胞凋亡,这些说明TRPC6可能是黄芪总苷下游的调控因子之一。因此,我们猜测黄芪总苷对TGF-β1诱导足细胞损伤的保护作用可能与调节TRPC6表达有关。
瞬时受体电位阳离子通道6(Transient receptor potential channel 6,TRPC6)是新近发现的足细胞裂孔隔膜蛋白之一,属于非选择阳离子通道蛋白家族的一员,与足细胞其他裂孔隔膜蛋白存在共定位分布并且与它们存在相互作用,其对维持足细胞裂孔隔膜的完整性和骨架结构、RhoA信号通路的传导起重要作用[13]。TRPC6基因突变可导致局灶性节段性肾小球硬化(FSGS)的发生,在肾病综合征、糖尿病肾病的发病过程中,足细胞上TRPC6均有不同程度的上调,并且与蛋白尿的发生密切相关[14-16]。在STZ诱导糖尿病大鼠模型、血管紧张素Ⅱ诱导的足细胞损伤模型中,也发现足细胞TRPC6表达上调,且与足细胞损伤程度呈正相关[17,18]。TRPC6可能通过调节细胞内Ca2+浓度、影响细胞骨架蛋白完整性、组成机械敏感性Ca2+通道等机制导致足细胞损伤[19-21]。
本实验研究采用TGF-β1诱导足细胞损伤模型,给予黄芪总苷进行干预,观察黄芪总苷干预前后及不同剂量黄芪总苷对TGF-β1诱导下足细胞损伤情况的影响,并试图证实黄芪总苷可能通过调节TRPC6表达的分子机制发挥其保护作用。结果显示黄芪总苷可显著缓解TGF-β1对足细胞增殖的抑制作用。TGF-β1干预下可使足细胞TRPC6蛋白和mRNA表达上调,黄芪总苷作用后可显著逆转上述变化,并且存在一定的量效关系。这些结果证实黄芪总苷通过调节足细胞TRPC6分子表达发挥保护作用。
综上所述,在TGF-β1诱导的足细胞损伤中,黄芪总苷通过调节足细胞TRPC6的表达实现其对足细胞的保护作用。但在足细胞损伤中TRPC6与足细胞其他特异性分子相互作用,机制复杂,治疗足细胞损伤的特异性药物的开发及临床应用研究值得继续深入开展。
[1] Gui D,Guo Y,Wang F,etal.Astragaloside Ⅳ,a novel antioxidant,prevents glucose-induced podocyte apoptosis in vitro and in vivo[J].PLoS One,2012,7(6):e39824.
[2] Lu WS,Li S,Guo WW,etal.Effects of Astragaloside IV on diabetic nephropathy in rats[J].Genet Mol Res,2015,14(2):5427-5434.
[3] Wang N,Wei RB,Li QP,etal.Protective effects of astragaloside in rats with adriamycin nephropathy and underlying mechanism[J].Chin J Nat Med,2016,14(4):270-277.
[4] 黄海庭,林 栩,尤燕舞,等.TRPC6在TGF-β1诱导的体外培养肾小球足细胞损伤中的表达及其高表达对nephrin、desmin表达的影响[J].免疫学杂志,2016,32(7):570-576.
[5] Mallipattu SK,He JC .The podocyte as a direct target for treatment of glomerular disease?[J].Am J Physiol Renal Physiol,2016,311(1):F46-451.
[6] Lewko B.Treatment of nephrotic syndrome:immuno-or rather podocyte therapy? [J].Postepy Hig Med Dosw (Online),2016,70:459-470.
[7] Qi XM,Wang J,Xu XX,etal.FK506 reduces albuminuria through improving podocyte nephrin and podocin expression in diabetic rats[J]. Inflamm Res,2016,65(2):103-114.
[8] Shimizu A,Zhong J,Miyazaki Y,etal.ARB protects podocytes from HIV-1 nephropathy independently of podocyte AT1[J].Nephrol Dial Transplant,2012,27(8):3169-3175.
[9] Zhang XL,Guo YF,Song ZX,etal.Vitamin D prevents podocyte injury via regulation of macrophage M1/M2 phenotype in diabetic nephropathy rats[J].Endocrinology,2014 ,155(12):4939-4950.
[10] Xu C,Tang F,Lu M,etal.Astragaloside IV improves the isoproterenol-induced vascular dysfunction via attenuating eNOS uncoupling-mediated oxidative stress and inhibiting ROS-NF-κB pathways[J].Int Immunopharmacol,2016,33:119-127.
[11] Haiyan H,Rensong Y,Guoqin J,etal.Effect of astragaloside IV on neural stem cell transplantation in alzheimer′s disease rat models[J].Evid Based Complement Alternat Med,2016,2016:3106980.
[12] Yao XM,Liu YJ,Wang YM,etal.Astragaloside IV prevents high glucose-induced podocyte apoptosis via downregulation of TRPC6[J].Mol Med Rep,2016,13(6):5149-5156.
[13] Wieder N,Greka A.Calcium,TRPC channels,and regulation of the actin cytoskeleton in podocytes:towards a future of targeted therapies[J].Pediatr Nephrol,2016 ,31(7):1047-1054.
[14] Winn MP,Conlon PJ,Lynn KL,etal.A mutation in the TRPC6 cation channel causes familial focal segmental glomerulosclerosis[J].Sci J,2005,308(5729):1801-1804.
[15] Hofstra JM,Coenen MJ,Schijvenaars MM,etal.TRPC6 single nucleotide polymorphisms and progression of idiopathic membranous nephropathy[J].PLoS One,2014,9(7):e102065.
[16] Ilatovskaya DV,Staruschenko A.Podocyte injury in diabetic nephropathy:implications of angiotensin II-dependent activation of TRPC channels[J].Am J Phvsiol Renal Physiol,2015,309(5):F393-397.
[17] Zhang X,Song Z,Guo Y,etal.The novel role of TRPC6 in vitamin D ameliorating podocyte injury in STZ-induced diabetic rats[J].Mol Cell Biochem,2015 ,399(1-2):155-165.
[18] Ilatovskaya DV,Palygin O,Chubinskiy-Nadezhdin V,etal.Angiotensin Ⅱ has acute effects on TRPC6 channels in podocytes of freshly isolated glomeruli[J].Kidney Int,2014,86(3):506-514.
[19] Jiang L,Ding J,Tsai H,etal.Over-expressing transient receptor potential cation channel 6 in podocytes induces cytoskeleton rearrangement through increases of intracellular Ca2+and Rho A activation[J].Exp Biol Med (Maywood),2011,236(2):184-193.
[20] Estacion M,Li S,Sinkins WG,etal.Activation of human TRPC6 channels by receptor stimulation [J].J Biol Chem,2004,279(21):22047-22056.
[21] Gottlieb P,Folgering J,Maroto R,etal.Revisiting TRPC1 and TRPC6 mechanosensitivity[J].Pflugers Arch,2008,455 (6):1097-1103.
[收稿2016-08-16 修回2016-10-17]
(编辑 许四平)
Effects of astragaloside on TRPC6 expression on mouse podocyte induced by TGF-β1
HUANGHai-Ting,WUHao-Hao,QINYou-Ling,LINXu,YOUYan-Wu,GUOPeng-Wei,TANGChun-Rong.
DepartmentofNephrology,theAffiliatedHospitalofYoujiangMedicalUniversityforNationalities,Baise533000,China
Objective:To explore the possible mechanism of astragaloside involved in the mouse podocytes injury induced by TGF-β1 in vitro.Methods: Mouse podocytes were cultured in vitro and then all cell were divided into 5 groups:normal control group,TGF-β1 treatment group ,TGF-β1 treatment +astragaloside low dose group,TGF-β1 treatment +astragaloside middle dose group and TGF-β1 treatment +astragaloside high dose group.The proliferation rate of each group was investigated by MTT assay,the expression of TRPC6 protein and mRNA were measured by Western blot and RT-PCR respectively after 48 hours.Results: TGF-β1 can significantly inhibit the proliferation of podocytes(P<0.05),fusions of foot processes or even effaced of podocytes were observed.TGF-β1 could also increase the expression of TRPC6.Astragaloside could reduce the inhibition of TGF-β1 to the proliferain of podocytes significantly,make the cell shape tend to be normal,and reduce the expression of TRPC6 mRNA and protein with dose-effect relation.Conclusion: TRPC6 play an important role in the TGF-β1 induecd podocytes injury.Astragaloside can alleviate podocytes injury by reduce the expression of TRPC6.
Podocytes;TGF-β1;TRPC6;AST
10.3969/j.issn.1000-484X.2017.03.011
黄海庭(1987年-),女,在读硕士,住院医师,主要从事肾病综合征足细胞损伤机制研究,E-mail:hhtwsw123@126.com。
及指导教师:林 栩(1963年-),男,硕士,教授,主要从事肾小球疾病基础与临床研究,E-mail:linyyfyy@163.com。
R329.2+5 R692 R285.5
A
1000-484X(2017)03-0370-04
①本文为广西自然科学基金(2014GXNSFAA118269)。
