新兵(学员)预防接种20 μg重组乙型肝炎疫苗(酿酒酵母)的免疫效果分析①
2017-04-10孙走南李瑾慧苏文莉黄留玉常国辉
唐 玥 杨 益 孙走南 李瑾慧 苏文莉 张 洁 黄留玉 常国辉
(军事医学科学院疾病预防控制所免疫规划中心,北京100071)
新兵(学员)预防接种20 μg重组乙型肝炎疫苗(酿酒酵母)的免疫效果分析①
唐 玥 杨 益 孙走南 李瑾慧 苏文莉 张 洁 黄留玉②常国辉②
(军事医学科学院疾病预防控制所免疫规划中心,北京100071)
目的:分析评价军队某部乙型肝炎表面抗体(Antibody to hepatitis B virus surface antigen,抗-HBs)阴性/弱阳性的新入伍人员,接种剂型为20 μg/ml的酿酒酵母重组乙型肝炎疫苗(Recombinant hepatitis B vaccine derived Saccharomyces Cerevisiae Yest,HepB-SCY)后的免疫效果。方法:利用酶联免疫吸附法(Enzyme-linked immunosorbent assay,ELISA)和放射免疫法(Radioimmunoassay,RIA),筛选抗-HBs为阴性的3 251名和弱阳性的1 090名新兵(学员)为实验观察对象,按照0、1和6的接种程序,接种20 μg/ml剂型的HepB-SCY,分别在每针接种后第28天采血,用化学粒子发光免疫分析法(Chemiluminescence immunoassay,CLIA)检测血清抗体的几何平均浓度(Geometric mean titer,GMT)。结果:观察对象全程免疫后,在弱阳性新兵(学员)中,第1、2和3针接种后阳转率分别为90.24%、97.82%和99.52%,第2针免疫后的阳转率明显优于1针免疫后阳转率(χ2=25.65,P<0.01),而第2与3针免疫后的阳转率之间无统计学差异(χ2=4.66,P>0.01);第1和第2针免疫后乙肝表面抗体的GMT值分别为1 575.92 mU/ml(374.94~4 606.45)和2 144.592 mU/ml(757.078~6 089.4),二者的GMT水平存在统计学差异(Z=-2.372,P<0.01)。在阴性人群中,第2和第3针接种后阳转率分别为86.13%和98.72%,其中,高应答反应阳转率分别为56.43%和87.53%,第3针免疫后的阳转率明显优于第2针(χ2=118.5,P<0.05),第3针免疫后的高应答反应率也明显高于第2针(χ2=231.07,P<0.05);第1、2和3针免疫后的GMT值分别为101.352 mU/ml(2.11~409.23)、155.812 mU/ml(26.76~840.78)和747.312 mU/ml(228.60~1893.6),第2和3针的GMT水平之间差异存在统计学意义(Z=-23.042,P<0.01),第1和2针的GMT水平之间差异也存在统计学意义(Z=-3.099,P<0.01)。结论:接种20 μg/ml剂型的HepB-SCY可激发机体产生较高水平的抗-HBs,并可有效提高群体的阳转率和高应答反应率。
新兵(新学员);重组乙肝疫苗;免疫效果
目前,接种乙肝疫苗是国际上公认的有效降低乙肝病毒(Hepatitis B virus,HBV)感染率的手段之一[1]。全世界有近180个国家将乙型肝炎疫苗加入计划免疫之列,其中有些国家已经向全年龄人群实施乙型肝炎疫苗计划免疫。我国自1992年实施新生儿乙型肝炎疫苗计划免疫以来,乙肝报告发病率呈下降趋势,但是,2014年中国疾病预防控制中心的统计数字显示,我国仍有9 000万乙肝病毒携带者,其中有2 800万是慢性乙肝患者,几乎占全国人口的7%,每年因慢性乙肝导致的癌症相关死亡病例高达33万多例,乙肝仍然是一个重要的公共卫生问题[2]。我军自2006年开始实施新兵(学员)接种10 μg/ml乙型肝炎疫苗的免疫措施[3],近10年来,军队乙型肝炎发病率在全军报告传染病的发病序位,一直高居前3位,成为严重危害军队人群健康的主要传染病之一。本研究通过对抗-HBs阴性和弱阳性的新兵全程接种20 μg/ml剂量的重组乙型肝炎疫苗,监测每针接种后的抗体阳转率和抗体浓度,为进一步制定适合军队的乙型肝炎疫苗免疫策略提供重要数据参考。
1 材料与方法
1.1 观察对象 2013年某军校入学新学员和某集团军入伍新兵,年龄分布在16~20岁间的健康人群,无乙型肝炎感染史,在观察期间和观察前2周内无接种其他生物预防制品及免疫球蛋白,对疫苗成分无过敏史,无肌肉注射禁忌,腋下体温≤37.0℃,本人知情同意。
1.2 方法
1.2.1 筛选与分组 首先,利用酶联免疫吸附法(Enzyme-linked immunosorbent assay,ELSIA)检测并剔除抗-HBs阳性的对象,并采用放射免疫法(Radioimmunoassay,RIA)测定乙肝表面抗原(Hepatitis B surface antigen,HBsAg)和抗-HBs,剔除HBsAg阳性或抗-HBs 几何平均浓度(Geometric mean titer,GMT)≥100 mU/ml的对象,再用化学粒子发光免疫分析法(Chemiluminescence immunoassay,CLIA)筛选出HBsAg阴性、抗-HBs<100 mU/ml者为实验观察对象。其中,10 mU/ml≤抗-HBs<100 mU/ml为抗-HBsAg弱阳性监测对象组;抗-HBs<10 mU/ml为抗-HBs阴性监测对象组。全部观察对象均按照3针免疫程序,每人单次接种1 ml重组乙型肝炎疫苗(20 μg/ml),监测对象分别在接种第1针、第2针和第3针后28 d,采血3 ml进行抗-HBs检测。
1.2.2 疫苗与接种 重组乙型肝炎疫苗(酿酒酵母),由北京天坛生物股份有限公司研制生产,经中国食品药品检定研究院检定,符合《重组乙型肝炎疫苗(酵母)制造及检定规程》要求。规格为每支20 μg/ml,在2~8℃冷藏条件下保存和运输。免疫程序为0、1、6个月进行接种,于上臂三角肌肌内注射。
1.2.3 抗体检测和判定标准 采用酶联免疫吸附法(ELISA)、放射免疫法(RIA)初筛和化学微粒子发光免疫分析法(CLIA法,试剂为美国雅培公司生产,检测方法依据试剂说明书)复检相结合的方式,分别检测新兵和新学员入伍前血清抗-HBs和接种不同针次疫苗后的血清抗-HBs。抗体水平的判断标准如下:观察对象抗-HBs<10 mU/ml,为阴性;10 mU/ml≤抗-HBs<100 mU/ml,为弱阳性;抗-HBs≥100 mU/ml,为阳性。观察对象免疫前抗-HBs<10 mU/ml,免后抗-HBs≥10 mU/ml,或免前10 mU/ml≤抗-HBs<100 mU/ml,免后抗-HBs≥100 mU/ml视为阳转;观察对象免前抗-HBs<10 mU/ml,免后抗-HBs≥100 mU/ml,视为抗体高应答反应。
1.2.4 质量与安全 严格按照《预防接种工作规范》的有关要求进行操作,所有研究者均具有相应岗位资质证书。在接种疫苗后30 min和6、24、48、72 h,研究人员对观察对象进行系统的不良反应观察。从接种疫苗后第4天~第4周,采取主动报告与定期随访相结合的方式观察疫苗接种后的不良反应。
1.3 统计学分析 采用Excel和SAS软件,对调查数据和实验结果进行统计学处理,抗体阳转率比较采用χ2检验;抗体几何平均滴度(Geometric mean titer,GMT)的组间比较采用独立样本的非参数秩和检验(Mann-Whitney秩和检验)。
2 结果
2.1 乙肝疫苗免疫前抗-HBs水平检测 通过 ELISA法初筛和CLIA法复检,对10 102份血清标本进行抗-HBs水平的筛查,有4 341名观察对象符合试验要求。其中,阴性观察对象共有3 251名,抗-HBs<10 mU/ml;弱阳性观察对象共有1 090名,10 mU/ml≤抗-HBs<100 mU/ml,结果见表1。
2.2 乙肝疫苗免疫后监测对象的阳转率 弱阳性人群第1针接种后共采血779份,抗-HBs阳转人数为703人,阳转率为90.24%;第2针接种后共采血459份,阳转人数为449人,阳转率为97.82%;第3针接种后共采血417份,阳转人数为415人,阳转率为99.52%。统计分析显示:抗-HBs弱阳性观察对象中,乙型肝炎疫苗2针免疫后的阳转率明显优于1针免疫后阳转率(χ2=25.65,P<0.01),而3针免疫后与2针免疫后阳转率无统计学差异(χ2=4.66,P>0.01),结果见表2。
阴性人群第2针接种后共采血2 293份,抗-HBs阳转人数为1 975人,阳转率为86.13%,其中,高应答人数为1 294人,高应答反应阳转率为56.43%。第3针接种后共采血1 868份,阳转人数为1 844人,阳转率为98.72%,其中高应答人数为1 635人,高应答反应阳转率为87.53%。统计分析显示:抗-HBs阴性观察对象中,乙型肝炎疫苗3针免疫后的阳转率明显优于2针免疫后的阳转率(χ2=118.5,P<0.05),结果见表3;乙型肝炎疫苗3针免疫后的高应答反应阳转率也明显优于2针免疫后的高应答反应阳转率(χ2=231.07,P<0.05),结果见表4。
表1 乙型肝炎表面抗体水平统计
Tab.1 Statistics of hepatitis B surface antibody level

ObservedparticipantsPositive(%)Weaklypositive(%)Negative(%)101025761(57.03)1090(10.79)3251(32.18)
2.3 乙肝疫苗免疫后监测对象的抗-HBs滴度 弱阳性观察对象中,乙肝疫苗第1针免疫后抗-HBs的GMT值为1 575.92 mU/ml(374.94~4 606.45),第2针免疫后抗-HBs的GMT值为2 144.59 mU/ml(757.078~6 089.4),采用Mann-Whitney秩和检验(Median,QR,即中位数,四分位间距)方法统计分析显示:乙型肝炎疫苗第2针免疫后GMT水平与第1针免疫后GMT水平差异存在统计学意义(Z=-2.372,P<0.01),同时,与第1针免疫后GMT的数据分布相比,第2针免疫后的GMT数据较集中于高数值区间,表明其具有更好的群体免疫效果,结果见表5。
阴性观察对象中,乙肝疫苗1针、2针和3针免疫后的GMT值分别为101.35 mU/ml(2.11~409.23)、155.81 mU/ml(26.76~840.78)和747.31 (228.60~1 893.6),分析显示:乙肝疫苗第3针免疫后GMT水平与第2针免疫后GMT水平存在统计学差异(Z=-23.042,P<0.01),第2针免疫后GMT水平与第1针免疫后GMT水平存在统计学差异(Z=-3.099,P<0.01),其中,第3针接种后GMT数据分布更集中于高值区间,表明其群体免疫效果明显优于第2针接种和第1针接种,结果见表6。
表2 弱阳性人群乙肝疫苗免疫后阳转率分析
Tab.2 Seroconversion rates after 20 μg dosages of HepB-SCY in weakly positive recruits
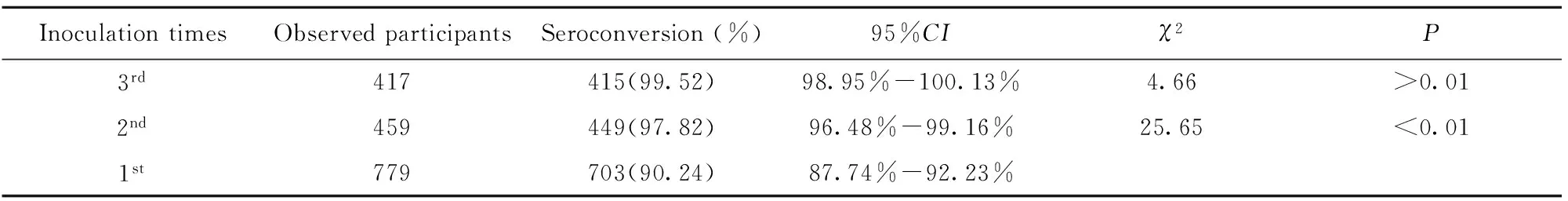
InoculationtimesObservedparticipantsSeroconversion(%)95%CIχ2P3rd417415(99.52)98.95%-100.13%4.66>0.012nd459449(97.82)96.48%-99.16%25.65<0.011st779703(90.24)87.74%-92.23%
表3 阴性人群乙肝疫苗免疫后阳转率分析
Tab.3 Seroconversion rates after 20 μg dosages of HepB-SCY in negative recruits

InoculationtimesObservedparticipantsSeroconversion(%)95%CIχ2P3rd18681844(98.72%)98.20%-99.23%118.50<0.00012nd22931975(86.13%)84.72%-87.55%
表4 阴性人群乙肝疫苗免疫后高应答反应阳转率分析
Tab.4 High-responding seroconversion rates after 20 μg dosages of HepB-SCY in negative recruits
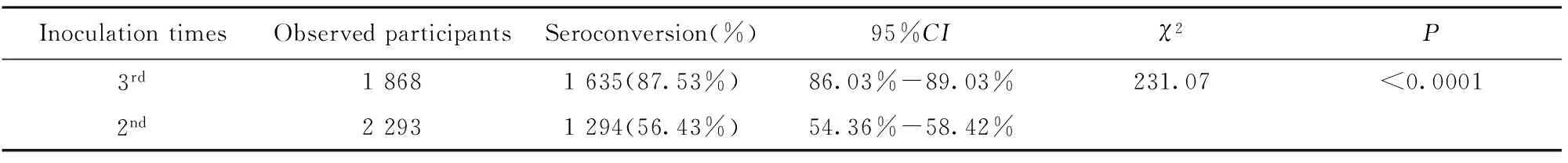
InoculationtimesObservedparticipantsSeroconversion(%)95%CIχ2P3rd18681635(87.53%)86.03%-89.03%231.07<0.00012nd22931294(56.43%)54.36%-58.42%
表5 弱阳性人群乙肝疫苗免疫后的GMT分析(mU/ml)
Tab.5 GMT after 20 μg dosages of HepB-SCY in weak positive recruits(mU/ml)

InoculationtimesGMT(MedianQR)ZP2nd2144.59(757.078-6089.4)-2.372<0.011st1575.92(374.94-4606.45)
表6 阴性人群乙肝疫苗免疫后的GMT分析(mU/ml)
Tab.6 GMT after 20 μg dosages of HepB-SCY in negative recruits(mU/ml)
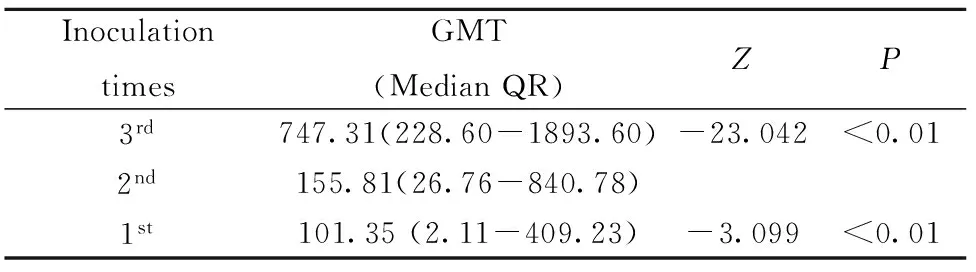
InoculationtimesGMT(MedianQR)ZP3rd747.31(228.60-1893.60)-23.042<0.012nd155.81(26.76-840.78)1st101.35(2.11-409.23)-3.099<0.01
2.4 安全性观察结果 本次试验期间,疫苗的总体不良反应发生率为1.97%(95%CI,1.17%~2.89%),未收到三级(含)及以上不良反应报告。
3 讨论
我国从1992年开始实施以新生儿为主的乙肝免疫策略,目前已有20多年的预防接种史。2014年最新的调查成果显示,全国1~4岁儿童的乙肝表面抗原的流行率降至0.32%,与2006年(0.96%)相比下降了66%,5~14岁的青少年乙肝表面抗原流行率降至0.94%,与2006年相比下降了61%,提前实现了世界卫生组织关于西太平洋地区乙肝控制的目标。但是,我国目前仍有9 000万乙肝表面抗原携带者,流行率为6.95%,与2006年(7.18%)相比下降了3.2%,因此,整个人群的发病率并未出现明显下降,乙型肝炎防治仍然不容乐观,尤其是成人免疫策略急需加强[4-8]。
研究中涉及的10 102名观察对象多为乙肝疫苗新生儿计划免疫实行后出生的新兵(学员)。实验室血清抗-HBs结果检测显示,部分地区新兵(学员)入伍前抗-HBs阳性率达到71.89%,平均为57.07%,弱阳性率为10.79%,说明通过基础免疫获得乙肝抗体的成功率已达到50%以上,有一半以上的入伍新兵已无需再进行乙肝疫苗接种。然而仍有32.18%的新兵(学员)尚未接种乙型肝炎疫苗或接种不成功。研究表明,健康人群中乙肝疫苗的无应答率为2%~15%[9],这是导致无法建立高效群体免疫屏障的重要不利因素,这种现象可能与疫苗接种的剂量偏低有关,因此,适当增加乙型肝炎疫苗的剂量可有效提高应答率[10,11]。我军实施10 μg/ml 剂型的乙型肝炎疫苗接种已近10年,全程免疫后群体抗-HBs的阳转率在70%~85%之间,而本次接种的疫苗为20 μg/ml剂型的重组乙型肝炎疫苗,在抗-HBs弱阳性的新兵(学员)中,第1针接种后的阳转率90.24%,第2针接种后的阳转率为97.82%,第2针接种后的阳转率统计学上明显优于第1接种后的阳转率(χ2=25.65,P<0.01);在抗-HBs阴性的新兵(学员)中,第2针接种后的阳转率为86.13%,第3针接种后的阳转率为98.72%,三针接种后的阳转率统计学上明显优于二针接种后的阳转率(χ2=118.50,P<0.000 1),其中,在抗-HBs阴性的新兵(学员)中,第2针接种后高应答反应率为56.43%,第3针接种后的高应答反应率为87.53%。免疫效果明显优于10 μg/ml剂型的乙型肝炎疫苗。同时,实验结果也显示:抗-HBs阴性的新兵(学员),第2针免疫后GMT为155.81 mU/ml,第3针免疫后GMT为747.31 mU/ml,与第2针免疫后GMT的数据分布相比,第3针免疫后的GMT数据较集中于高数值区间;抗-HBs弱阳性的新兵(学员),第1针免疫后GMT为1 575.92 mU/ml,第2针免疫后GMT为2 144.59 mU/ml,表明20 μg剂型的乙型肝炎疫苗可以在接种人群中产生更高的抗体水平和更优群体免疫效果。因此,在条件允许情况下,接种20 μg/ml剂型的乙型肝炎疫苗,部队官兵可以获得更加高效和持久的免疫保护。
[1] Wasley A,Kruszon-Moran D,Kuhnert W,etal.The prevalence of hepatitis B virus infection in the united states in the era of vaccination[J].Infectious Diseases,2010,202(2):192-201.
[2] Liu J,Zhang S,Wang Q,etal.Prevalence of HBsAg/HBeAg among 1 963 801 couples preparing for pregnancy in rural China:An observational study[J].J Viral Hepat,2017,doi:10.1111/jvh.12693.
[3] 孙海龙,马纯钢,李申龙,等.军队传染病流行趋势分析与防治对策[J].解放军预防医学杂志,2010,28(6):391-392.
[4] Halperin SA,Ward B,Cooper C,etal.Comparison of safety and immunogenicity of two doses of investigational hepatitis B virus surface antigen co-administered with an immunostimulatory phosphorothioate oligodeoxyribonucleotide and three doses of a licensed hepatitis B vaccine in healthy adults 18-55 years of age[J].Vaccine,2012,30(15):2556-2563.
[5] Yang S,Tian G,Cui Y,etal.Factors influencing immunologic response to hepatitis B vaccine in adults[J].Scientific Reports,2016,6:7251.
[6] 郭永豪,刘 倩,徐 瑾,等.国产重组CHO 20 μg乙型肝炎疫苗成人免疫效果比较[J].中华疾病控制杂志,2013,17(11):967-970.
[7] David MC,Ha SH,Paynter S,etal.A systematic review and meta-analysis of management options for adults who respond poorly to hepatits B vaccinafion[J].Vaccie,2015,33(48):872-874.
[8] Liang X,Bi S,Yang W,etal.Reprint of:Epidemiological serosurvey of hepatitis B in China-declining HBV prevalence due to hepatitis B vaccination[J].Vaccine,2013,31S:J21-J28.
[9] Ritz N,Mui M,Ballich A,etal.Non-specific effect of Bacille Calmette-Guérin vaccine on the immune response to routine immunisations[J].Vaccine,2013,31(30):3098-3103.
[10] Gallagher KE,Kadokura E,Eckert LO,etal.Factors influencing completion of multi-dose vaccine schedules in adolescents:a systematic review[J].BMC Public Health,2016,16(1):172-178.
[11] Yao J,Ren J,Shen L,etal.The effects of booster vaccination of hepatitis B vaccine on anti-HBV surface antigen negative children 11-15 years after primary vaccination [J].Hum Vaccine,2011,7 (10):1055-1059.
[收稿2016-04-18 修回2016-07-14]
(编辑 倪 鹏)
Immune effect of 20 μg dosages of recombinant hepatitis B vaccine derived Saccharomyces Cerevisiae Yest in recruits
TANGYue,YANGYi,SUNZou-Nan,LIJin-Hui,SUWen-Li,ZHANGJie,HUANGLiu-Yu,CHANGGuo-Hui.
InstituteofDiseaseControlandPrevention,AcademyofMilitaryMedicalSciences,Beijing100071,China
Objective:To evaluate the immune effect of 20 microgram dosages of recombinant hepatitis B vaccine derived Saccharomyces Cerevisiae Yest (HepB-SCY) in recruits.Methods: A total of 4 341 subjects whose antibody to hepatitis B virus surface antigen(anti-HBs) was weak positive or negative tested by Enzyme-linked Immunosorbent Assay(ELISA) and Radioimmunoassay(RIA) were received a HepB-SCY vaccine intramuscularly at 0,1,and 6 months.Anti-HBs concentrations were evaluated by a Chemiluminescence Immunoassay (CLIA) at 28 days after every injection.Results: After the first,second and third dose,the 20 microgram dosages of HepB-SCY increased the seroconversion (anti-hepatitis B surface antigen) rate to 90.24%,97.82% and 99.52% in weak positive recruits,respectively.There were significant differences between the second dose and the first one (χ2=25.65,P<0.01),but there were no significant differences between the third dose and the second one(χ2=4.66,P>0.01).Geometric mean titer(GMT) of anti-hepatitis B surface antigen(anti-HBs) were more than 1 575.92 mU/ml(374.94-4 606.45) after the first dose and up to 2 144.59 mU/ml(757.078-6 089.4) after the second dose in weak positive recruits,showing significant difference between them(Z=-2.372,P<0.01).After the second dose and the third one,seroconversion rates in the negative recruits were 86.13% and 98.72%,respectively.And the high-responding seroconversion rates were 56.43% and 87.53%,respectively.Both of them indicating significant difference between the second dose and the third one(χ2=118.5,P<0.05),(χ2=231.07,P<0.05).The GMT in the negative recruits were 101.35 mU/ml(2.11-409.23),155.81 mU/ml(26.76-840.78) and 747.31 mU/ml(228.60-1893.6) after the first dose ,the second and the third one,respectively.There were significant different between the second dose and the third one(Z=-23.042,P<0.01),the same results between the first dose and the second one(Z=-3.099,P<0.01).Conclusion: No serious allergic reactions were observed.The 20 microgram dosages of HepB-SCY could induce higher level of anti-HBs,and increase the high-responding seroconversion rates.
Recruit(Newly enrolled cadets);Recombinant hepatitis B vaccine;Immune effect
10.3969/j.issn.1000-484X.2017.03.008
唐 玥(1988年-),女,硕士,护师,主要从事感染与免疫方面的研究。
R186.3 R183.7
A
1000-484X(2017)03-0356-05
①本文为国家新药创制重大专项课题(2012ZX09J12106-01B)。
②通讯作者,E-mail:huangliuyuly@163.com;E-mail:changgh7@qq.com。
