奥沙利铂调控PI3K/Akt信号通路抑制脑胶质瘤细胞株U87生长的作用研究①
2017-04-10段友强刘义锋
段友强 刘义锋 李 巍
(郑州大学附属郑州中心医院神经外科,郑州450007)
·基础免疫学·
奥沙利铂调控PI3K/Akt信号通路抑制脑胶质瘤细胞株U87生长的作用研究①
段友强 刘义锋②李 巍③
(郑州大学附属郑州中心医院神经外科,郑州450007)
目的:研究奥沙利铂(Oxaliplatin,Ox)调控PI3K/Akt信号通路抑制脑胶质瘤细胞株U87生长的作用。方法:培养U87脑胶质瘤细胞,分别利用0、20、40、80 μg/ml的奥沙利铂处理U87细胞24、36、48、72 h,利用MTT检测各处理组细胞增殖情况;利用流式细胞仪检测40 μg/ml的奥沙利铂处理48 h对U87细胞周期及细胞凋亡的影响;Western blot检测40 μg/ml 的奥沙利铂处理48 h对U87细胞凋亡相关蛋白及PI3K/Akt信号通路蛋白表达的影响。结果:奥沙利铂处理抑制U87细胞增殖,与0 μmol/L处理相比,差异显著(P<0.01),40 μg/ml的奥沙利铂处理48 h差异最显著。40 μg/ml的奥沙利铂处理48 h后,U87细胞周期被阻滞在S期,U87细胞凋亡显著增加(P<0.01),抑凋亡因子Bcl-2蛋白表达明显下降,促凋亡因子Bax、Cleaved-caspase3蛋白表达明显升高(P<0.01),PI3K及p-Akt的表达量明显降低(P<0.01),Akt表达量无明显差异(P>0.05)。结论:奥沙利铂可能通过抑制PI3K/Akt信号通路抑制U87细胞增殖,阻滞细胞周期,促进细胞凋亡。
奥沙利铂;脑胶质瘤细胞;增殖;细胞周期;凋亡
脑胶质瘤常发于神经外胚层,是神经系统常发恶性肿瘤,发病率约占颅内肿瘤的45%[1]。目前对胶质瘤的治疗仍以手术为主,但是由于胶质瘤具有浸润性生长的特点,手术并不能完全切除癌变组织,手术后极易复发,致死率极高[2,3],因此迫切的需要寻找新的胶质瘤治疗手段。奥沙利铂是第三代铂类抗癌药物,具有极好的抗肿瘤效果,药物对正常细胞的毒副作用较小,与顺铂、卡铂之间无交叉耐药的出现[4]。奥沙利铂在结肠癌[5]、乳腺癌[6]、非小细胞肺癌[7]、胃癌[8]等癌症的治疗中取得了较好的效果,但是关于奥沙利铂作用于胶质瘤的相关研究还较少。本研究通过体外培养脑胶质瘤细胞株U87,并使用奥沙利铂处理,探究了奥沙利铂对U87细胞增殖、细胞周期以及凋亡的影响,并探讨了可能存在的作用机制,以期为脑胶质瘤的治疗提供基础研究。
1 材料与方法
1.1 材料 胶质瘤U87细胞系由中国科学院细胞库提供;奥沙利铂购自山东铂源药业有限公司;胎牛血清、胰蛋白酶、DMEM培养基购自美国Hyclone;蛋白酶裂解液购自上海碧云天生物技术有限公司;Bax单抗、Bcl-2单抗、Cleaved-caspase3单抗、PI3K单抗、Akt单抗、p-Akt单抗购自美国CTS;蛋白提取试剂盒、细胞凋亡检测试剂盒购自南京凯基生物科技有限公司;MTT试剂盒购自美国Roche;酶标仪、流式细胞仪购自美国Thermo。
1.2 方法
1.2.1 U87细胞培养 取冻存的脑胶质瘤U87细胞株,置于37℃恒温水浴锅解冻,解冻完全后离心收集细胞,将细胞接种于含10%胎牛血清的DMEM培养基中,细胞放于37℃、5%CO2细胞培养箱中培养至约铺满培养皿底80%时取出,弃去细胞培养液,使用PBS缓冲液冲洗细胞2次,向细胞中加入0.25%的胰蛋白酶消化2~3 min,待大部分细胞脱离皿底时,向细胞中加入DMEM细胞培养液终止消化,细胞转移至离心管中离心收集沉淀,向沉淀中加入DMEM培养液重悬细胞,重悬后细胞接种至新的含10%胎牛血清的DMEM细胞培养液中继续培养。
1.2.2 四氮唑蓝测定细胞增殖 取对数生长期的U87细胞,弃去细胞培养液,经PBS缓冲液清洗后,加入0.25%胰酶消化,消化完全后将细胞转移至离心管中,1 000 r/min离心10 min取沉淀,向细胞沉淀中加入培养液后重悬,显微镜下计数并调整细胞浓度为5×106个/ml,按每孔200 μl的量将细胞悬液接种于96孔板中,将细胞置于细胞培养箱中培养24 h。培养结束后弃去旧培养液,向细胞中分别加入含奥沙利铂浓度为0、20、40、80 μg/ml的新鲜细胞培养液,并设置空白对照组,空白对照组不加细胞,置于细胞培养箱中继续培养24、36、48、72 h,培养结束前4 h向每孔细胞中加入20 μl MTT,置于培养箱中继续培养直至结束,向每孔细胞中加入200 μl DMSO,混匀后置于酶标仪中检测490nm处吸光度,并分析细胞的增殖情况。细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.2.3 流式细胞仪PI单染色法检测细胞周期将U87细胞接种于6孔板中,细胞生长至对数期后,加入40 μg/ml的奥沙利铂处理48 h,另取不做处理的细胞作为对照,胰酶消化各组细胞后,离心收集细胞沉淀,PBS重悬细胞并调整细胞浓度为5×105个/ml,取1 ml细胞,向细胞中加入3 ml预冷的75%的乙醇4℃过夜,PBS清洗2次,加入500 μl含50 mg/L RNaseA及10 μg/ml PI的PBS缓冲液,室温避光孵育30 min后,利用流式细胞仪检测细胞周期的分布情况。
1.2.4 流式细胞仪测定细胞凋亡 将U87细胞接种于6孔板中,待细胞生长至对数期,向细胞中加入终浓度为40 μg/ml的奥沙利铂处理细胞48 h,另取不做处理的细胞作为对照,胰酶消化各组细胞,离心收集细胞沉淀,PBS重悬细胞并调整细胞浓度为5×105个/ml,取1 ml细胞,向细胞中加入10 μl Annexin V-FITC和5 μl PI,室温避光孵育15 min后,使用流式细胞仪检测细胞凋亡情况。
1.2.5 Western blot检测细胞中相关蛋白表达 取对数生长期的经40 μg/ml奥沙利铂处理48 h的U87细胞,胰酶消化后收集细胞沉淀,向沉淀中加入细胞裂解液后置于冰上孵育30 min,4℃,12 000 r/min离心20 min,上清转移至新的离心管中,采用BCA试剂盒检测所提取蛋白浓度。向提取的蛋白中加入Loading Buffer,100℃煮沸5 min制备蛋白样品。配置蛋白胶,蛋白胶凝固后上样,保证每孔蛋白上样量一致,80 V电泳30 min后,换用120 V电压继续电泳,直至溴酚蓝跑出玻璃板。冰浴100 V转膜,5%脱脂奶粉室温孵育PVDF膜6 h,分别以Bax、Bcl-2、Cleaved-caspase3、PI3K、Akt、p-Akt单克隆抗体作为一抗,4℃过夜孵育,TBST清洗3次,加入二抗置于37℃孵育1 h,TBST清洗3次,加入ECL发光剂进行显影,利用自动凝胶成像系统采集图像。

2 结果
2.1 奥沙利铂抑制U87细胞增殖 分别使用0、20、40、80 μg/ml的奥沙利铂处理对数期的U87细胞24、36、48、72 h后,利用MTT检测各组细胞存活情况,并进行统计,结果如图1所示,奥沙利铂处理对U87细胞的存活具有抑制作用,且具有浓度时间依赖性,U87细胞存活率随着奥沙利铂处理时间的增长、处理浓度的增高而降低,与0 μg/ml处理相比,差异显著(P<0.01)。40 μg/ml的奥沙利铂处理48 h对U87细胞存活的抑制作用最明显。
2.2 奥沙利铂对U87细胞周期的影响 利用流式细胞仪检测40 μg/ml奥沙利铂处理48 h对U87细胞周期的影响,结果如表1所示,奥沙利铂处理后,G0/G1期和G2/M期细胞减少,S期细胞增多,与 0 μg/ml奥沙利铂处理相比,差异显著(P<0.05),40 μg/ml奥沙利铂处理诱导U87细胞被阻滞在S期。
2.3 奥沙利铂促进U87细胞凋亡 40 μg/ml奥沙利铂处理U87细胞48 h后,利用流式细胞仪检测U87细胞凋亡情况,并进行统计,结果如图2所示,40 μg/ml奥沙利铂处理后,U87细胞凋亡明显增多,与0 μg/ml处理相比差异具有显著统计学意义(P<0.01)。
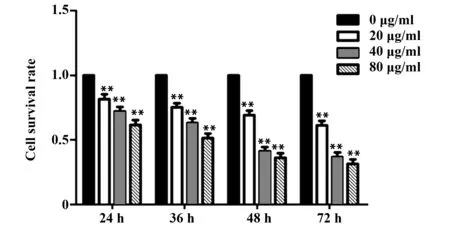
图1 奥沙利铂处理对U87细胞存活的影响Fig.1 Effect of oxaliplatin treatment on U87 cell survivalNote: **.P<0.01.

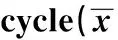

GroupsG0/G1phase(%)Sphase(%)G2/Mphase(%)0μg/mloxaliplatin39.40±1.2447.25±2.2013.35±2.5340μg/mloxaliplatin32.75±2.391)56.53±3.501)10.72±1.051)
Note:Compared with 0 μg/ml oxaliplatin group,1)P<0.05.

图2 奥沙利铂处理对U87细胞凋亡的影响Fig.2 Effect of oxaliplatin treatment on U87 cell apoptosisNote: A.Flow cytometry detected U87 cell apoptosis;B.U87 cell apoptosis rate,**.P<0.01.
2.4 奥沙利铂对Bcl-2、Bax、Cleaved-caspase3蛋白表达的影响 收集经40 μg/ml奥沙利铂处理48 h后处于对数期的U87细胞,提取细胞总蛋白,Western blot检测凋亡相关蛋白Bcl-2、Bax、Cleaved-caspase3的表达,结果如图3所示,40 μg/ml奥沙利铂处理后,抑凋亡因子Bcl-2蛋白表达量降低,促凋亡因子Bax、Cleaved-caspase3蛋白表达量升高,与0 μg/ml处理相比具有显著性差异(P<0.01)。
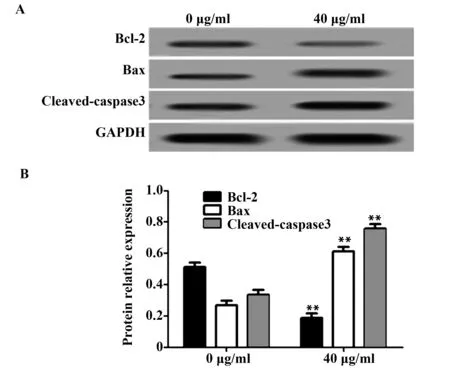
图3 奥沙利铂处理对U87细胞凋亡蛋白表达影响Fig.3 Effect of oxaliplatin on expression of apoptotic protein in U87 cellsNote: A.Western blot detected the protein expression rate;B.The protein relative expression rate,**.P<0.01.
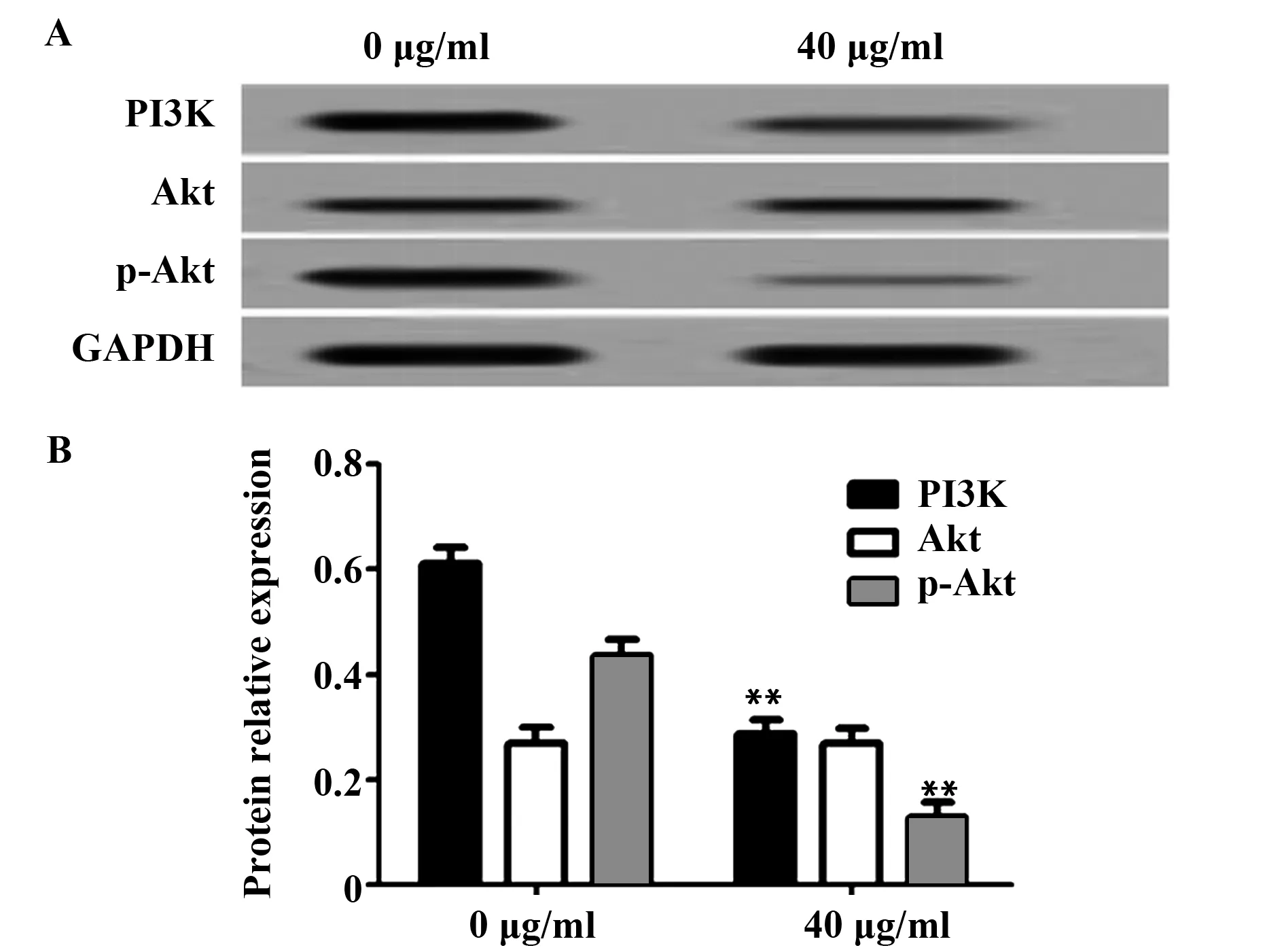
图4 奥沙利铂处理对PI3K/Akt通路关键蛋白表达影响Fig.4 Effect of oxaliplatin treatment on protein expression in PI3K/Akt pathwayNote: A.Western blot detected the protein expression rate;B.The protein relative expression rate,**.P<0.01.
2.5 奥沙利铂对PI3K、Akt、p-Akt蛋白表达的影响 Western blot检测40 μg/ml奥沙利铂处理48 h对PI3K/Akt通路蛋白表达的影响,结果如图4所示,与0 μg/ml处理相比,40 μg/ml奥沙利铂处理后,PI3K及p-Akt的表达量明显降低(P<0.01),Akt表达量无明显差异(P>0.05)。
3 讨论
脑胶质瘤是常发于人颅内的一种原发性肿瘤,是颅内发病率以及致死率最高的恶性肿瘤。传统的脑胶质瘤治疗手段是手术切除为主,辅以放疗、化疗、生物治疗等多种治疗方法。由于脑胶质瘤的恶性程度极高,在颅内呈浸润性生长,与正常脑组织的界限很不明显,手术难以完全切除癌变组织,因此术后脑胶质瘤的复发率极高。
奥沙利铂是继顺铂和卡铂之后开发的第三代铂类金属抗肿瘤药物,属于DNA烷化剂。奥沙利铂不仅具有很高的抗癌活性,而且对顺铂耐药的细胞也具有抑制作用。研究发现,奥沙利铂进入到细胞内,通过与DNA结合形成铂类-DNA复合物,引起DNA的损伤,进而引起细胞凋亡;引起肿瘤细胞凋亡是铂类抗肿瘤药物发挥作用的主要方式[9]。为了探究奥沙利铂对脑胶质瘤细胞的作用,分别使用0、20、40、80 μg/ml的奥沙利铂处理U87细胞24、36、48、72 h,检测U87细胞的存活情况,结果发现,奥沙利铂能显著抑制胶质瘤细胞的存活,且呈浓度时间依赖性,其中40 μg/ml的奥沙利铂处理48 h对U87细胞存活的抑制作用最明显。胶质瘤的发生发展过程十分复杂,除了与细胞活性的升高有关之外,与细胞周期调控的失常也具有密切的关系。细胞周期进程中,细胞周期蛋白通过与相关的激酶结合调控细胞周期进程[10]。肿瘤药物通常将肿瘤细胞周期阻滞在G1/S或G2/M期,从而修复受损的DNA[11]。本研究利用40 μg/ml奥沙利铂处理U87细胞48 h,流式细胞仪检测细胞周期的分布情况,结果显示,奥利沙铂处理后,处于G0/G1期和G2/M期细胞减少,S期细胞增多,说明奥利沙铂处理诱导U87细胞被阻滞在S期。Bcl-2和Bax属于Bcl-2家族,Bcl-2家族在细胞凋亡过程中具有重要的作用[12]。Bcl-2抑制细胞凋亡,Bax对细胞凋亡具有促进作用,二者在细胞中常以同源或异源二聚体形式存在[13]。当细胞内Bcl-2含量增多时,Bcl-2/Bax二聚体含量增多,凋亡受到抑制,当Bax含量增加时,Bax自身形成同源二聚体,促进细胞凋亡[14]。caspase家族在细胞凋亡过程中具有重要作用。caspase3位于caspase级联反应的下游,是caspase凋亡依赖途径的交汇点,caspase3的活化对细胞凋亡具有促进作用[15]。流式细胞仪检测结果显示,40 μg/ml奥沙利铂处理U87细胞48 h显著促进U87细胞凋亡,Western blot检测结果发现,奥沙利铂处理后,Bcl-2蛋白表达明显降低,Bax、Cleaved-caspase3蛋白表达明显升高,证实奥沙利铂通过调控凋亡相关蛋白的表达促进U87细胞凋亡。
PI3K/Akt信号通路在细胞中广泛存在,对细胞的增殖、分化、凋亡及细胞周期进程具有调控作用[16]。有研究证实,PI3K/Akt通路的活化促进癌细胞增殖,抑制凋亡的发生[17]。研究PI3K/Akt对细胞凋亡的调控,发现活化的Akt通过磷酸化Bcl家族成员BAD,阻断BAD/Bcl-2复合体的形成,直接调控细胞凋亡[18],也可以通过磷酸化NF-κB,促进NF-κB转录,进而促进Bcl-xl的表达,促进细胞存活[19],Akt还可通过磷酸化mTOR参与细胞周期进程[20]。本研究利用Western blot检测奥利沙铂处理对PI3K、Akt、p-Akt蛋白表达的影响,结果显示,奥沙利铂处理后,PI3K及p-Akt的表达量明显降低,Akt表达量无明显差异,证实奥利沙铂对PI3K/Akt信号通路具有抑制作用。奥沙利铂处理可以显著抑制U87细胞增殖,阻滞细胞周期进程,促进细胞凋亡,作用机制可能与PI3K/Akt信号通路的抑制有关,为临床上奥沙利铂治疗脑胶质瘤提供了新的研究思路。
[1] Zhang B,Wang H,Liao Z,etal.EGFP-EGF1-conjugated nanoparticles for targeting both neovascular and glioma cells in therapy of brain glioma[J].Biomaterials,2014,35(13):4133-4145.
[2] 郭成永,梁朝辉,魏可欣,等.解旋酶 RECQ1 和细胞核相关抗原 Ki-67 在脑胶质瘤组织中的表达及相关性[J].中国老年学杂志,2015,35(12):82-83.
[3] Li Q,Lu XH,Wang CD,etal.Antiproliferative and apoptosis-inducing activity of schisandrin B against human glioma cells[J].Cancer Cell Int,2015,15(1):1-11.
[4] Rödel C,Graeven U,Fietkau R,etal.Oxaliplatin added to fluorouracil-based preoperative chemoradiotherapy and postoperative chemotherapy of locally advanced rectal cancer(the German CAO/ARO/AIO-04 study):final results of the multicentre,open-label,randomised,phase 3 trial[J].Lancet Oncol,2015,16(8):979-989.
[5] 顾术东,茅国新.晚期结肠癌组织中ERCC1和BRCA1的表达与奥沙利铂方案化疗疗效及预后的关系[J].肿瘤防治研究,2014,41(10):1111-1115.
[6] Zhang J,Wang L,Wang Z,etal.A phase II trial of biweekly vinorelbine and oxaliplatin in second-or third-line metastatic triple-negative breast cancer[J].Cancer Biol Ther,2015,16(2):225-232.
[7] 郝仲芳,刘金婷,李克爱.吉西他滨联合奥沙利铂治疗老年非小细胞肺癌58例[J].肿瘤学杂志,2013,19(1):72-73.
[8] Yang L,Song Y,Zhou AP,etal.A phase II trial of oxaliplatin plus S-1 as a first-line chemotherapy for patients with advanced gastric cancer[J].Chin Med J(Engl),2013,126(18):3470-3474.
[9] Chen MH,May BH,Zhou IW,etal.Integrative medicine for relief of nausea and vomiting in the treatment of colorectal cancer using oxaliplatin-based chemotherapy:a systematic review and meta-analysis[J].Phytother Res,2016,30(5):741-753.
[10] Strack S,Wilson TJ,Cribbs JT.Cyclin-dependent kinases regulate splice-specific targeting of dyna min-related protein 1 to microtubules[J].J Cell Biol,2013,201(7):1037-1051.
[11] Mariaule G,Belmont P.Cyclin-dependent kinase inhibitors as marketed anticancer drugs:where are we now? A short survey[J].Molecules,2014,19(9):14366-14382.
[12] 李 勇,王力利,王银洁,等.胃癌原发灶和淋巴结转移灶中锌指蛋白 139 与肿瘤细胞凋亡和生存素及 B 细胞淋巴瘤/白血病-2 的关系及意义研究[J].中国全科医学,2015,18(3):250-254.
[13] Shirali S,Aghaei M,Shabani M,etal.Adenosine induces cell cycle arrest and apoptosis via cyclinD1/Cdk4 and Bcl-2/Bax pathways in human ovarian cancer cell line OVCAR-3[J].Tumour Biol,2013,34(2):1085-1095.
[14] Liu G,Wang T,Wang T,etal.Effects of apoptosis-related proteins caspase-3,Bax and Bcl-2 on cerebral ischemia rats[J].Biomed Rep,2013,1(1):861-867.
[15] Li X,Huang T,Jiang G,etal.Synergistic apoptotic effect of crocin and cisplatin on osteosarcoma cells via caspase induced apoptosis[J].Toxicol Lett,2013,221(3):197-204.
[16] Dai H,Song D,Xu J,etal.Ammonia-induced Na,K-ATPase/ouabain-mediated EGF receptor transactivation,MAPK/ERK and PI3K/AKT signaling and ROS formation cause astrocyte swelling[J].Neurochem Int,2013,63(6):610-625.
[17] Heavey S,O′Byrne KJ,Gately K.Strategies for co-targeting the PI3K/AKT/mTOR pathway in NSCLC[J].Cancer Treat Rev,2014,40(3):445-456.
[18] Kumar D,Shankar S,Srivastava RK.Rottlerin induces autophagy and apoptosis in prostate cancer stem cells via PI3K/Akt/mTOR signaling pathway[J].Cancer Lett,2013,343(2):179-189.
[19] Dilly A,Ekambaram P,Guo Y,etal.Platelet-type 12-lipoxygenase induces MMP9 expression and cellular invasion via activation of PI3K/Akt/NF-κB[J].Int J Cancer,2013,133(8):1784-1791.
[20] Riquelme I,Tapia O,Leal P,etal.miR-101-2,miR-125b-2 and miR-451a act as potential tumor suppressors in gastric cancer through regulation of the PI3K/AKT/mTOR pathway[J].Cell Oncol(Dordr),2015,106(8):23-33.
[收稿2016-09-26 修回2016-11-08]
(编辑 倪 鹏)
Research of oxaliplatin inhibit growth in glioma U87 cells by regulating PI3K/Akt signal pathway
DUANYou-Qiang,LIUYi-Feng,LIWei.
DepartmentofNeurosurgery,ZhengzhouCentralHospitalAffiliatedtoZhengzhouUniversity,Zhengzhou450007,China
Objective:To investigate the effect of oxaliplatin inhibit the growth in glioma U87 cells by regulating PI3K/Akt signal pathway.Methods: The glioma U87 cells were cultivated in vitro,using 0,20,40,80 μg/ml oxaliplatin treated U87 cells 24,36,48,72 h respectively,MTT was used to detect cell proliferation.Using 40 μg/ml oxaliplatin treated U87 cells 48 h,flow cytometry was used to detect cell cycle and apoptosis.Cells apoptosis protein and PI3K/Akt pathway protein expression after 40 μg/ml oxaliplatin treated U87 cells 48 h was detected by Western blot.Results: MTT assay showed that compared with the 0 μg/ml treatment,oxaliplatin treatment could significantly inhibited U87 cell survival (P<0.01),40 μg/ml oxaliplatin treatment 48 h ,the survival inhibitory was the most obvious.U87 cell cycle was arrested in S phase after 40 μg/ml oxaliplatin treatment 48 h.After 40 μg/ml oxaliplatin treatment 48 h,compared with the 0 μg/ml treatment,U87 cell apoptosis rate significantly increased (P<0.01).Western blot showed that after 40 μg/ml oxaliplatin treatment,anti-apoptotic factor Bcl-2 expression had significant decreased,pro-apoptotic factors Bax,Cleaved-caspase3 protein expression had significantly increased (P<0.01).PI3K,p-Akt expression was significantly decreased (P<0.01),and Akt expression had no significant change in Akt pathway (P>0.05).Conclusion: Oxaliplatin may suppress U87 cell proliferation,arrest cell cycle,and promote apoptosis by inhibit PI3K/Akt signaling pathway.
Oxaliplatin; Glioma cells; Proliferation; Cell cycle; Apoptosis
10.3969/j.issn.1000-484X.2017.03.002
①本文为国家自然科学基金项目(No.81401097)。
段友强(1967年-),男,硕士,主治医师,主要从事神经外科方面的研究,E-mail:youqiangduan6705@163.com。
R739.4
A
1000-484X(2017)03-0328-05
②郑州大学附属南阳中心医院神经内科,南阳473000。
③沈阳军区总医院神经内科,沈阳110000。
