土壤水分亏缺对Bt棉铃壳杀虫蛋白表达的影响
2017-04-08张祥胡大鹏李远张丽雅王剑陈源陈德华
张祥,胡大鹏,李远,张丽雅,王剑,陈源,陈德华
(扬州大学江苏省作物遗传生理重点实验室,江苏扬州 225009)
土壤水分亏缺对Bt棉铃壳杀虫蛋白表达的影响
张祥,胡大鹏,李远,张丽雅,王剑,陈源,陈德华
(扬州大学江苏省作物遗传生理重点实验室,江苏扬州 225009)
【目的】研究土壤水分亏缺对Bt棉杀虫蛋白含量及Bt基因表达、氮代谢酶活性的影响,为Bt棉抗虫性安全表达提供理论参考。【方法】2014—2015年以Bt棉常规品种泗抗1号、杂交种泗抗3号为材料,采用盆栽法,2014年设置5个土壤水分处理:G1、G2、G3、G4和CK,其土壤含水量分别为最大持水量的15%、30%、45%和75%。2015年设置4个处理:G2、G3、G4和CK。观察土壤水分亏缺对盛铃期Bt棉铃壳杀虫蛋白含量影响。所有处理于盛花期前10 d控制浇水,如遇下雨,将处理盆钵移入室内。使用WET土壤三参数速测仪监测土壤水分,用称重法控制土壤水分,即当监测发现土壤水分低于设计值时,于早晨、中午、傍晚进行定量补水。2015年进一步研究水分亏缺对Bt基因表达量、氮代谢相关合成酶(硝酸还原酶和谷氨酸丙酮酸转氨酶)活性、分解酶(肽酶和蛋白酶)活性的影响。【结果】与对照(土壤含水量为最大持水量75%)相比,泗抗1号和泗抗3号铃壳中Bt蛋白含量随土壤水分亏缺程度的增加而降低,且在土壤含水量为最大持水量60%时开始显著下降,但泗抗1号下降幅度低于泗抗3号,其中2014年泗抗1号下降22.5%,泗抗3号下降41.6%。在土壤含水量为最大持水量60%时,铃壳中Bt基因表达量增加,泗抗1号、泗抗3号分别比对照提高48.6%和22.1%。氮代谢相关酶活性变化表明,水分亏缺条件下,2个类型品种的硝酸还原酶(NR)和谷氨酸丙酮酸转氨酶(GPT)活性降低,肽酶和蛋白酶活性增加。且肽酶和蛋白酶活性变化幅度高于NR和GPT。相关分析表明,NR和GPT活性与铃壳中杀虫蛋白含量呈显著或极显著正相关;肽酶和蛋白酶活性与杀虫蛋白含量呈显著负相关。【结论】水分亏缺胁迫下,供试品种铃壳中杀虫蛋白质含量下降。但在转录水平,未发现Bt基因表达量下降。但氮代谢关键合成酶(NR和GPT)活性降低,分解酶(肽酶和蛋白酶)活性增加。因此,蛋白质合成减弱、分解加强可能导致铃壳中杀虫蛋白含量下降。
Bt棉;水分亏缺;基因表达;杀虫蛋白;氮代谢
0 引言
【研究意义】转Bt基因抗虫棉(Bt棉)已在中国大面积生产上广泛应用[1-2],其自身合成的杀虫蛋白能有效地减轻棉铃虫等相关害虫的危害[3],从而减少农药用量。这样既节省了植棉用工和成本,又减轻了农药对环境的污染,具有良好的经济效益和生态效益[4]。因此,保证Bt棉植株杀虫蛋白安全高效表达至关重要。【前人研究进展】迄今为止,国内外一致认为Bt棉的杀虫蛋白表达不稳定[5-7],其中,不良环境条件是重要的影响因素[8-9]。前人已证实土壤水分亏缺(干旱)对Bt棉叶片杀虫蛋白表达量有较大影响[10-11],如2005年和2006年中国河北、山东部分地区都出现抗虫棉抗性减弱,棉铃虫危害加重现象,后经分析这可能与当地6月出现的干旱少雨有关[12]。CARTER等[13]和BENEDICT等[14]发现当6月和7月降水量较少时,造成土壤含水量降低,土壤水分压力会降低植株中总可溶性蛋白和杀虫蛋白的含量。干旱胁迫可导致棉苗组织内可变态(活性态、功能态)DNA和稳定态DNA降解失活,产生大量的DNA残余片段,从而使功能蛋白和结构蛋白合成过程受抑。以上研究结果与Bt棉生产上出现的抗虫性失效具有一定吻合。【本研究切入点】前人研究取样的材料是以叶片为主,而棉铃是棉花的主要产量器官,也是棉铃虫危害主要取食的对象,用叶片抗虫性结果不能完全反映棉铃等生殖器官对棉铃虫的抗性。棉铃虫危害棉铃时,首先取食铃壳,因此,棉铃铃壳中杀虫蛋白含量反映了棉铃的抗虫性。但土壤水分亏缺对Bt棉棉铃尤其是铃壳中杀虫蛋白含量的影响和机理鲜见报道。【拟解决的关键问题】在长江流域地区,经常会发生伏旱不良天气[15],引起不同程度的土壤水分亏缺。本研究通过对土壤水分亏缺造成Bt棉杀虫蛋白含量及Bt基因表达、氮代谢酶活性的影响,进一步明确土壤水分亏缺逆境对Bt棉抗虫的机理,可为逆境下合理防治棉铃虫提供科学依据。
1 材料与方法
1.1 试验材料与试验设计
试验于2014—2015年在扬州大学江苏省遗传栽培生理重点实验室进行。以转Bt基因(Cry1Ac)抗虫棉品种泗抗1号(常规种)、泗抗3号(杂交种)为材料,分别以代号SK1和SK3表示。
试验为盆栽棉花,所用盆钵直径35 cm,高30 cm,每盆装土20 kg,将取自大田的土壤自然风干、过筛去杂后装盆,用水沉实。供试土壤为砂壤土,含有机质18.8 g·kg-1、水解氮134.7 mg·kg-1、速效磷22.5 mg·kg-1和速效钾81.3 mg·kg-1。供试土壤最大田间持水量为23.5%。采用营养钵育苗移栽,两年均于4月7日播种,5月20日移栽盆中,每天保持盆中土壤含水量接近田间持水量,定期浇水,肥料与其他管理措施按照当地高产栽培要求进行。
2014年于盛铃期,设置5个土壤水分处理:G1、G2、G3、G4和CK,其土壤含水量分别为最大持水量的15%、30%、45%、60%和75%。2015年设置4个处理:G2、G3、G4和CK。每处理4盆,即4次重复。
所有处理于盛花期前10 d控制浇水,如遇下雨,将处理盆钵移入室内。使用WET土壤三参数速测仪监测土壤水分,用称重法控制土壤水分,即当监测发现土壤水分低于设计值时,于早晨、中午、傍晚进行定量补水。
2014年7月20日和2015年7月22日选取长势一致的棉花植株,标记内围1—2果节位当日花,于花后10 d进行水分处理,胁迫4 d后,取样标记的棉铃,液氮速冻后放入-72℃超低温冰箱中保存待测。
1.2 Bt蛋白含量的测定
应用酶联免疫法(ELISA)进行,试剂盒由中国农业大学提供。测定方法参见文献[16]。
1.3 实时荧光定量PCR
1.3.1 植物总RNA的提取和纯化 用TIANGEN公司的植物RNA提取试剂盒提取和纯化植物总RNA,具体步骤根据产品提供的程序进行。
1.3.2 反转录 用TIANGEN公司的Quant cDNA第一链合成试剂盒,在无RNA酶的0.2 mL PCR薄壁管中加入5 μL RNA样品、2.5 μL Oligo(dT)和9.625 μL RNase-freeddH2O,70℃变性5 min,然后迅速置于冰上冷却5 min,依次加入表1组分,体系为25 μL(可按比例做其他体系)在PCR仪上进行42℃反应60 min。

表1 反转录体系各组分及其体积Table 1 The compositions of reverse transcription system and their volume
1.3.3 实时荧光定量PCR 用TaKaRa公司SYBR Green Ⅰ(Molecular probes)作为实时荧光定量PCR的荧光指示探针,在ABI7500 Real-Time PCR System扩增仪上进行。Bt引物序列为Bt-F:5′-GTTCT GCCCAAGGTATCGAA-3′和Bt-R:5′-GCAACGATA CGTTGTTGTGG-3′。
qRT-PCR反应体系为15 μL,包括7.5 μL SYBR®Premix Ex TaqTM(2×)、0.3 μL正向引物(10 μm)、0.3 μL反向引物(10 μm)、0.3 μL ROX Reference Dye II(50×)、1.2 μL cDNA和5.4 μL ddH2O,在荧光定量PCR仪上按照两步法扩增程序,即95℃ 30 s;95℃ 5 s,60℃ 35 s,40个循环。最后进行融解曲线的检测收集,每个样品设3个重复。根据各样品特定荧光阈值下的Ct值,采用2-△△Ct计算方法分析不同样品间相对表达量的高低。
1.4 酶活性测定
硝酸还原酶(nitrogen reductase,NR)活性、谷氨酸丙酮酸转氨酶(glutamic pyruvic transaminase,GPT)活性、肽酶活性、蛋白酶活性测定方法参见文献[17]。
1.5 数据处理
采用Excel2003软件进行数据处理和作图,SPSS13.0软件进行统计分析。
2 结果
2.1 水分亏缺对铃壳中杀虫蛋白含量的影响
土壤水分亏缺对2个Bt棉品种铃壳中杀虫蛋白含量有显著影响(图1)。与对照相比,2014和2015年水分亏缺处理均显著降低了Bt棉铃壳中杀虫蛋白含量。且铃壳中杀虫蛋白含量随着水分亏缺程度的增加而逐渐降低,如2014年SK1和SK3在G4、G3、G2和G1的处理下分别比对照下降了22.5%、26.3%、36.1%和48.8%及41.6%、68.6%、74.7%和76.7%。
品种间相比,水分亏缺胁迫下SK3铃壳中杀虫蛋白含量下降幅度比SK1大。2年结果基本一致,其中,在2014年,SK3所有水分亏缺处理平均比对照下降了65.4%,明显高于泗抗1号的33.4%。且当G3条件下,两年度SK1铃壳中杀虫蛋白含量均显著高于SK3,说明SK1较SK3对干旱适应性较强。
方差分析(表2)进一步表明,不同程度水分亏缺处理间差异均达到显著水平。其中,G4处理杀虫蛋白含量显著低于CK。
综上所述,土壤含水量为最大持水量的60%可能是Bt棉铃壳中杀虫蛋白含量大幅下降的土壤水分亏缺临界值,且SK1下降幅度小于SK3。
2.2 土壤水分亏缺对铃壳中Bt表达的影响
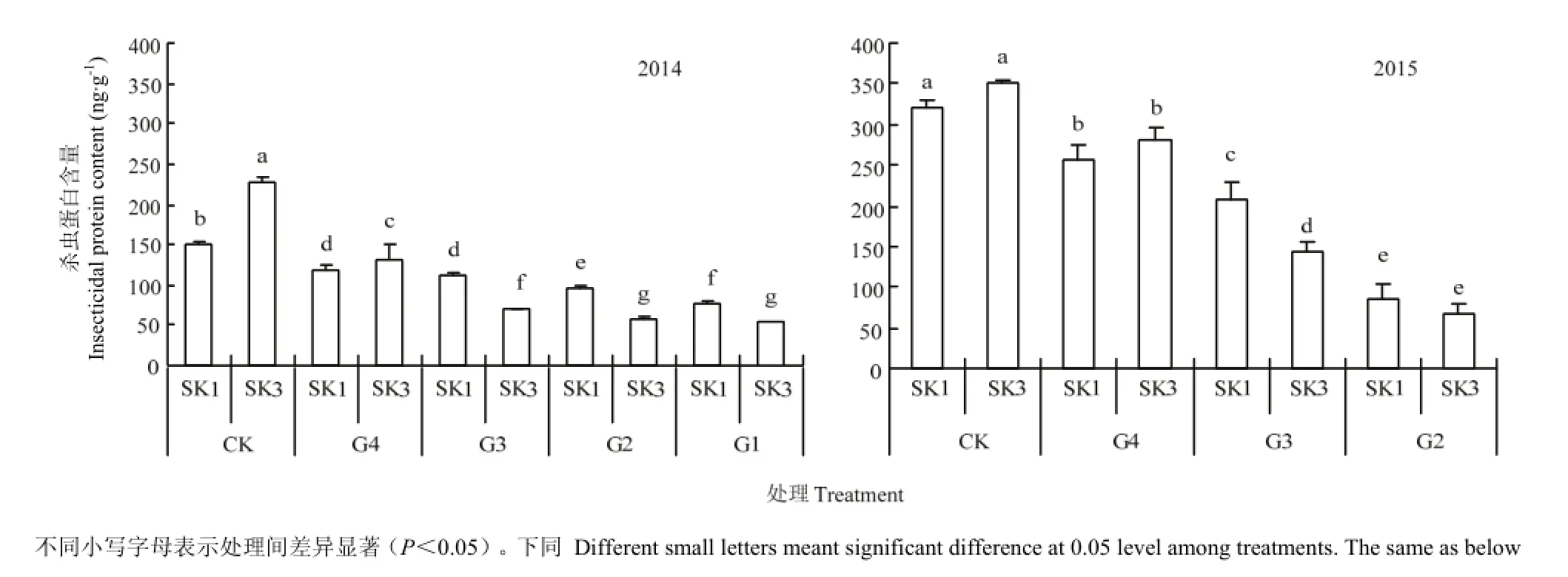
图1 水分亏缺处理对铃壳中杀虫蛋白含量的影响Fig. 1 Effects of water deficit on the content of insecticidal protein in boll shell
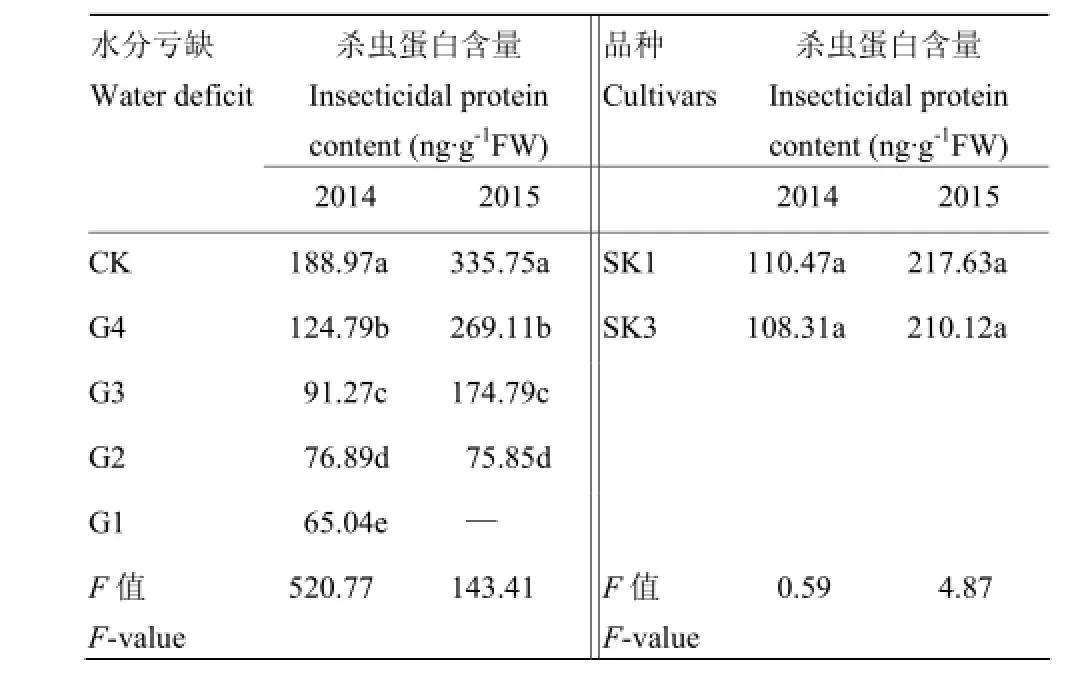
表2 水分亏缺处理铃壳中杀虫蛋白方差分析及新复极差显著性测验Table 2 ANOVA and SSR text of the content of insecticidal protein in boll shell
进一步分析相关基因表达(图2)发现,G4处理胁迫96 h后,SK1和SK3铃壳中Bt表达量均显著提高。与各自对照相比,泗抗1号、泗抗3号Bt表达量分别增加48.6%和22.1%。说明土壤水分亏缺条件下,Bt棉Bt表达量均有不同程度提高,且常规种SK1提高幅度高于杂交种SK3。
方差分析(表3)表明,与对照(CK)相比,土壤水分亏缺处理(G4)可显著提高铃壳中Bt表达量,提高幅度达40.0%。品种间相比,常规种(SK1)Bt表达量较杂交种(SK3)高。
2.3 氮代谢生理特征
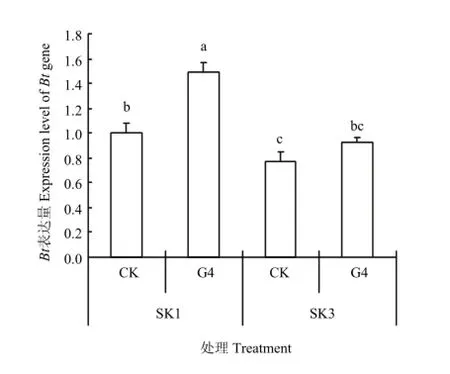
图2 水分亏缺胁迫96 h对铃壳中Bt表达量的影响Fig. 2 Effects of 96 h under the treatment of water deficit on expression level of Bt gene in boll shell
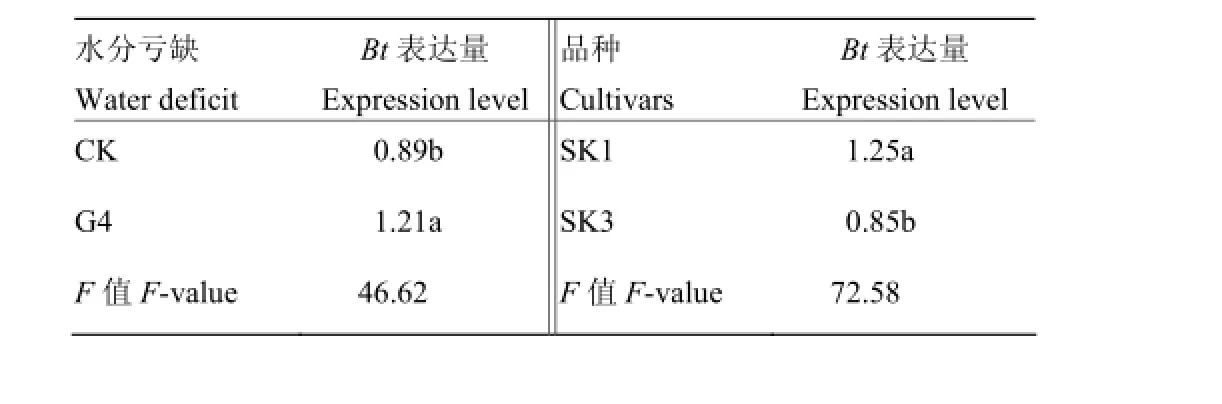
表3 水分亏缺处理铃壳中Bt表达量方差分析及新复极差显著性测验(2015)Table 3 ANOVA and SSR test of the expression level of Bt gene in boll shell
2.3.1 NR和GPT活性 在不同水分亏缺处理下,SK1和SK3铃壳中氮代谢合成相关的NR和GPT活性表现出相似趋势。与各自对照相比,SK1和SK3在土壤水分亏缺(G4)条件下,铃壳中NR和GPT活性均显著下降。其中SK1NR和GPT酶活性分别下降19.1%和17.2%;SK3则分别下降24.8%和15.6%(表4)。
方差分析表明(表4),土壤水分亏缺处理(G4)可显著降低Bt棉铃壳中氮代谢相关合成酶(NR和GPT)活性。而品种间相比,NR活性间差异不显著,但SK3的GPT活性显著高于SK1。
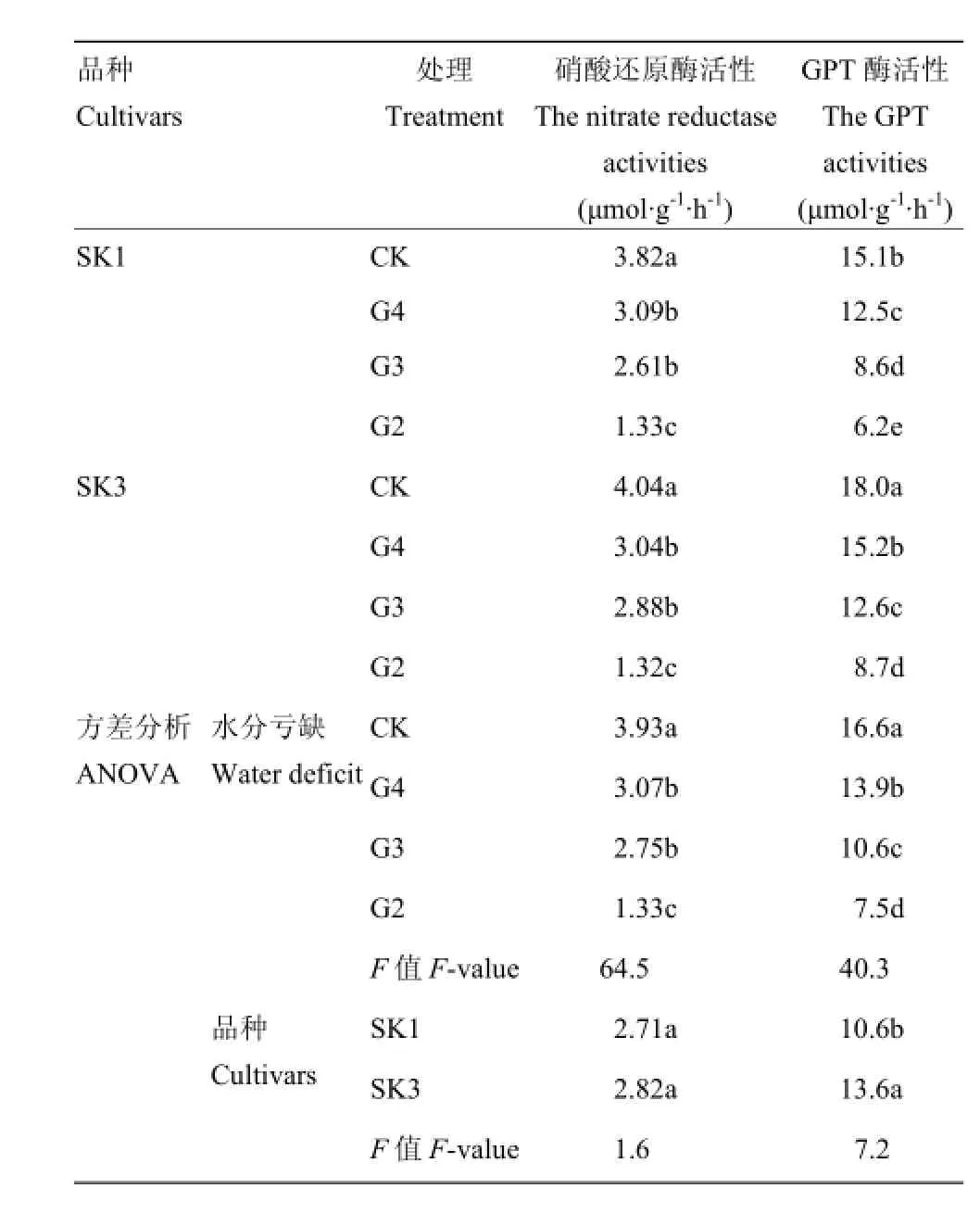
表4 水分亏缺处理铃壳中硝酸还原酶和GPT酶活性影响及方差分析(2015)Table 4 Effect of water deficit on theactivities of nitrate reductase and GPT in boll shell and ANOVA
2.3.2 肽酶和蛋白酶活性 肽酶和蛋白酶变化趋势与Bt蛋白变化趋势正好相反(表5)。在土壤水分亏缺(G4)条件下,SK1和SK3铃壳中肽酶和蛋白酶活性均显著增加。且SK3增加幅度大于常规种SK1,其中SK1肽酶和蛋白酶活性分别比CK增加39.7%和65.2%;SK3则分别增加41.9%和92.9%。
表5进一步表明,土壤水分亏缺处理(G4)可显著降低Bt棉铃壳中氮代谢相关分解酶(肽酶和蛋白酶)活性。而品种间相比,SK3铃壳中2种酶活性均显著高于SK1。说明在土壤含水量为土壤最大持水量的60%条件下,铃壳中蛋白质分解速度加快,且泗抗3号蛋白质分解速率明显高于泗抗1号。
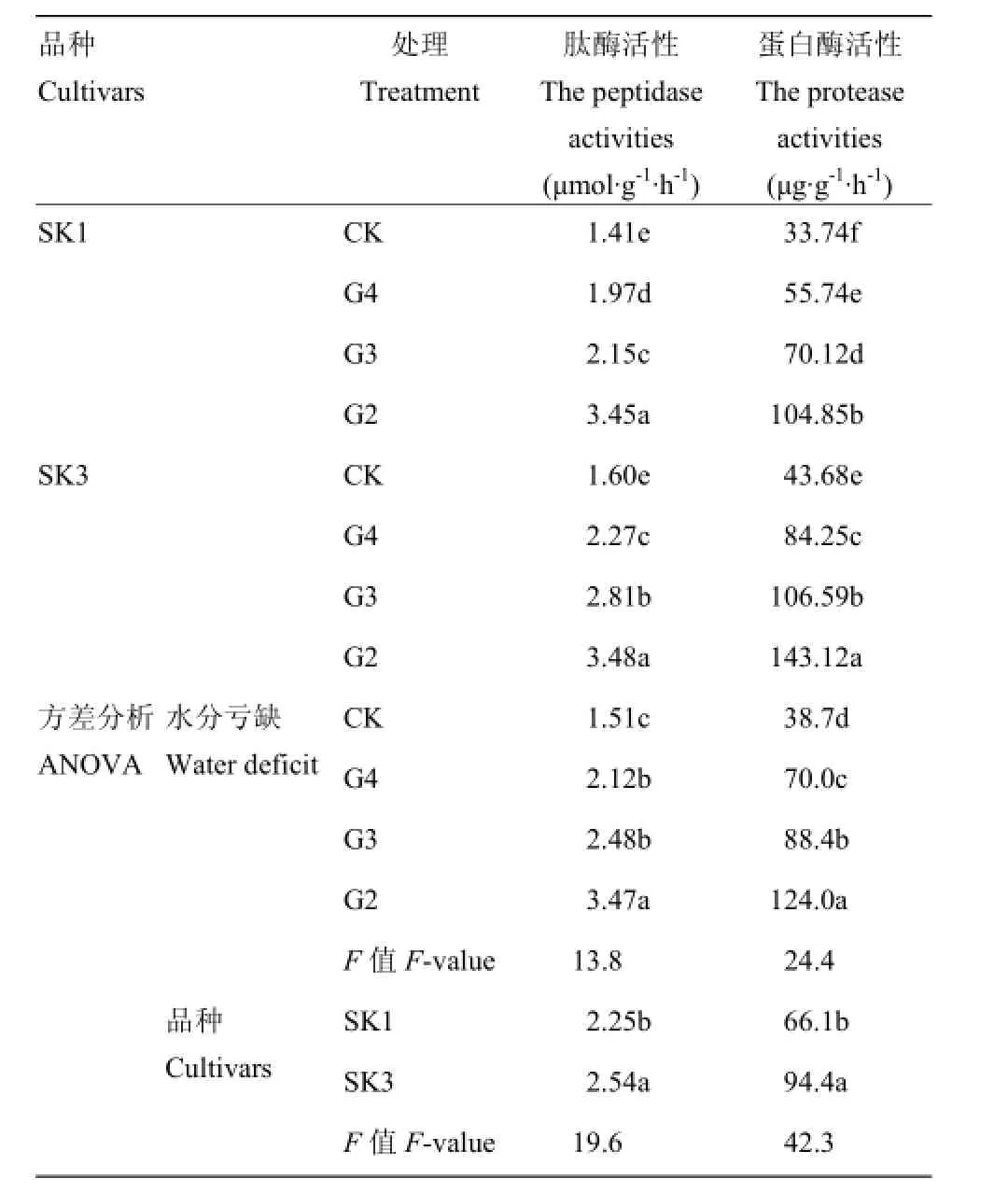
表5 水分亏缺处理铃壳中肽酶和蛋白酶活性影响及方差分析(2015)Table 5 Effect of water deficit on the activities of peptidase and protease in boll shell and ANOVA
2.4 杀虫蛋白含量与氮代谢关系
相关分析(表6)表明,2个品种铃壳中NR活性、GPT活性与杀虫蛋白含量都存在显著或极显著正相关;而肽酶活性、蛋白酶活性则与杀虫蛋白含量呈极显著负相关,进一步说明,在土壤水分亏缺条件下,蛋白质合成减少(NR、GPT活性下降),分解增加(肽酶、蛋白酶活性提高),引起杀虫蛋白浓度下降。
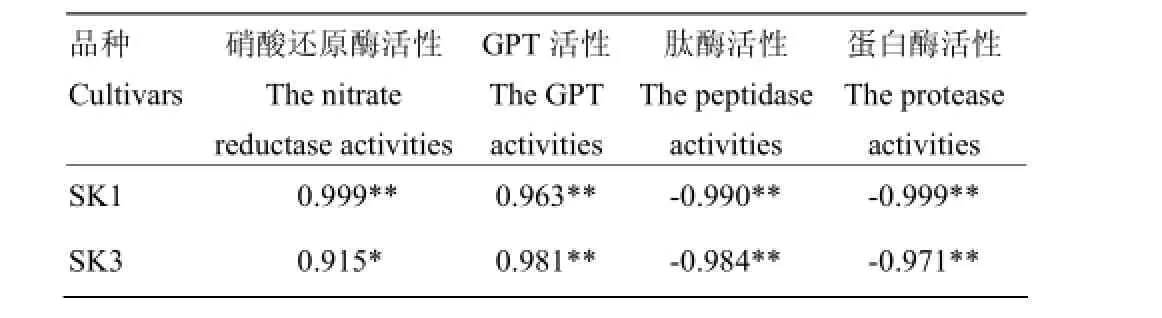
表6 Bt水分亏缺下铃壳中杀虫蛋白含量与氮代谢关键酶活性相关系数Table 6 Correlation coefficients between insecticidal protein content and key enzyme activities in boll shell under water deficit stress
3 讨论
前人研究表明,土壤水分亏缺对Bt棉杀虫蛋白含量有一定影响。其中王留明等[18]和BLAISE等[19]发现土壤水分亏缺可引起叶片和幼蕾中杀虫蛋白含量降低,但对棉铃影响则未明确指出。但MARTINS等[20]认为土壤含水量为最大持水量的25%—30%条件下,叶片和幼蕾杀虫性未有明显变化。本文通过研究不同程度土壤水分亏缺胁迫96 h条件下,棉铃铃壳中杀虫蛋白含量的变化发现:土壤水分亏缺可导致泗抗1号和泗抗3号铃壳中杀虫蛋白含量下降,且随着土壤水分亏缺程度的增加,下降幅度越大。2个类型品种均在土壤水分含量为最大持水量的60%处理下开始显著低于各自对照。由此推测,土壤水分含量为最大持水量的60%可能是引起棉铃杀虫蛋白含量下降的土壤水分临界值。因此,在Bt棉生产上,特别要注意在棉花花铃期可能出现的土壤水分含量低于土壤最大持水量60%的土壤墒情,这会引起生殖器官抗虫性的大幅度下降,从而引起棉铃虫危害程度的加大,对棉花生产造成损失。此外,常规种泗抗1号在土壤水分亏缺条件下,铃壳中杀虫蛋白含量下降幅度小于杂交种泗抗3号。在正常水分条件(土壤含水量为最大持水量的75%)下,泗抗3号铃壳中杀虫蛋白含量显著高于泗抗1号,但当土壤含水量下降到最大持水量的45%或更低时,泗抗1号则显著高于泗抗3号。上述结果说明,泗抗1号生殖器官中杀虫蛋白含量在土壤水分亏缺条件下稳定性高于泗抗3号,在干旱年份可选用抗旱性强的泗抗1号。
逆境对Bt棉抗虫性下降机理,目前还未明确,但有以下几种推断:一种推断认为在逆境下,Bt的启动子甲基化失活,使得Bt表达关闭(Switch off)[21];第二种推断杀虫蛋白在不良环境下可能与棉株体内产生的单宁等物质结合而失活[22];第三种推断认为在逆境下,蛋白质合成下降,从而杀虫蛋白表达量也下降[23]。本研究发现,土壤水分含量为最大持水量60%胁迫96 h并未导致Bt棉供试品种铃壳中转录水平Bt表达量的下降,相反泗抗1号和泗抗3号铃壳中的Bt表达量还显著增加。这与第一种推断正好相反,笔者推测Bt表达关闭这一推断并不适用于土壤水分亏缺逆境。上述结果也表明了基因的转录和翻译是2个相对独立的过程,相关性较低[24-25]。但是蛋白质是生命活动的主要执行者,因此,蛋白质水平比基因表达研究能提供更直接和准确的信息[26]。从本研究结果来看,常规棉品种泗抗1号比杂交棉品种泗抗3号杀虫蛋白下降幅度小,且泗抗1号Bt表达水平的上升幅度大于泗抗3号。说明:第一,从mRNA到蛋白质合成是一个复杂的调控过程,尽管逆境条件下mRNA水平转录水平提高,但有可能翻译效率有所下降,也有可能翻译蛋白质降解加速,使得最终杀虫蛋白含量下降。这一点已由蛋白酶和肽酶活性大幅度增加得到进一步验证;第二,土壤水分亏缺条件下,棉铃中Bt表达量提高是植物本身对逆境的一种自我调控措施。而泗抗1号提高幅度较泗抗3号高,表明其对土壤水分亏缺胁迫适应能力强,最终表现为铃壳中杀虫蛋白含量下降程度低。
从氮代谢角度而言,前人研究发现,湿度胁迫下叶片中杀虫蛋白含量的下降与Bt杀虫蛋白合成能力下降、分解能力增强相关[27]。CHEN等[28-29]通过对不同类型Bt棉品种生育过程中毒蛋白含量变化的研究表明GPT活性、可溶性蛋白含量与Bt杀虫蛋白含量密切正相关,认为氮代谢活性影响Bt杀虫蛋白的表达。本文研究也表明,在土壤水分亏缺条件下,泗抗1号和泗抗3号铃壳中氮代谢相关合成酶(NR和GPT)活性降低,氮代谢相关分解酶(蛋白酶和肽酶)活性增加,且NR和GPT活性与杀虫蛋白含量呈显著或极显著正相关。蛋白酶和肽酶与杀虫蛋白含量呈极显著负相关。说明蛋白质合成减少,分解加快可能是导致土壤水分亏缺条件下Bt抗虫棉棉铃杀虫蛋白含量下降的原因。进一步分析发现,土壤水分亏缺条件下,氮代谢相关分解酶活性增加幅度明显高于相关合成酶减少幅度,这说明蛋白质分解加速可能是导致最终杀虫蛋白含量降低的主导因素,但此方面还应进一步验证。
综上所述,Bt棉在盛铃期受到土壤水分亏缺胁迫后引起铃壳中杀虫蛋白含量下降,抗虫性降低。棉花的盛铃阶段既是产量品质形成关键期,又经常遇到土壤水分含量低于最大持水量60%的情况。因此,在栽培上应通过选择对土壤水分亏缺逆境适应能力强的Bt棉品种,同时通过及时灌溉、施肥、喷施具有抗逆性作用的调节剂[30-31]等方式保持杀虫蛋白的高效稳定表达,提高Bt棉的抗虫性,为转Bt棉的优质高产栽培提供有效保证。
4 结论
水分亏缺胁迫96 h后,供试品种铃壳中杀虫蛋白含量显著下降。但在转录水平未发现Bt表达量降低。而在翻译水平,蛋白质分解酶(肽酶和蛋白酶)活性增加,且与杀虫蛋白含量呈极显著负相关;蛋白质合成酶(NR和GPT)活性减弱,且与杀虫蛋白含量呈显著或极显著正相关。表明水分亏缺条件下,杀虫蛋白含量下降原因并不在于基因表达水平。其主要原因在于蛋白质分解加强,合成减弱。
[1] CLIVE J. 全球生物技术/转基因作物商业化发展态势. 中国生物工程杂志, 2012, 32(1): 1-14.
CLIVE J. The development trend of global biotechnology/GM crops commercialization.China Biotechnology, 2012, 32(1): 1-14. (in Chinese)
[2] 黄季焜, 米建伟, 林海, 王子军, 陈瑞剑, 胡瑞法, ROZELLE S, PRAY C. 中国10年抗虫棉大田生产: Bt抗虫棉技术采用的直接效应和间接外部效应评估. 中国科学(生命科学), 2010, 40(3): 260-272.
HUANG J K, MI J W, LIN H, WANG Z J, CHEN R J, HU R F, ROZELLE S, PRAY C. A decade of Bt cotton in farmer fields in China: Assessing the direct effects and indirect externalities of Bt cotton adoption in China.Science China (Life Science), 2010, 40(3): 260-272. (in Chinese)
[3] SUJII E R, TOGNI P H B, RIBEIRO P D, BERNARDES T A, MILANE P V G N, PAULA D P, PIRES C S S, FONTES E M G. Field evaluation of Bt cotton crop impact on nontarget pests: Cotton aphid and boll weevil.Neotropical Entomology, 2013, 42(1): 102-111.
[4] DHILLON M K, SHARMA H C. Comparative studies on the effects of Bt-transgenic and non-transgenic cotton on arthropod diversity, seed cotton yield and bollworms control.Journal of Environmental Biology, 2013, 34(1): 67-73.
[5] HALLIKERI S S, HALEMANI H L, PATIL B C, NANDAGAVI R A.Influence of nitrogen management on expression of Cry protein in Bt-cotton (Gossypium hirsutum).Indian Journal of Agronomy, 2011, 56(1): 62-67.
[6] 王冬梅, 李海强, 丁瑞丰, 汪飞, 李号宾, 徐遥, 阿克旦·吾外士,刘建. 新疆北部地区转Bt基因棉外源杀虫蛋白表达时空动态研究.棉花学报, 2012, 24(1): 18-26.
WANG D M, LI H Q, DING R F, WANG F, LI H B, XU Y, AHTAM U, LIU J. Spatio-temporal expression of foreign Bt insecticidal protein in transgenic Bt cotton varieties in northern Xinjiang province, China.Cotton Science, 2012, 24(1): 18-26. (in Chinese)
[7] KUMAR R, DAHIYA K K, KUMAR D. Evaluation of Bt cotton hybrids against bollworms in cotton.Annals of Agri-Bio Research, 2013, 18(1): 39-43.
[8] ADDISON S J, ROGERS D J. Potential impact of differential production of the Cry2Ab and Cry1Ac proteins in transgenic cotton in response to cold stress.Journal of Economic Entomology, 2010, 103(4): 1206-1215.
[9] KNOX O G G, CONSTABLE G A, PYKE B, GUPTA V V S R.Environmental impact of conventional and Bt insecticidal cotton expressing one and two Cry genes in Australia.Australian Journal of Agricultural Research, 2006, 57(5): 501-509.
[10] PARIMALA P, MUTHUCHELIAN K. Physiological response of non-Bt and Bt cotton to short-term drought stress.Photosynthetica, 2010, 48(4): 630-634.
[11] ROCHESTER I J. Effect of genotype edaphic, environmental conditions, and agronomic practices on Cry1Ac protein expression in transgenic cotton.Journal of Cotton Science, 2006, 10(4): 252-262.
[12] 刘耀武, 刘洪春, 付桂月, 李宏华, 孙福燕. 近年抗虫棉抗虫性下降原因分析及对策. 中国植保导刊, 2008, 28(1): 30-31.
LIU Y W, LIU H C, FU G Y, LI H H, SUN F Y.Reason analyzed and counter measures of the decline of insect-resistance for anti-insect cotton in recent years.China Plant Protection, 2008, 28(1): 30-31. (in Chinese)
[13] Carter R, Clower J J, Young R R, Lambert H. Transgenic Bt cottonconsultants’ views & observations//Proceeding, Beltwide Cotton Conference, New Orleans, 1997: 874-875.
[14] BENEDICT J H, SACHS E S, ALTMAN D W, DEATON W R, KOHEL R J, RING D R, BERBERICH S A.Field performance of cottons expressing transgenic CryIA insecticidal proteins for resistance to Heliothisvirescens and Helicoverpazea (Lepidoptera: Noctuidae).Journal of Economic Entomology, 1996, 89(1): 230-238.
[15] 李勇, 杨晓光, 代姝玮, 王文峰. 长江中下游地区农业气候资源时空变化特征. 应用生态学报, 2010, 21(11): 2912-2921.
LI Y, YANG X G, DAI S W, WANG W F. Spatiotemporal change characteristics of agricultural climate resources in middle and lower reaches of Yangtze River.ChineseJournal of Applied Ecology, 2010, 21(11): 2912-2921. ( in Chinese)
[16] 陈松, 吴敬音, 何小兰, 黄骏麒, 周宝良, 张荣铣. 转基因抗虫棉组织中Bt毒蛋白表达量的ELISA测定. 江苏农业学报, 1997, 13(3): 154-156.
CHEN S, WU J Y, HE X L, HUANG J Q, ZHOU B L, ZHANG R X. Quantification using ELISA ofBacillus thuringiensisinsecticidal protein expressed in the tissue of transgenic insect-resistant cotton.Jiangsu Journal of Agricultural Science, 1997, 13(3): 154-156. ( in Chinese)
[17] 邹琦. 植物生理学实验指导. 北京: 中国农业出版社, 2000: 127-130.
ZOU Q.Experimental Instruct of Plant Physiology. Beijing: China Agriculture Press, 2000: 127-130. (in Chinese)
[18] 王留明, 王家宝, 沈法富, 张学坤, 刘任重. 渍涝与干旱对不同转Bt基因抗虫棉的影响. 棉花学报, 2001, 13(2): 87-90.
WANG L M, WANG J B, SHEN F F, ZHANG X K, LIU R Z. Influences of water logging and drought on different transgenic Bt cotton cultivars.Cotton Science, 2001, 13(2): 87-90. ( in Chinese)
[19] BLAISE D, KRANTHI K R. Cry1Ac expression in transgenic Bt cotton hybrids is influenced by soil moisture and depth.Current Science, 2011, 101(6): 783-786.
[20] MARTINS C M, BEYENE G, HOFS J L, KRUGER K, VYVER C V, SCHLUTER U, KUNERT K J. Effect of water-deficit stress on cotton plants expressing theBacillus thuringiensistoxin.Annals of Applied Biology, 2008, 152(2): 255-262.
[21] STAM M, MOL J N M, KOOTER J M. The silence of genes in transgenic plants.Annals of Botany, 1997, 79: 3-12.
[22] HOLT H E. Season-long monitoring of transgenic cotton plants development of an assay for the quantification of Bacillus thuringiensis insecticidal crystal protein//Cotton Research and Development Corporation: The Ninth Australian Cotton Conference. Broadbeach, Australia, 1998: 331-335.
[23] CHEN D H, YE G Y, YANG C Q, CHEN Y, WU Y K. The Effect of high temperature on the insecticidal properties of Bt Cotton.Environmental and Experimental Botany, 2005, 53(3): 333-342.
[24] WASHBURN M P, KOLLER A, OSHIRO G, ULASZEK R R, PLOUFFE D, DECIU C, WINZELER E, YATES J R. Protein pathway and complex clustering of correlated mRNA and protein expression analyses inSaccharomyces cerevisiae.Proceedings of the National Academy of Sciences of the USA, 2003, 100: 3107-3112.
[25] HUDSON D, EDWARDS R. Dynamics of transcription-translation net works.Physica Dnonlinear Phenomena, 2016, 331: 102-113.
[26] ZHU H, BILGIN M, SNYDER M. Proteomics.Annual Review of Biochemistry, 2003, 72: 783-812.
[27] 王永慧, 陈建平, 张祥, 陈源, 陈德华. 温湿度胁迫对Bt 棉叶片氨基酸组分及Bt 蛋白含量的影响. 华北农学报, 2012(6): 102-106.
WANG Y H, CHEN J P, ZHANG X, CHEN Y, CHEN D H. Effect of combination stress of temperature and humidity on amino acids and Bt protein content in leave of Bt cotton.Acta Agriculturae Boreali-Sinica, 2012(6): 102-106. (in Chinese)
[28] CHEN D H, YE G Y, YANG C Q, CHEN Y, WU Y K. Effect of introducingBacillus thuringiensisgene on nitrogen metabolism in cotton.Field Crops Research, 2005, 92: 1-9.
[29] 陈德华, 聂安全, 杨长琴, 陈源, 吴云康. Bt棉毒蛋白表达特征与氮代谢关系及其化学调节的研究. 中国棉花, 2003, 30(7): 10-12.
CHEN D H, NIE A Q, YANG C Q, CHEN Y, WU Y K. The research of the relationship between Bt protein expression characteristics and nitrogen metabolism and its chemical control of Bt cotton.China Cotton, 2003, 30(7): 10-12. (in Chinese)
[30] XIANG Z, LI Z, GUO Y Y, YONG H W, YUAN C, DE H C.The impact of introducing theBacillus thuringiensisgene into cotton on boll nitrogen metabolism.Environmental and Experimental Botany, 2007, 61: 175-180.
[31] 张祥, 马爱丽, 房静, 肖健, 峦娜, 王永慧, 陈源, 陈德华. 赤霉酸和缩节胺对转Bt基因抗虫棉棉铃Bt毒蛋白表达及氮代谢的影响.棉花学报, 2010, 22(2): 150-156.
ZHANG X, MA A L, FANG J, XIAO J, LUAN N, WANG Y H, CHEN Y, CHEN D H. Effect of GA3and DPC on Bt protein expression and boll nitrogen metabolism of Bt transgenic cotton.Cotton Science, 2010, 22(2): 150-156. ( in Chinese)
(责任编辑 李莉)
Effects of Soil Water Deficit on Insecticidal Protein Expression in Boll Shell of Transgenic Bt Gene Cotton
ZHANG Xiang, HU DaPeng, LI Yuan, ZHANG LiYa, WANG Jian, CHEN Yuan, CHEN DeHua
(Jiangsu Provincial Key Laboratory of Crop Genetics and Physiology, Yangzhou University, Yangzhou 225009, Jiangsu)
【Objective】 The effects of soil water deficit on insecticidal protein expression in boll shell of Bt gene cotton were studied. 【Method】 In 2014 and 2015, two Bt cotton cultivars Sikang 1 (a conventional cultivar) and Sikang 3 (a hybrid cultivar) were selected as experimental materials and were planted in pots. In 2014, five soil water contents were designed at boll peaking stage: 15% of maximum capacity of soil moisture (G1), 35% of maximum capacity of soil moisture (G2), 40% of maximum capacity of soil moisture (G3), 60% of maximum capacity of soil moisture (G4), 75% of maximum capacity of soil moisture (CK), respectively. Four treatments (G2, G3, G4, CK) were set in 2015. The effects of soil water deficit on insecticidal protein content in boll shell were determined. Ten days before flowering peak stage, watering should be controlled in each treatment. The pots weremoved indoors in case of rain. At the same time, the soil water contents were monitored by WET sensor. When the soil water contents were below the designed value, the pots were watered in the morning, at noon and in the evening. On the basis of these studies, the effects of soil water deficit on Bt gene expression, activities of nitrogen metabolism-related enzymes were determined in 2015. 【Result】 The results of the two years experiments showed that the insecticidal protein content of boll shell decreased with water deficit level increasing. Compared with the control (75% of maximum capacity of soil moisture), the boll shell insecticidal protein content decreased significantly when the soil water content was below 60% of maximum capacity of soil moisture. In comparison with the control, the insecticidal protein contents of cultivar Sikang 1 and Sikang 3 decreased by 22.5% and 41.6%, respectively, with the soil water content at 60% of maximum capacity of soil moisture. However, larger increments of Bt gene expression were observed when the boll shell insecticidal protein content was significantly reduced. Compared with that of respective control, the levels of Bt gene expression in Sikang 1 and Sikang 3 increased by 48.6% and 22.1%, respectively. Furthermore, the key enzyme activity of the nitrogen metabolism showed that the boll shell protease and peptidase increased but the activities of nitrogen reductase and GPT activities decreased. There existed a significant positive correlation of insecticidal protein content with nitrogen reductase and GPT activities; and a significant negative correlation of protease and peptidase activities with insecticidal protein content. 【Conclusion】 Under the condition of soil water deficit, the boll shell insecticidal protein content decreased significantly. However, the expression levels of Bt gene in the two cultivars increased significantly. NR and GPT activities decreased, while protease and peptidase activities increased. Thus, the decrease of insecticidal protein content was considered as a results of decrease of synthesis and increase of decomposition of protein.
Bt cotton; water deficit; gene expression; insecticidal protein; nitrogen metabolism
10.3864/j.issn.0578-1752.2017.04.004
2016-07-04;接受日期:2016-09-23
国家自然科学基金(31301263,31471435,31671613)、江苏省农业三新工程项目(SXGC(2016)320)、江苏省高校优势学科建设工程、江苏高校品牌专业建设工程、国家博士后基金(2016M591934)、中国农业科学院科技创新工程(2016PCTS-1)
联系方式:张祥,Tel:0514-87979357;E-mail:yzzhangxiang@163.com。通信作者陈德华,Tel:0514-87979357;E-mail:cdh@yzu.edu.cn
