应用锁式探针结合斑点杂交技术检测甜瓜细菌性叶斑病
2017-04-08徐瑞胡白石田艳丽黄艳宁谢进曹亮彭斯文朱校奇
徐瑞,胡白石,田艳丽,黄艳宁,谢进,曹亮,彭斯文,朱校奇
(1湖南省农业生物资源利用研究所,长沙 410125;2南京农业大学植物保护学院,南京 210095)
应用锁式探针结合斑点杂交技术检测甜瓜细菌性叶斑病
徐瑞1,胡白石2,田艳丽2,黄艳宁1,谢进1,曹亮1,彭斯文1,朱校奇1
(1湖南省农业生物资源利用研究所,长沙 410125;2南京农业大学植物保护学院,南京 210095)
【目的】甜瓜细菌性叶斑病是危害甜瓜的重要种传细菌病害,是由丁香假单胞杆菌流泪病致病变种甜瓜菌株(Pseudomonas syringaepv.lachrymans)引起的。论文旨在建立高效、快捷、操作简单的检测技术以防止此病原菌传播。【方法】以GenBank公布的甜瓜细菌性叶斑病菌的甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因序列为靶标,设计甜瓜细菌性叶斑病菌特异性锁式探针,建立锁式探针与斑点杂交技术结合的检测体系。以保存的目的菌株为材料,提取DNA作为模板进行锁式探针连接反应、酶切反应和扩增反应,并将锁式探针连接反应、酶切反应和扩增反应的反应温度和反应时间分别进行优化。利用优化的锁式探针连接反应、酶切反应和扩增反应分别对健康的甜瓜种子、带有甜瓜细菌性叶斑病的甜瓜种子、无菌水及25株其他参试菌株进行检测,测定该体系的特异性。将甜瓜细菌性叶斑病菌的DNA按10倍梯度稀释,依次稀释为1 ng·μL-1、100 pg·μL-1、10 pg·μL-1、1 pg·μL-1、100 fg·μL-1、10 fg·μL-1和1 fg·μL-1作为模板,利用优化的锁式探针连接反应、酶切反应和扩增反应,测定灵敏度。将探针与斑点杂交技术结合建立高通量检测体系,将上述反应过程中的扩增产物固定于尼龙膜上,将锁式探针上Zipcode序列的反向互补序列合成cZipcode(检测探针),检测探针(cZipcode)用地高辛标记后与产物进行杂交。锁式探针结合斑点杂交技术分别进行特异性检测和灵敏度测定。探针与斑点杂交技术结合建立的高通量检测体系进行人工模拟种子带菌检测,进一步验证该体系的可靠性。利用建立的高通量检测方法对205份市售疑似带病的甜瓜种子进行检测。【结果】锁式探针特异性测定结果表明,26株甜瓜细菌性叶斑病菌均能得到一条105 bp的特异性条带,而剩余25株参试菌株及无菌水均无扩增产物产生。灵敏度测定结果表明,当目的菌株的浓度稀释为1 pg·μL-1时均能检测到一条105 bp的特异性条带,所以探针的检测灵敏度为1 pg·μL-1。探针与斑点杂交技术结合建立的检测甜瓜细菌性叶斑病菌高通量体系能将甜瓜细菌性叶斑病与所有的参试菌种区分开,26株甜瓜细菌性叶斑病菌杂交后出现了显色反应,而25株参试菌株及无菌水均没有发生显色。锁式探针结合斑点杂交的灵敏度检测同样达到1 pg·μL-1。将锁式探针结合斑点杂交进行人工模拟种子带菌检测,能将1粒带菌种子从1 000粒健康的种子检测出来,模拟种子带菌检测率都能达到0.1%(1/1 000)。从205份市售甜瓜种子中成功检测到7份市售种子带菌。将带菌种子分别加入一定量的无菌水浸泡4 h,提取悬液DNA,将悬液DNA进行PCR扩增后测序,NCBI比对后确定为甜瓜细菌性叶斑病菌。【结论】基于锁式探针结合斑点杂交技术的检测体系能够快速、准确地识别甜瓜细菌性叶斑病。
甜瓜细菌性叶斑病;锁式探针;斑点杂交;种子
0 引言
【研究意义】 中国是甜瓜生产大国,近年来种植面积的不断扩大,甜瓜细菌性叶斑病有发展蔓延的趋势[1-3]。有研究报道,在某些特定产区,甜瓜细菌性叶斑病的发病率在30%以上,严重时达到100%,致使甜瓜大幅减产[4-5]。建立快速、灵敏、便捷的甜瓜细菌性叶斑病菌检测体系用以检测甜瓜种子,能够有效防止甜瓜细菌性叶斑病的发生和传播。【前人研究进展】SZEMES等[6]运用Padlock探针结合Microarray技术对10种重要的植物病原菌进行了检测并对这种技术成功地进行了优化,结果表明这是一种灵敏度、特异性很好,效率很高的高通量检测技术;田艳丽等对水稻白叶枯病菌(Xanthomomas oryzaepv.oryzae)、瓜类细菌性果斑病菌(Acidovorax citrulli)等病原菌设计了Padlock探针,并且成功地将其运用于实际样品检测,其中在瓜类细菌性果斑病菌上设计Padlock探针能将其成功与燕麦褐条病菌(Acidovorax avenae)区分开,并且这两种病原菌所选的特异性序列只有一个碱基的差异[7-8];王辉等[9]运用斑点杂交技术鉴定了4种支原体即人型支原体(MH)、生殖支原体(MG)、解脲脲原体(UU)和微小脲原体(UP),能够同时进行多种病原菌的检测,提高了临床检测的效率;黄冠军[10]建立了柑橘溃疡病菌(Xanthomonas axonopodispv.citri)锁式探针检测技术,此方法特异性很强、灵敏度很高、重复性高;王念武等[11]建立了番茄溃疡病菌(Clavibacter michiganensissubsp.michiganensis)基于锁式探针技术的实时荧光PCR快速检测方法,并用该方法对来自日本、韩国等的45份样本进行了分析检测。此检测方法高于常规PCR两个数量级,成功地从45份样品中检测到5份样品带有番茄溃疡病菌;陈艳鸿等[12]建立了锁式探针结合正向斑点杂交技术对地毯草黄单胞菌大豆致病变种(Xanthomonas axonopodispv.glycines)检测体系,建立的体系能够对大豆细菌性斑疹病菌特异性识别,检测灵敏度达到100 fg·μL-1;李志锋等[13]对菜豆晕疫病菌(Pseudomonas savastanoipv.phaseolicola)建立了锁式探针体系,与传统PCR相比灵敏度高出了10倍;王婷[14]以番茄上危害较大的番茄细菌性溃疡病菌(Clavibacter michiganensissubsp.michiganensis)、番茄细菌性斑点病菌(Pseudomonas syringaepv.tomato)和番茄青枯病菌(Ralstonia solanacearum)为研究对象,分别建立了基于锁式探针的反向斑点杂交技术体系,检测体系能够特异性的识别目标菌株,实现对靶标序列的特异性检测;蔡俊等[15]建立的基于小麦矮腥黑穗病菌(Tilletia controversa)超分支滚环扩增检测体系,能够专一地检测出小麦矮腥黑穗病菌,完全将其与近缘种分开,同样灵敏度高于常规PCR 10倍。【本研究切入点】目前主要用普通PCR对甜瓜细菌性叶斑病进行检测,而普通PCR容易出现假阳性等问题,锁式探针能够避免常规的PCR等检测方法易受检测样品中杂质干扰以及假阳性的现象。迄今为止,尚未见锁式探针技术检测甜瓜细菌性叶斑病的相关报道。【拟解决的关键问题】以甜瓜细菌性叶斑病菌为研究对象,寻找特异性核苷酸片段,设计Padlock探针。建立甜瓜细菌性叶斑病菌Padlock探针结合斑点杂交的高通量检测体系,为甜瓜细菌性叶斑病快速检测提供技术支持。
1 材料与方法
试验于2012年7月至2014年4月在南京农业大学完成。
1.1 试验材料与仪器
共选用51株参试菌株,包括26株丁香假单胞杆菌流泪病致病变种甜瓜菌株、12株丁香假单胞杆菌流泪病致病变种黄瓜菌株及13株其他参试菌株(表1)。
清JS-780全自动凝胶成像分析系统(上海培清科技有限公司);Eppendorf Mastercycler pro384梯度PCR扩增仪(德国艾本德股份公司);VP HL-2000紫外交联仪(美国思伯明科学器材有限公司);Y-8C双稳定时电泳仪(北京六一仪器厂)。10×UDG缓冲液、Taq DNA连接酶购自New England Biolabs(英国);dNTP、MgCl2、核酸外切酶Ⅲ、核酸外切酶Ⅰ、10×Taq聚合酶Buffer、Taq聚合酶购自大连宝生物公司;细菌基因组DNA制备试剂盒购自爱思进生物技术有限公司(杭州);Nylon-N+尼龙膜购自Amersham(英国);地高辛标记检测试剂盒购自罗氏公司(德国)。
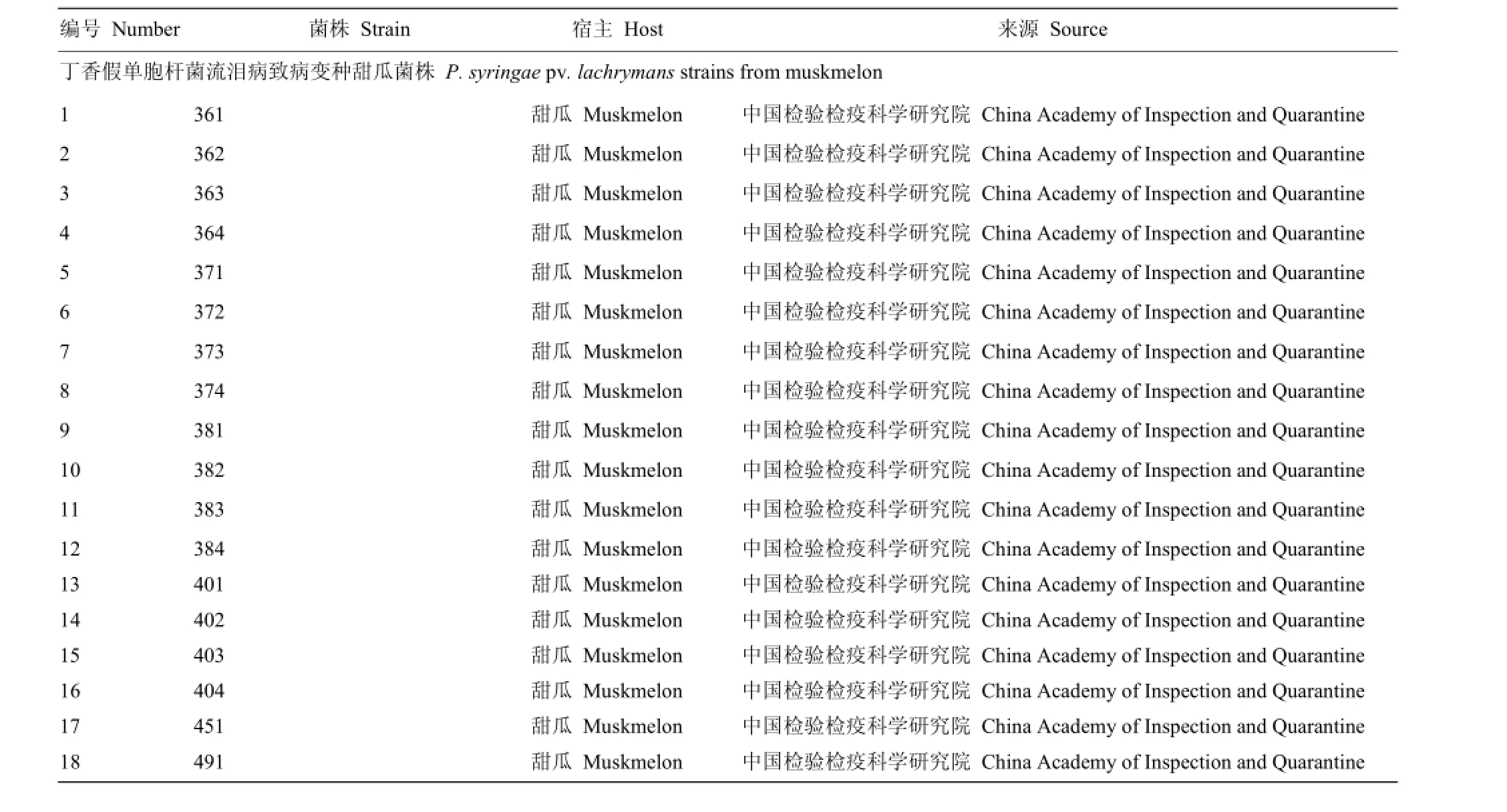
表1 供试菌株Table 1 Bacterial strains used in this study
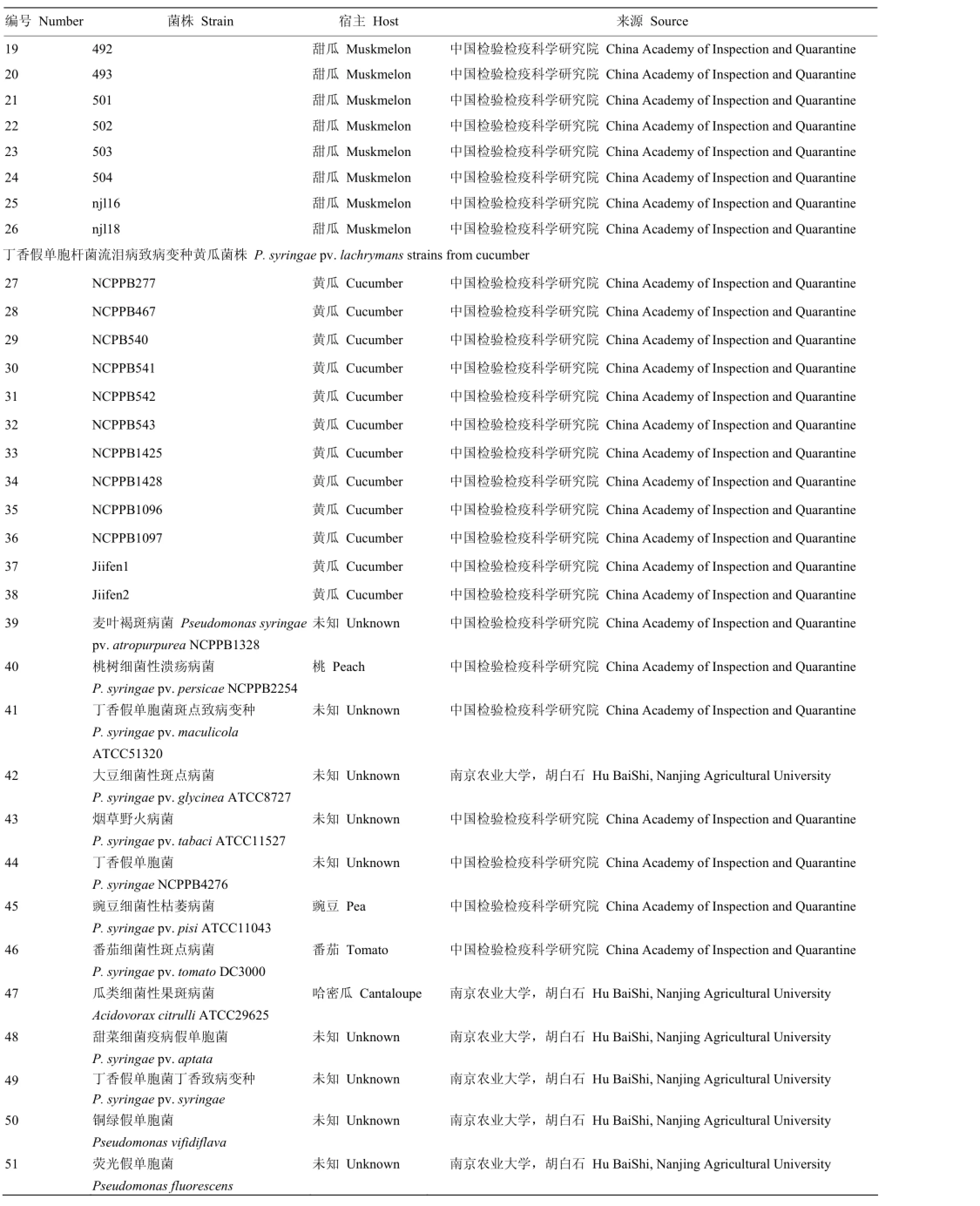
续表1 Continued table 1
1.2 靶标基因选取及锁式探针设计
将GAPDH作为靶标基因,用Bioedit软件将所有参试菌株的GAPDH基因序列比对,选取甜瓜细菌性叶斑病基因序列的特异部分为Padlock探针T2端,靠近T2端的作为T1端。然后将设计的Padlock探针与GenBank登录的所有细菌序列比较以确保Padlock探针的特异性。甜瓜细菌性叶斑病菌探针由生工生物技术公司(上海)合成(表2)。
1.3 核酸提取
所有参试菌株活化后,用Axygen的细菌基因组DNA制备试剂盒(爱思进生物技术(杭州)有限公司)分别提取参试菌株的DNA,操作参照产品说明书。
1.4 锁式探针连接、酶切和扩增反应
锁式探针连接反应:1 μL Padlock探针(2 μmol·L-1),1 μL 10×Taq DNA连接酶Buffer,0.4 μL Taq DNA连接酶(40 U·μL-1),6.6 μL灭菌去离子水,2 μL待测模板DNA。反应程序:预变性96℃ 7 min;96℃变性30 s,68℃连接40 s,67℃退火4 min,共30个循环;最后96℃灭活5 min。
锁式探针酶切反应:连接反应后的产物管中加入0.5 U Exonuclease I,0.5 U Exonuclease III(TaKaRa Biotechnology Dalian China),1 μL 10×Exonuclease I Buffer [500 mmol·L-1Tris-HCl(pH 8.0),50 mmol·L-1MgCl2, 10 mmol·L-1DTT]和11 μL 10×Exonuclease III Buffer [670 mmol·L-1Tris-HCl(pH 8.0),67 mmol·L-1MgCl2, 10 mmol·L-1DTT]。反应程序:37℃反应1 h,然后将反应后的产物95℃灭活30 min。
锁式探针扩增反应:1.5 µL MgCl2(25 mmol·L-1),2.0 μL dNTP(2.5 mmol·L-1each),2.5 µL 10×Taq聚合酶Buffer,0.2 μL Taq DNA聚合酶,2.5 μL Uracil-DNA Glycosylase,1 µL 10×Uracil-DNA Glycosylase Buffer,通用引物各2 μL(2 µmol·L-1),加入2 μL酶切产物作为扩增反应模板,无菌水补足到25 μL。通用引物序列:P1-f19(5′-CGAGATGTACCGCTA TCGT-3′)、P2-r20(5′-TCATGCTGCTAACGGTCG AG-3′)。
1.5 锁式探针与斑点杂交结合的高通量检测技术
(1)探针制备取zipcode反向互补序列20 μL,加入Roche DIG杂交试剂盒中的1号4 μL,充分混匀,放置于37℃温育22—24 h。70℃水浴中终止反应10 min,保存于-20℃冰箱;(2)点样中和及紫外交联将PCR产物于沸水浴中10 min中后迅速放置于冰盒中,取2 μL点于尼龙膜上。在干净的玻璃上放置一张比膜稍大的滤纸并用中和液浸湿,将点样后的尼龙膜置于上面静置4 min。然后放于自然空气干燥30 min,置于紫外交联仪上交联5 min。将固定好的杂交膜置于10×SSC溶液中浸润平衡5 min;(3)将10 mL预杂交液倒入杂交管中,按55℃杂交温度预热15 min。将浸润平衡好的尼龙膜放入预热的杂交管中,55℃预杂交1 h;(4)取出杂交膜置于另一杂交管中,加入5 mL含有探针的新鲜杂交液,55℃杂交过夜;(5)用100 mL洗脱液A于68℃杂交炉中洗涤30 min,然后用洗脱液B于68℃杂交炉中洗膜两次,每次15 min。然后用Washing Buffer(50 mL马来酸加入150 µL吐温-20)于室温下轻摇洗脱5 min;(6)将尼龙膜转置于1×Blocking Buffer静置30 min,接着放于Antibody solution中静置40 min,Washing Buffer每次洗脱15 min,洗脱2次,尼龙膜置于30 mL Detection Buffer中平衡5 min,最后置于15 mL现配的Color substrate中避光显色1—8 h。尼龙膜出现明显清晰的条带后,用无菌水浸泡10 min终止反应。
1.6 锁式探针特异性检测
根据上述试验过程,用锁式探针对51株参试菌株(表1)进行检测,探针的特异性通过PCR扩增结果(反应体系和反应程序同1.4)和斑点杂交结果(反应体系和反应程序同1.5)来判定。
1.7 锁式探针灵敏度检测
甜瓜细菌性叶斑病的DNA依次稀释为1 ng·μL-1、100 pg·μL-1、10 pg·μL-1、1 pg·μL-1、100 fg·μL-1、10 fg·μL-1和1 fg·μL-17个梯度,运用锁式探针将7个梯度分别作为模板扩增(反应体系和反应程序同1.4)及斑点杂交(反应体系和反应程序同1.5),根据扩增和斑点杂交结果判定探针的灵敏度。
1.8 人工模拟种子带菌检测
取约200颗健康的甜瓜种子浸泡于甜瓜细菌性叶斑病菌悬液中4 h,将种子自然风干,风干后的带菌甜瓜种子和健康甜瓜种子按0/1 000、1/1 000、10/1 000、50/1 000和100/1 000混合。浸泡于200 mL无菌水中,振荡4 h后抽取浸提液,提取DNA作为目标模板进行斑点杂交。

表2 试验所用锁式探针序列Table 2 Padlock probes sequence used in this study
1.9 市售种子检测
对市售的205份甜瓜种子进行检测。分别将待测种子加入一定量的无菌水浸泡4 h,将浸出液取出离心后提取DNA,然后用对应的探针对提取的DNA进行检测。
2 结果
2.1 锁式探针特异性测定
用设计的锁式探针对51株参试菌株进行试验。26株目标菌株反应结果为阳性,均扩增到一条105 bp的特异性目的条带。而剩余25株参试菌株及空白对照均无扩增产物产生(图1)。说明此研究设计的锁式探针对甜瓜细菌性叶斑病有较好的特异性。
2.2 锁式探针灵敏度测定
将DNA浓度为1 ng·μL-1左右的目的菌株按10倍梯度稀释,依次稀释为1 ng·μL-1、100 pg·μL-1、10 pg·μL-1、1 pg·μL-1、100 fg·μL-1、10 fg·μL-1和1 fg·μL-1作为模板,共7个梯度。由图2可以看出,连接体系中加入1 pg目的DNA基因组,都能扩增出105 bp的目的片段。探针的检测灵敏度为1 pg·μL-1。
2.3 锁式探针结合斑点杂交特异性检测
取4 μL锁式探针扩增产物(2.1部分)点在尼龙膜上进行斑点杂交测定。26株甜瓜细菌性叶斑病病菌杂交后出现了显色反应,而非目的菌株杂交后无颜色反应(图3)。
2.4 锁式探针结合斑点杂交灵敏度检测
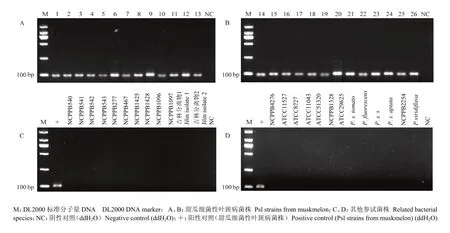
图1 锁式探针特异性Fig. 1 Specifcity amplification of Padlock probe
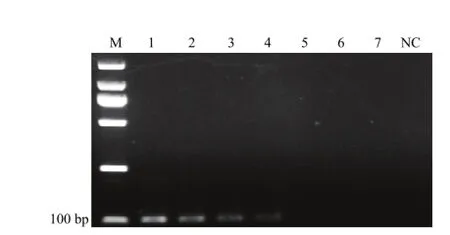
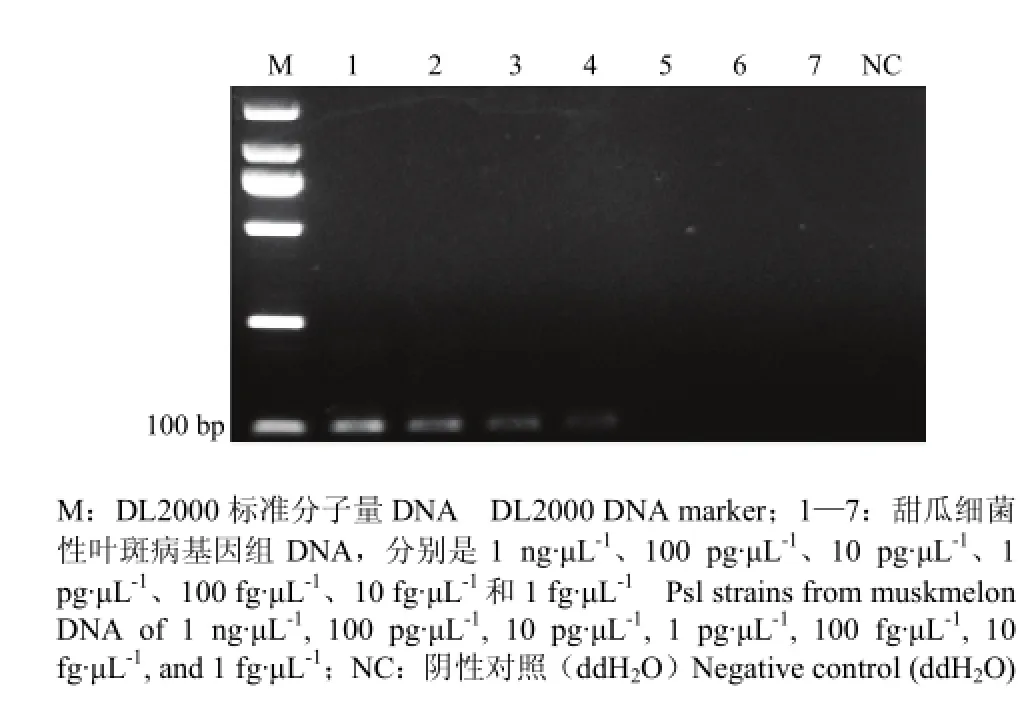
图2 锁式探针灵敏度Fig. 2 Sensitivity of Padlock probe
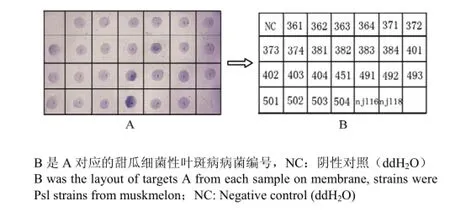
图3 锁式探针结合斑点杂交特异性Fig. 3 The specificity of dot-blot hybridization combined with Padlock probe
将4 μL锁式探针扩增产物(上述2.2)点在尼龙膜上进行斑点杂交测定。同样灵敏度也能达到1 pg·μL-1(图4)。
2.5 锁式探针结合斑点杂进行人工模拟种子带菌检测
模拟种子带菌检测率达到0.1%(1/1 000)(图5),能将1粒带菌种子从1 000粒健康的种子检测出来。
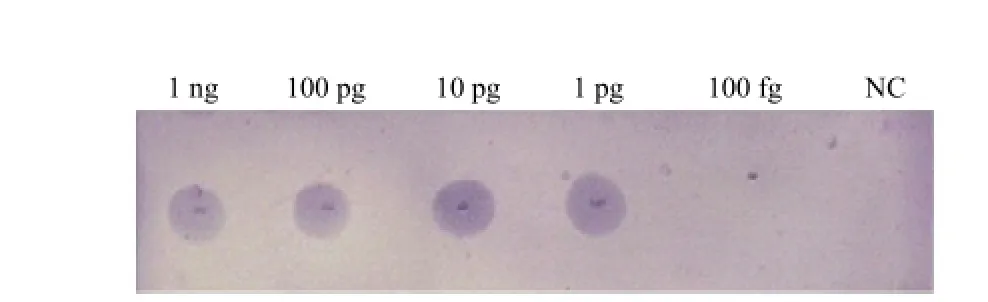
图4 锁式探针结合斑点杂交灵敏度Fig. 4 Sensitivity of dot-blot hybridization combined with Padlock probe
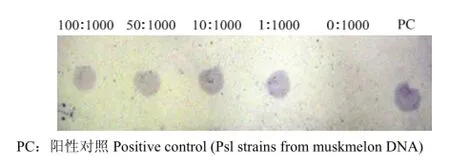
图5 锁式探针结合斑点杂进行人工模拟种子带菌检测Fig. 5 Detection of artificially infested seeds by dot-blot hybridization combined with Padlock probe
2.6 锁式探针结合斑点杂交对市售疑似带有甜瓜细菌性叶斑病的甜瓜种子检测
运用锁式探针结合斑点杂交对市售疑似带有甜瓜细菌性叶斑病的甜瓜种子检测,从205份市售甜瓜种子中检测到7份甜瓜种子带菌。由图6中可以看出1、12、55、58、104、110和111号种子带有甜瓜细菌性叶斑病。
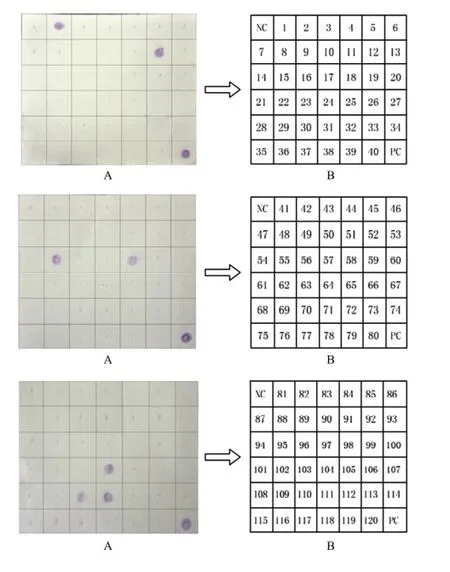
图6 锁式探针结合斑点杂交对市售甜瓜种子的检测Fig. 6 Detection of commercially available sweet melon seeds by dot-blot hybridization combined with Padlock probe
3 讨论
甜瓜细菌性叶斑病的检测方法有多种,主要有免疫检测技术和常规分子生物学检测方法,但是这些检测方法均存在不足之处。凝集试验拥有能够定性、操作简便、检测周期短等特点,但灵敏度不高。目前植物细菌性病害诊断应用较广免疫学方法是酶标抗体技术-酶联免疫吸附法(ELISA)。ELISA能用于定性分析检测和定量分析检测[16],由于ELISA自身反应过程较为复杂,使得ELISA灵敏度和特异性较低,容易出现假阳性和假阴性[17]。流动注射免疫检测和胶体金标记免疫层析检测法是两种新型的免疫检测技术[18],也都存在一定的缺陷,流动注射免疫检测不能实现大批量的样品分析[19],胶体金标记免疫层析检测法稳定性和灵敏度不高[20]。基因芯片技术能够实现一次分析检测大量样品和高通量的特点,但其重复性有待提高[21-22]。巢式PCR是运用两对引物进行扩增容易引起交叉污染[23]。多重PCR具有检测费用低和操作简单等特点,但其要求多对引物同时加入同一PCR体系中,引物的竞争性扩增和引物间的配对影响,从而影响其扩增效果[24]。荧光定量PCR具有定量准确、安全快速和准确灵敏等优点,但它能与非特异性的双链DNA结合造成假阳性结果[25]。
锁式探针是一条长的寡聚核苷酸链,长度为100 bp左右[26],探针两端(磷酸化的5′端和羟基化的3′端)能与目的片段进行特异性结合[27]。探针两端称为T1端和T2端,锁式探针两端有很强的特异性,能够检测单碱基突变[28-29]。锁式探针设计的前期是找到一条特异性的序列,得到特异性序列后并不能简单的得到一条特异性探针。特异性探针的设计是一个大量筛选和反复验证的过程,T1端和T2端的位置、长度、GC含量等都要经过反复考量,多次试验后才有可能得到一条特异性强和灵敏度高的Padlock探针。
将锁式探针结合斑点杂交技术能够实现甜瓜细菌性叶斑病菌高通量检测。此方法避免了常规的PCR等检测方法易受检测样品中杂质干扰、以及假阳性的现象。
4 结论
以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3- phosphate dehydrogenase,GAPDH)基因为靶标基因,设计了能特异性识别甜瓜细菌性叶斑病的锁式探针,并且将锁式探针与斑点杂交技术相结合建立了甜瓜细菌性叶斑病的高通量检测体系,将反应过程进行了优化,该体系灵敏度达到1 pg·μL-1。该方法适用于甜瓜细菌性叶斑病菌的检测,对防止该病的蔓延传播有实际应用价值。
[1] 李亚利. 甜瓜细菌性叶斑病的寄主范围测定、16S rDNA鉴定及西瓜细菌性果斑病菌的PCR检测[D]. 兰州: 甘肃农业大学, 2006.
LI Y L. Studies on host rang and 16S rDNA identification of bacterial spot of muskmelon leaves as well as PCR detection of bacterial blotch of watermelon[D]. Lanzhou: Gansu Agricultural University, 2006. (in Chinese)
[2] 代园凤. 丁香假单胞菌黄瓜致病变种黄瓜株系和甜瓜株系的分子生物学比较[D]. 南京: 南京农业大学, 2013.
DAI Y F. Molecular comparison ofPseudomonas syringaepv.lachrymansstrains from cucumber and muskmelon[D]. Nanjing: Nanjing Agricultural University, 2013. (in Chinese)
[3] 李亚利, 贾迎春, 蒲崇建, 薛莉, 陈秀蓉. 甜瓜细菌性叶斑病菌(Pseudomonas syringaepv.lachrymans)寄主范围测定. 甘肃农业大学学报, 2006, 41(6): 63-66.
LI L Y, JIA Y C, PU C J, XUE L, CHEN X R. Host plants of bacterial spot of cucurbits leaves infected byPseudomonas syringae.Journal of Gansu Agricultural University, 2006, 41(6): 63-66. (in Chinese)
[4] 李亚利, 贾迎春, 蒲崇建, 杨成德, 陈秀蓉. 采用16S rDNA鉴定甜瓜细菌性叶斑病菌. 植物保护, 2007, 33(3): 65-68.
LI L Y, JIA Y C, PU C J, YANG C D, CHEN X R. Identification of the pathogen of bacterial spot of cucurbits leaves based on 16S rDNA sequences.Plant Protection, 2007, 33(3): 65-68. (in Chinese)
[5] 郝平琦, 李武成, 问亚军, 王振仓, 马飞明. 甜瓜细菌性叶斑病发病因素的调查和防治试验. 陕西农业科学, 2015, 61(1): 65-66.
HAO P Q, LI W C, WEN Y J, WANG Z C, MA F M. Investigation on the pathogenic factors of melon leaf spot and control of the pathogenic bacteria. Shaanxi Journal of Agricultural Sciences, 2015, 61(1): 65-66. (in Chinese)
[6] SZEMES M, BONANTS P, DE WEERDT M, BANER J, LANDEGREN U, SCHOEN C D. Diagnostic application of padlock probes-multiplex detection of plant pathogens using universal microarrays.Nucleic Acids Research, 2005, 33(8): e70.
[7] 田艳丽. 重要植物病原细菌的高通量分子检测技术研究及应用[D].南京: 南京农业大学, 2009.
TIAN Y L. Development and application of high-throughput plant pathogen molecular detection technology[D]. Nanjing: Nanjing Agricultural University, 2009. (in Chinese)
[8] TIAN Y L, ZHAO Y Q, WALCOTT R R, HU B S, LIU F Q. Reliable and sensitive detection ofAcidovorax citrulliin cucurbit seed using padlock-probe-based assay.Plant Disease, 2013, 97(7): 961.
[9] 王辉, 王玮蓁, 段逸群, 孔繁荣, 琳·吉尔伯特. 反向线点杂交方法检测和鉴定4种常见致病支原体. 中国皮肤性病学杂志, 2004, 18(11): 57-58, 68.
WANG H, WANG W Z, DUAN Y Q, KONG F R, GILBERT L. Simultaneous detection of four common pathogenic mycoplasma by reverse line blot (RLB) hybridization.The Chinese Journal of Dermatovenereology, 2004, 18(11): 57-58, 68. (in Chinese)
[10] 黄冠军. 基于锁式探针的柑桔溃疡病菌检测新技术研究[D]. 重庆:重庆大学, 2008.
HUANG G J. New detection technology forXanthomonos axonopodispv.citribased on padlock probe[D]. Chongqing: Chongqing University, 2008. (in Chinese)
[11] 王念武, 王婷, 沈建国, 胡方平. 基于锁式探针的番茄溃疡病菌实时荧光PCR快速检测. 中国农业科学, 2014, 47(5): 903-911.
WANG N W, WANG T, SHEN J G, HU F P. Rapid detection forClavibacter michiganensissubsp.michiganensisusing real-time PCR based on padlock probe.Scientia Agricultura Sinica, 2014, 47(5): 903-911. (in Chinese)
[12] 陈艳鸿, 田艳丽, 赵玉强, 胡白石. 应用锁式探针技术检测大豆细菌性斑疹病. 农业生物技术学报, 2015, 23(10): 1377-1385.
CHEN Y H, TIAN Y L, ZHAO Y Q, HU B S. Development of padlock probe based method for detection of bacterial pustule of soybean (Glycine max).Journal of Agricultural Biotechnology, 2015, 23(10): 1377-1385. (in Chinese)
[13] 李志锋, 王忠文, 冯建军, 郑耘, 王颖, 李一农, 章桂明. 基于锁式探针技术的菜豆晕疫病菌检测技术研究. 植物检疫, 2016, 30(2): 63-68.
LI Z F, WANG Z W, FENG J J, ZHENG Y, WANG Y, LI Y N, ZHANG G M. Detection ofPseudomonas savastanoipv.phaseolicolausing a padlock-based assay.Plant Quarantine, 2016, 30(2): 63-68. (in Chinese)
[14] 王婷. 番茄上三种主要病原细菌的高通量检测[D]. 福州: 福建农林大学, 2013.
WANG T. High-throughput detection for three major bacterial pathogens on tomato[D].Fuzhou: Fujian Agriculture and Forestry University, 2013. (in Chinese)
[15] 蔡俊, 殷幼平, 葛建军, 陈洪俊, 黄冠军, 张雯迪, 王中康. 超分支滚环扩增法检测小麦矮腥黑穗菌. 中国农业科学, 2009, 42(10): 3493-3500.
CAI J, YIN Y P, GE J J, CHEN H J, HUANG G J, ZHANG W D, WANG Z K. Detection ofTilletia controversawith HRCA approach.Scientia Agricultura Sinica, 2009, 42(10): 3493-3500. (in Chinese)
[16] LU X X, YI Y, SU Q D, BI S L. Expression and purification of recombinant Hepatitis delta virus (HDV) antigen for use in a diagnostic ELISA for HDV infection using the high-density fermentation strategy inEscherichia coli.Biomedical and Environmental Sciences, 2016, 29(6): 417-423.
[17] 李薛, 李德庆, 赵鹏, 崔治中. ELISA与IFA检测鸡血清ALV-A/B特异性抗体相关性比较. 病毒学报, 2012, 28(6): 615-620.
LI X, LI D Q, ZHAO P, CUI Z Z. The ALV-A/B specific antibodies correlation between ELISA and IFA detection in chicken serum.Chinese Journal of Virology, 2012, 28(6): 615-620. (in Chinese)
[18] 林彤, 独军政, 丛国正, 邵军军, 高闪电, 常惠芸, 谢庆阁. 胶体金标记免疫层析技术的最新应用进展. 安徽农业科学, 2010, 38(16): 8429-8431.
LIN T, DU J Z, CONG G Z, SHAO J J, GAO S D, CHANG H Y, XIE Q G. Latest application of gold immunochromatographic assay.Journal of Anhui Agricultural Sciences, 2010, 38(16): 8429-8431. (in Chinese)
[19] 林影, 叶茂, 韩双艳, 吴晓英. 免疫检测技术的研究进展. 食品与生物技术学报, 2007, 26(4): 117-120.
LIN Y, YE M, HAN S Y, WU X Y. The progress on the research of immunoassay.Journal of Food Science and Biotechnology, 2007, 26(4): 117-120. (in Chinese)
[20] 许欣, 王锋. 免疫胶体金技术及其在临床诊断上的研究进展. 江西农业学报, 2009, 21(6): 125-128.
XU X, WANG F. Immune colloidal gold technique and its application in clinical diagnosis.Acta Agriculturae Jiangxi, 2009, 21(6): 125-128. (in Chinese)
[21] 肖翔, 官春云, 尹明智, 李栒, 官梅. 基因芯片技术在农业中应用的研究进展. 中国农学通报, 2012, 28(33): 187-193.
XIAO X, GUAN C Y, YIN M Z, LI X, GUAN M. Research progress on application of gene chip in agriculture.Chinese Agricultural Science Bulletin, 2012, 28(33): 187-193. (in Chinese)
[22] 邱秀文, 吴小芹, 黄麟, 叶建仁. 基因芯片技术在生物研究中的应用进展. 江苏农业科学, 2014, 42(5): 60-62.
QIU X W, WU X Q, HUANG L, YE J R. Advances in the application of gene chip technology in biological research.Jiangsu Agricultural Sciences, 2014, 42(5): 60-62. (in Chinese)
[23] 陈金, 毕水莲. PCR技术检测空肠弯曲菌的研究进展. 食品安全质量检测学报, 2015, 6(9): 3428-3434.
CHEN J, BI S L. Advances in detection ofCampylobacter jejuniby polymerase chain reaction technology.Journal of Food Safety & Quality, 2015, 6(9): 3428-3434. (in Chinese)
[24] 何玮玲, 张驰, 杨静, 黄明, 杨军. 食品中4种肉类成分多重PCR的快速鉴别方法. 中国农业科学, 2012, 45(9): 1873-1880.
HE W L, ZHANG C, YANG J, HUANG M, YANG J. A quick multiplex PCR method for the identification of four meat ingredients in food products.Scientia Agricultura Sinica, 2012, 45(9): 1873-1880. (in Chinese)
[25] 陈旭, 齐凤坤, 康立功, 李景富. 实时荧光定量PCR技术研究进展及其应用. 东北农业大学学报, 2010, 41(8): 148-155.
CHEN X, QI F K, KANG L G, LI J F. Advance and application of realtime fluorescent quantitative PCR.Journal of Northeast AgriculturalUniversity, 2010, 41(8): 148-155. (in Chinese)
[26] BARIŠIĆ I, SCHOENTHALER S, KE R, NILSSON M, NOEHAMMER C, WIESINGER-MAYR H. Multiplex detection of antibiotic resistance genes using padlock probes.Diagnostic Microbiology & Infectious Disease, 2013, 77(2): 118-125.
[27] SATO K, ISHII R, SASAKI N, SATO K, NILSSON M. Bead-based padlock rolling circle amplification for single DNA molecule counting.Analytical Biochemistry, 2013, 437(1): 43-45.
[28] PRINS T W, DIJK J P V, HOEF A M, VOORHUIJZEN M M, BROEDERS S, TRAPMANN S, SEYFARTH R, PARDIGOL A, SCHOEN C D, AARTS H J, KOK E J . Towards a multiplex cereal traceability tool using padlock probe ligation on genomic DNA.Food Chemistry, 2010, 118(4): 966-973.
[29] TSUI C K, WANG B, KHADEMPOUR L, ALAMOUTI S M , BOHLMANN J, MURRAY B W, HAMELIN R C. Rapid identification and detection ofpine pathogenic fungi associated with mountain pine beetles by padlock probes.Journal of Microbiological Methods, 2010, 83(1): 26-33.
(责任编辑 岳梅)
Development of Padlock Probe Combined with Dot-Blot Hybridization Based Methods for Detection of Bacterial Spot of Melon Leaves
XU Rui1, HU BaiShi2, TIAN YanLi2, HUANG YanNing1, XIE Jin1, CAO Liang1, PENG SiWen1, ZHU XiaoQi1
(1Institute of Agricultural and Biological Resources Utilization, Hunan Academy of Agricultural Sciences, Changsha 410125;2College of Plant Protection, Nanjing Agricultural University, Nanjing 210095)
bacterial spot of melon leaves; Padlock probe; dot-blot hybridization; seed
10.3864/j.issn.0578-1752.2017.04.008
2016-10-14;接受日期:2016-11-23
国家“863”计划(2012AA101501)、国家公益性行业(农业)科研专项(201303117)
联系方式:徐瑞,E-mail:real88xu@163.com。通信作者朱校奇,E-mail:zhuxiaoqi222@163.com
Abstract:【Objective】 Bacterial spot of melon leaves caused byPseudomonas syringaepv.lachrymansis distributed widely in the world and inflicts different degrees of damage.P. syringaepv.lachrymansis a typical seed-borne pathogen. The objective of this study is to build effective, commercially viable and convenient detecting technologies and to prevent the spread of this pathogen.【Method】The house-keeping gene of DNA glyceraldehyde-3-phosphate dehydrogenase (GAPDH) was selected as the target gene, the specific Padlock probe was designed for bacterial leaf spot of melon, and a bacterial detection system based on Padlock probe combined with dot-blot hybridization was developed. The target strain was selected as experimental materials, and DNA was extracted as a template for ligation reaction, enzyme-cleavage reaction and amplification reaction. The reaction temperature and reaction time of the ligation reaction, enzyme-cleavage reaction and amplification reaction were optimized. The optimized reactions were tested for healthy melon seeds, melon seeds with bacterial spot of melon leaves, sterile water and 25 experimental strains. In order to determine the sensitivity of Padlock probe, DNA of the target strain was diluted to 1 ng·μL-1, 100 pg·μL-1, 10 pg·μL-1,1 pg·μL-1, 100 fg·μL-1, 10 fg·μL-1and 1 fg·μL-1as the templates. Sensitivity was determined by optimized ligation reaction, enzyme-cleavage reaction and amplification reaction. Padlock probe combined with dot-blot hybridization was developed, the amplification product in the course of the reaction was fixed on the nylon membrane, the reverse complementary sequence of the Zipcode sequence was synthesized into cZipcode (detection probe), the detection probe (cZipcode) was labeled with digoxigenin and hybridized with the amplified product. Padlock probe combined with dot-blot hybridization techniques were used for specific detection and sensitivity. Artificial infestation seeds were detected to further verify the reliability of the system. A total of 205 commercially melon seeds with suspected disease were detected by high throughput detection method.【Result】The specificity of the Padlock probe showed that a specific band of 105 bp was got from 26 strains of bacterial spot of melon leaves, while the remaining 25 strains and sterile water were not amplified products. The results of sensitivity showed that the target strain was diluted to 1 pg·μL-1and got a specific band of 105 bp, so the detection sensitivity of the Padlock probe was 1 pg·μL-1. Padlock probe could distinguish bacterial spot of melon leaves from all other experimental strains and its sensitivity could be up to 1 pg·μL-1. Twenty-six strains of bacterial spot of melon leaves had color reaction, the remaining 25 strains and sterile water did not have color reaction. The sensitivity of Padlock probe combined with dot-blot hybridization also could be up to 1 pg·μL-1. Padlock probe combined with dot-blot hybridization could detect one bacterial seed from 1 000 healthy seeds, and the detection rate reached 0.1% (1/1 000). Seven commercially seed-borne bacteria were successfully detected from 205 commercially melon seeds. The seven seed-borne bacteria, respectively, were soaked in sterile water for 4 h, DNA was extracted for PCR amplification and sequencing, the results of DNA sequencing were compared with NCBI and verified the bacterial spot of melon leaves. 【Conclusion】Detecting system based on Padlock probe combined with dot-blot hybridization could detectP. syringaepv.lachrymansfrom sweet melon fast and accurately.
