被转化生长因子β活化的长链非编码RNA对人淋巴瘤Raji细胞增殖、周期及凋亡的影响
2017-04-08赵伟李晓明
赵伟,李晓明
(1.西南医科大学,四川 泸州 646000;2.西南医科大学附属医院 血液内科,四川 泸州 646000)
被转化生长因子β活化的长链非编码RNA对人淋巴瘤Raji细胞增殖、周期及凋亡的影响
赵伟1,李晓明2
(1.西南医科大学,四川 泸州 646000;2.西南医科大学附属医院 血液内科,四川 泸州 646000)
目的 研究被转化生长因子β活化的长链非编码RNA(LncRNA-ATB)对人淋巴瘤Raji细胞增殖、凋亡和周期的影响及其潜在机制。方法 通过实时荧光定量PCR(qRT-PCR)检测LncRNA-ATB短发夹RNA(short hairpin RNA,shRNA)和miR-200c模拟物(miR-200c mimics)效果,以及LncRNA-ATB、miR-200c和鼠类肉瘤病毒癌基因(KRAS)的表达;噻唑蓝(MTT)法检测沉默LncRNA-ATB对Raji细胞增殖的影响;流式细胞术检测LncRNA-ATB对Raji细胞凋亡和周期的影响;荧光素酶报告基因(Luciferase)实验检测KRAS是否为miR-200c的直接靶基因。结果 LncRNA-ATB-shRNA可有效沉默Raji细胞中LncRNAATB的表达,沉默LncRNA-ATB的表达可抑制Raji细胞的增殖能力,促进Raji细胞的凋亡能力,并使Raji细胞的周期阻滞于G1期。进一步研究显示LncRNA-ATB可作为ceRNA与miR-200c竞争性地调控miR-200c直接靶分子KRAS的表达而促进肿瘤细胞增殖。结论 LncRNA-ATB可通过上调KRAS的表达而在淋巴瘤细胞的增殖、凋亡和周期过程中发挥着重要的作用。
被转化生长因子β活化的长链非编码RNA;Raji细胞;鼠类肉瘤病毒癌基因;miR-200c;增殖
淋巴瘤是一组起源于淋巴结或淋巴结以外的淋巴组织的高度异质性的恶性肿瘤,在我国,结外淋巴瘤较结内淋巴瘤更为普遍[1]。根据病理学特征可分为霍奇金淋巴瘤和非霍奇金淋巴瘤,其中非霍奇金淋巴瘤为我国恶性淋巴瘤的主要类型[2]。近年来,我国恶性淋巴瘤的发病率呈现逐年上升的趋势。随着新型免疫治疗和分子靶向治疗在临床上应用,某些亚型的恶性淋巴瘤的治疗效果、预后和生存质量较以往有了显著提高。但仍有部分亚型的恶性淋巴瘤尚无有效的治疗方案,临床治疗效果极差,5年生存率仍处于较低水平[3]。因此,目前急需寻找淋巴瘤潜在的治疗靶点,并制定全新并有效的治疗策略。
近年来,越来越多的研究证实非编码RNA在人体多种疾病进程中发挥着至关重要的作用[4]。长链非编码RNA(long non-coding RNA,LncRNA)为转录本长度超过200 nt但自身不编码蛋白质的RNA[5]。许多研究已证实,被转化生长因子β活化的长链非编码RNA(long non-coding RNA activated by TGF-β,LncRNA-ATB)在多种生理过程中起着关键作用,如细胞增殖、细胞凋亡、细胞周期、细胞侵袭和转移[6-8]。因此,LncRNA可作为原癌基因参与调控肿瘤的发生、发展[9-10]。LncRNA-ATB是新近发现的长链非编码RNA,定位于14号染色体[11]。研究发现,Lnc RNA-ATB可通过与miR-200家族结合并调控其下游信号通路而促进肿瘤的侵袭和转移[11]。然而Lnc RNA-ATB在血液系统肿瘤尤其是淋巴瘤发生、发展过程中的作用,目前尚无研究报道。本研究拟通过检测沉默 Burkitt淋巴瘤 Raji细胞中 LncRNA-ATB的表达对Raji细胞的增殖、凋亡和周期的影响并检测LncRNA-ATB、miR-200c及鼠肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene homolog,KRAS)的相互作用关系,来研究LncRNA-ATB对Raji细胞增殖、凋亡和周期的影响并探讨其发挥作用的潜在分子机制。
1 材料与方法
1.1 材料
Trizol试剂购自江苏省海门市碧云天生物技术研究所,RNA逆转录试剂购自日本TaKaRa公司,LncRNA-ATB-shRNA和miR-200c mimics由上海吉玛公司设计并合成,LipofectamineTM2000试剂购于美国 Invitrogen公司,MTT试剂盒购自美国Promega公司,FITC标记的Annexin-V及PI试剂购自美国BD公司,人淋巴瘤系Raji细胞购自中国科学院上海细胞库。
1.2 方法
1.2.1 细胞培养和转染 人淋巴瘤细胞系Raji用购自美国Gibco公司含100 ml/L胎牛血清(fetal bovine serum,FBS)的1640培养基,置于温度37℃、50 ml/L二氧化碳CO2细胞培养箱中培养。当细胞密度达70%后,将LncRNA-ATB-shRNA及LncRNAATB NC经LipofectamineTM2000转入Raji细胞中,具体操作步骤参见脂质体试剂说明书。将转染后结肠癌细胞分别为LncRNA-ATB-shRNA组和Lnc RNA-ATB NC组。
1.2.2 实时荧光定量聚合酶链反应(qRT-PCR)待细胞转染48 h后,收集细胞,用Trizol裂解Raji细胞,分别提取细胞总RNA,逆转录以cDNA为模板。qRT-PCR的反应条件为:95℃预变性5 min,95℃变性10 s,60℃退火30 s,共35个循环,实验重复3次。
1.2.3 MTT 细胞转染48h后,取对数生长期的Raji细胞,制备单细胞悬液,以5.0×103/孔细胞密度接种于96孔板,每组设8个复孔,分别培养1~6 d,每孔加入20 μl浓度为1.5 g/L的MTT,培养4 h后每孔加入150μl甲基亚砜(dimethyl sulfoxide,DMSO),读取吸光度值,绘制细胞生长曲线。
1.2.4 流式细胞术 取转染48 h后的处理组细胞及对照细胞,用5 ml磷酸盐缓冲液(phosphate buffered saline,PBS),1000r/min离心5min,反复洗涤3次后,弃上清液;加入100 μl流式洗液和异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的Annexin-V (20 μg/ml)10 μl,室温避光30 min,再加入蛋白酶抑制剂(protease inhibitor,PI)(50μg/ml)5μl,避光反应10 min后,加入400 μl流式洗液,尼龙膜过滤细胞,除去细胞团块后,立即利用流式细胞仪检测。如检测细胞凋亡,处理后同时以加入FITC标记的Annexin-V和PI的同型对照抗体细胞作为对照,尼龙膜过滤细胞,除去细胞团块后,立即利用流式细胞仪检测。
1.3 统计学方法
数据分析采用SPSS 22.0统计软件,计量资料以均数±标准差(±s)表示,两组间的数据比较用t检验,多组间重复测量数据比较用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 LncRNA-ATB-shRNA
下调Raji细胞中LncRNA-ATB的表达转染LncRNA-ATB-NC(LncATB-NC)及LncRNA-ATB-shRNA(Lnc-ATB-shRNA)于Raji细胞48 h后,分别提取两组细胞总RNA,各自逆转录为cDNA,qRT-PCR检测两组间LncRNA-ATB的相对表达量,结果显示,qRT-PCR结果标准化后,LncRNA-ATB-NC组LncRNA-ATB表达量为(1.000± 0.050),则LncRNA-ATB-shRNA组LncRNA-ATB表达量为(0.381±0.083),经t检验,两组差异有统计学意义(t=7.346,P=0.007),LncRNA-ATB-shRNA组中LncRNA-ATB表达较LncRNA-ATB-NC组下调。见图1。
2.2 LncRNA-ATB-shRNA抑制Raji细胞的增殖
MTT检测转染LncRNA-ATB-NC与LncRNA-
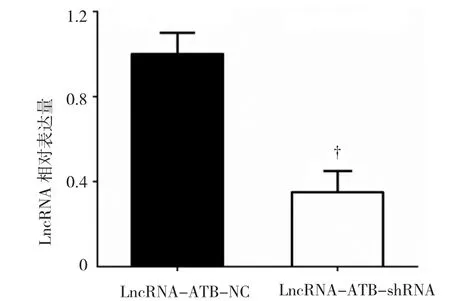
图1 转染LncRNA-ATB-shRNA和NC的Raji细胞中LncRNA-ATB表达水平
ATB-shRNA的Raji细胞的增殖情况。结果显示:①不同时间点的OD值有差异(F=11.251,P=0.003)。②LncRNA-ATB-shRNA组与LncRNA-ATB-NC组与LncRNA-ATB-shRNA的Raji细胞的细胞凋亡情况,结果可见,LncRNA-ATB-NC组凋亡细胞百分比为(3.741±1.331)%,LncRNA-ATB-shRNA组凋亡细胞百分比为(11.517±4.319)%,经t检验,两组差异有统计学意义(t=6.448,P=0.021),见图3。Lnc RNA-ATB-shRNA组的Raji细胞的凋亡细胞数目较LncRNA-ATB-NC组增加。的OD值有差异(F=21.126,P=0.001),LncRNAATB-shRNA组与LncRNA-ATB-NC组相比在OD值较低,增殖速度较慢。③LncRNA-ATB-shRNA组与LncRNA-ATB-NC组的OD值变化趋势有差异(F=11.119,P=0.007)见附表和图2。从检测后第3天开始,LncRNA-ATB-shRNA组细胞的增殖较对照组出现增殖抑制的现象。
2.3 LncRNA-ATB-shRNA促进Raj细胞的凋亡
流式细胞术检测分别转染LncRNA-ATB-NC

图2 转染LncRNA-ATB-shRNA与NC的Raji细胞的增殖情况
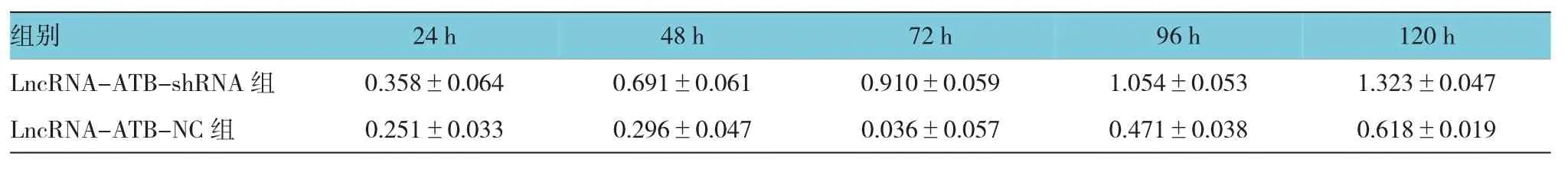
附表 两组各时间点OD值比较 (n=3)
2.4 LncRNA-ATB-shRNA阻滞Raji细胞周期
流式细胞术检测分别转染LncRNA-ATB-NC 与LncRNA-ATB-shRNA的Raji细胞的细胞周期情况,结果可见,LncRNA-ATB-NC组G1期细胞百分比为(39.564±3.194)%,LncRNA-ATB-shRNA组G1期细胞百分比为(53.451±6.179)%,经t检验,两组差异有统计学意义(t=3.153,P=0.037),见图4。LncRNA-ATB-shRNA组的Raji细胞的G1期细胞数目较LncRNA-ATB-NC组增加。
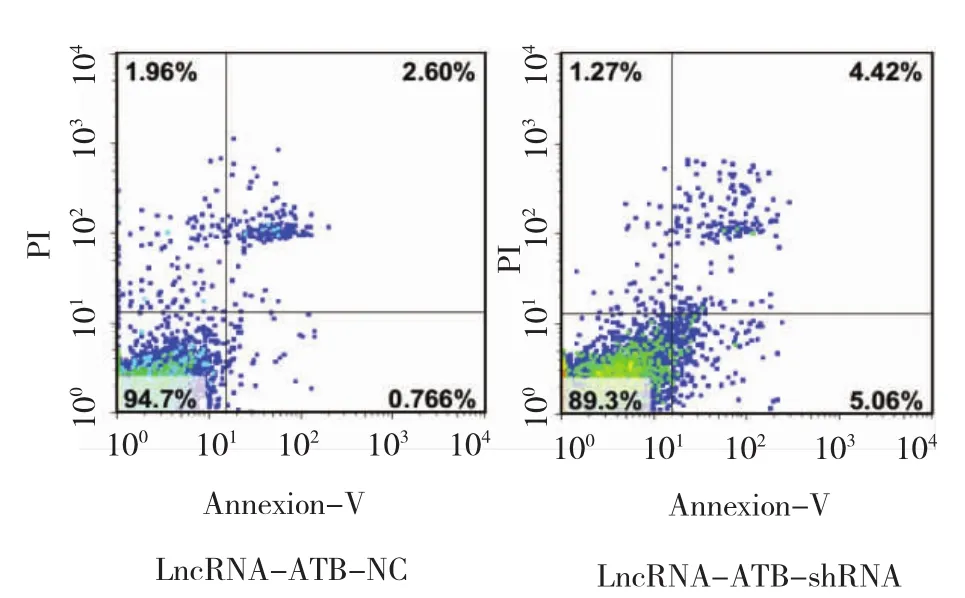
图3转染LncRNA-ATB-shRNA与LncRNA-ATB-NC 的Raji细胞的凋亡情况

图4转染LncRNA-ATB-shRNA与LncRNA-ATB-NC的Raji细胞周期情况
2.5 Raji细胞LncRNA-ATB可调控miR-200c的表达
qRT-PCR检测转染LncRNA-ATB-NC与Lnc RNA-ATB-shRNA的Raji细胞中miR-200c的表达,以及转染miR-200c-NC与miR-200c-mimics的Raji细胞中LncRNA-ATB的表达。结果显示,qRTPCR结果标准化后,LncRNA-ATB-NC组miR-200c表达量为(1.000±0.050),则LncRNA-ATB-shRNA 组LncRNA-ATB表达量为(3.319±0.013),经t检验,两组差异有统计学意义(t=10.473,P=0.011),见图5A。转染LncRNA-ATB-shRNA组的Raji细胞miR-200c的表达比LncRNA-ATB-NC组增加。而转染miR-200c-NC与 miR-200c mimics的 Raji细胞LncRNA表达无变化(t=0.795,P=0.597),见图5B。结果提示在淋巴瘤细胞系Raji细胞中LncRNA-ATB可调控miR-200c的表达。
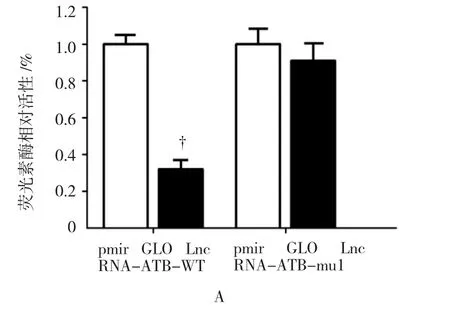
2.6 miR-200c靶向抑制KRAS
上述结果提示,LncRNA-ATB可能作为ceRNA调控miR-200c的表达而参与淋巴瘤的发生、发展,因此,进一步检测Raji细胞中miR-200c的靶基因。经查阅既往文献及网站预测,选取增殖相关基因KRAS作为下一步的研究重点[12-13]。Luciferase结果显示,在淋巴瘤细胞Raji中KRAS为miR-200c直接靶基因(见图6A)。结果显示,qRT-PCR结果标准化后,miR-200c-NC组KRAS表达量为(1.000± 0.050),则 miR-200c mimics组KRAS表达量为(0.347±0.107),经t检验,两组差异有统计学意义(t=4.195,P=0.027),见图6B。miR-200c-mimics组的Raji细胞中KRAS的表达较miR-200c-NC降低。结果提示,在淋巴瘤Raji细胞中miR-200c可直接靶向抑制增殖相关基因KRAS的表达。

图5 淋巴瘤Raji细胞中LncRNA-ATB与miR-200c的相互作用关系
2.7 Raji细胞LncRNA-ATB可调控KRAS的表达本研究利用qRT-PCR及Western blot检测转染LncRNA-ATB-NC与 LncRNA-ATB-shRNA的Raji细胞中KRAS的表达。结果显示,qRT-PCR结果标准化后,LncRNA-ATB-NC组KRAS表达量为(1.000±0.050),则LncRNA-ATB-shRNA组KRAS表达量为(0.547±0.047),经t检验,两组差异有统计学意义(t=3.198,P=0.41),见图7。LncRNA-ATB-shRNA组的Raji细胞KRAS的表达较LncRNA-ATBNC组降低。结果提示,淋巴瘤Raji细胞中,LncRNAATB可竞争性地上调KRAS的表达而促进淋巴瘤的增殖。

图6 淋巴瘤Raji细胞中miR-200c靶向抑制KRAS的表达
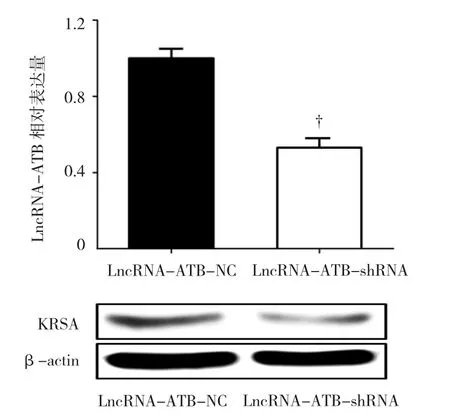
图7 淋巴瘤Raji细胞中沉默LncRNA-ATB抑制KRSA的表达
3 讨论
越来越多的研究证实,LncRNA的异常表达与肿瘤的发生及进展密切相关,其可通过不同机制在不同的调节水平发挥作用,如染色质修饰、转录水平及转录后水平,从而发挥癌基因或抑癌基因的功能。随着2代测序技术的发展,越来越多的长链非编码RNA被证实同淋巴瘤的恶性表型密切相关。研究表明,长链非编码RNA HOTAIR和LUNAR1等均可促进淋巴瘤细胞的增殖并同弥漫性大B淋巴瘤的不良预后呈正相关[14-15]。由Notch活性调控的长链非编码RNA LUNAR1可增强IGF1R mRNA的表达并维持IGF1信号,因此,LUNAR1对T细胞急性淋巴细胞白血病体内和体外的增殖至关重要[16]。但恶性淋巴瘤特异性的长链非编码RNA的相关研究仍较少,由于LncRNA具有高度组织特异性和时空特异性,目前急需进一步挖掘更多的与淋巴瘤发生及进展密切相关的LncRNA。LncRNA-ATB是新近鉴定出的可被TGF-β活化的长链非编码RNA,可介导TGF-β的促转移作用[11]。在胰腺癌[17]、结直肠癌[10]和前列腺癌等[18]多种实体肿瘤内异常高表达,且与恶性肿瘤的不良预后密切相关,提示其可参与调控肿瘤的发生、发展,但其生理功能和作用机制尚不完全清楚。然而,关于LncRNA-ATB在血液系统肿瘤尤其是恶性淋巴瘤发生、进展中的研究,目前国内外尚无相关报道。
本研究发现,沉默淋巴瘤Raji细胞LncRNA-ATB表达后,Raji细胞的增殖受到抑制,而凋亡能力则增加,此外其细胞周期亦阻滞于G1期,提示LncRNAATB可促进淋巴瘤细胞的增殖。既往文献报道,LncRNA-ATB可在多种肿瘤细胞及瘢痕疙瘩成纤维细胞中作为竞争性内源性RNA与miR-200c结合[19-20]。为寻找进一步的机制,笔者检测Raji细胞中LncRNA-ATB与miR-200c的关系。结果显示,LncRNA-ATB可调控miR-200c的表达,而miR-200c的表达则对LncRNA-ATB的表达无影响。上述结果提示LncRNA-ATB在淋巴瘤Raji细胞中亦作为ceRNA与miR-200c竞争性地调控其下游通路。
KRAS基因又称为GTP酶KRA,于人类11、12及1号染色体定位。KRAS基因是一类癌基因,编码大小为21kD的RAS蛋白,其具有GTP酶活性[21]。当原癌基因的RAS基因激活变为癌基因时,其表达产物KRAS蛋白的构型和功能亦发生相应改变,活化的KRAS蛋白可持续性地激活下游信号通路,使细胞不可控制地增殖[22-23]。在淋巴瘤患者中约有10%的患者KRAS基因发生突变[24],当KRAS突变后,将导致细胞内细胞传导系统紊乱,细胞增殖失控而导致癌变。本研究结果显示,在淋巴瘤Raji细胞中KRAS为miR-200c的直接靶分子,而LncRNA-ATB可作为miR-200c的ceRNA竞争性地上调KRAS的表达,从而促进淋巴瘤细胞增殖。
综上所述,本研究利用RNA干扰技术沉默Raji细胞中LncRNA-ATB的表达,检测LncRNA-ATB在Raji细胞增殖、凋亡和周期中的作用及潜在机制。研究发现,沉默LncRNA-ATB表达可以抑制Raji细胞增殖,而促进结肠癌细胞的凋亡,并使细胞周期阻滞于G1期。其可能的潜在机制为LncRNA-ATB作为ceRNA与miR-200c竞争性地调控KRAS的表达。本研究为LncRNA-ATB在淋巴瘤细胞恶性增殖过程中的分子机制相关研究提供一定的前期基础,为进一步研究LncRNA-ATB在淋巴瘤发生、发展中的作用提供理论基础,为淋巴瘤的治疗提供新的分子靶标。
[1] 张欣,王洁,艾丽梅.783例淋巴瘤患者流行病学分析[J].现代预防医学,2013,40(20):3908-3912.
[2] 李小秋,李甘地,高子芬,等.中国淋巴瘤亚型分布:国内多中心性病例10002例分析[J].诊断学理论与实践,2012,11(2):111-115.
[3] 李禹兵,刘延香,路喻清.非霍奇金淋巴瘤的研究进展[J].现代肿瘤医学,2010,18(3):620-624.
[4] WAPINSKI O,CHANG H Y.Long noncoding RNAs and human disease[J].Trends Cell Biol,2011,21(6):354-361.
[5] KOGO R,SHIMAMURA T,MIMORI K,et al.Long noncoding RNA HOTAIR regulates polycomb-dependent chromatin modification and is associated with poor prognosis in colorectal cancers[J]. Cancer Res,2011,71(20):6320-6326.
[6] PONTING C P,OLIVER P L,REIK W.Evolution and functions of long noncoding RNAs[J].Cell,2009,136(4):629-641.
[7] SUN Y W,CHEN Y F,LI J,et al.A novel long non-coding RNA ENST00000480739 suppressestumourcellinvasion by regulating OS-9 and HIF-1alpha in pancreatic ductal adenocarcinoma[J].Br J Cancer,2014,111(11):2131-2141.
[8] ZHANG C Y,LI R K,QI Y,et al.Upregulation of long noncoding RNA SPRY4-IT1 promotes metastasis of esophageal squamouscellcarcinoma via induction ofepithelial-mesenchymal transition[J].Cell Biol Toxicol,2016,32(391):1-11.
[9] LI W,KANG Y.A new long noncoding in metastasis:long noncoding RNA mediates the prometastatic functions of TGF-beta[J]. Cancer Cell,2014,25(5):557-559.
[10] IGUCHI T,UCHI R,NAMBARA S,et al.A long noncoding RNA,lncRNA-ATB,is involved in the progression and progno sis of colorectal cancer[J].Anticancer Res,2015,35(3):1385-1388.
[11] YUAN J H,YANG F,WANG F,et al.A long noncoding RNA activated by TGF-beta promotes the invasion-metastasis cascade in hepatocellular carcinoma[J].Cancer Cell,2014,25(5):666-681.
[12] SONG C,LIU L Z,PEI X Q,et al.miR-200c inhibits breast cancer proliferation by targeting KRAS[J].Oncotarget,2015,6(33): 34968-34978.
[13] KOPP F,WAGNER E,ROIDL A.The proto-oncogene KRAS is targeted by miR-200c[J].Oncotarget,2014,5(1):185-195.
[14] YAN Y,HAN J,LI Z,et al.Elevated RNA expression of long noncoding HOTAIR promotes cell proliferation and predicts a poor prognosis in patients with diffuse large B cell lymphoma[J]. Mol Med Rep,2016,13(6):5125-5131.
[15] PENG W,FENG J.Long noncoding RNA LUNAR1 associates with cell proliferation and predicts a poor prognosis in diffuse large B-cell lymphoma[J].Biomed Pharmacother,2016(77):65-71.
[16] TRIMARCHI T,BILAL E,NTZIACHRISTOS P,et al.Genomewide mapping and characterization of Notch-regulated long non coding RNAs in acute leukemia[J].Cell,2014,158(3):593-606.
[17] QU S,YANG X,SONG W,et al.Downregulation of lncRNAATB correlates with clinical progression and unfavorable prog nosis in pancreatic cancer[J].Tumour Biol,2016,37(3):3933-3938.
[18] XU S,YI X M,TANG C P,et al.Long non-coding RNA ATB promotes growth and epithelial-mesenchymal transition and predicts poor prognosis in human prostate carcinoma[J].Oncol Rep, 2016,36(1):10-22.
[19] SAITO T,KURASHIGE J,NAMBARA S,et al.A long noncoding RNA activated by transforming growth factor-beta is an independent prognostic marker of gastric cancer[J].Ann Surg Oncol,2015,22 Suppl 3(3):915-922.
[20] ZHU H Y,BAI W D,LI C,et al.Knockdown of lncRNA-ATB suppresses autocrine secretion of TGF-beta2 by targeting ZNF217 via miR-200c in keloid fibroblasts[J].Sci Rep,2016(6): 24728.
[21] MCCUBREY J A,STEELMAN L S,CHAPPELL W H,et al. Roles of the Raf/MEK/ERK pathway in cell growth,malignant transformation and drug resistance[J].Biochim Biophys Acta, 2007,1773(8):1263-1284.
[22] CAMPBEL P M,GROEHLER A L,LEE K M,et al.K-Ras promotes growth transformation and invasion of immortalized human pancreatic cells by Raf and phosphatidylinositol 3-kinase signaling[J].Cancer Res,2007,67(5):2098-2106.
[23] DOWNWARD J.Targeting RAS signalling pathways in cancer therapy[J].Nat Rev Cancer,2003,3(1):11-22.
[24] VON LINTIG F C,HUVAR I,LAW P,et al.Ras activation in normal white blood cells and childhood acute lymphoblastic leukemia[J].Clin Cancer Res,2000,6(5):1804-1810.
Effect of LncRNA-ATB on proliferation,apoptosis and cell cycle of Raji cell
Wei Zhao1,Xiao-ming Li2
(1.Southwest Medical University,Luzhou,Sichuan 646000,China;2.Department of Hematology,the Affiliated Hospital of Southwest Medical University, Luzhou,Sichuan 646000,China)
Objective To investigate effects of long non-coding RNA activated by TGF-β (LncRNA-ATB) on cell proliferation,apoptosis,and cell cycle of human lymphoma Raji cell. Methods The efficiency of LncRNA-ATB shRNA,miR-200c mimics,and the expressions of LncRNA-ATB,miR-200c,and KRAS were detected by quantitative real time PCR (qRT-PCR).The cell proliferation of Raji transfected with LncRNAATB shRNA and NC were analyzed by MTT assays,and the cell apoptosis and cell cycle of Raji cells transfected with LncRNA-ATB shRNA and NC were analyzed by flow cytometry.Luciferase assays were performed to detect whether KRAS was the direct target of miR-200c.Results The expression of LncRNA-ATB could be effectively silenced by LncRNA-ATB-shRNA.Compared with Raji cells transfected with LncRNAATB-NC,cell proliferation significantly inhibited in Raji cells transfected with LncRNA-ATB-shRNA,but cells apoptosis was significantly promoted.Cell cycle was arrested at G1 phage in Raji cells transfected with LncRNA-ATB-shRNA.Further investigation found that LncRNA-ATB could promote the proliferation of Raji cells and function as ceRNA to upregulate the expression of KRAS by competed with miR-200c.Conclusions LncRNA-ATB may play an important role in the proliferation,apoptosis and cell cycle of Raji cells by upreg-ulating the expression of KRAS.
LncRNA-ATB;Raji cell;kirsten rat sarcoma viral oncogene;miR-200c;proliferation
R733.4
A
10.3969/j.issn.1005-8982.2017.05.004
1005-8982(2017)05-0018-06
2016-06-07
李晓明,E-mail:lxm6358@21cn.com
