负载牙周祖细胞的钛种植体治疗单根牙缺失的实验研究
2017-04-08刘艳玲牟雁东
刘艳玲,牟雁东
(西南医科大学 口腔医学院,四川 泸州 646000)
负载牙周祖细胞的钛种植体治疗单根牙缺失的实验研究
刘艳玲,牟雁东
(西南医科大学 口腔医学院,四川 泸州 646000)
目的 探讨自体牙祖细胞在钛种植体表面形成生物工程牙周组织的能力。方法 拔除Lewis大鼠下颌第一磨牙(M1)和第二磨牙(M2),收获和培养牙周祖细胞。检测体外培养的牙周祖细胞的增殖、碱性磷酸酶活性、克隆形成能力及分化能力。制作含牙周祖细胞的钛种植体,并植入宿主大鼠M1磨牙拔除处。评价生物工程牙周组织的形态和组织学特征。结果 源自牙髓细胞(DPCs)的软牙周膜(PDL)表现出高增殖率、克隆形成力、脂肪,骨及神经元细胞分化能力等生物学特性。生物工程牙周组织在钛种植体表面形成骨质样组织,伴有贯穿纤维的PDL组织纵向插入种植体。结论 源自DPCs的PDL能够用于下颌钛种植体上自体PDL组织再生。
牙周膜;生物工程组织;钛种植体
目前,用于提升钛种植体性能和延长使用时间的主要方法包括:改变种植体表面形状和构造、改变控制细胞行为的表面构型、覆盖纳米结构的覆盖物及使用生长因子等[1-3]。种植体与牙周骨组织的直接紧密结合被称之为骨整合现象。骨融合是目前临床上使用较为理想的一种种植体/骨表面,其本质是形成的牙齿通过软牙周膜(periodontal ligament,PDL)组织吸附到周围的牙槽骨[4-6]。种植体植入后与牙槽骨形成骨性结合是种植体行使功能的生物学基础,种植体能否种植成功与早期种植体表面骨融合形成密切相关。种植完成后能否促使钛种植体与人体体液及组织相互作用,并在种植体表面产生骨性结合,是种植体能否产生良好生物相容性的关键。LE GUÉHENNECL等[6]将骨融合定义为直接使骨种植体在无结缔组织层干扰情况下与骨接触。骨融合是比牙龈软组织结合更为重要的一种生物固定,是义齿种植及其长期有效的前提。源自PDL的祖细胞具有自我更新、多向分化及参与牙周组织再生的功能,因此在PDL组织工程中应用源自PDL的祖细胞是治疗牙周疾病的潜在有效方法[7-8]。PDL再生的先决条件是能够在口腔环境中原位传递具有增殖和分化的PDL祖细胞。PDL组织工程中使用的支架材料通常要求具有组织相容性、生物降解性、细胞黏附、传递生长因子和机械稳定性等特性。基质胶是基底膜基质,广泛用于细胞分化研究,本研究拟探讨在钛种植体表面采用基质胶直接形成功能性PDL组织的可行性,以期为临床治疗提供新思路。
1 材料与方法
1.1 大鼠上颌磨牙拔除术及牙周组织收获和细胞培养
麻醉状态下,拔除21只6~8周龄LEWIS大鼠下颌第一磨牙(M1)和第二磨牙(M2)后,每天皮下注射姑息性镇痛药2次,饮用水中也加入镇痛药,连续3d,并采用软食喂养。
收集拔除的磨牙和相应牙周软组织,并用灭菌汉克平衡盐缓冲液(Hank'balanced salt solution,HBSS)平衡盐缓冲液冲洗。将牙根置于50 ml含0.67 mg/ml胶原酶Ⅱ和0.3 mg/ml中性蛋白酶的HBSS中37℃孵育1 h,收集原代细胞。原代细胞用含20%小牛血清、2.0 mg/ml胶原酶Ⅰ及0.25%胰蛋白酶的DMEM高糖培养基37℃孵育消化1.5 h,HBSS冲洗细胞,40μm细胞滤网过滤,随后将细胞重悬于含 20%小牛血清、100 u/ml青霉素及100μg/ml链霉素的DMEM高糖培基中,5%二氧化碳CO2及37℃条件中培养,每2~3 d更换1次新鲜培基。
1.2 大鼠PDL细胞增殖和碱性磷酸酶活性(alkaline phosphatase,ALP)及细胞克隆形成分析
大鼠PDL细胞增殖情况采用Pico Green dsDNA quantification kit(美国themofisher公司)进行检测,并且实验独立重复进行3次。取80 μl标本、100μl磷酸对硝基苯酯及20 μl 2-氨基-2-甲基-1-丙醇混匀,37℃孵育1 h,检测405 nm波长处OD值,通过与4-硝基苯酚405 nm波长处OD值标准曲线比较,计算标本中ALP含量。
收获大鼠PDL细胞,以2 000个/孔浓度接种于25 cm2细胞培养瓶,用含20%小牛血清的DMEM培基培养细胞分别培养1、2及3周,10%甲醛固定细胞,结晶紫染色。当细胞克隆直径>2 mm时,计为细胞克隆,实验重复进行5次。
1.3 PDL细胞分化潜能分析
成脂诱导分化培养基包含5mmol 3-异丁基-1-甲基黄嘌呤(isobutyl-methylxanthine,IBMX),1 mmol地塞米松,10 mmol胰岛素,200 mmol吲哚美辛和50 mg/ml庆大霉素。神经性分化培养基包含10 mmol基底膜提取物(BME),2%二甲亚砜和200 mmol丁羧基苯甲醚(butylated hydroxyanisole,BHA)。促成骨分化培养基含5 mmol/L磷酸二氢钾(KH2PO3)、10-8mol/L地塞米松、50mg/ml L-抗坏血酸和50mg/ml庆大霉素。
1.4 免疫组织化学分析
通过免疫组织化学检测骨唾液酸蛋白(Bone sialoprotein,BSP)、牙本质涎磷蛋白(Dentin sialophosphoprotein,DSPP)、基质细胞抗原(stromal cell antigen-1,STRO-1)及骨钙素(Osteocalcin,OCN)评估大鼠PDL细胞分化状况,免疫组织化学检测采用Vectastain ABC(美国Vector公司)染色试剂盒和快绿复染。
1.5 实时荧光定量聚合酶链反应(quantitative real time polymerase chain-reaction,qRT-PCR)
Trizol(上海生物工程股份有限公司)试剂提取对照和分化组PDL细胞qRT-PCR,高保真互补脱氧核糖核酸(cDNA)逆转录试剂盒将信使核糖核酸(messenger ribonucleic acid,mRNA)逆转录为cDNA。ABI Prism 7000型定量PCR仪(美国ABI公司)和Assays-on-DemandTM(美国TaqMan公司)基因表达试剂盒检测BSP、DSPP、骨膜蛋白(Periostin,PN)及甘油醛-3-磷酸脱氢酶(GAPDH)的表达。
1.6 种植体制作、制备、植入、收获及处理
表面涂层种植体(2.0 mm×1.5 mm)采用大颗粒喷砂酸蚀处理。牙槽骨暴露后,用球钻(直径1.4 mm)和定制牙钻(直径1.5 mm)准备植入位点,2 mm时自动停止。P3收集P3培养的大鼠PDL细胞,重悬于基质胶,每个定制的1.7 mm直径模孔加入2μl (1×106个细胞)。将种植体也植入定制模孔,37℃加热1 h,使基质胶固化,固化完成后,种植体表面覆盖0.5 mm厚的基质胶,能够耐受压力。由于种植体十分稳定,种植床制备时要求在种植过程中避免摩擦。定制模孔中分别放入至加入基质胶作为对照组。每只拔除M1磨牙的大鼠右侧种植细胞移植体,左侧种植阴性对照移植体。
分离鼠下颚,用10%福尔马林固定。其中7只大鼠下颌骨脱水,树脂渗透包埋,150μm切片,砂纸盘抛光至35~50μm,最后用氧化铝抛光膏抛光至0.3μm,荧光和组织形态学分析后,Stevenel's blue 和Van Geison's picro-fuschin(这个目前也无中文名称)联合染色。余下14只未脱钙大鼠下颌骨种植体采用甲基丙烯酸甲酯进行塑料包埋,400μm厚度纵向切片,抛光至150μm,甲苯胺蓝和碱性复红染色。
1.7 生物工程PDL组织形态学和组织形态学评价
荧光显微镜下观察种植体切片形态,并直接评估种植体和骨整合率。
1.8 统计学分析
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,采用t检验进行比较,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠PDL细胞特征
第3代大鼠PDL细胞持续增长>33d(见图1A)。第3代PDL细胞ALP活性在培养前20 d持续升高,第20只30 d呈下降趋势(见图1B)。第1代和第2代大鼠PDL DPCs形成的菌落形成单位(colonyforming units,CFUs)大致相同,直径在0.5~3.0 mm,随着时间增加,无论是第1代还是第2代PDL细胞,CFUs均下降,第1代PDL第3周CFUs低于第2周和第1周(t=7.823和8.966;P=0.003和0.001),第2周低于第1周(t=5.382,P=0.001)。见图1C。
2.2 大鼠PDL细胞分化
第3代PDL细胞内富含脂质空泡油红O染色阳性,而对照组细胞阴性(见图1F、I)。成骨诱导培基茜素红S染色后,可见富含矿物质的阳性组织,而对照组细胞培养基阴性(见图1G、J)。神经性分化培养基培养的细胞可见神经元阳性细胞体和胞浆延伸,而对照组细胞则没有(见图1H、K)。茜素红S染色定量分析表明成骨诱导培基培养的细胞矿物质含量是对照组的3倍以上(见图1D)。qRT-PCR结果表明,成骨诱导培基培养的PDL细胞中BSP,DSPP和骨膜蛋白表达上升,而成脂诱导分化培养基和神经性分化培养基培养的细胞中骨膜蛋白表达下降(见图1E)。免疫组织化学分析表明,正常培基培基的大鼠PDL DPCs中STRO-1阳性表达率为10%左右(图2A、E),神经元诱导培基培养的细胞神经核抗原(neuronal nuclear antigen,NeuN)表达阳性(见图2B、F),成骨诱导培基培养细胞BSP和DSPP表达阳性(见图2C、D、G、H)。
2.3 钛种植体表面硬组织和软组织形成分析

21例实验和对照种植体中2例种植位点炎症,排除在本次研究之外。8例基质胶覆盖,而未加PDL细胞的种植体中,仅1例出现种植体骨整合,其余7例被血供丰富的肉芽组织围绕。9例基质胶覆盖,且加PDL细胞的种植体中,没有出现种植体骨整合,也未出现血供差,结构完整的PDL样组织形成(见图3 A、B)。单独钛种植体在8周时骨和种植体表面出现肉芽组织,18周时出现骨整合。见图3C。

图1 大鼠PDL细胞体外培养特征

图2 免疫组织化学分析诱导培养的PDL细胞
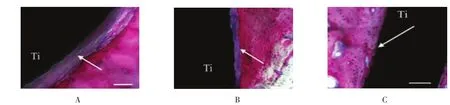
图3 钛种植体表面硬组织和软组织形成情况
3 讨论
1982年,NYMAN等证实PDL细胞能够用于重建粘附于牙齿的结缔组织。还有研究发现,PDL能够沉积于牙骨质,并与胶原共同粘附至牙种植体;PDL还能在真空钛种植体上与骨有机结合,该研究结果提示PDL组织具有再生功能,并表明牙种植体具有新潜能,人类中自体PDL组织再生潜能[9-10]。本实验利用源自大鼠磨牙牙根的自体PDL细胞在下颌中植入的钛种植体上重建PDL组织。以往大量研究对源自DPC的PDL细胞自我更新、克隆形成、分化及在牙骨质和周围牙槽骨间重建结缔组织的能力[11-13]。
本研究结果表明基质胶、富含基本细胞外基质成分的三维生物基质支架能够在钛种植体和牙槽骨表面形成大鼠PDL再生组织。尽管只有10%的PDL细胞实验种植体形成生物工程牙骨质样组织,并伴有垂直于种植体表面的胶原纤维,与自然形成的PDL组织类似,结果提示合适的胶原纤维分布有利于后续牙骨质组织形成。21例种植体中2例发生种植体周围感染,但是由于人类口腔卫生保持良好、采用抗炎治疗及种植体位点保护等原因,笔者预计人类中软组织收口愈合效果会优于动物实验结果。
本研究结果表明,源自DPCs的PDL能够用于下颌钛种植体上自体PDL组织再生。源自DPCs的PDL表现出高增殖率、克隆形成力、脂肪,骨及神经元细胞分化能力等生物学特性。生物工程牙周组织在钛种植体表面形成骨质样组织,伴有贯穿纤维的PDL组织纵向插入种植体。总之,本研究证实覆盖于钛种植体表面的含有自体细胞的生物工程牙周组织能够修复牙体缺损。
[1] BROOKS A N,KILGOUR E,SMITH P D.Molecular pathways: fibroblast growth factor signaling:a new therapeutic opportunity in cancer[J].Clinical Cancer Research,2012,18(18):1855-1862. [2]L’HÔTE C G,KNOWLES M A.Cell responses to FGFR3 signalling:growth,differentiation and apoptosis[J].Experimental Cell Research,2005,304(304):417-431.
[3] DANIELE G,CORRAL J,MOLIFE L R,et al.FGF receptor inhibitors:role in cancer therapy[J].Current Oncology Reports, 2012,14(2):111-119.
[4] DIENSTMANN R,RODON J,PRAT A,et al.Editor's choice: genomic aberrations in the FGFR pathway:opportunities for targeted therapies in solid tumors[J].Annals of Oncology,2014,25(3): 552-563.
[5] DIECI M V,ARNEDOS M,ANDRE F,et al.Fibroblast growth factor receptor inhibitors as a cancer treatment:from a biologic rationale to medical perspectives[J].Cancer Discovery,2013,3(3): 264-279.
[6] LE GUÉHENNEC L,SOUEIDAN A,LAYROLLE P,et al.Surface treatments of titanium dental implants for rapid osseolntegration[J].Dent Mater,2007,23(7):844-854.
[7] PULTE D,BRENNER H.Changes in survival in head and neck cancers in the late 20th and early 21st century:a period analysis[J].Oncologist,2010,15(9):994-1001.
[8] KANG H,KIESS A,CHUNG C H.Emerging biomarkers in head and neck cancer in the era of genomics[J].Nature Reviews Clinical Oncology,2015,12(1):11-26.
[9] 谢成婕,北垣次郎太,村上伸也.一种蛋白酶体阻断剂对牙周膜细胞生物学性能的影响[J].广东牙病防治,2014,22(11):568-572.
[10] KEMPEN P M W V,BOCKEL L V,BRAUNIUS W W,et al. HPV-positive oropharyngeal squamous cell carcinoma is associated with TIMP3 and CADM1 promoterhypermethylation[J]. Cancer Medicine,2014,3(5):1185-1196.
[11] HUGHES S E.Differential expression of the fibroblast growth factor receptor (FGFR)multigene family in normal human adult tissues[J].Journal of Histochemistry& Cytochemistry Official Journal of the Histochemistry Society,1997,45(7):1005-1019.
[12] 王晓阳.纤维结合蛋白促进牙周组织再生的细胞学特征[J].中国组织工程研究,2003,7(29):4001-4001.
[13] SCHMITZ K,SCHILDHAUS H U,HEUKAMP L C,et al.Definition of a fluorescence in situ hybridization score identifies high-and low-level FGFR1 amplification types in squamous cell lung cancer[J].Lung Cancer,2012,77(11):1473.
Effect of bioengineered periodontal tissue on titanium dental implant
Yan-ling Liu,Yan-dong Mu
(School of Stomatology,Southwest Medical University,Luzhou,Sichuan 646000,China)
Objective To investigate the ability of autologous dental progenitor formed bioengineered periodontal tissue on titanium dental implants.Methods The Lewis rats maxillary first and second molars(M1 and M2)were extracted and the periodontal ligament(PDL)-derived dental progenitor cells(DPCs)were harvested and cultured.The proliferation,alkaline phosphatase activity,colony-forming and differentiation potential of DPCs were detected.Implants were prepared by DPC,and placed at the healed M1 extraction site of each rat host.Bioengineered PDL tissues were evaluated morphologically and histomorphometricly.Results Cultured PDL-derived DPCs exhibited high proliferation rates,clonogenicity,and adipose,bone,and neural cell differentiation.Bioengineered periodontal tissues formed cementum-like tissue on the titanium implant surface.PDL tissue with sharpey's fibers inserted perpendicular to the implant.Conculsions PDL-derived DPCs could potentially be used to regenerate autologous PDL tissues on titanium implants grown in the jaw.
periodontal ligament;bioengineered tissue;titanium dental implant
R782.12
A
10.3969/j.issn.1005-8982.2017.05.003
1005-8982(2017)05-0013-05
2016-11-14
牟雁东,E-mail:995448060@qq.com
