贵州主要发酵豆制品加工中丙烯酰胺形成动态
2017-04-07文安燕张帅曾海英秦礼康
文安燕,张帅,曾海英,2,秦礼康*
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州省农畜产品贮藏与加工重点实验室,贵州贵阳550025)
贵州主要发酵豆制品加工中丙烯酰胺形成动态
文安燕1,张帅1,曾海英1,2,秦礼康1*
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州省农畜产品贮藏与加工重点实验室,贵州贵阳550025)
以水豆豉、黑豆豉、豆瓣酱及腐乳等贵州主要发酵豆制品为试材,采用高效液相色谱-串联质谱(HPLC-MS/MS)方法,测定其各生产阶段的丙烯酰胺含量。结果表明,在发酵前的热处理环节中,均无丙烯酰胺形成;但发酵开始,随着发酵过程的延伸,丙烯酰胺的含量呈上升趋势。到发酵结束时,黑豆豉、水豆豉、豆瓣酱及腐乳样品中丙烯酰胺含量分别达(15040±191)μg/kg、(16496±204)μg/kg、(16 821±45)μg/kg及(5 655±24)μg/kg,表明低温发酵的豆制品体系中会形成大量丙烯酰胺,存在一定食用安全风险。
丙烯酰胺;高效液相色谱-串联质谱;发酵豆制品
近年来,丙烯酰胺(acrylamide,AA)作为一种神经毒性、遗传毒性和致癌性化合物,被国际癌症机构(Interna tional Agencyfor Research on Cancer,IARC)列为2A类致癌物[1],倍受国内外学者关注。自2002年4月瑞典斯德哥尔摩大学首次在油炸或焙烤的淀粉类食品中发现了含量高达12 800 μg/kg的丙烯酰胺后[2],各国食品安全研究机构对不同食品中丙烯酰胺的形成予以了极大关注,并对丙烯酰胺在食品中的分析检测[3-5]、形成机理[6-8]、毒理[9-11]和抑制途径[12-14]等方面展开了深入的研究。
目前,对食品中的丙烯酰胺研究主要集中在油炸品、烘烤谷物类、速溶咖啡及茶叶等。大量研究表明,在煎、烤、炸等高温烹饪(>120℃)条件下,天冬酰胺酸与还原糖发生美拉德反应,是产生大量丙烯酰胺的主要途径,同时油脂、蛋白质和碳水化合物等成分在高温条件下会生成丙烯醛进而形成丙烯酰胺[15]。但是,较新的研究发现,在生理学条件下(37℃、pH7.4),天冬酰胺在被氧化的过程中,也能产生丙烯酰胺[16],氨和丙烯醛可在各种温度甚至在室温下反应生成丙烯酰胺[17]。张帅等[18-19]分别采用高效液相色谱-串联质谱法(highperformanceliquidchromatographytandem massspectrometer,HPLC-MS/MS)或气相色谱-串联质谱法(gaschromatographytandemmassspectrometer,GC-MS/MS)测定,豆豉、豆瓣酱、腐乳、酱油等发酵豆制品的丙烯酰胺含量分别达1000~15000μg/kg、400~2000μg/kg、2000~8000μg/kg和5~1 152 μg/kg。
豆豉、酱油、腐乳和豆酱作为我国四大传统大豆发酵食品,其营养保健功能日益引起世界各国食品界和医学界的高度重视[20]。但是,由于豆类发酵品生产工艺的特殊性,发酵过程中易受原料品质波动、杂菌污染以及环境因素的影响,存在较大的安全隐患,如生物胺、病源微生物及其毒素等内源性污染物已被学者大量研究[21-23],可对丙烯酰胺形成动态却罕有报道。因此,本实验采用HPLC-MS/MS方法,对贵州主要发酵豆制品(包括黑豆豉、水豆豉、豆瓣酱及腐乳)不同加工阶段的丙烯酰胺含量进行动态分析,为进一步探讨传统发酵豆制品中丙烯酰胺的形成机制、风险评估以及控制措施提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
实验材料是根据生产工艺特点自贵州省发酵豆制品生产企业进行取样,包括:水豆豉生产中的泡豆、蒸煮、发酵及成品环节;黑豆豉生产中的泡豆、蒸煮、发酵初期、发酵终期及成品环节;豆瓣酱生产中的泡豆、蒸煮、发酵、配料及成品环节;腐乳后发酵期为1个月、3个月以及8个月时的样品。
1.1.2 试剂
丙烯酰胺标准品(纯度>99.8%):美国Sigma公司;13C3-丙烯酰胺标准品(纯度为99%):英国Cambridge Isotope Laboratories;甲醇、甲酸(均为色谱纯):美国Tedia公司;Milli-Q超纯水:Academic超纯水系统制备;乙酸锌、亚铁氰化钾(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
UPLC-TQD Waters高效液相四级杆串联质谱仪、6 mL 200mgOASIS固相萃取柱:美国Waters公司;X-22R冷冻离心机:美国BECKMAN公司;Multi Reax旋涡混合器:德国Heidolph公司。
1.3 方法
1.3.1 丙烯酰胺含量方法检测
在GB 5009.204—2014《食品中丙烯酰胺的测定》的基础上[24],适当调节流动相梯度比例,缩短检测时间,提高检测效率。
(1)标准溶液的配制
丙烯酰胺标准液:准确称取10.00 mg丙烯酰胺标准品,用超纯水溶解并定容在100 mL棕色容量瓶中,配制成100μg/mL的丙烯酰胺标准储备液并至于4℃冰箱中低温保存。分别配制0.01μg/mL、0.05μg/mL、0.1μg/mL、0.2μg/mL、1 μg/mL的AA标准溶液。
内标溶液:准确称取13C3-丙烯酰胺内标标准品10.00mg,用超纯水溶解并定容在100 mL棕色容量瓶中,配制成100 μg/mL的13C3-丙烯酰胺内标标准储备液并于-20℃条件下保存,再取1 mL内标储备液于100 mL容量品种,用超纯水稀释成质量浓度为1 μg/mL的13C3-丙烯酰胺内标液。
(2)样品的前处理
称量与加内标:准确称取样品1.0g于50mL聚丙烯离心管中,精密加入500 μL的13C3-丙烯酰胺内标液(1 μg/mL),静置10 min。
脱脂:向离心管加石油醚20 mL,充分振荡15 min,待均匀分散后弃去石油醚,反复操作两次。
提取:加乙酸锌与亚铁氰化钾各3 mL进行蛋白质沉淀,加入超纯水定容至20 mL,振荡15 min,冷冻离心(4℃、3 600 r/min)15 min,过滤待用。
纯化:HLB固相萃取柱(6mL200mgOASIS)先用5mL甲醇活化和5 mL超纯水平衡,吸取待用液2 mL缓慢通过HLB固相萃取柱,再用1 mL超纯水淋洗,最后用2 mL 40%甲醇水溶液(含有0.01%甲酸)洗脱,收集洗脱液,过0.22 μm水相滤膜。
(3)高效液相色谱条件
色谱柱:ACQUITYUPLCC18HPLC柱(210mm×20mm,1.7 μm);流动相:超纯水∶甲醇=99∶1(其中分别加入0.1%甲酸);柱温:30℃;流速:0.2 mL/min;进样量:5 μL。
(4)质谱条件
离子源:电喷雾ESI+模式;扫描方式:正离子扫描;检测方式:多重反应监测(multiple reaction monitoring,MRM);离子源温度:120℃;脱溶剂气温度:350℃;锥孔电压:20V;质谱跃迁模式:丙烯酰胺(m/z为72.2>55.0,为定量离子对;m/z为72.2>44.0,为定性离子对)能量碰撞为9 eV;13C3-丙烯酰胺(m/z为74.79>58.0,为定性定量离子对)能量碰撞为10 eV。
(5)结果计算
按下式计算试样中AA的含量。
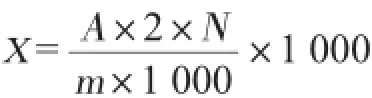
式中:X为样品中丙烯酰胺的含量,μg/kg;A为质谱仪测定的丙烯酰胺的含量,ng/mL;2为待用液过HLB固相萃取柱体积,mL;N为稀释倍数;M为样品质量,g。
以上样品中丙烯酰胺含量的检测均重复检测3次,测定结果用平均值±标准差表示。
2 结果与分析
2.1 丙烯酰胺标准曲线回归方程
将0.01 μg/mL、0.05 μg/mL、0.1 μg/mL、0.2 μg/mL、1 μg/mL标准溶液依次进样,计算标准曲线的回归方程和相关系数,结果见图1。
不同地区有着自己国家不同的文化、生活习惯、语言、工作方式及宗教信仰,我国企业在管理本土化劳务的过程中,一定要对当地人民的生活习惯、文化风俗及宗教信仰等方面的内容进行充分的了解,避免在管理过程中出现纠纷的情况,使事情变得更加复杂[5]。因此,企业劳务管理人员应及时与当地的人民进行沟通,并制定相应的管理办法,提高管理水平。为此,企业应定期加强管理人员及相关工作人员的培训学习,将“以人为本”的管理理念充分融入管理过程中,使我国的管理人员与当地的劳务人员相处的更加融洽。
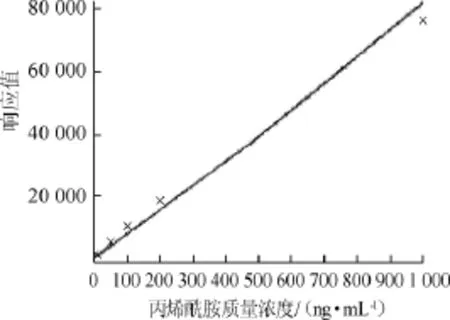
图1 丙烯酰胺标准曲线Fig.1 Standard curve of acrylamide
由图1可知,标准曲线回归方程(Y为响应值,X为试样质量浓度)Y=81.827 6X+415.248,相关系数R2= 0.984 907,该方法在0.01~1 μg/mL都有良好的线性。
2.2 样品前处理
本实验以13C3-丙烯酰胺为内标,质量浓度为1 μg/mL,使用固相萃取柱进行萃取,其中洗脱液(甲醇水溶液)的浓度对回收率影响较大。实验选取3组样品,分别在甲醇体积分数为20%、40%、60%、80%条件下对回收率进行分析,结果见表1。
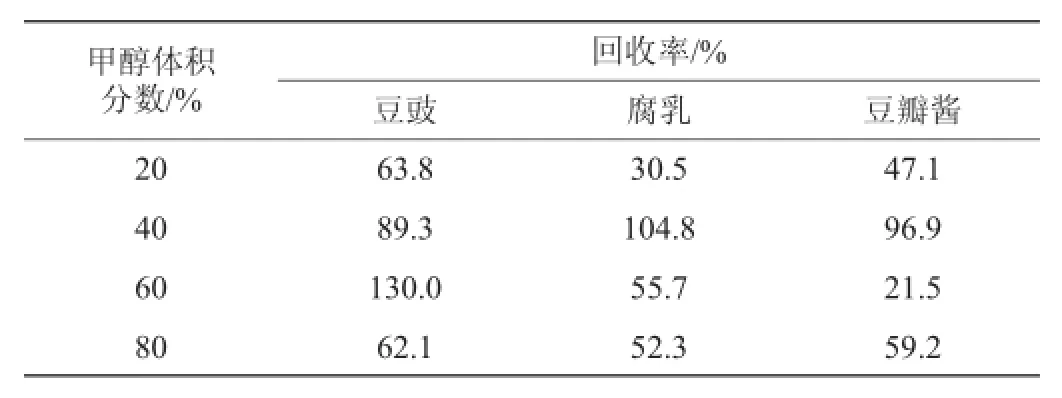
表1 不同洗脱液浓度对回收率的影响Table 1 Effect of different eluent concentration on recovery rates
由表1可知,在甲醇体积分数为40%时3组样品的回收率较好,因此选择甲醇体积分数40%为宜。
2.2 流动相的选择
丙烯酰胺为强极性化合物,在一般反相色谱柱上保留较弱,即使以100%超纯水也很难得到很好的保留,因此实验中选择添加甲酸来改善质谱的离子化效率,同时丙烯酰胺在质谱仪中分解为正离子,这更能提高质谱检测灵敏度[25],并显著提高相应强度。在水相中添加1%甲醇(0.1%甲酸)作为流动相,当用超纯水-甲醇(99∶1,0.1%甲酸)作为流动相时,与其他参考条件[26-27]比较,峰形较好且显著地改善拖尾现象,而且当加大流动相中超纯水的比例时,丙烯酰胺的出峰时间适当地延长从而导致目标峰和杂质峰能够有效分离开。
2.3 质谱条件的确定
2.4 精密度和内标回收率
选择腐乳、豆豉、豆瓣酱3种不同样品基质,分别添加3个不同加标量内标液(13C3-AA1μg/mL、0.5μg/mL、0.1μg/mL)各1mL。各加内标水平测量6次,作为精密度试验。以回收率作为衡量方法的准确度,以相对标准偏差(relative standard deviation,RSD)作为方法的精密度。测定结果见表2。
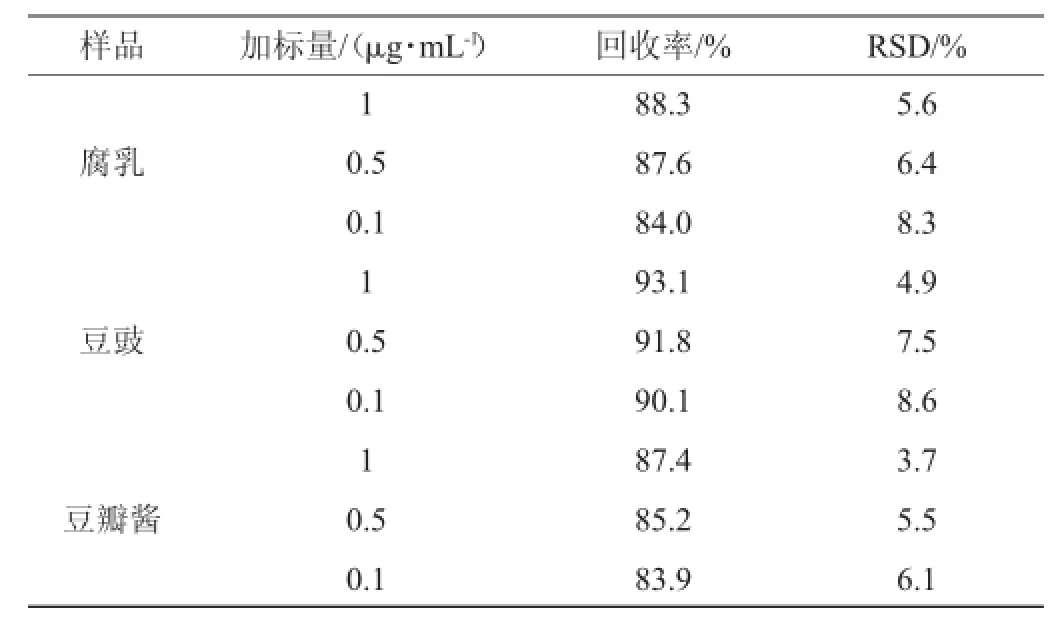
表2 不同样品的回收率实验结果(n=5)Table 2 Results of recovery rates of different samples(n=5)
由表2可知,腐乳的回收率在84.0%~88.3%,平均回收率为86.6%;豆豉的回收率在90.1%~93.1%,平均回收率为91.7%;豆瓣酱的回收率在83.9%~87.4%,平均回收率为85.0%。它们的相对标准偏差(relative standard deviation,RSD)(n=5)为3.7%~8.6%,均在允许范围内,符合残留分析要求。因此,该方法可以用来分析测定腐乳、豆豉以及豆瓣酱中丙烯酰胺的含量。
2.5 发酵豆制品检测结果
使用该方法对水豆豉、黑豆豉、豆瓣酱及腐乳等贵州主要发酵豆制品不同加工阶段的丙烯酰胺的含量进行测量。
2.5.1 水豆豉不同生产阶段丙烯酰胺含量
对水豆豉泡豆、蒸煮、发酵(制曲)和成品阶段的丙烯酰胺含量进行测定,结果见图2。

图2水豆豉不同生产阶段丙烯酰胺含量Fig.2 Contents of acrylamide in water Douchi from different producing stages
图2 表明,在水豆豉生产阶段中的泡豆和蒸煮环节,未检测出丙烯酰胺,而在发酵阶段检测到了丙烯酰胺。通过检测,发酵阶段中丙烯酰胺含量为(13 228±64)μg/kg,成品中含量为(15 040±191)μg/kg,并且两阶段丙烯酰胺含量差异显著(P<0.05)。水豆豉制作工艺一般采用的是细菌,细菌型豆豉中主要的微生物是枯草芽孢杆菌。在制曲的过程中创造了一个高温高湿的环境条件,大多数微生物生长受到抑制,枯草杆菌却能迅速繁殖[28]。在较高温度条件下,使之繁殖于蒸熟大豆上,借助其较强的蛋白酶系生产出风味独特的豆豉,且豆粒上布满黏液、可牵拉成丝并有特殊臭味。而枯草芽孢杆菌在高温高湿条件下发酵大豆,可能形成一种低温(或常温)、高湿(或液态)的非典型美拉德反应体系,从而生成丙烯酰胺。
2.5.2 黑豆豉不同生产阶段丙烯酰胺含量
对黑豆豉泡豆、蒸煮、发酵初期、发酵末期及成品阶段的丙烯酰胺含量进行测定,结果见图3。

图3黑豆豉不同生产阶段丙烯酰胺含量Fig.3 Contents of acrylamide in black Douchi from different producing stages
图3 表明,黑豆豉的生产阶段中泡豆和蒸煮环节未检测出丙烯酰胺,在发酵以及成品阶段有丙烯酰胺。在发酵初期、末期及成品中丙烯酰胺含量分别为(9013±313)μg/kg、(13 619±723)μg/kg、(16 496±204)μg/kg,并且发酵初期的含量与末期以及成品含量差异显著,发酵末期含量和成品含量差异显著(P<0.05)。对于黑豆豉,发酵过程结束加入烹制好的油辣椒,其成品丙烯酰胺含量与发酵末期相比,差异显著,油辣椒的制作生产过程中产生的丙烯酰胺对于成品中丙烯酰胺含量的影响较大,其产生的途径可能是由于在油炸高温环境下发生的美拉德反应。
2.5.3 豆瓣酱不同生产阶段丙烯酰胺含量
对豆瓣酱泡豆、蒸煮、发酵、配料及成品阶段的丙烯酰胺含量进行测定,结果见图4。
图4表明,在豆瓣酱的生产过程中,泡豆和蒸煮环节未产生丙烯酰胺,在发酵、配料以及成品阶段有丙烯酰胺的产生。发酵期间、配料阶段及成品中丙烯酰胺含量分别为(14855±107)μg/kg、(16337±44)μg/kg、(16821±45)μg/kg,并且发酵阶段与配料及成品中丙烯酰胺含量两两差异显著(P<0.05)。发酵过程完结加入调料后,丙烯酰胺含量也有小范围的上升,并且含量差异显著,说明在盐辣培的制作生产环节也会产生丙烯酰胺,其产生的途径可能是由于在油炸高温环境下发生的美拉德反应。

图4 豆瓣酱不同生产阶段丙烯酰胺含量Fig.4 Contents of acrylamide in fermented bean paste from different producing stages
2.5.4 腐乳不同发酵阶段丙烯酰胺含量
腐乳的生产,成品并非是直接经过预处理如泡豆、蒸煮后接种发酵而制成的,在预处理之后,还要经过原料性状的变化,整个生产工艺比较繁杂且耗时长,难以取样,故对腐乳后熟阶段一个月、三个月和八个月阶段的丙烯酰胺含量进行测定,结果见图5。
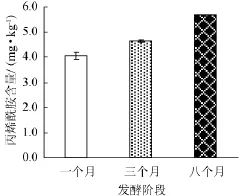
图5腐乳不同发酵阶段丙烯酰胺含量Fig.5 Contents of acrylamide in sufu from different fermented stages
图5 表明,随着腐乳发酵时间的延长,丙烯酰胺的含量出现上升的趋势。发酵一个月、三个月及八个月中丙烯酰胺的含量分别为(4 057±123)μg/kg、(4 651±38)μg/kg、(5 655±24)μg/kg,并且这三个阶段中丙烯酰胺含量差异显著(P<0.05)。
现有丙烯酰胺形成理论认为,丙烯酰胺是由富含淀粉的食品原料在高温(120~170℃)、低湿(水分含量5%)的美拉德反应过程中产生的[6]。而从高湿态发酵的水豆豉、黑豆豉、腐乳、豆瓣酱等传统发酵制品中检测出高含量的丙烯酰胺,却无法用现有形成理论来诠释。豆类传统发酵制品可能是一种低温(或常温)、高湿(或液态)的非典型美拉德反应体系。对于本实验的研究结果,在发酵豆制品中,丙烯酰胺产生于微生物前发酵阶段(即制曲阶段),其形成机理是否也是由于微生物体内某种氧化性物质作用而产生,还有待进一步研究分析。
3 结论
水豆豉、黑豆豉、豆瓣酱及腐乳等贵州主要发酵豆制品加工中,发酵前各工序均无丙烯酰胺形成;但随着发酵时间的延长,丙烯酰胺的含量呈上升趋势;发酵结束时,黑豆豉、水豆豉、豆瓣酱及腐乳样品中丙烯酰胺含量分别达(15040±191)μg/kg、(16496±204)μg/kg、(16821±45)μg/kg及(5 655±24)μg/kg。通过探索在常温、高湿条件下的传统发酵豆制品中丙烯酰胺动态变化,揭示了低温、高湿条件下存在新的丙烯酰胺产生途径或酶促机制,对进一步研究丙烯酰胺的风险控制具有重要的理论创新意义和实际应用价值。
[1]ZHANG Y,REN Y P,ZHANG Y.New research developments on acrylamide:analytical chemistry,formation mechanism,and mitigation recipes[J].Chem Inform,2010,41(3):4375-4397.
[2]TAREKE E,RYDBERG P,KARLSSON P,et al.Analysis of acrylamide, a carcinogen formed in heated food stuffs[J].J Agr Food Chem,2002, 50(17):4998-5006.
[3]GEZER P G,LIU G L,KOKINI J L.Eection of acrylamide using a biodegradable zein-based sensor with surface enhanced Raman spectroscopy[J].Food Control,2016,68:7-13.
[4]GHIASVAND A R,HAJIPOUR S.Direct determination of acrylamide in potato chips by using headspace solid-phase microextraction coupled with gas chromatography-flame ionization detection[J].Talanta,2016, 46:417-422.
[5]ARABI M,OSTOVAN A,GHAEDI M,et al.Novel strategy for synthesis of magnetic dummy molecularly imprinted nanoparticles based on functionalized silica as an efficient sorbent for the determination of acrylamide in potato chips:Optimization byexperimental design methodology [J].Talanta,2016,154:526-532.
[6]MOTTARAM D S,WEDZICHA B L,DODSON A T.Food chemistry: acrylamide is formed in the Mailard reaction[J].Nature,2002,419:448-449.
[7]STADLER R H,VARGA N.Food chemistry:acrylamide from Maillard reaction products[J].Nature,2002,419(6906):449-450.
[8]ZYZAK D V,SANDERS R A,STOJANOVIC M,et al.Acrylamide formation mechanism in heated foods[J].J Agr Food Chem,2003,51(16): 4782-4787.
[9]BARBER D S,HUNT M R.Metabolism,toxicokinetics and hemoglobin adduct formation in rats following subacute and subchronic acrylamide dosing[J].Neuro Toxicol,2001,22:341-353.
[10]BELAND F A,MELLICK P W,OLSON G R,et al.Carcinogenicity of acrylamide in B6C3F(1)mice and F344/N rats from a 2-year drinking water exposure[J].Food Chem Toxicol,2013,51:149-159.
[11]JIN X L,MELANIE C,JENNIFER R,et al.Dietary acrylamide exposure in male F344 rats:Dataset of systemic oxidative stress and inflammation markers[J].Data in Brief,2016,7:460-467.
[12]XU X,AN X N.Study on acrylamide inhibitory mechanism in Maillard model reaction:Effect of p-coumaric acid[J].Food Res Int,2016,84: 9-17.
[13]ZHANG Y,HUANG M M,WANG Q,et al.Structure-guided unravelling:Phenolic hydroxyls contribute to reduction of acrylamide using multiplex quantitative structure-activity relationship modelling[J].Food Chem,2016,199:492-501.
[14]KOCADAGLI T,GÖNCÜOGLU N,HAMZALIOGLU A,et al.In depth study of acrylamide formation in coffee during roasting:Role of sucrose decomposition and lipid oxidation[J].Food Funct,2012,3:970-975.
[15]郭波莉,魏益民,潘家荣.食品中丙烯酰胺风险评估及其形成机理研究进展[J].食品科学,2006,37(3):247-251.
[16]TAREKE E,HEINZE T M,COSTA G G D,et al.Acrylamide formed at physiological temperature as a result of asparagine oxidation[J].J Agr Food Chem,2009,57:9730-9733.
[17]YASUHARA A,TANAKA Y,HENGEL M,et al.Gas chromatographic investigation of acrylamide formation in browning model system[J].J Agr Food Chem,2003,51:3999-4003.
[18]张帅,梁桂娟,吴世兰,等.传统发酵豆制品中丙烯酰胺检测的HPLC-MS方法构建[J].食品与发酵工业,2012(9):151-155.
[19]MO W M,HE H L,HUANG X F.Simultaneous determination of ethyl carbamate,chloropropanols and acrylamide in fermented products,flavoring and related foods by gas chromatography-triple quadrupole mass spectrometry[J].Food Control,2014,43:251-257.
[20]秦礼康,曾海英,丁霄霖.陈窖豆豉粑传统工艺剖析及优势菌群鉴定[J].食品科学,2006,37(6):118-123.
[21]GUAN R F,LIU Z F,ZHANG J J,et al.Investigation of biogenic amines in sufu(furu):A Chinese traditional fermented soybean food product[J].Food Control,2013,31:345-352.
[22]GUIDI L R,ABREU GLORIA M B.Bioactive amines in soy sauce: Validation of method,occurrence and potential health effects[J].Food Chem,2012,133:323-328.
[23]ZHAO H F,WANG Y Q,ZOU Y,et al.Natural occurrence of deoxynivalenol in soy sauces consumed in China[J].Food Control,2013,29: 71-75.
[24]中华人民共和国国家卫生和计划生育委员会.GB 5009.204—2014食品中丙烯酰胺的测定[S].北京:中国标准出版社,2014.
[25]STADLER R H,SCHOLZ G.Acrylamide:an update on current knowledge in analysis,levels in food,mechanisms of formation,and potential strategies of control[J].Nutr Rev,2004,62(12):449-467.
[26]樊祥,方晓明,陈家华,等.液相色谱-串联四级杆质谱对食品中丙烯酰胺的测定研究[J].分析测试学报,2005,24(3):82-85.
[27]张凌云,刘波,徐荣,等.液相色谱-串联质谱法测定饮用水中的丙烯酰胺[J].环境化学,2010,29(1):152-153.
[28]牛广财,贾亭亭,魏文毅,等.淡豆豉的研究进展[J].中国酿造,2013,32(9):1-5.
Dynamic of acrylamide formation in main fermented soy products in Guizhou province
Using main fermented soy products in Guizhou province such as water Douchi,black Douchi,fermented bean paste and sufu as raw material,the acrylamide contents at different processing stages were determined with HPLC-MS/MS.The results showed that no acrylamide was produced at the heat treatment phase of materials.However,the acrylamide content was significantly increased at fermentation phase.At the end of fermentation,the acrylamide content of black Douchi,water Douchi,fermented bean paste and sufu reached(15 040±191)μg/kg,(16 496±204)μg/kg, (16 821±45)μg/kg and(5 655±24)μg/kg,respectively.It indicated that soy products in low temperature fermentation system could produce a large quantity of acrylamide,which may pose risks towards food safety.
acrylamide;HPLC-MS/MS;fermented soy products
TS264.2
0254-5071(2017)03-0085-05
10.11882/j.issn.0254-5071.2017.03.018
2016-09-09
贵州省农业攻关(黔科合NY[2013]3049号)
文安燕(1992-),女,硕士研究生,研究方向为油脂与植物蛋白工程。
*通讯作者:秦礼康(1965-),男,教授,博士,研究方向为传统特色发酵食品工业化。
WEN Anyan1,ZHANG Shuai1,ZENG Haiying1,2,QIN Likang1*
(1.School of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China;2.Key Laboratory of Agricultural and Animal Products Store&Processing of Guizhou Province,Guiyang 550025,China)
