海洋氨肽酶菌株的筛选鉴定及其酶学特性研究
2017-04-07杨丽娜迟乃玉石群王晓辉张庆芳
杨丽娜,迟乃玉,石群,王晓辉,张庆芳*
(1.大连大学生命科学与技术学院,辽宁大连116622;2.辽宁省海洋微生物工程技术研究中心,辽宁大连116622)
海洋氨肽酶菌株的筛选鉴定及其酶学特性研究
杨丽娜1,2,迟乃玉1,2,石群1,2,王晓辉1,2,张庆芳1,2*
(1.大连大学生命科学与技术学院,辽宁大连116622;2.辽宁省海洋微生物工程技术研究中心,辽宁大连116622)
从大连渤海海域海泥海水样品中分离出一株高产海洋氨肽酶(aminopeptidase)菌株YZ1-2,对其进行形态学、生理生化、分子生物学(16S rDNA)鉴定,确定该菌株为蜡样芽孢杆菌(Bacillus cereus)。并对其产海洋氨肽酶进行酶学特性研究,结果表明,最适作用温度为30℃;最适作用pH值为8.5;Co2+、Zn2+等能较强地激活氨肽酶的活性,Ni2+、Ca2+等对酶的抑制性较强;乙二胺四乙酸(EDTA)可以有效地抑制氨肽酶活性。
海洋氨肽酶;筛选鉴定;蜡样芽孢杆菌;酶学特性
氨肽酶(aminopeptidase)EC 3.4.11.11作为一种外肽酶,可将多肽链水解为小肽和游离的氨基酸[1-3]。目前发现氨肽酶存在于多种生物中,如一些高等动物的胰脏、肠液中,也广泛分布于多种植物、微生物和原生动物体内[4]。蛋白质水解生成的多肽、寡肽和少量氨基酸,其溶解性、营养特性及口感风味较蛋白质而言均可得到明显改善[5],是食品加工的主要原材料,因而蛋白质的水解已成为现代食品加工中的重要课题[6]。但其水解液往往呈现苦味,这种苦味是由末端的疏水性氨基酸的多肽所导致的,从而限制了蛋白质水解物的应用[7]。因此,减少、阻止和去除蛋白质水解物的苦味,就显得尤为重要。目前,氨肽酶在食品工业上可以与蛋白酶协同作用,生产酱油等调味品、制备生物多肽以及对蛋白水解液进行脱苦[8-9]。既增加了游离氨基酸的量,又可以提高营养价值,改善食品风味。另外,氨肽酶在医学领域还可用作分子工具测定蛋白序列[10],以及在环境卫生方面可以作为解毒剂或消毒剂等[11]。目前,国内科研人员对氨肽酶的菌种来源大部分集中在陆地土壤、腐乳或购买于菌种保藏管理中心以及通过基因重组获得等[12-13],而来源于海洋菌株生产氨肽酶的研究尚鲜见报道。
本实验利用L-亮氨酸-4-硝基苯胺(L-leucine-4-nitroanilide,LNA)法,拟从渤海海域的海泥海水中分离得到一株产海洋亮氨酸氨肽酶的蜡样芽孢杆菌(Bacilluscereus)。本研究初步探索了海洋氨肽酶产生菌的筛选鉴定及酶学特性,为后期海洋低温氨肽酶的规模化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
来源于中国辽宁大连渤海海域附近的海泥海水样品(鹿岛港,N:39°11′,S:121°35′;滨海路沿线,N:39°7′,S:121°41′;荞麦山桥,N:39°13′,S:121°42′),现保存于实验室-80℃冰箱中备用。
蜡样芽孢杆菌(Bacillus cereus)YZ1-2:大连大学辽宁省海洋微生物工程技术研究中心实验室分离、筛选及保藏。
1.1.2 试剂
L-亮氨酸-4-硝基苯胺(LNA):大连凯美化工工程配套有限公司;三(羟甲基)氨基甲烷(Tris):天津市福晨化学试剂厂;核酸Marker:加拿大Fermentas MBI公司;引物(合成)、Ezup柱式细菌基因组DNA抽提试剂盒(SK8255):生工生物工程(上海)股份有限公司;其余试剂均为国产分析纯。
Tris-HCl缓冲液(pH 8.0)的配制:121.1 g Tris,800 mL去离子水,加入约42 mL浓盐酸调节pH至8.0。
26 mmol LNA乙醇溶液的配制:0.196 gL-亮氨酸-4-硝基苯胺,30 mL无水乙醇,混匀。
1.1.3 培养基
分离筛选培养基:蔗糖30g/L,牛肉膏5g/L,LNA0.5g/L,MgSO4·7H2O0.5g/L,KH2PO41.0g/L,琼脂粉20g/L,pH7.0。
斜面培养基:酵母浸粉10 g/L,蛋白胨10 g/L,葡萄糖6 g/L,K2HPO42 g/L,琼脂粉20 g/L,pH 7.0。
种子培养基:胰蛋白胨10g/L,牛肉膏5g/L,NaCl10g/L,pH 7.0。
发酵培养基:玉米粉30 g/L,豆渣粉20 g/L,KH2PO40.05 g/L,MgSO4·7H2O 0.3 g/L,NaCl 1 g/L,CoCl20.1 g/L,pH 8.0。
以上培养基均在0.1 MPa、121℃高压蒸汽灭菌20 min。
1.2 仪器与设备
LDZX-40BI立式压力蒸汽灭菌锅:上海申安医疗器械厂;HZP-256全温振荡培养箱:上海智诚分析仪器制造有限公司;CX21FS3显微镜:日本奥林巴斯有限公司;PH-3G pH计:陕西鼎盛仪器设备有限公司;UV-H232可见紫外分光光度计:菲迪康乐(广州)科学仪器有限公司;2720 thermal cycler PCR扩增仪:美国Applied Biosystems公司;DYY-5稳压电泳仪:北京六一仪器厂;FR980凝胶成像仪:上海复日科技仪器有限公司。
1.3 方法
1.3.1 菌株筛选
菌株初筛:在以L-亮氨酸-4-硝基苯胺(LNA)为底物的分离培养基中挑选出带有黄色水解圈的菌株,在氨肽酶作用下,可将无色的LNA分解生成黄色对硝基苯胺(p-nitroaniline,p-NA),根据生成的水解圈和菌落直径比值的大小筛选出高活力的目的菌株[14],转接至固体斜面再次纯化培养。
菌株复筛:以测定菌株氨肽酶酶活高低作为复筛依据,将初筛菌株进行摇瓶发酵培养,通过测定酶活,逐步筛选出目的高产菌株。
1.3.2 氨肽酶活测定方法
将接种划线培养的单菌落转接于装液量为100mL/250mL的一级种子培养基中,于26℃、200 r/min条件下培养10~12h,连续转接两次种子;以5%的接种量转接到50mL/250mL的发酵培养基中,于26℃、200 r/min条件下发酵培养48 h。
对发酵液离心,条件为4℃、8 000 r/min离心15 min,上清即为粗酶液。取0.4 mL粗酶液加入pH 8.0的Tris-HCl缓冲液6 mL,30℃水浴预热5 min,加26 mmol/L LNA乙醇溶液0.4 mL,准确反应10 min,立即放冰浴中终止反应,将在沸水浴中灭活粗酶液作为对照,其余条件同上,5 min后于波长405 nm处比色。根据下列公式计算酶活[15]。

式中:ΔOD405nm为反应液测定前后吸光度变化值;6.8为反应体系总体积,mL;D为样品稀释倍数;K为标准曲线斜率;10为反应时间,min;0.4为样品体积,mL。
氨肽酶酶活定义:在30℃、pH 8.0条件下,每分钟水解生成1 μg对硝基苯胺(p-NA)所需的酶量定义为一个酶活单位(U)[16]。
1.3.3 菌株鉴定
(1)菌株形态学鉴定
24 h后,观察斜面培养基中的菌落形态特征;挑取菌龄为24 h的单菌落,进行革兰氏染色,观察结果。
(2)菌株生理生化特征鉴定
参照《常见细菌系统鉴定手册》[17]与《微生物实验技术》[18],对该菌株进行淀粉水解、油脂水解、明胶液化、石蕊牛乳试验、糖发酵产酸试验、甲基红(methyl red,MR)试验、伏-普(voges-prokauer,V-P)试验、柠檬酸盐试验、硫化氢产生试验、尿素水解试验、过氧化氢酶试验、硝酸盐还原试验。
(3)菌株分子生物学(16S rDNA)鉴定
利用Ezup柱式细菌基因组DNA抽提试剂盒SK8255(上海生工)提取菌株基因组DNA。以筛选得到的菌株YZ1-2 DNA为模板,进行聚合酶链式反应(polymerase chain reaction,PCR)和琼脂糖凝胶电泳。将PCR扩增产物送至上海生工进行测序,测序结果与美国国家生物技术信息中心(national center of biotechnology information,NCBI)网站上的GenBank数据库中的已知菌种16S rDNA进行序列比对(https://blast.ncbi.nlm.nih.gov/Blast.cgi),确定菌株同源性,并利用MEGA5.05软件构建系统发育树。
1.3.4 酶学性质的初步研究
(1)氨肽酶最适作用温度
根据氨肽酶酶活测定方法,将酶液分别置于不同温度条件下(10℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃)测定其酶活,相对酶活为样品酶活与同组最高酶活之比,并绘制温度-相对酶活折线图。
(2)氨肽酶的热稳定性
根据氨肽酶酶活测定方法,将酶液分别置于不同温度条件下(30℃、40℃、45℃、50℃、60℃、70℃)保温10 min、20 min、30 min、40 min、50 min、60 min,测定其酶活,相对酶活为样品酶活与同组最高酶活之比,并绘制时间-相对酶活折线图。
(3)氨肽酶最适作用pH
根据氨肽酶酶活测定方法,将酶液分别置于不同pH值(5.0、6.0、7.0、8.0、8.5、9.0、10.0、10.5、11.0)的Tris-HCl缓冲液中,测定其酶活,相对酶活为样品酶活与同组最高酶活之比,并绘制pH值-相对酶活折线图。
(4)氨肽酶的pH稳定性
根据氨肽酶酶活测定方法,将酶液分别置于不同pH值(5.0、6.0、7.0、8.0、8.5、9.0、10.0、10.5、11.0)的Tris-HCl缓冲液中保温60 min,测定其酶活,相对酶活为样品酶活与同组最高酶活之比,并绘制pH值-相对酶活折线图。
(5)金属离子对氨肽酶活的影响
根据氨肽酶酶活测定方法,向酶液分别加入含有不同金属离子(Co2+、Ca2+、K+、Fe2+、Mg2+、Zn2+、Mn2+、Ni2+、Cu2+)的盐溶液,使反应体系中金属离子终浓度分别为1 mmol/L和10mmol/L,以不添加金属离子的样品为对照,测定其酶活,相对酶活为样品酶活与同组最高酶活之比,考察金属离子对氨肽酶活的影响。
(6)抑制剂对氨肽酶活的影响
根据氨肽酶酶活测定方法,向酶液分别加入抑制剂乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、二硫苏糖醇(dithiothreitol,DTT),使得各反应体系的终浓度为1 mmol/L,以不添加抑制剂的样品为对照,测定其酶活,相对酶活为样品酶活与同组最高酶活之比,考察抑制剂对氨肽酶活的影响。
2 结果与分析
2.1 菌株的筛选
对大连周边海泥海水样品中分离的菌株进行初筛,得到9株具有黄色水解圈的菌株,并通过复筛,得到一株性能稳定、活力较高的海洋氨肽酶菌株,现将其命名为YZ1-2。利用种子培养基甘油保藏于-20℃冰箱中,用于后续实验。
2.2 菌株YZ1-2形态学鉴定
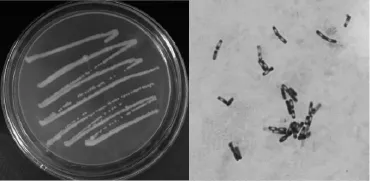
图1 菌株YZ1-2菌落形态及显微形态Fig.1 Colonial morphology and microscopic morphology of strain YZ1-2
由图1可知,菌株YZ1-2菌落较大,近似圆形,边缘不整齐,呈毛玻璃状,灰白色,不透明,用接种环易于挑取,中心有光泽,呈蜡烛样颜色;革兰氏染色结果阳性,呈杆状,两端生有芽孢。
2.3 生理生化鉴定

表1 菌株YZ1-2的生理生化特征Table 1 Physiological and biochemical characteristics of strain YZ1-2
由表1可知,菌株YZ1-2生理生化鉴定阳性反应结果:淀粉水解试验、明胶水解试验、葡萄糖发酵产酸试验、伏-普(VP)试验、柠檬酸盐试验、过氧化氢酶试验、硝酸盐还原试验;阴性反应结果:油脂水解试验、石蕊牛乳试验、蔗糖发酵产酸试验、甲基红(MR)试验、硫化氢产生试验、尿素水解试验。
2.4 分子生物学(16S rDNA)鉴定与系统发育树的构建
对海洋氨肽酶高产菌株YZ1-2进行序列鉴定,结果见图2。由图2可知,PCR扩增产物序列长度为1 496 bp。
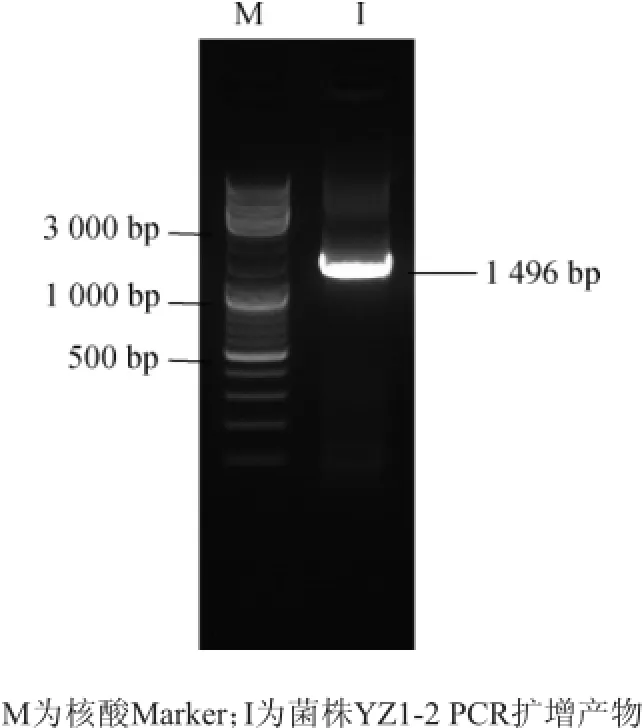
图2 菌株YZ1-2 16S rDNA PCR扩增产物电泳图Fig.2 PCR amplification products electrophoregram of 16S rDNA of strain YZ1-2
将菌株YZ1-2的16S rDNA基因序列与GenBank数据库中的已知菌种的16SrDNA基因序列进行比对,以MEGA5.05软件构建菌株YZ1-2系统发育树,结果如图3所示。由图3可知,菌株YZ1-2与蜡样芽孢杆菌同源性最高为100%,因此可以鉴定菌株YZ1-2为蜡样芽孢杆菌(Bacillus cereus)。
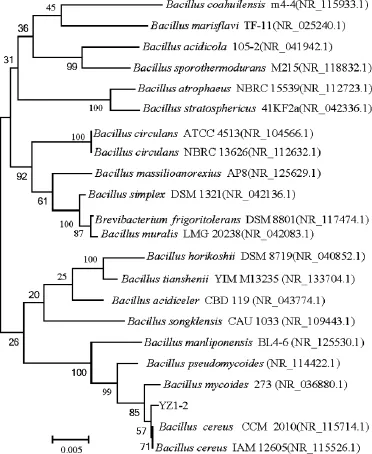
图3 菌株YZ1-2 16S rDNA序列系统发育树Fig.3 Phylogenetic tree of strain YZ1-2 based on 16S rDNA sequence
2.5 酶学性质研究
2.5.1 酶最适作用温度
由图4可知,该海洋氨肽酶最适作用温度为30℃,作用温度>45℃以后,氨肽酶活迅速下降,在20~45℃的温度条件下,相对酶活能保持在80%以上,在10℃仍保有60%以上的相对酶活力,在65℃和70℃条件下,相对酶活不足20%,说明该酶在低温条件下,活力较高,这符合低温酶的特性,同时也是低温酶的应用优势[19]。
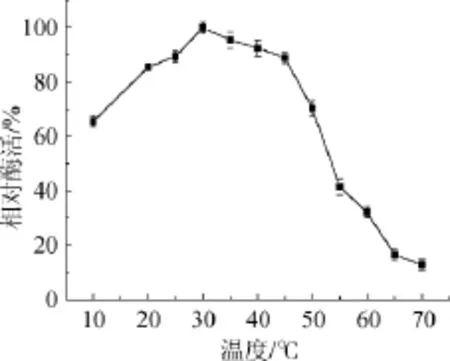
图4 氨肽酶最适作用温度Fig.4 The optimal temperature of the aminopeptidase
2.5.2 酶的热稳定性
由图5可知,该海洋氨肽酶热稳定性比较弱,随着温度的不断升高,其相对酶活呈下降趋势。经45℃条件下处理30min后,相对酶活就已经低于60%,且在50℃、60℃、70℃条件下分别处理10 min,相对酶活迅速下降,酶活经60℃、70℃处理40 min,相对酶活均低于10%。分析其原因可能是低温酶类具有较高的柔韧性,与底物结合可以消耗较低的能量,进而使得酶的热稳定性降低[20-21]。
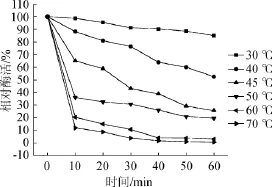
图5 氨肽酶的热稳定性Fig.5 The thermostibility of the aminopeptidase
2.5.3 酶最适作用pH及稳定性
由图6可知,该氨肽酶的最适作用pH值为8.5,当pH值≤7.0或pH值≥10.5时,其相对酶活均不足60%;由该氨肽酶的pH稳定性折线可知,在pH值为5.0~8.5时,酶的稳定性随着pH的增加而升高;pH值为5.0时,相对酶活<20%;pH值为7.0时,相对酶活<60%;pH值为8.5时,相对酶活最高;且当pH值为8.0~10.0时,该氨肽酶均有80%以上的酶活。但随着pH越来越大,氨肽酶稳定性也逐渐丧失。由此可以得出:在偏酸中性或过碱性环境下,均不利于氨肽酶发挥活性,而在弱碱性环境下,氨肽酶发挥活性较好,稳定性最高,说明该氨肽酶有一定的耐弱碱性。
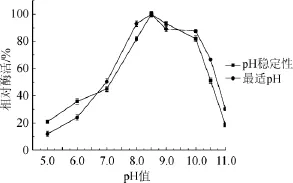
图6 氨肽酶最适pH及其稳定性Fig.6 The optimal pH and stability of the aminopeptidase
2.5.4 金属离子对氨肽酶的影响
由表2可知,不同种类的金属离子对该海洋氨肽酶的作用不同,同种金属离子在不同终浓度条件下的酶活规律表现也不尽相同。其中,Co2+、Zn2+、Mg2+能较强的激活氨肽酶的活性;Ca2+、Fe2+、Ni2+、Cu2+对酶的抑制性较强,K+、Mn2+对酶的作用不明显,且Mn2+对酶有较弱的激活作用。由此可以推测出该酶的活性中心构象的维持可能与金属离子有关[22]。
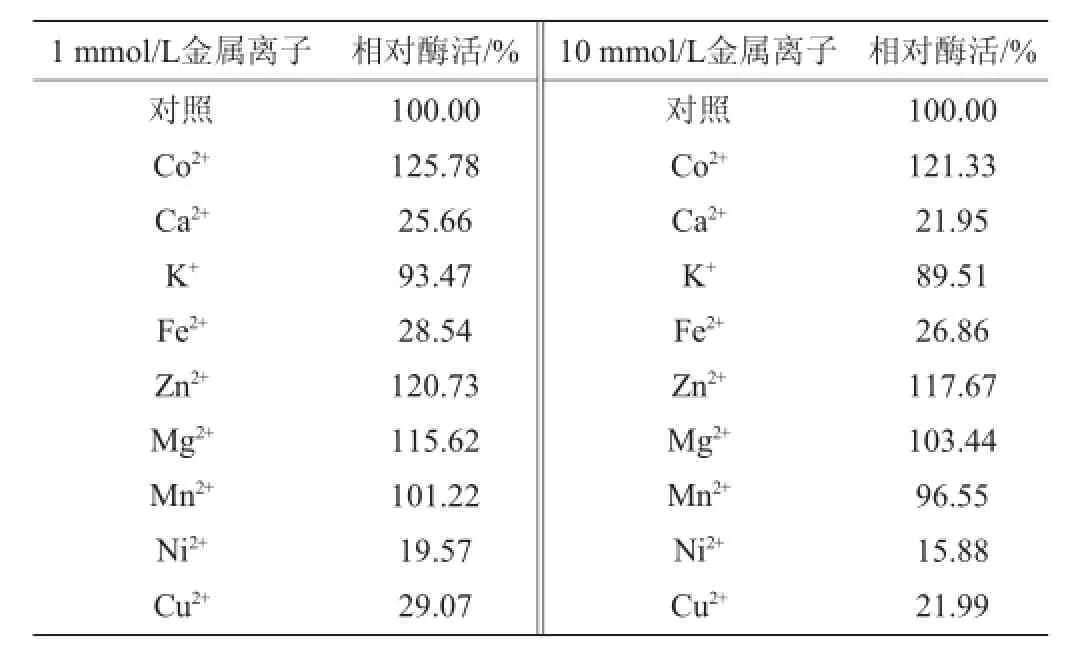
表2 金属离子对氨肽酶活性的影响Table 2 Effects of metal ions on aminopeptidase activity
2.5.5 抑制剂对氨肽酶活的影响

表3 常见抑制剂对氨肽酶活的影响Table 3 Effects of common inhibitors on aminopeptidase activity
由表3可知,金属螯合剂EDTA、蛋白质变性剂SDS与还原剂DTT均可以有效的抑制氨肽酶活性,其中EDTA可强烈的抑制氨肽酶活性。
3 结论
本实验从渤海海域的海泥海水样品中,初筛得到9株产海洋氨肽酶菌株,以发酵产酶能力作为复筛的依据,逐步筛选出一株高产菌株YZ1-2,并对其进行形态学鉴定、生理生化鉴定以及分子生物学(16S rDNA)鉴定,鉴定菌株YZ1-2为蜡样芽孢杆菌(Bacillus cereus)。对其所产的海洋氨肽酶粗酶酶学性质进行初步研究,结果表明,最适作用温度为30℃,酶的热稳定性较差,属于低温酶类;酶的最适作用pH值为8.5,且该酶的pH稳定性大约在8.0~10.0,有一定的耐碱性;Co2+、Zn2+、Mg2+能较强的激活氨肽酶的活性,Ca2+、Fe2+、Ni2+、Cu2+对酶的抑制性较强,K+、Mn2+对酶的作用不明显,且Mn2+对酶有较弱的激活作用;金属螯合剂EDTA、蛋白质变性剂SDS与还原剂DTT均可以有效的抑制氨肽酶活性,其中,EDTA的抑制作用最为明显。
[1]DUTOIT R,BRANDT N,LEGRAIN C,et al.Functional characterization of two M42 aminopeptidases erroneously annotated as cellulases[J].Plos One,2012,7(11):154-159.
[2]MICHALSKA K,STEEN A D,CHHOR G,et al.New aminopeptidase from"microbial dark matter"archaeon[J].Faseb J,2015,29(9):4071-4079.
[3]张晓鸣,高梅娟,颜袅,等.酶解大豆蛋白制备风味增强肽[J].食品与生物技术学报,2009,28(1):8-13.
[4]CHISTOSERDOVA L,LAPIDUS A,HAN C,et al.Genome ofMethylobacillusflagellatus,molecular basis for obligate methylotrophy,and polyphyletic origin of methylotrophy[J].J Bacteriol,2007,189(11): 4020-4027.
[5]段刚,赵振锋,钱莹.酶制剂在蛋白质加工行业的应用[J].食品与生物技术学报,2005,24(4):104-109.
[6]张连慧,贺寅,刘新旗.大豆肽制备研究进展及其在食品中的应用[J].食品工业科技,2012,33(24):423-425.
[7]潘进权.蛋白酶脱除大豆蛋白水解物苦味的研究进展[J].食品研究与开发,2011,32(5):167-171.
[8]魏亚娟,田亚平,须瑛敏.枯草芽孢杆菌脱苦氨肽酶在水解大豆分离蛋白中的应用研究[J].食品工业科技,2008,29(4):149-151.
[9]谷海先,王建.风味蛋白酶的开发与利用[J].中国酿造,2003,22(1):26-28.
[10]潘进权,罗晓春,谢明权.毛霉蛋白酶的组分特性及对大豆蛋白水解的研究[J].中国粮油学报,2009,24(5):31-35.
[11]ZERVOUDI E,SARIDAKIS E,BIRTLEY J R,et al.Rationally designed inhibitor targeting antigen-trimming aminopeptidases enhances antigen presentation and cytotoxic T-cell responses[J].P Natl Acad Sci USA,2013,110(49):19890-19895.
[12]TAYLOR J M,YANEVA M,VELASCO K,et al.Aminopeptidase activities as prospective urinary biomarkers for bladder cancer[J]. Proteom Clin Appl,2014,8(5-6):317-326.
[13]张金虎.蜡状芽孢杆菌CZ发酵生产氨肽酶的过程调控[D].广州:华南理工大学,2013.
[14]吴庆勋.氨肽酶高产菌株的选育及发酵条件优化[D].无锡:江南大学,2006.
[15]田亚平,须瑛敏.一种枯草芽孢杆菌氨肽酶的纯化及酶学性质[J].食品工业科技,2006,27(3):7-9.
[16]ZHAO G M,WANG Y L,TIAN W,et al.Changes of arginyl and leucyl aminopeptidase activities in biceps femoris along Jinhua ham processing[J].Meat Sci,2006,74(3):450-458.
[17]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:91-100.
[18]张庆芳,迟乃玉.微生物实验技术[M].沈阳:辽宁科学技术出版社,2001:119-141.
[19]王强,李旭,窦少华,等.海洋葡甘聚糖酶菌株的分离鉴定及酶学性质研究[J].中国酿造,2016,35(6):65-69.
[20]吴继卫.适冷酶及其适冷机制[J].安徽农业科学,2011,39(23):13938-13939.
[21]张金伟,曾润颖.南极产低温脂肪酶菌株Psychrobactersp.7195的选育、发酵条件及酶学性质研究[J].生物磁学,2006,6(1):6-10.
[22]迟桂荣.海洋微生物极端酶的开发和应用[J].德州学院学报:自然科学版,2005,21(2):80-82,96.
Isolation and identification of a aminopeptidase-producing strain from marine and its enzymatic properties
YANG Lina1,2,CHI Naiyu1,2,SHI Qun1,2,WANG Xiaohui1,2,ZHANG Qingfang1,2*
(1.College of Life Science and Technology,Dalian University,Dalian 116622,China; 2.Liaoning Marine Microbial Engineering and Technology Center,Dalian 116622,China)
Ahigh marine aminopeptidase-producingstrain YZ1-2 wasisolated from sea water sample from the Dalian Bohai Sea area,and was identified asBacillus cereusby morphology,physiological and biochemical experiments,molecular biology(16S rDNA)identification.The enzymatic properties of aminopeptidase produced by strain YZ1-2 were researched.The results showed that the optimum temperature of enzymes was 30℃;the optimum pH was 8.5;the aminopeptidase activity could be strongly activated by Co2+,Zn2+,etc,and inhibited by Ni2+and Ca2+,etc.EDTA could effective inhibition on aminopeptidase activity.
marine aminopeptidase;isolation and identification;Bacillus cereus;enzymatic properties
Q93
0254-5071(2017)03-0066-05
10.11882/j.issn.0254-5071.2017.03.014
2016-12-15
国家高技术研究发展计划“863计划”(2007AA021306)
杨丽娜(1991-),女,硕士研究生,研究方向为微生物酶制剂开发与利用。
*通讯作者:张庆芳(1965-),女,教授,博士,研究方向为微生物酶制剂开发与利用。
