能量策略对酶法合成谷胱甘肽效率影响
2017-04-07孙维景段超孙怡然万伟建段学辉
孙维景,段超,孙怡然,万伟建,段学辉*
(南昌大学食品学院食品科学与技术国家重点实验室,江西南昌330047)
能量策略对酶法合成谷胱甘肽效率影响
孙维景,段超,孙怡然,万伟建,段学辉*
(南昌大学食品学院食品科学与技术国家重点实验室,江西南昌330047)
通过比较和调控细胞酶催化前体氨基酸合成谷胱甘肽(GSH)反应过程中的能量类型和添加策略,跟踪反应过程中合成GSH的浓度变化,考察能量种类和添加模式对酶法合成GSH转化效率的影响。结果表明,葡萄糖作为能量碳源对酵母细胞酶催化合成GSH转化率的影响明显,初始反应液添加100 mmol/L葡萄糖酶法合成GSH转化率为27.88%,分批定点流加葡萄糖(第2、3、4小时各添加27.78 mmol/L)酶法合成GSH转化率可达到35.81%;在酶反应过程能量供应策略中,初始反应液中添加0.5 g/L的腺苷时,酶法合成GSH的转化率提高到36.37%;初始反应液添加0.5 g/L腺苷结合分批定点流加葡萄糖(第2、3、4小时各添加27.78 mmol/L),酶法合成GSH转化率达到41.57%。
谷胱甘肽;细胞酶;催化合成;能量
谷胱甘肽(glutathione,GSH)是由谷氨酸、半胱氨酸和甘氨酸构成的同时具有γ-谷氨酰基和巯基的活性三肽化合物[1-2]。GSH是一种广泛存在于生物体中的活性物质,具有解毒、抗氧化性、维持细胞内氧化还原平衡和辅助蛋白质复性等重要的生理功能[3-5]。近几年,谷胱甘肽在医疗、保健、食品和日化行业的应用越来越广泛[6]。酶法合成GSH是在反应体系中加入前体氨基酸,供给能量三磷酸腺苷(adenosine triphosphate,ATP)、辅助因子(Mg2+),利用酵母细胞中的GSH合成酶系催化合成GSH方法[7-8]。近年来,酶法合成GSH的研究主要集中在两个方面,一是构建高表达GSHⅠ和GSHⅡ酶的工程菌来提高GSH的合成能力[9-11],二是通过调控细胞酶催化反应动力学影响因素来提高GSH的转化效率[12-14]。在后者的研究中,ATP能量的有效供给是影响酶反应效率的主要因素之一。LIN J等[15]利用大肠杆菌(Escherichia coil)的GSH合成酶系和酿酒酵母(Saccha romyces cerevisiae)WSH2中ATP合成酶系,构建以葡萄糖为能源的ATP再生系统,同时向反应液里添加腺苷脱氨酶抑制剂、敲除能量再生细胞中的腺苷脱氨酶基因,切断腺苷到次黄嘌呤的转化途径,提高ATP的再生效率,进而增加GSH产量。YOSHIDAH等[16]通过代谢工程手段,构建高GSH合成酶系工程菌,细胞催化合成GSH产量相对于原始菌提高了2.6倍。
本实验研究主要考察酶催化合成GSH反应过程中的能量作用,通过调控能量添加模式,探讨组合能量添加模式,保持反应系统中能量再生水平和有效供应,对酶法合成谷胱甘肽转化效率的促进作用。本实验目的是通过改变酶法合成GSH过程中能量的供给方式来提高GSH的产率,为酶法合成GSH的工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
酿酒酵母(Saccharomyces cerevisiae)SP5:南昌大学食品科学国家重点实验保藏。
还原型谷胱甘肽(纯度98%)、四氧嘧啶(纯度98%)、腺苷(纯度≥99%)、L-谷氨酸(纯度99%)、L-半胱氨酸(纯度99%)、甘氨酸(纯度>99%):上海晶纯试剂有限公司;水合氯化镁(分析纯)、磷酸二氢钾(分析纯):汕头市西陇化工股份有限公司;葡萄糖(分析纯):天津市大茂化学试剂厂;其他试剂皆为国产分析纯。
酶催化合成GSH反应液:磷酸钾缓冲液100 mmol/L,L-Glu 20 mmol/L,L-Cys 20 mmol/L,葡萄糖100 mmol/L,Gly 40 mmol/L,MgCl2·6H2O 10 mmol/L,pH 7.0。
1.2 仪器与设备
756PC紫外可见光分光光度计:上海光谱仪器有限公司;BHC-1300ⅡA/B3生物安全柜:苏净集团安泰公司;DSHZ-300多用途水浴恒温振荡器:江苏太仓试验设备厂;DSX-280A手提式蒸汽灭菌锅:上海申安医疗器械厂;AL104电子分析天平:瑞士Mettler Toledo公司;SHP-150生化培养箱:上海精宏实验设备有限公司;GL-20G-Ⅱ型高速冷冻离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 细胞培养
将在-20℃保藏的酵母菌种接种到活化培养基中,培养箱中30℃培养2 d;接种到装有50 mL种子培养液的250 mL锥形瓶中,30℃、200r/min振荡培养24h;种子液以10%(V/V)接种量添加至装有50 mL发酵液的250 mL锥形瓶中,30℃、200 r/min振荡培养24 h[17];离心,收集酵母细胞,放-20℃冰箱里冷冻保存。
1.3.2 不同碳源和浓度对酶催化合成GSH的影响
取冷冻酵母细胞2g放入装有10mL酶反应液的100mL锥形瓶中,酶反应液的糖源分别为葡萄糖、蔗糖、乳糖和麦芽糖,其初始浓度分别为50mmol/L、100mmol/L和150mmol/L,37℃、200 r/min振荡培养6 h,过程跟踪检测GSH转化率。
1.3.3 葡萄糖及其添加策略对酶催化合成GSH的影响
(1)不同初始葡萄糖浓度对酶催化合成GSH的影响
初始葡萄糖添加量分别为50 mmol/L、100 mmol/L、150 mmol/L,测定合成GSH含量。
(2)一次性添加不同量的葡萄糖对酶催化合成GSH的影响
选择在第4小时分别添加葡萄糖浓度55.56 mmol/L,83.33 mmol/L和111.11 mmol/L,测定其对合成GSH含量的影响。
(3)不同时间一次性添加83.33 mmol/L葡萄糖对酶催化合成GSH的影响
选择分别在第2、3、4小时添加83.33 mmol/L的葡萄糖,跟踪检测酶催化反应过程中合成GSH含量。
(4)不同时间分别流加葡萄糖对酶催化合成GSH的影响
在第2、3、4小时各添加一次葡萄糖(27.78 mmol/L),使葡萄糖总量83.33 mmol/L保持不变,跟踪测定酶催化反应过程中合成GSH含量。
1.3.4 添加不同质量浓度腺苷对酶催化合成GSH的影响
分别向初始反应液中添加0.2 g/L、0.5 g/L、0.8 g/L的腺苷,跟踪测定酶催化反应过程中合成GSH含量。
1.3.5 添加三磷酸腺苷和流加葡萄糖组合对酶催化合成
GSH的影响
在初始反应液中添加0.5 g/L三磷酸腺苷,同时在第2、3、4小时各添加一次葡萄糖(27.78 mmol/L),使葡萄糖总含量为83.33mmol/L保持不变,跟踪测定酶催化反应过程中合成GSH含量。
1.3.6 GSH测定方法
准确称量用滤纸吸干的酿酒酵母2g,加入到含有10mL酶法反应液的100mL锥形瓶里,37℃、200r/min反应。过程检测时,将反应液和酵母细胞转入20mL离心管,6000r/min离心10 min,取上清液按照四氧嘧啶法[18]测定其吸光度值,按照GSH标准曲线回归方程计算酶反应液中GSH含量。GSH转化率的计算公式如下:

式中:OD305nm表示在波长305 nm处的吸光度值;N表示酶反应液稀释倍数;C表示初始添加的半胱氨酸的质量浓度,mmol/L;0.011 2表示截距;9.016 7表示斜率;307.33表示GSH的分子质量。
2 结果与分析
2.1 GSH标准曲线

图1 谷胱甘肽标准曲线Fig.1 Standard curve of glutathione
用GSH标准品配制0.1mg/mL的GSH标准溶液,依次稀释得到质量浓度分别为0、0.02mg/mL、0.04mg/mL、0.06mg/mL、0.08 mg/mL、0.10 mg/mL的GSH标准溶液。每组依次加入0.1 mol/L的四氧嘧啶溶液1 mL,0.5 mol/L磷酸盐缓冲液(pH7.5)1 mL,0.1 mol/L的NaOH溶液1 mL,立即摇匀,放置6 min,加入1 mol/L的NaOH溶液1 mL,再次摇匀,在波长305 nm处测定其吸光度值。以GSH的质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制GSH标准曲线,结果见图1。
由图1可知,GSH标准曲线回归方程:y=9.016 7x+ 0.011 2,相关系数R2=0.999 4。表明GSH质量浓度在0~0.10 g/L范围内二者线性关系良好。
2.2 不同碳源和浓度对GSH合成的影响
反应液中加入不同浓度、不同糖源细胞酶催化合成GSH实验,跟踪测定GSH含量,结果如表1所示。

表1 不同碳源和浓度对酶催化谷胱甘肽合成的影响Table 1 Effect of different carbon sources and concentration on the enzyme catalytic synthesis of glutathione
从表1可以看出,不同浓度麦芽糖与乳糖为碳源时,细胞酶催化合成GSH的转化率较低(仅为7.01%~9.55%),可能是由于酵母细胞利用麦芽糖和乳糖合成ATP的转化率较低[19]。在蔗糖和葡萄糖初始添加量≥100 mmol/L时,酵母细胞利用蔗糖催化合成GSH转化率的效果低于葡萄糖,故选择葡萄糖作为碳源。当初始葡萄糖添加量分别为100 mmol/L、150 mmol/L时,GSH转化率分别达到27.88%、28.34%。因此,选择葡萄糖作为碳源,从经济角度考虑,选择初始葡萄糖添加量为100 mmol/L。
2.3 葡萄糖能量供应策略对酶催化合成GSH的影响
2.3.1 不同初始葡萄糖浓度对酶催化合成GSH的影响
不同初始葡萄糖浓度酶催化合成GSH实验结果见图2。

图2 不同初始葡萄糖浓度对酶催化合成谷胱甘肽的影响Fig.2 Effect of initial glucose concentration on the enzyme catalytic synthesis of glutathione
由图2可知,当初始葡萄糖的浓度为50mmol/L时,反应液中合成GSH转化率为16.92%;与100 mmol/L葡萄糖GSH转化率27.88%相比低10.96个百分点。说明低的初始葡萄糖浓度影响酶催化合成GSH的连续合成。当初始葡萄糖的浓度为150mmol/L时,合成GSH转化率相对100 mmol/L葡萄糖效果没有明显提高,说明酶催化反应过程中能量的转化利用效率和酶催化反应机制共同影响GSH的转化[8]。结果表明,初始葡萄糖浓度添加量为100mmol/L时,GSH转化率较高,达到27.88%。
2.3.2 补加葡萄糖质量浓度对酶催化合成GSH的影响
在酶催化合成GSH反应4 h时,向反应液中分别补加55.56 mmol/L、83.33 mmol/L和111.11 mmol/L葡萄糖,考察GSH转化率,结果见图3。由图3可知,过程(反应4 h时)补加83.33 mmol/L的葡萄糖GSH转化率为30.80%;补加111.11 mmol/L葡萄糖GSH转化率30.56%,转化率增量与添加83.33 mmol/L相近,但达到转化率高点的时间比补加83.33mmol/L葡萄糖明显延长2h;补加55.56mmol/L葡萄糖最终GSH转化率28.90%,其效果明显低于添加83.33mmol/L葡萄糖(GSH转化率30.80%)。结果表明,补加83.33mmol/L的葡萄糖效果较优。
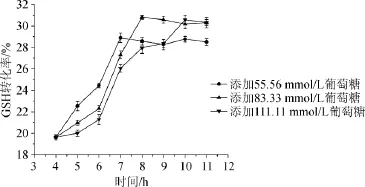
图3 在第4小时添加不同浓度葡萄糖对酶催化合成谷胱甘肽的影响Fig.3 Effect of adding different glucose concentration at 4 h on the enzyme catalytic synthesis of glutathione
2.3.3 葡萄糖补加时机对酶催化合成GSH的影响

图4 在不同时间添加相同量葡萄糖对酶催化合成谷胱甘肽的影响Fig.4 Effect of adding the same glucose concentration at different time on the enzyme catalytic synthesis of glutathione
分别在酶反应第2、3、4小时添加83.33 mmol/L葡萄糖,检测反应过程中合成GSH的浓度,结果见图4。由图4可知,在第2小时补加葡萄糖,GSH转化率为30.20%;在第3小时补加葡萄糖,其高点GSH转化率达到33.08%;在第4小时补加葡萄糖的效果与在第2小时补加相近。结果表明,在第3小时补加葡萄糖时机合适。
2.3.4 葡萄糖多点流加策略对酶催化合成GSH的影响
选择在第2、3、4小时各流加27.78 mmol/L葡萄糖,流加总量控制83.33 mmol/L葡萄糖,并以第3小时添加葡萄糖作为对照,实验跟踪反应过程中合成GSH的浓度,结果见图5。由图5可知,采用多点葡萄糖能量流加操作时,反应液中GSH转化合成含量稳定增加,其GSH转化率最高达到35.81%。结果表明,分批多次流加葡萄糖能够避免一次性添加所引起的葡萄糖过快消耗而导致的反应过程区间能量供应不足现象,能够较好地稳定和维持反应系统的能量再生和供应,保障细胞酶催化合成GSH的能量需求,提高酶催化转化效率[20]。

图5 不同补加葡萄糖方式对酶催化合成谷胱甘肽的影响Fig.5 Effect of different adding ways of glucose on the enzyme catalytic synthesis of glutathione
2.4 添加能量前体腺苷对酶催化合成GSH的影响
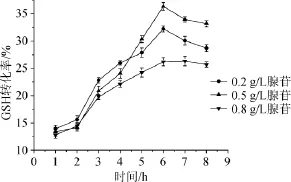
图6 添加不同浓度腺苷对酶催化合成谷胱甘肽的影响Fig.6 Effect of different adenosine concentrations on the enzyme catalytic synthesis of glutathione
腺苷是能量ATP的前体,添加少量腺苷,有利于改善初始酶反应液的能量水平,提高GSH合成效率。实验向反应液中分别添加0.2 g/L、0.5 g/L、0.8 g/L的腺苷,考察过程GSH催化转化效率,结果见图6。由图6可知,向初始反应液中添加不同浓度腺苷后,细胞酶催化合成GSH的起动和反应速度明显加快,当添加0.2 g/L腺苷时,反应6 h,GSH转化率为32.26%;初始反应液中添加0.5 g/L的腺苷时,合成GSH速度在第4~6小时间明显提高,反应6 h合成GSH转化率最高为36.37%;当初始反应液中添加0.8 g/L腺苷时,其GSH合成速度和转化率提高不大,其原因可能是由于反应液中腺苷浓度过高,ATP转化率降低而且大量未转化的中间体ADP抑制GSH的合成致使GSH转化率降低[21-22]。结果表明,添加适当浓度的腺苷,能够提高初始反应液中能量ATP的浓度,有利细胞酶催化合成GSH。
2.5 添加腺苷和葡萄糖流加组合能量策略对酶催化合成GSH的影响
反应液初始添加0.5 g/L腺苷,酶催化合成反应至第2、3、4小时分别流加27.78 mmol/L的葡萄糖,组合调控反应系统中的能量供应,跟踪测定酶反应过程中合成GSH的浓度,结果见图7。由图7可知,组合添加腺苷和葡萄糖流加能量供应操作时,反应液中合成积累的GSH浓度稳定上升,GSH转化效率明显提高,其反应液中合成GSH转化率最高达到41.57%。结果表明,过程中能量的稳定有序供应对酶反应GSH的合成和转化效率提高有促进作用。

图7 添加腺苷同时流加葡萄糖对酶催化合成谷胱甘肽的影响Fig.7 Effect of adding adenosine combined with fed-batch glucose on the enzyme catalytic synthesis of glutathione
3 结论
生物酶催化合成GSH是大多数生物体内重要的合成代谢活动之一。能量的供应直接影响着GSH的合成效率。筛选合适的能量糖源,调控酶催化合成GSH反应中的能量水平和再生效率,选择组合腺苷预加和葡萄糖流加能量策略,对酵母细胞酶催化合成GSH的转化效率有明显的提高作用。酶催化合成GSH研究结果表明,多次分批流加葡萄糖有利于稳定酶反应中的ATP再生和能量供应,提高合成GSH的转化率;采用组合初始反应液添加0.5 g/L腺苷和过程流加能量葡萄糖策略,能够提高初始反应液中ATP的浓度和稳定细胞酶催化合成GSH反应过程中的能量供给,其合成GSH转化率最高达到41.57%。结果表明,添加0.5 g/L腺苷和过程流加能量葡萄糖策略可以提高GSH的合成效率。
参考文献:
[2]RAGHUNATHAN V K,ELLIS E M,TETTEY J N A,et al.Involvement of reduced glutathione and glutathione reductase in the chronic toxicity of hexavalent chromium to monocytesin vitro[J].Toxicology,2007,231 (2):105-106.
[3]HARRIS I S,TRELOAR A E,INOUE S,et al.Glutathione and thioredoxin antioxidant pathways synergize to drive cancer initiation and progression[J].Cancer Cell,2015,27(2):211-222.
[4]JESCHKE V,GERSHENZON J,VASSÃO D G.Chapter eight-insect detoxification of glucosinolates and their hydrolysis products[J].Adv Bot Res,2016,80(2):199-245.
[5]OZER H K.The role of intermembrane space redox factors in glutathione metabolism and intracellular redox equilibrium[D].Columbia:University Of South Carolina,2015.
[6]ZHAO Y,BIAN X,YOU X,et al.Nystatin-enhanced glutathione productionbySaccharomycescerevisiaedependson γ-glutamylcysteine synthase activity and K+[J].Engi Life Sci,2013,13(2):156-162.
[7]HARA K Y,SHIMODATE N,HIROKAWA Y,et al.Glutathione production by efficient ATP-regeneratingEscherichia colimutants[J]. FEMS Microbiol Lett,2009,297(2):217-224.
[8]DEPONTE M.Glutathione catalysis and the reaction mechanisms of glutathione-dependentenzymes[J].BBA Gen Subjects,2013,1830(5):3217-3266.
[9]王玮玮,唐亮,周文龙,等.谷胱甘肽生物合成及代谢相关酶的研究进展[J].中国生物工程杂志,2014,34(7):89-95.
[10]肖蓉,罗慧珍,张小娟,等.干旱和盐胁迫条件下枣树谷胱甘肽过氧化物酶基因(ZjGPX)的差异表达及功能分析[J].中国农业科学,2015,48(14):2806-2817.
[11]宋冬梅,朱益波,周丽丽,等.酿酒酵母GSHⅠ基因的克隆、表达与结构分析[J].食品工业科技,2013,34(13):157-160.
[12]LI W,LI Z,YE Q.Enzymatic synthesis of glutathione using yeast cells in two-stage reaction[J].Bioproc Biosyst Eng,2010,33(6):675-682.
[13]贾建萍,裘娟萍,周彦钢.谷胱甘肽分批补料发酵动力学模型的建立[J].现代食品科技,2012,28(4):391-395.
[14]董永胜,马蕾,王艳杰.提高微生物谷胱甘肽产率措施的探讨[J].中国酿造,2016,35(5):6-9.
[15]LIN J,LIAO X,DU G,et al.Enhancement of glutathione production in a coupled system of adenosine deaminase-deficient recombinantEscherichia coliandSaccharomyces cerevisiae[J].Enzyme Microb Tech, 2009,44(5):269-273.
[16]YOSHIDA H,HARA K Y,KIRIYAMA K,et al.Enzymatic glutathione production using metabolically engineeredSaccharomyces cerevisiaeas awhole-cellbiocatalyst[J].Appl Microbiol Biot,2011,91(4):1001-1006.
[17]张倩,段超,牛书操,等.环境因子对发酵液中谷胱甘肽稳定性的影响[J].中国酿造,2016,35(8):48-53.
[18]CHEN J,XIE L,CAI J,et al.Enzymatic synthesis of glutathione using engineeredSaccharomyces cerevisiae[J].Biotechnol Lett,2013,35(8): 1259-1264.
[19]冮洁,卜红宇.酿酒酵母菌产谷胱甘肽的发酵条件研究[J].中国酿造,2009,28(1):59-61.
[20]劳兴珍,卞芙蓉,杨士彦,等.pH及流加葡萄糖对酵母分批发酵生产谷胱甘肽的影响[J].氨基酸和生物資源,2009,31(4):43-45,55.
[21]沈立新,魏东芝,张嗣良,等.大肠杆菌BL21(pTrc-gsh)与酵母耦联合成谷胱甘肽的研究[J].生物工程学报,2001,17(4):452-455.
[22]APONTOWEILP,BERENDSW.GlutathionebiosynthesisinEscherichia coliK 12 properties of the enzymes and regulation[J].Biochim Biophys Acta,1975,399(1):1-9.
Effect of energy strategy on the efficiency of enzymatic synthesis of glutathione
SUN Weijing,DUAN Chao,SUN Yiran,WAN Weijian,DUAN Xuehui*
(State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Nanchang University, Nanchang 330047,China)
Through the comparison and regulation of energy types and adding strategy in the process of glutathione(GSH)synthesis by cell enzyme catalytic precursor amino acids,the changes of GSH content in the reaction process were detected.The effects of energy types and adding modes on the conversion efficiency of GSH were investigated.The results showed that the glucose as energy carbon source had obvious effect on the conversion rate of GSH by yeast cells enzyme catalytic synthesis.The conversion rate of GSH by enzyme catalytic synthesis was 27.88%with addition of glucose 100 mmol/L in the initial reaction solution and 35.81%using batch addition glucose operation(adding glucose 27.78 mmol/L at 2 h,3 h, 4 h,respectively)in the initial reaction solution.In the process of energy supply strategy of enzyme reaction,the conversion rate of GSH by enzyme catalytic synthesis was increased to 36.37%with addition of adenosine 0.5 g/L in the initial reaction solution.When adding adenosine 0.5 g/L combined with glucose(adding glucose 27.78 mmol/L at 2 h,3 h,4 h,respectively)in the initial reaction solution,the conversion rate of GSH reached to 41.57%.
glutathione;cell enzymes;catalytic synthesis;energy
TQ920.1
0254-5071(2017)03-0049-05
10.11882/j.issn.0254-5071.2017.03.011
2016-12-22
南昌大学食品科学与技术国家重点实验室自由探索课题(SKLF-TS-201113)
孙维景(1990-),女,硕士研究生,研究方向为食品生物技术。
*通讯作者:段学辉(1958-),男,教授,博士,研究方向为食品生物技术。
