低分子肝素对脓毒症大鼠肝损伤保护作用的实验研究
2017-04-07潘毅何飞民陈军喜夏芝辉闫
潘毅++何飞民++陈军喜++夏芝辉++闫智杰++吴丽丽++程英

[摘要]目的 探讨低分子肝素对脓毒症大鼠肝损伤的保护作用及其机制。方法 将50只雄性SD大鼠随机分为对照组(10只)、模型组(20只)、治疗组(20只)。采用盲肠结扎穿刺法(CLP)制作脓毒症模型,模型组采用尾静脉注射生理盐水,治疗组采用尾静脉注射低分子肝素。检测大鼠血清在不同时间点的血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6)水平,并观察12 h肝脏组织病理学改变。结果 与对照组比较,模型组和治疗组各时间点的血清ALT、AST、PT、APTT、TNF-α、IL-6水平均明显升高(P<0.01)。与模型组比较,治疗组血清ALT、AST、PT、APTT、TNF-α、IL-6水平在不同时间点(6、12 h)有所降低(P<0.05)。治疗组12 h肝组织病理学改变较模型组明显改善。结论 低分子肝素对脓毒症大鼠肝损伤具有保护作用,其机制可能与其抗凝、抑制炎症因子的释放有关。
[关键词]低分子肝素;脓毒症;肝损伤;炎症因子
[中图分类号] R332 [文献标识码] A [文章编号] 1674-4721(2017)02(c)-0007-04
Experimental study of protective effect of low molecular weight heparin on hepatic injury induced by sepsis in rat
PAN Yi1 HE Fei-min2 CHEN Jun-xi1 XIA Zhi-hui1 YAN Zhi-jie1 WU Li-li1 CHENG Ying1
1.Intensive Care Unit,the 4th Affiliated Hospital of Nanchang University in Jiangxi Province,Nanchang 330000,China;2.Jiangxi Health Vocational College in Jiangxi Province,Nanchang 330000,China
[Abstract]Objective To explore the protective effect and mechanism of low molecular weight heparin in liver injury of septic rats.Methods 50 male SD rats were randomly divided into control group (10 cases),model group (20 cases) and treatment group (20 cases).Cecal ligation puncture (CLP) was used to made sepsis model.Rats in model group were given tail vein injection saline,and the treatment group was given tail vein injection low molecular weight heparin.The level of serum alanine aminotransferase (ALT),aspartate aminotransferase (AST),prothrombin time (PT),activated partial thromboplastin time (APTT),tumor necrosis factor-α(TNF-α) and interleukin-6 (IL-6) of rats′ serum was detected at different time points,and histopathological changes of liver were observed at 12 h.Results Compared with control group,the level of serum ALT,AST,PT,APTT,TNF-αand IL-6 in model group and treatment group at different time points were obviously increased (P<0.01).Compared with model group,the level of serum ALT,AST,PT,APTT,TNF-α and IL-6 in treatment group at different time points (6 and 12 h) were decreased (P<0.05).Histopathological changes of liver at 12 h in treatment group obviously improved than model group.Conclusion Low molecular weight heparin has protective effect on liver damage of septic rats,the mechanism may be related to anticoagulation and inhibition of release of inflammatory factors.
[Key words]Low molecular weight heparin;Sepsis;Liver injury;Inflammatory factor當前,脓毒症的发病率呈逐年上升趋势,由于脓毒症极易引起多脏器障碍综合征,是危重病患者死亡的主要原因之一。肝脏是人体重要的器官之一,承担包括生物合成、代谢、清除毒物和免疫防御等多种功能,同时它也易受各种代谢产物、毒物、微生物、循环因素等的侵害,是脓毒症早期易损器官[1],因此,寻求一种有效的药物防治患者脓毒症过程中诱发的急性肝损伤并提高其存活率已成为危重病医学亟待解决的问题。本实验采用经典的大鼠盲肠结扎穿孔脓毒症造模,使用低分子肝素从抗凝、调节炎症反应、减轻脂质过氧化损伤、清除自由基等途径共同干预,研究其对脓毒症诱发急性肝损伤的保护作用及其作用机制,为低分子肝素治疗脓毒症肝损伤提供实验基础和理论依据。
1材料与方法
1.1实验动物和脓毒症模型制备
选取购自南昌大学医学院实验动物中心的Wistar雄性大鼠50只,体重(180±20)g。以10%水合氯醛(3 ml/kg)经腹腔麻醉后,于前腹正中作长约2 cm切口,游离肠系膜和盲肠,在距盲肠末端1 cm处用7-0丝线结扎盲肠,用22G针头于盲端部位贯通穿刺2次,两针孔相距约3 mm,还纳肠管,逐层缝合关腹。术毕,碘伏消毒包扎伤口。对照组动物除不行盲肠结扎和穿孔外,其余步骤与CLP组相同。模型成功标准:发热(肛温超过自身正常参考值1℃)、心率加快(约为自身正常参考值的2倍)、呼吸频率加快(约为自身正常参考值的2倍),TNF-α等急性期血浆炎症介质显著增高等。
1.2实验分组
实验大鼠随机分为对照组10只,模型组20只、治疗组20只共三组50只;模型组给予生理盐水1 ml尾静脉注射,治疗组给予低分子肝素100 U/kg体重加生理盐水稀释至1 ml尾静脉注射。造模后根据6、12 h不同的观察的时间点将模型组和治疗组各分为2组,每组10只。
1.3主要试剂及仪器
10%水合氯醛(南昌大学医学院实验中心),0.9%氯化钠注射液100 ml∶0.9 g(江西科伦药业有限公司,批号:F16061904);低分子肝素钙注射液0.4 ml:4100AXaIU(河北常山生化药业有限公司,批号:F402160906);大鼠TNF-α、IL-6的ELISA试剂盒(武汉博士德生物工程公司)。生命体征监护仪(型号Bene View T5,深圳迈瑞公司),-70℃超低温冰箱(日本SANYO公司);高速台式离心机TCL-16G(上海安亭科学仪器厂);贝克曼AU2700全自动生化分析仪,希森美康CS-5100全自动血凝仪及与仪器配套的专用含钙组织凝血活酶试剂盒,德国GeneCore公司全自动酶联免疫检测仪,OLYMPUS BX41光学显微镜,HMIAS-200W多功能病理图像分析系统(武汉千屏影像技术有限责任公司)等。
1.4 样本采集
经右侧颈动脉放血采集血样2.0 ml,加入枸橼酸钠抗凝的真空采血管,立即离心(2000 r/min,7 min)后,取上清保存于-70℃的冰箱待检。为了避免批间误差的测量误差,在全部标本收集完后,一次性成批检验。
1.5肝脏病理标本的制作
在12 h采血后处死大鼠,留取各组大鼠肝组织同一部位以及取肉眼观察有脓点的部位,将取下来的组织用10%甲醛固定后,经脱水、石蜡包埋、切片、脱蜡、苏木精-伊红染色(HE染色)、透明处理封片后,利用多功能病理图像分析系统放大400倍照相,观察肝脏的病理学改变。
1.6 观察内容及方法
观察各组大鼠一般状况(血压、心率、体温、呼吸频率等生命体征变化)。各实验组大鼠手术后分别于0、6、12 h时间点从大鼠右侧颈动脉取血留取标本,全自动生化分析仪检测丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)水平;全自动血凝仪检测凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)水平;采用酶联免疫吸附法(ELISA)检测血清中的肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)水平。
1.7 统计学分析
应用SPSS 21.0软件进行数据处理,计量资料以均数±标准(x±s)表示,多组比较采用重复测量的方差分析,先行方差齐性检验,方差齐,各组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2结果
2.1低分子肝素对大鼠ALT、AST水平的影响
与对照组比较,模型组和治疗组各时间点血清ALT、AST水平均明显升高(P<0.01)。与模型组比较,治疗组血清ALT、AST水平降低,两组在不同时间点(6、12 h)差异有统计学意义(P<0.05)(表1)。
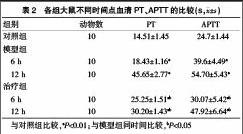
2.2各组大鼠不同时间点血清PT、APTT的比较
与对照组比较,模型组和治疗组各时间点的血清PT、APTT水平均明显升高(P<0.01)。与模型组比较,治疗组血清PT、APTT降低,两组在不同时间点(6、12 h) 差异有统计学意义(P<0.05)(表2)。
与对照组比较,aP<0.01;与模型组同时间比较,bP<0.05
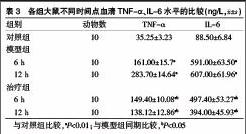
2.3各组大鼠不同时间点血清TNF-α、IL-6水平的比較
对照组血清TNF-α、IL-6处于低水平,模型组和治疗组各时间点的血清TNF-α、IL-6水平显著高于对照组(P<0.01)。与模型组比较,治疗组血清TNF-α、IL-6降低,两组在不同时间点(6、12 h)差异有统计学意义(P<0.05)(表3)。
2.4肝脏组织病理损伤的改变
制模后12 h光镜下可见,对照组肝细胞结构完整,肝小叶形态正常,肝血窦无扩张和炎性细胞浸润;模型组肝细胞肿胀、空泡样脂肪变性,肝索排列紊乱,肝血窦扩张,少量淤血,并可见炎性细胞没润,局灶性肝细胞坏死;治疗组肝细胞水肿、淤血减轻,轻度脂肪变性,肝细胞坏死明显减少,肝血窦中中性粒细胞浸润较轻(图1)
3讨论
脓毒症是由感染引起的全身炎症反应综合征,往往导致多器官功能受损,是危重病患者死亡的重要原因之。本实验选择脓毒症导致的肝损伤的大鼠作为研究对象,一是因为肝脏是脓毒症最常受累的器官之一,导致肝功能障碍甚至肝功能衰竭;二是肝细胞受到损伤时,使其代谢、合成、解毒、分泌与免疫功能发生障碍,这些变化又反过来加剧了机体的损伤,从而使脓毒症进一步恶化[2],因此,防治脓毒症肝损伤是脓毒症研究的重要课题,积极开展脓毒症肝损伤研究具有较大的现实意义。
脓毒症引起肝细胞损伤的发病机制复杂,研究表明,在脓毒症发生过程中肝组织经受了内毒素血症、炎症损伤和缺血缺氧性损伤等的多重打击[3]。脓毒症早期,肠黏膜通透性增高,肠道细菌或内毒素通过门静脉移位至肝脏,内毒素等作用于肝脏库普弗细胞可释放大量细胞因子[4];其中,促炎细胞因子如TNF-α、IL-1β和IL-6表达明显高于抗炎细胞因子如IL-4、IL-10,导致机体产生过度炎症反应[5],这些炎症反应进一步通过炎症级联反应,生成大量氧自由基和过氧化反应产物,引发膜脂质过氧化反应,导致肝细胞膜及线粒体膜完整性破坏,细胞及线粒体肿胀,呼吸链完整性遭受破坏,ATP合成减少,能量代谢障碍,引起肝细胞坏死或凋亡[6]。在脓毒症时,机体处于高代谢状态,肝脏是参与众多物质代谢的重要器官,多种激素、神经、体液因子等可引起肝脏发生高代谢,如蛋白合成与分解均增加、糖异生增强,这使肝脏氧耗超过氧供。此时即使肝血流量不减少,肝脏也存在相对性缺血、缺氧[7]。同时,肝脏微血管收缩、黏附分子过度表达、吞噬细胞功能下降、分泌型细胞因子(IL-1、血小板活化因子等)产生等通过物理性阻塞和炎症性损伤加剧了肝脏微循环障碍,使肝脏缺氧加重,也是脓毒症引起肝细胞损伤的重要原因[8]。
在针对脓毒症肝损伤治疗方面,依据诸多可能的发病机制,许多学者采用了相应的保肝药物治疗,如以异甘草酸镁为代表的抗炎类药物,以多烯磷脂酰胆碱为代表的肝细胞膜修复保护类药物,以谷胱甘肽为代表的解毒类药物,以水飞蓟素为代表的抗氧化类药物,以S-腺苷蛋氨酸为代表的利胆类药物等。脓毒症肝损伤的发病机制是多种因素迭加的,是一个十分复杂的过程,上述药物在某一方面,一定程序上具有一定作用,但尚未完全解决根本问题。近20多年来治疗脓毒症的重点主要是针对体内失控的炎症反应,包括各种炎症介质的单克隆抗体、各种致炎细胞因子的特异性抑制剂及糖皮质激素等。但是多项大规模、多中心的临床试验结果均未证实这种抗炎治疗能够改善脓毒症患者的预后[9]。
多项研究表明,在脓毒症过程中凝血系统在内毒素等细菌成分和单核细胞、内皮细胞表达的组织因子及大量释放的炎性介质损伤血管内皮细胞的共同作用下被激活[10];同时,纤溶途径因纤溶酶原激活物抑制剂-1(PAI-1)产生的增加,导致纤溶酶原转化成纤溶酶显著减少,引起机体的凝血、纤溶系统功能紊乱[11];此外, 脓毒症肝功能不全,生理性抗凝物质如抗凝血酶Ⅲ、蛋白C系统和组织因子途径抑制物的在肝脏合成受阻,也参与了脓毒症凝血功能障碍的发生、发展。这些炎症反应和凝血激活的相互促进、相互影响构成了脓毒症的病理、生理过程[12],随着对脓毒症炎症和凝血两途径相互间作用的认识不断加深,现已发现,脓毒症炎症反应和凝血功能紊乱造成的微循环障碍与脓毒症发生、发展及预后密切相关[13],利用抗凝物质对脓毒症进行干预以改善各组织器官损伤已成为脓毒症治疗研究的热点[14]。基于这些最新研究成果,本研究探讨低分子肝素对脓毒症大鼠肝损伤保护作用的可行性及其相关机制,期望为临床治疗脓毒症肝损伤找到确实有效,又经济可行的治疗方法。
低分子肝素由普通肝素经化学或酶学方法解聚而成,相对分子质量为45 000 D,因为其具有相对较低的抗凝活性,在临床上弥补了普通肝素容易导致出血、生物利用度低等缺点而被广泛应用。低分子肝素作为一种抗凝药物,具有快速和持续抗血栓形成作用,能够抑制脓毒症患者炎性介质和氧自由基的释放,抑制细胞黏附和激活、补体系统的激活,保护血管内皮细胞的连续性和完整性,从而改善脓毒症患者微循环功能[15]。低分子肝素治疗脓毒症的临床报告呈增多趋势,有一定疗效,但基础研究很少,缺乏基础理论依据,有待于进一步研究。本实验结果表明低分子肝素对肝损伤具有保护作用。应用低分子肝素后,治疗组ALT、AST、PT、APTT、TNF-α、IL-6较模型组明显下降,表明低分子肝素能够抑制炎症瀑布效应和凝血级联反应,改善凝血功能障碍,从而减轻脓毒症肝损伤,改善肝功能。
综上所述,低分子肝素对脓毒症大鼠肝损害具有保护作用,其机制可能与其抗凝、抑制炎症因子的释放有关。
[参考文献]
[1]吴孟超,李梦东.实用肝病学[M].北京:人民卫生出版社,2011:23-59.
[2]姚咏明.现代脓毒症理论与实践[M].北京:科学出版社,2005:623-627.
[3]陈智,朱海红,杨英.细胞因子风暴与肝衰竭[J].临床肝胆病杂志,2014,30(10):981-983.
[4]马思远,张雅萍.肠源性内毒素损害防治策略思考[J].中华烧伤杂志,2011,27(2):125-127.
[5]Yang Q,Shi Y,He J,et al.The evolving story of macrophages in acute liver failure[J].Immunol Lett,2012,147(1-2):1-9.
[6]Sakaguchi S,Furusawa S.Oxidative stress and septic shock:metabolic aspects of oxygen-derived free radicals generated in the liver during endotox emia[J].FEMS Immunol Med Microbiol,2006,47(2):167-177.
[7]Schiff ER,Maddrey WC,Sorrell M.希夫肝臟病学[M].11版.王福生,译.北京:北京大学医学出版社,2015:849-851.
[8]Albuszies G,Radermacher P,Vogt J,et al.Effect of increased cardiac output on hepatic and intestinal microcirculatory blood flow,oxygenation,and metabolism in hyperdynamic murine septic shock[J].Crit Care Med,2005,33(10):2332-2338.
[9]马晓春.应重视脓毒症的抗凝治疗[J].中国危重病急救医学,2010,22(9):516-517.
[10]Napoleone,Di Santo A,Bastone A,et al.Long pentraxin PTX3 up regulates tissue factor expression in human endothelial cells:a novel link between vascular inflammation and clotting activation[J].Arterio Scler Thromb Vasc Biol,2002,22 (5):782-787.
[11]Tymi K.Critical role for oxidative stress platelets and coagulation in capillary blood flow impairment in sepsis[J].Microcirculation,2011,18 (2):152-162.
[12]Comet AD,Smit EG,Beishuizen A,et al.The role of heparin and allied compounds in the treatment of sepsis[J].Thromh Haernoat,2007,98(3):579-586.
[13]Clemens F,Christian JW.Effects of anticoagulant strategies on activation of inflammation and coagulation[J].Expert Op in Biol Ther,2007,7 (6):855-870.
[14]Boos CJ,Goon PK,Lip GY.The endothelium,inflammation,and coagulation in sepsis[J].Clin Pharmacol Ther,2006,79(1):20-22.
[15]马晓春.应加深对脓毒微循环功能障碍的认识[J].中国危重病急救医学,2011,23(2):66.
(收稿日期:2016-11-09 本文编辑:许俊琴)
