遵循指南推广伏立康唑血浓度监测
2017-04-07肖桂荣徐珽吕晓菊
肖桂荣,徐珽,吕晓菊
(1.四川大学华西医院临床药学部,四川 成都 610041;2.四川大学华西医院感染性疾病中心,四川 成都 610041)
遵循指南推广伏立康唑血浓度监测
肖桂荣1,徐珽1,吕晓菊2
(1.四川大学华西医院临床药学部,四川 成都 610041;2.四川大学华西医院感染性疾病中心,四川 成都 610041)
如何遵循指南,根据患者生理病理情况并结合药代动力学特点,开展伏立康唑血药浓度监测以期安全有效地抗感染,是每一位感染医师和临床药师的追求与面临的问题。本文分析了实施伏立康唑血药浓度监测的必要性,综述了指南中关于伏立康唑血浓度监测指征及目标浓度的循证推荐,以推进伏立康唑个体化给药。
伏立康唑;血药浓度监测;稳态谷浓度;指南;指征
伏立康唑是一种较新的唑类抗真菌药,越来越多地用于曲霉菌、新型隐球菌、克柔念珠菌、耐氟康唑光滑念珠菌等真菌感染[1-4],尤其被推荐为侵袭性曲霉病的首选药物[1-2]。由于该药体内药代动学个体差异大且易与其他药物发生相互作用,患者内及患者间存在血药浓度差异,浓度较高时发现了毒副作用,浓度较低时疗效降低,故需监测血药浓度。目的是通过血药浓度监测,制订和调整个体化给药方案,提高疗效,保障用药安全[5]。研究表明,侵袭性真菌感染使用伏立康唑者行血药浓度监测,可有效优化抗菌效果、降低毒副作用[6-9]。指南[1-3,6-13]推荐使用伏立康唑的患者监测血药浓度以指导临床用药。
1 实施伏立康唑血药浓度监测的必要性
血药浓度监测为感染医师和临床药师提供了一个判断临床药物治疗的客观指标,但不是每种药物都需要实施血药浓度监测,应结合药物药学特点及患者生理病理情况,理清血药浓度监测的必要性,方能掌握血药浓度监测的指征。
1.1 伏立康唑血药浓度、与疗效及不良反应相关但治疗窗窄
伏立康唑不良反应以消化系统、神经系统、眼部及附属器官等损害为主,肝毒性和神经毒性(脑病、肌痉挛、幻觉)发生率较高[14]。其不良反应尤其是肝毒性、神经毒性,在一定程度上限制了伏立康唑的临床应用[15]。
Hamada Y等[16]Meta分析发现伏立康唑谷浓度≥1 μg/mL时疗效增加[OR 7.23,95%CI(2.84,18.37),P<0.000 1];谷浓度≥4 μg/mL时神经毒性发生率增加[OR 3.63,95%CI(1.84,7.17),P=0.000 2],谷浓度≥5 μg/mL时肝毒性发生率增加[OR 2.23,95%CI(1.12,4.46),P=0.02],发生视觉障碍者血药浓度高于未发生者;推荐谷浓度范围1~4 μg/mL。
Luong ML等[17]Meta分析发现伏立康唑谷浓度≥1.0~2.2 μg/mL时疗效增加[72.4% vs. 63.1%,P=0.001;OR 2.30,95% CI(1.39,3.81),I2=66%],谷浓度1 μg/mL可作为预测疗效的临界点[OR 1.94,95% CI(1.04,3.62),P=0.04];谷浓度≥4~6 μg/mL时不良反应风险增加[31.4% vs. 17.8%,P<0.001;OR 4.17,95% CI(2.08,8.36),I2=79%],肝毒性风险增加约4倍[12.4% vs. 4.2%,P<0.001;OR 3.70,95% CI(2.08,6.59),I2=37%],神经毒性风险增加5.6倍[28.9% vs. 16.5%,P=0.002;OR 5.60,95% CI(1.84,17.00),I2=74%], 谷 浓 度6 μg/mL可作为预测不良反应的临界点[OR 4.60,95% CI(1.49,14.16),P=0.008];推荐谷浓度范围1~6 μg/mL,以期疗效最大化及不良反应最小化。
可见,伏立康唑血药浓度与治疗作用及不良反应相关,谷浓度可作为预测疗效及不良反应的指标,有可供参考的谷浓度范围,但是治疗窗窄,具有实施血药浓度监测的指征。Park WB等[18]通过随机盲法单中心研究发现血药浓度监测可降低药物不良反应发生率(4% vs. 17%,P=0.02)。
1.2 伏立康唑血药浓度个体差异大
伏立康唑成人口服后绝对生物利用度可达96%,约0.5~2 h血药浓度达高峰,血浆蛋白结合率约为58%,稳态血药浓度下的分布容积4.6 L/kg,主要经肝脏代谢,体内呈非线性药代动力学特点,口服200 mg后终末半衰期约为6 h。但伏立康唑体内血药浓度差异很大,原因如下。
1.2.1 食物降低口服生物利用度伏立康唑成人口服生物利用度>90%(餐前1 h或餐后2 h服药),但若与食物同服,其生物利用度降低22%,高脂饮食可致药时曲线下面积(Aarea Under the Curve,AUC)降低24%,峰浓度降低34%[19]。低血药浓度在口服治疗的患者中更多见。
1.2.2 年龄因素伏立康唑血药浓度在患者内及患者间波动很大,尤其是儿童。成人体内伏立康唑的清除具有饱和性,呈非线性动力学特征,即最大血药浓度及药时曲线下面积的增加与药物剂量的增加不成比例[7,9]。相反,儿童口服生物利用度明显低于成人(文献报道[5]儿童生物利用度在50%~80%),肝微粒体代谢更快,清除速率是成人的3倍,若儿童按成人每12 h接受4 mg/kg的剂量给药,体内呈线性动力学特征[6,20]。
Hamada Y等[16]Meta分析还发现老年患者(年龄>60岁)血药浓度升高[WMD 4.53,95% CI(0.20,8.86),P=0.04]。
1.2.3 药物相互作用广泛伏立康唑经细胞色素P450酶(Ccytochrome P450 enzyme,CYP450)3A4、2C19、2C9代谢,而体内约40%的药物主要由这几种酶代谢。如果因药物因素或遗传因素造成代谢酶活性个体差异,则会影响伏立康唑的代谢,导致血药浓度降低而治疗无效,或血药浓度升高而中毒。
真菌病可发生于任何年龄、性别,免疫功能低下者更为多见,如合并糖尿病、免疫系统疾病、器官移植、结核病、艾滋病者,而这些患者尤其是老年患者往往还合并高血压病、冠状动脉粥样硬化性心脏病等疾病,需要降糖药、免疫抑制药、激素、抗结核药、抗逆转录病毒药、β肾上腺素能受体拮抗药、血管紧张素转换酶抑制药、血管紧张素受体拮抗药、钙通道阻滞药、他汀类降脂药等治疗。这些药物大多可抑制或诱导CYP3A4、2C19、2C9活性,尤其是CYP3A4活性(临床上约30%的药物经CYP3A4代谢),与伏立康唑发生相互作用,致血药浓度波动。同时,伏立康唑本身也是CYP3A4、2C19、2C9的抑制药,可能使经过这些酶代谢的药物(如奎尼丁、西沙比利、西罗莫司、抗结核药、环孢素、他克莫司、磺脲类降糖药)血药浓度升高,而禁止联用或需剂量调整。综合指南[1-3,6-13,24]及说明书中关于伏立康唑相互作用的内容见表1。
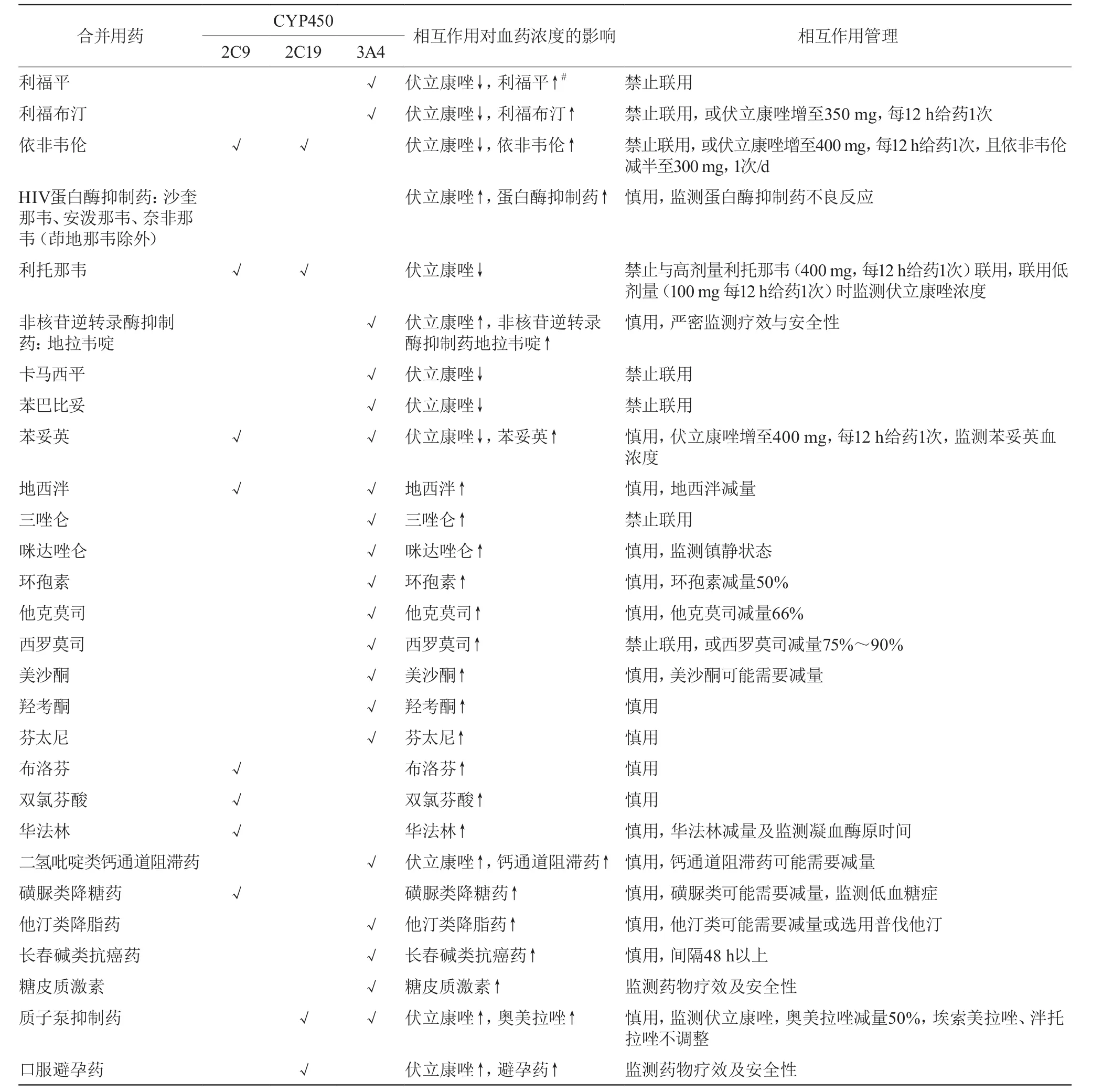
表1 伏立康唑药物相互作用
可见,伏立康唑相互作用是复杂的,且有时是双向性的,使得在多药联合过程中无法预测血药浓度。另外,伏立康唑相互作用除了通过CYP450介导外,还可通过影响尿苷二磷酸葡萄糖醛酸转移酶活性、增加或降低药物转运体P糖蛋白的表达而表现出来。
药物相互作用广泛却缺乏剂量调整建议。说明书或文献往往只报告了药物存在相互作用,而未给出联合用药剂量调整建议;即使给出了个别药物的调整建议,也只是22种药物之间的相互作用数据,很难预测33种及以上药物间的相互作用。然而,血药浓度监测可以解开相互作用的困扰。
1.2.4 CYP2C19基因多态性代谢酶活性还受遗传因素影响,即CYP2C19存在基因多态性,分快代谢型(正常)与慢代谢型,白种人和黑种人中慢代谢型比例3%~5%,而亚洲人中慢代谢型比例高达15%~20%[21]。慢代谢型的伏立康唑血药浓度约为快代谢型的2~4倍甚至更高[7]。Weiss J等[22]多元回归分析显示,49%的伏立康唑用药差异可由CYP2C19基因多态性解释(P<0.000 1)。
既然伏立康唑的药物暴露量与CYP2C19基因多态性有显著相关性,那么可通过检测基因型确定初始给药剂量,使患者及时达到有效血药浓度范围。但CYP2C19基因多态性只是影响伏立康唑药学特征的一方面,其影响易被药物-药物、药物-疾病相互作用所掩盖,基因型检测无法预测其他代谢酶、转运体、相互作用的综合影响,单纯依赖CYP2C19基因型检测结果难以准确指导临床用药,这是基因检测指导临床用药的局限性。故需结合CYP2C19基因型、药物相互作用及非线性药动学特征来设计初始给药方案,并在用药过程中根据血药浓度监测结果调整方案。
综上所述,伏立康唑具有非线性药代动力学特征,同一剂量可出现较大的血药浓度差异,治疗窗窄,联合用药易产生相互作用,肝药酶诱导剂可致药代动力学及药效动力学显著改变,代谢酶CYP2C19具有遗传多态性。以上影响药代动力学及药效动力学特征的诸多因素,均是实施血药浓度监测的指征。
2 伏立康唑血药浓度监测指南推荐
伏立康唑2002年在美国上市,2008年被美国感染病学会曲霉病指南[23]列为侵袭性曲霉病的首选药物,指南中还提及有限的资料显示血药浓度监测对优化伏立康唑安全性(也可能包括疗效)起重要作用。随着研究的深入,近5年来多数指南[1-3,6-13]都开始推荐对使用伏立康唑的患者监测血药浓度,以达到临床安全有效的用药目的。部分学会机构还出台了伏立康唑血药浓度监测标准,详细列出血药浓度监测指征、目标浓度范围及方案调整办法[6-9,24]。
2.1 伏立康唑血药浓度监测指征
指南对伏立康唑血药浓度监测指征的推荐见表2。
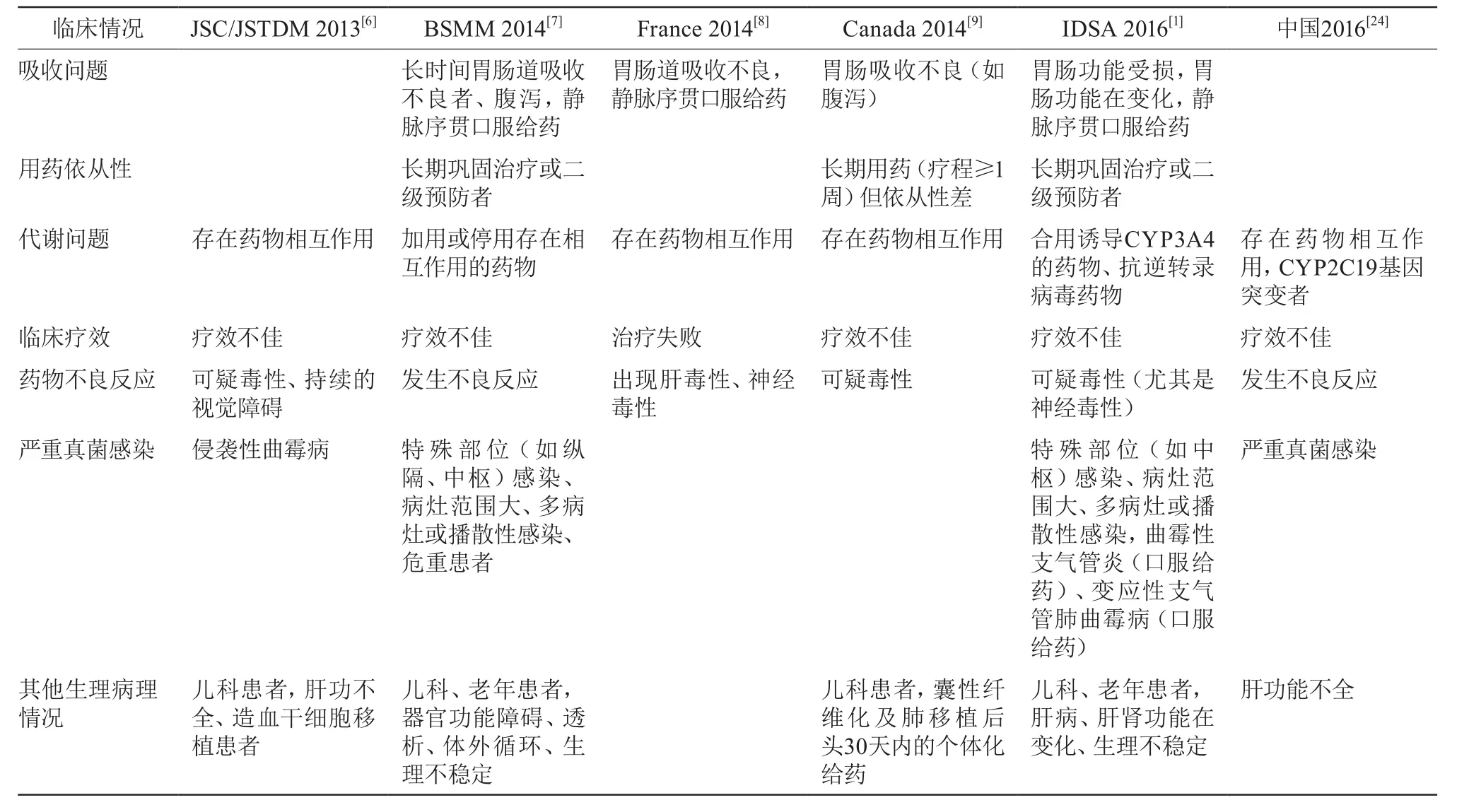
表2 伏立康唑血药浓度监测指征推荐
可见,对于接受伏立康唑治疗的大部分患者,如存在吸收或代谢问题、发生可疑不良反应、严重侵袭性真菌感染的患者,都应监测血药浓度。对于接受伏立康唑治疗的大部分患者,如存在胃肠功能受损或变化、肝功能不全、静脉序贯口服给药、并用或停用存在相互作用的药物、严重侵袭性真菌感染、疗效不佳、发生可疑不良反应、儿科及移植患者,都应监测血药浓度。
2.2 目标浓度及检测方法
指南[6]指出,伏立康唑药时AUC/MIC、谷浓度/ MIC比值均与疗效相关,谷浓度/MIC比值2~5时可达最大疗效,谷浓度可预测疗效与安全性;监测谷浓度比AUC方便可行;不推荐常规监测峰浓度来预测临床疗效。故对伏立康唑行血药浓度监测时,建议监测稳态谷浓度。
血药浓度监测标本需在药物达稳态后,下次给药前30 min内采集。伏立康唑被给予负荷剂量时可在第3天达稳态血药浓度,未予负荷剂量则需4~7天达稳态血药浓度;故建议给予负荷剂量,首次监测时机不应早于第5次给药前(第3天)[24]。可予高效液相色谱法、生物检定法监测血药浓度[6-9],高效液相色谱法不易被其他因素干扰,被推荐用于血药浓度监测,而生物检定法敏感性和特异性低于高效液相色谱法[6]。指南推荐的目标浓度、采样时间、检测技术见表3。
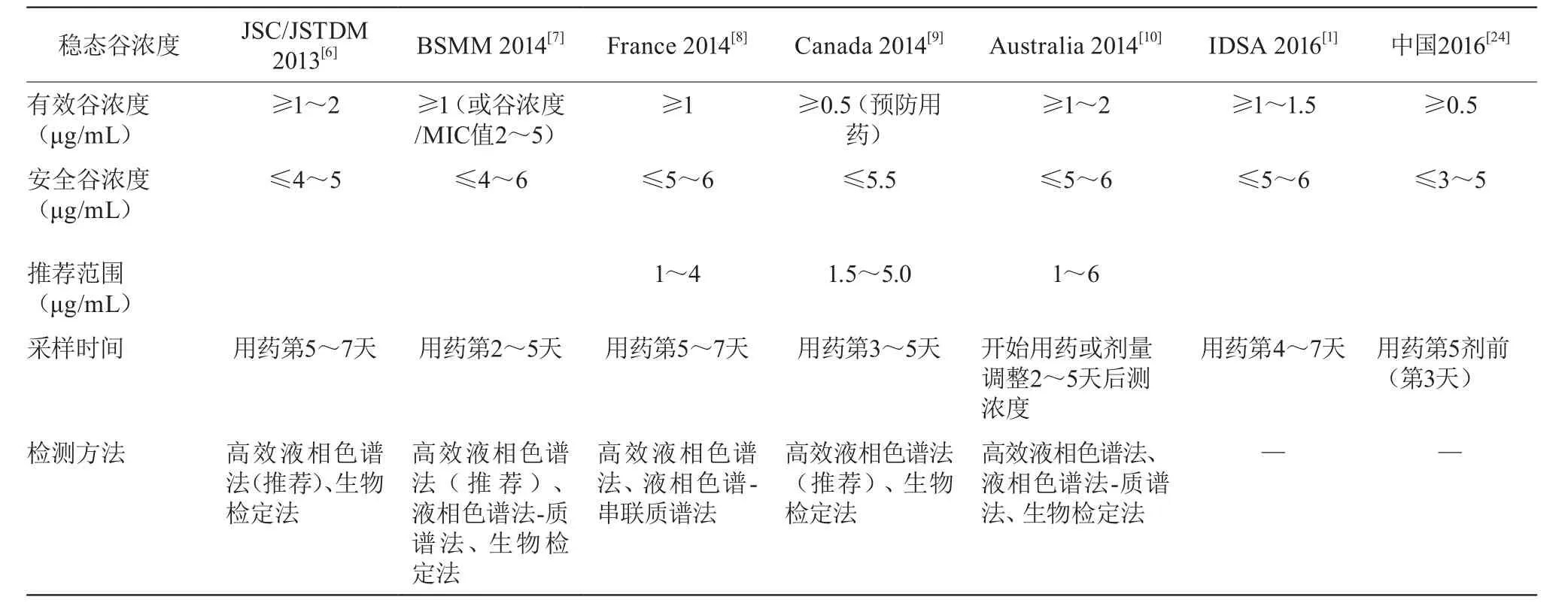
表3 伏立康唑血药浓度目标范围及检测方法推荐
可见,指南多推荐稳态谷浓度下限1 μg/mL(对于预后较差的患者如中枢感染、病灶范围大、多病灶或播散性感染,可能需要更高的浓度如2 μg/mL),上限4~6 μg/mL。
2.3 给药方案设计与调整
若给予常规剂量的伏立康唑,仅49%(29/59)的患者血药浓度达标,达标率低[25]。因此,既要给予负荷剂量使血药浓度快速达稳态,也要结合患者年龄、并用药物相互作用等因素个体化设计合理的初始给药方案。儿童每12 h接受3 mg/kg或4 mg/kg的伏立康唑后表现出线性清除关系,所以想要儿童获得与成人相似的血药浓度则需要提高伏立康唑的给药剂量,以保证儿科患者最佳的血药浓度和疗效[3,26-27]。成人及儿童初始给药方案见表4。
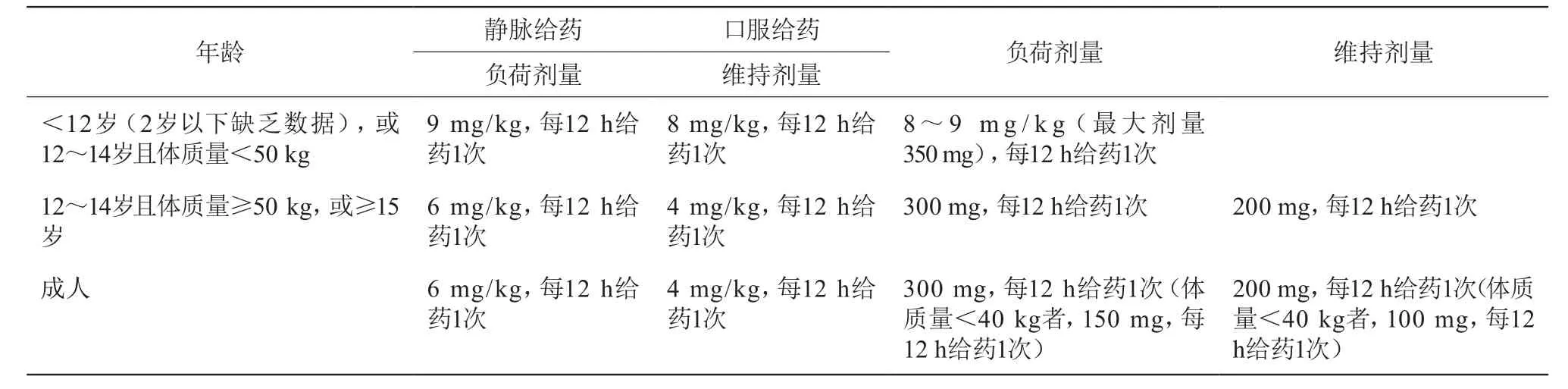
表4 伏立康唑初始给药剂量推荐
给予上述方案后监测稳态谷浓度,后续根据监测结果调整给药方案。若血药浓度监测结果未在目标范围内,需检查患者用药依从性,调整伏立康唑剂量,必要时停用有相互作用的并用药物[7,9]。若稳态血药浓度检测值低于目标浓度范围下限,则伏立康唑剂量增加50%(成人静脉给药增至6 mg/kg,每12 h给药1次,口服给药从200 mg,每12 h给药1次,增至300 mg,每12 h给药1次),若检测值高于目标浓度范围上限则剂量减少25%,若检测值高于10 μg/mL或发生不良事件(如肝毒性、精神/神经毒性、视觉障碍),则停药一剂,之后维持剂量减少50%[7,9,24]。调整伏立康唑剂量、从静脉序贯口服给药、加用或停用影响伏立康唑的药物时,推荐2~5天后重新监测伏立康唑谷浓度水平[9,24]。
综上所述,伏立康唑在抗真菌治疗中有着非常重要的作用,疗效确切应用广泛,具有可供参考的治疗药物浓度范围和中毒水平,治疗作用、不良反应与血药浓度相关,药代动力学特征可被多因素如患者年龄、给药途径、CYP450、药物相互作用、人种、CYP2C19基因多态性等影响,稳态血药浓度波动大。故推荐对于接受伏立康唑治疗的大部分患者,如存在吸收或代谢问题(尤其是药物相互作用)、发生可疑不良反应、严重侵袭性真菌感染的患者,均应监测血药浓度;达到稳态血药浓度后,下次用药前30 min内抽血监测谷浓度(首次监测时机应不早于第5次给药前);稳态血药谷浓度参考值1~5 μg/mL;并根据监测结果调整给药剂量,使伏立康唑在目标浓度范围内高效低毒地发挥治疗作用。目前,伏立康唑血药浓度监测在国内还处于起步阶段,值得在大多数医疗机构推广,以期安全有效地应用药物。
[1] Patterson TF, Thompson GR 3rd, Denning DW, et al. Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America[J].Clin Infect Dis,2016,63(4):1-60.
[2] Denning DW, Cadranel J, Beigelman-Aubry C, et al. Chronic pulmonary aspergillosis: rationale and clinical guidelines for diagnosis and management[J].Eur Respir J, 2016,47(1):45-68.
[3] Pappas PG, Kauffman CA, Andes DR et al. Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of America[J].Clin Infect Dis,2016,62(4):1-50.
[4] Perfect JR, Dismukes WE, Dromer F, et al. Clinical Practice Guidelines for the Management of Cryptococcal Disease: 2010 Update by the Infectious Diseases Society of America[J].Clin Infect Dis,2010,50(3):291-322.
[5] 中华医学会儿科学分会临床药理学组.儿童治疗性药物监测专家共识[J].中华儿科杂志,2015,53(9):650-659.
[6] Hamada Y, Tokimatsu I, Mikamo H, et al. Practice guidelines for therapeutic drug monitoring of voriconazole: a consensus review of the Japanese Society of Chemotherapy and the Japanese Society of Therapeutic Drug Monitoring[J].J Infect Chemother,2013,19(3):381-392.
[7] Ashbee HR, Barnes RA, Johnson EM, et al. Therapeutic drug monitoring (TDM) of antifungal agents: guidelines from the British Society for Medical Mycology[J].J Antimicrob Chemother, 2014,69(5):1162-1176.
[8] Scodavolpe S, Quaranta S, Lacarelle B, et al. Triazole antifungal agents: practice guidelines of therapeutic drug monitoring and perspectives in treatment optimization[J]. Ann Biol Clin (Paris), 2014,72(4):391-404.
[9] Laverdiere Michel, Bow EJ, Rotstein C, et al. Therapeutic drug monitoring for triazoles: A needs assessment review and recommendations from a Canadian perspective[J].Can J Infect Dis Med Microbiol,2014,25(6):327-343.
[10] Chau MM, Kong DC, van Hal SJ, et al. Consensus guidelines for optimising antifungal drug delivery and monitoring to avoid toxicity and improve outcomes in patients with haematological malignancy, 2014[J].Intern Med J,2014,44(12b):1364-1388.
[11] Fleming S, Yannakou CK, Haeusler GM, et al. Consensus guidelines for antifungal prophylaxis in haematological malignancy and haemopoietic stem cell transplantation, 2014[J].Intern Med J,2014,44(12b):1283-1297.
[12] Limper AH, Knox KS, Sarosi GA, et al. An official American Thoracic Society statement: Treatment of fungal infections in adult pulmonary and critical care patients[J]. Am J Respir Crit Care Med,2011,183(1):96-128.
[13] 张婴元,汪复.念珠菌病诊断与治疗:专家共识[J].中国感染与化疗杂志,2011,11(2):81-95.
[14] 薛阳,李红磊,张薇,等.伏立康唑抗真菌作用研究进展[J].人民军医,2016,59(7):746-748.
[15] Elewa H, El-Mekaty E, El-Bardissy A, et al. Therapeutic Drug Monitoring of Voriconazole in the Management of Invasive Fungal Infections: A Critical Review[J].Clin Pharmacokinet, 2015,54(12):1223-1235.
[16] Hamada Y, Seto Y, Yago K, et al. Investigation and threshold of optimum blood concentration of voriconazole:a descriptive statistical meta-analysis[J].J Infect Chemother, 2012,18(4):501-507.
[17] Luong ML, Al-Dabbagh M, Groll AH, et al. Utility of voriconazole therapeutic drug monitoring: a metaanalysis[J].J Antimicrob Chemother, 2016,71(7):1786-1799.
[18] Park WB, Kim NH, Kim KH, et al. The effect of therapeutic drug monitoring on safety and effcacy of voriconazole in invasive fungal infections: a randomized controlled trial[J].Clin Infect Dis,2012,55(8):1080-1087.
[19] Purkins L, Wood N, Kleinermans D, et al. Effect of food on the pharmacokinetics of multiple-dose oral voriconazole[J]. Br J Clin Pharmacol,2003,56(S1):17-23.
[20] Soler-Palacin P, Frick MA, Martin-Nalda A, et al. Voriconazole drug monitoring in the management of invasive fungal infection in immunocompromised children: a prospective study[J].J Antimicrob Chemother,2012,67(3):700-706.
[21] Chen L, Qin S, Xie J, et al. Genetic polymorphism analysis of CYP2C19 in Chinese Han populations from different geographic areas of mainland China[J].Pharmacogenomics,2008,9(6):691-702.
[22] Weiss J, Ten Hoevel MM, Burhenne J, et al. CYP2C19 genotype is a major factor contributing to the highly variable pharmacokinetics of voriconazole[J].J Clin Pharmacol,2009,49(2):196-204.
[23] Walsh TJ, Anaissie EJ, Denning DW, et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America[J].Clin Infect Dis,2008,46(3):327-360.
[24] 中国药理学会治疗药物监测研究专业委员会.中国伏立康唑个体化用药指南推荐意见初稿[EB/OL]. (2016-7-14)[2016-10-15].http://www.tdmchina.org/portal. php?mod=view&aid=464.
[25] Ceesay MM, Couchman L, Smith M, et al. Triazole antifungals used for prophylaxis and treatment of invasive fungal disease in adult haematology patients: Trough serum concentrations in relation to outcome[J].Med Mycol,2016,54(7):691-698.
[26] Pascual A, Csajka C, Buclin T, et al. Challenging recommended oral and intravenous voriconazole doses for improved effcacy and safety:population pharmacokineticsbased analysis of adult patients with invasive fungal infections[J].Clin Infect Dis,2012,55(3):381-390.
[27] Boast A, Curtis N, Cranswick N, et al. Voriconazole dosing and therapeutic drug monitoring in children: experience from a paediatric tertiary care centre[J].J Antimicrob Chemother, 2016,71(7):2031-2036.
本文编辑:张钰
Popularization of Monitoring of Voriconazole Concentration in Blood According to the Guidelines
Xiao Gui-rong1, Xu Ting1, Lv Xiao-ju2
(1. Department of Clinical Pharmacy, West China Hospital of Sichuan University, Sichuan Chengdu 610041, China; 2. Center of Infectious Diseases, West China Hospital of Sichuan University, Sichuan Chengdu 610041, China)
It is a target and a challenge for a pharmacist to monitor the variconazole concentration in blood according to the relevant guidelines based on the pathophysiology and pharmacodynamics of patients so as to control infection safely and effectively. The necessity of monitoring the voriconazole concentration in blood is analyzed in this paper, while the evidence-based recommendations on the indication of therapeutic drug monitoring and the target concentrations of voriconazole are reviewed to promote the individual administration of voriconazole.
Voriconazole; Blood Drug Concentration Monitoring; Steady-state Trough Concentration; Guideline; Indication
R978.5;R969.1
A
10.3969/j.issn.2096-3327.2017.02.019
2016 - 11 - 11
肖桂荣,男,药师。研究方向:临床药学与感染性疾病合理用药。E-mail:407903196@qq.com
吕晓菊,女,博士,主任医师,教授。研究方向:感染性疾病诊疗。E-mail:lvxj3396@yahoo.com.cn
