氟喹诺酮C-3均三唑硫乙酸席夫碱的合成及抗菌抗肿瘤活性检测*
2017-04-07张会丽胡国强黄文龙
张会丽,李 珂,胡国强,黄文龙
1)郑州工业应用技术学院药学院 郑州 451150 2)河南大学药学院 河南开封 475001 3)中国药科大学新药研究中心 南京 210009
氟喹诺酮C-3均三唑硫乙酸席夫碱的合成及抗菌抗肿瘤活性检测*
张会丽1),李 珂1),胡国强2)#,黄文龙3)
1)郑州工业应用技术学院药学院 郑州 451150 2)河南大学药学院 河南开封 475001 3)中国药科大学新药研究中心 南京 210009
#通信作者,男,1964年3月生,博士,教授,研究方向:新药分子的设计与合成,E-mail:hgqxy@sina.com.cn
氟喹诺酮;均三唑;生物电子等排体;席夫碱;硫乙羧酸;抗菌抗肿瘤活性
目的:探讨由抗菌氟喹诺酮到抗肿瘤氟喹诺酮的构建新策略。方法:用均三唑杂环作为环丙沙星C-3羧基的生物电子等排体,硫乙酸和亚胺席夫碱为其功能修饰侧链,合成了10个新氟喹诺酮C-3均三唑硫乙酸席夫碱目标化合物(7a~7j),其结构经元素分析和光谱数据确证,评价其体外对标准金黄色葡萄球菌和大肠埃希菌及SMMC-7721、L1210和HL60 3种癌细胞的生长抑制作用。结果:目标化合物的抑菌活性明显低于母体环丙沙星,但抗肿瘤活性显著高于母体化合物,尤其是苯环含有羟基或氟原子的化合物,其IC50已达到微摩尔级,与对照阿霉素相当。结论:均三唑杂环作为氟喹诺酮C-3羧基的等排体,且被功能基侧链修饰是构建抗肿瘤氟喹诺酮分子的有效策略。
基于现有药物骨架或作用机制的药物设计是发现小分子化学药物的有效策略[1-2]。喹啉骨架是现有药物及天然生物碱的重要药效团结构单元[3-4],而抗菌氟喹诺酮羧酸(FQAs)药物不仅与天然抗肿瘤药喜树碱具有相同的喹啉药效团骨架,而且二者的作用靶标均为拓扑异构酶,因此,通过结构修饰可将氟喹诺酮的抗菌活性转化为抗肿瘤活性或双效抗菌抗肿瘤活性,有望发展一类新结构的先导化合物[5-6]。与此同时,前文已发现抗菌氟喹诺酮的C-3羧基并非是抗肿瘤活性所必需的药效团,可被其生物电子等排体酰腙[7]或噁二唑杂环等替代[8],这为抗肿瘤氟喹诺酮分子的构建提供了新思路。作者基于电子等排药物分子设计原理,把噁二唑环中的氧原子(O)用其电子等排体亚胺(NH)替代,亦即用[1,2,4]-三唑作为C-3羧基的生物电子等排体,同时用亚胺席夫碱和硫乙酸作为其功能修饰侧链,合成了氟喹诺酮C-3均三唑硫乙酸席夫碱目标化合物,并对其初步的构效关系进行了分析,为抗菌抗肿瘤氟喹诺酮分子的构建和结构优化提供指导。
1 材料与方法
1.1 合成路线 目标化合物7a~7j的制备路线见图1。环丙沙星(化合物1)经肼解到环丙沙星酰肼(化合物2),与二硫化碳缩合得C-3酰肼二硫代甲酸(化合物3),在碱性水溶液中发生分子内环合反应得到C-3 [1,3,4]-噁二唑硫醇(化合物4),接着与水合肼反应制得C-3氨基-[1,2,4]-三唑硫醇(化合物5),它与氯乙酸进行亲核取代反应得到C-3氨基-[1,2,4]-三唑硫乙酸(化合物6)。中间体氨基均三唑硫乙酸6分子中的氨基与苯甲醛或取代的苯甲醛通过缩合反应形成亚胺功能基而得到C-3均三唑硫乙酸席夫碱(化合物7a~7j)。
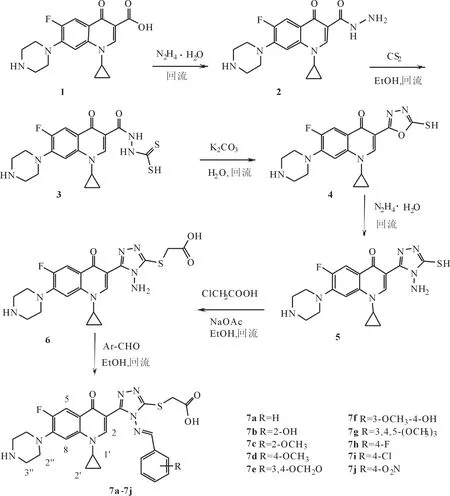
图1 目标化合物7a~7j的制备路线图
1.2 主要材料与仪器 环丙沙星(化合物1)(河南龙泉集团药业有限公司),化合物4按文献[8]的方法制备,其余试剂为分析纯。实验用细菌株由河南大学淮河临床医学院检验科提供,癌细胞株购自中国科学院细胞库。K-B数字熔点仪(上海精密科学仪器厂),Bruker AM-400型核磁共振仪(瑞士Bruker公司),Esquire LC型质谱仪(德国Bruker公司),PE2400-Ⅱ型元素分析仪(美国PE公司),BIO-AD-680型酶标仪(美国BIO-AD公司)。
1.3 化学合成 将制备的化合物4 (10 g, 26.0 mmol)加入到500 g/L水合肼(100.0 g, 0.8 mol)中,混合物加热回流反应24 h;减压蒸除溶剂,加水100 mL,滴加质量分数为300 g/L的氢氧化钠溶液溶解,加活性炭(1.0 g)回流脱色1 h。过滤,滤液用浓盐酸调pH 7.0;滤集固体用去离子水洗涤,无水乙醇-DMF重结晶,得黄色固体(化合物5)。
将化合物5 (10 g, 25.0 mmol)悬浮于200 mL无水乙醇,加入无水醋酸钠(3.0 g, 37.0 mmol)和氯乙酸(3.5 g, 37.0 mmol),混合物加热回流反应12 h;趁热滤除固体,放置析出固体,用无水乙醇重结晶,得类白色固体(化合物6)。
取1.0 g (2.2 mmol)化合物6溶于20 mL无水乙醇中,加入等物质的量的苯甲醛或取代苯甲醛,滴加浓硫酸0.5 mL,混合物回流反应24 h;减压蒸除溶剂,加入冰水20 mL溶解,用浓氨水调pH 7.0,放置析出的固体。滤集固体,用乙醇洗涤。粗品用无水乙醇重结晶,得无色固体目标化合物7a~7j。
1.4 抗肿瘤活性实验 将目标化合物7a~7j、对照蒽醌类抗肿瘤药阿霉素及母体环丙沙星用DMSO配成1.0×10-2mol/L的储备液,用RPMI 1640稀释至所需浓度(0.1、1.0、10.0、50.0、100.0 mol/L)即为供试液。①取对数生长期的人肝癌细胞(SMMC-7721),以每孔5 000个接种于96孔板。隔夜培养后,加入供试液。采用MTT法[8]检测肿瘤细胞活性,用酶标仪在570 nm波长处测OD值。②取对数生长期的小鼠白血病细胞(L1210)和人白血病细胞(HL60),分别以每孔7 000个接种于96孔板, 随后加入供试液。采用MTT法[8]检测肿瘤细胞活性,用酶标仪在570 nm波长处测OD值。细胞生长抑制率(细胞抑制率)=(1-实验组OD值/对照组OD值)×100%。以药物浓度对数值对细胞抑制率作线性回归得剂量-效应方程,依此计算出供试化合物对癌细胞的半数抑制浓度(IC50)。所有实验在相同的条件下进行3次。
1.5 抗菌活性实验 将目标化合物7a~7j及母体环丙沙星用DMSO溶液配成128 mg/L的供试液,采用标准试管二倍稀释法测定供试液对阳性金黄色葡萄球菌(S.aureusATCC 25923)和阴性大肠埃希菌(E.coliATCC 25922)的体外最低抑菌浓度(MIC)。
2 结果
2.1 化合物结构表征 1-环丙基-6-氟-7-哌嗪-1-基-3-(4-氨基-5-巯基-1,2,4-三唑-3-基)-喹啉(1H)-4-酮(化合物5):收率66%;熔点 237~ 239 ℃;1H NMR(DMSO-d6)δ:13.54(s, 1H, SH),8.74(s, 1H, 2-H),7.82(d,J=13.2 Hz, 1H, 5-H),7.56(d,J=7.2 Hz, 1H, 8-H),4.38(s, 2H, NH2), 3.66~3.63(m, 1H, 1′-H),3.34(t,J=6.2 Hz, 4H, 2×2″-H),2.68(t,J=6.2 Hz, 4H, 2×3″-H),1.35~1.24(m, 4H, 2×2′-H),MS(m/z)计算值401.47[M],测定值402[M+H]+;元素分析(C18H20FN7OS)计算值C 53.85%, H 5.02%, N 24.42%,测定值C 54.06%, H 4.87%, N 24.66%。
1-环丙基-6-氟-7-哌嗪-1-基-3-(4-氨基-5-羧甲硫基-1,2,4-三唑-3-基)-喹啉(1H)-4-酮(化合物6):收率73%;熔点 206~208 ℃;1H NMR(DMSO-d6)δ:14.63(brs, 1H, COOH), 8.75(s, 1H, 2-H),7.84(d,J=13.2 Hz, 1H, 5-H),7.58(d,J=7.2 Hz, 1H, 8-H),4.46,4.37(2s, 4H, NH2和SCH2),3.68~3.65(m, 1H, 1′-H),3.36(t,J=6.2 Hz, 4H, 2×2″-H),2.67(t,J=6.2 Hz, 4H, 2×3″-H),1.33~1.24(m, 7H, CH3和2×2′-H);MS (m/z)计算值459.51[M]+,测定值460[M+H]+; 元素分析(C20H24FN7O3S)计算值C 52.28%, H 4.83%, N 21.34%,测定值C 52.53%, H 4.65%, N 21.52%。
1-环丙基-6-氟-7-哌嗪-1-基-3-(4-苯甲叉氨基-5-羧甲硫基-1,2,4-三唑-3-基)-喹啉(1H)-4-酮(化合物7a):收率62%;熔点 226~ 228 ℃;1H NMR(DMSO-d6)δ: 14.68(brs, 1H, COOH), 8.77(s, 1H, 2-H),8.46(s, 1H, CH=N),7.86(d,J=13.2 Hz, 1H, 5-H),7.62~6.67(m, 6H, 8-H和Ph-H),4.46(s, 2H, SCH2),3.70~3.68(m, 1H, 1′-H),3.35(t,J=6.2 Hz, 4H, 2×2″-H),2.74(t,J=6.2 Hz, 4H, 2×3″-H),1.26~1.22(m, 4H, 2×2′-H);MS(m/z)计算值547.62[M]+,测定值548[M+H]+; 元素分析(C27H26FN7O3S)计算值C 59.22%, H 4.79%, N 17.90%,测定值C 59.44%, H 4.62%, N 18.16%。
1-环丙基-6-氟-7-哌嗪-1-基-3-[4-(2-羟基苯甲叉氨基)-5-羧甲硫基-1,2,4-三唑-3-基]-喹啉(1H)-4-酮(化合物 7b):收率73%;熔点 215~ 217 ℃;1H NMR(DMSO-d6)δ: 14.66(brs, 1H, COOH),9.67(s, 1H, OH),8.74(s, 1H, 2-H),8.48(s, 1H, CH=N),7.82(d,J=13.2 Hz, 1H, 5-H),7.64~7.12(m, 5H, 8-H和Ph-H),4.48(s, 2H, SCH2),3.73~3.68(m, 1H, 1′-H),3.36(t,J=6.2 Hz, 4H, 2×2″-H),2.72(t,J=6.2 Hz, 4H, 2×3″-H),1.33~1.26(m, 4H, 2×2′-H);MS(m/z)计算值563.62 [M]+,测定值564[M+H]+; 元素分析(C27H26FN7O4S)计算值C 57.54%,H 4.65%,N 17.40%,测定值C 57.78%,H 4.82%,N 17.63%。
1-环丙基-6-氟-7-哌嗪-1-基-3-[4-(2-甲氧苯甲叉氨基)-5-羧甲硫基-1,2,4-三唑-3-基]-喹啉(1H)-4-酮(化合物7c):收率52%;熔点 213~215 ℃;1H NMR(DMSO-d6)δ: 14.63(brs, 1H, COOH),8.77(s, 1H, 2-H),8.51(s, 1H, CH=N),7.92(d,J=13.2 Hz, 1H, 5-H),7.75~7.23(m, 5H, 8-H和Ph-H),4.46(s, 2H, SCH2),3.87(s, 3H, OCH3),3.76~3.70(m, 1H, 1′-H),3.37(t,J=6.2 Hz, 4H, 2×2″-H),2.78(t,J=6.2 Hz, 4H, 2×3″-H),1.35~1.28(m, 4H, 2×2′-H);MS(m/z)计算值577.64 [M]+,测定值578[M+H]+; 元素分析(C28H28FN7O4S)计算值C 58.22%,H 4.89%,N 16.97%,测定值C 58.44%,H 4.64%,N 17.15%。
1-环丙基-6-氟-7-哌嗪-1-基-3-[4-(4-甲氧苯甲叉氨基)-5-羧甲硫基-1,2,4-三唑-3-基]-喹啉(1H)-4-酮(化合物7d):收率76%;熔点 236~238 ℃;1H NMR(DMSO-d6)δ: 14.68(brs, 1H, COOH),8.81(s, 1H, 2-H),8.53(s, 1H, CH=N),7.96(d,J=13.2 Hz, 1H, 5-H),7.78~7.36(m, 5H, 8-H和Ph-H),4.47(s, 2H, SCH2),3.87(s, 3H, OCH3),3.72~3.68(m, 1H, 1′-H),3.35(t,J=6.2 Hz, 4H, 2×2″-H),2.83(t,J=6.2 Hz, 4H, 2×3″-H),1.35~1.26(m, 4H, 2×2′-H);MS(m/z)计算值577.64 [M]+,测定值578[M+H]+; 元素分析(C28H28FN7O4S)计算值C 58.22%,H 4.89%,N 16.97%,测定值C 58.47%,H 4.68%,N 17.10%。
1-环丙基-6-氟-7-哌嗪-1-基-3-[4-(3,4-二氧亚甲基苯甲叉氨基)-5-羧甲硫基-1,2,4-三唑-3-基]-喹啉(1H)-4-酮(化合物7e):收率82%;熔点 245~247 ℃;1H NMR(DMSO-d6)δ: 14.56(brs, 1H, COOH),8.94(s, 1H, 2-H),8.55(s, 1H, CH=N),7.93(d,J=13.2 Hz, 1H, 5-H),7.82~7.54(m, 4H, 8-H和Ph-H),6.26(s, 2H, OCH2O),4.47(s, 2H, SCH2),3.73~3.68(m, 1H, 1′-H),3.36(t,J=6.2 Hz, 4H, 2×2″-H),2.75(t,J=6.2 Hz, 4H, 2×3″-H),1.33~1.26(m, 4H, 2×2′-H);MS(m/z)计算值591.63[M+H]+,测定值592[M+H]+;元素分析(C28H26FN7O5S)计算值C 56.85%,H 4.43%,N 16.57%,测定值C 57.07%,H 4.62%,N 16.81%。
1-环丙基-6-氟-7-哌嗪-1-基-3-[4-(3-甲氧-4-羟基-苯甲叉氨基)-5-羧甲硫基-1,2,4-三唑-3-基]-喹啉(1H)-4-酮(化合物7f):收率85%;熔点 246~248 ℃;1H NMR(DMSO-d6)δ: 14.67(brs, 1H, COOH),10.42(s, 1H, OH),8.86(s, 1H, 2-H),8.54(s, 1H, CH=N),7.88(d,J=13.2 Hz, 1H, 5-H),7.76~7.55(m, 4H, 8-H和Ph-H),4.48(s, 2H, SCH2),3.87(s, 3H, CH3O),3.75~3.73(m, 1H, 1′-H),3.37(t,J=6.2 Hz, 4H, 2×2″-H),2.75(t,J=6.2 Hz, 4H, 2×3″-H),1.36~1.24(m, 4H, 2×2′-H);MS(m/z)计算值593.64[M]+,测定值594[M+H]+; 元素分析(C28H28FN7O5S)计算值C 56.65%,H 4.75%,N 16.52%,测定值C 56.83%,H 4.57%,N 16.74%。
1-环丙基-6-氟-7-哌嗪-1-基-3-[[4-(3,4,5-三甲氧苯甲叉氨基)-5-羧甲硫基-1,2,4-三唑-3-基]-喹啉(1H)-4-酮(化合物7g):收率66%;熔点 224~226 ℃;1H NMR(DMSO-d6)δ: 14.68(brs, 1H, COOH),8.83(s, 1H, 2-H),8.52(s, 1H, CH=N),7.88(d,J=13.2 Hz, 1H, 5-H),7.67(d,J=7.2 Hz,1H, 8-H),7.62(s, 2H, Ph-H),4.47(s, 2H, SCH2),3.88, 3.87(2s, 9H, 3×CH3O), 3.75~3.66(m, 1H, 1′-H),3.38(t,J=6.2 Hz, 4H, 2×2″-H),2.70(t,J=6.2 Hz, 4H, 2×3″-H),1.35~1.24(m, 4H, 2×2′-H);MS(m/z)计算值637.70[M]+,测定值638 [M+H]+; 元素分析(C30H32FN7O6S)计算值C 56.51%,H 5.06%,N 15.38%,测定值C 56.76%,H 5.28%,N 15.61%。
1-环丙基-6-氟-7-哌嗪-1-基-3[4-(4-氟苯甲叉氨基)-5-羧甲硫基-1,2,4-三唑-3-基]-喹啉(1H)-4-酮(化合物7h):收率75%;熔点 236~238 ℃;1H NMR(DMSO-d6)δ: 14.74(brs, 1H, COOH),8.88(s, 1H, 2-H),8.54(s, 1H, CH=N),8.12(d,J=7.5 Hz, 2H, Ph-H),8.05(d,J=13.2 Hz, 1H, 5-H),7.86~7.73(m, 3H, 8-H和Ph-H),4.51(s, 2H, SCH2),3.74~3.70(m, 1H, 1′-H),3.42(t,J=6.2 Hz, 4H, 2×2″-H),3.06(t,J=6.2 Hz, 4H, 2×3″-H),1.37~1.28(m, 4H, 2×2′-H);MS(m/z)计算值565.61[M]+,测定值566[M+H]+; 元素分析(C27H25F2N7O3S)计算值C 57.34%,H 4.46%,N 17.33%,测定值C 57.52%,H 4.23%,N 17.57%。
1-环丙基-6-氟-7-哌嗪-1-基-3-[4-(4-氯苯甲叉氨基)-5-羧甲硫基-1,2,4-三唑-3-基]-喹啉(1H)-4-酮(化合物7i):收率58%;熔点 215~217 ℃;1H NMR(DMSO-d6)δ:14.66(brs, 1H, COOH),8.83(s, 1H, 2-H),8.52(s, 1H, CH=N),7.94(d,J=13.2 Hz, 1H, 5-H),7.81~7.63(m, 3H, 8-H和Ph-H),4.48(s, 2H, SCH2),3.76~3.66(m, 1H, 1′-H),3.41(t,J=6.2 Hz, 4H, 2×2″-H),3.03(t,J=6.2 Hz, 4H, 2×3″-H),1.35~1.26(m, 4H, 2×2′-H);MS(m/z)计算值582.06[M]+,测定值582[M+H]+(35Cl); 元素分析(C27H25ClFN7O3S)计算值C 55.72%,H 4.33%,N 16.84%,测定值C 55.96%,H 4.60%,N 17.06%。
1-环丙基-6-氟-7-哌嗪-1-基-3-[4-(4-硝基苯甲叉氨基)-5-羧甲硫基-1,2,4-三唑-3-基]-喹啉(1H)-4-酮(化合物7j):收率78%;熔点 246~248 ℃;1H NMR(DMSO-d6)δ:15.14(brs, 1H, COOH),9.12(s, 1H, 2-H),8.56(s, 1H, CH=N),8.17(d,J=13.2 Hz, 1H, 5-H),8.06(d,J=7.5 Hz, 2H, Ph-H),7.87~7.68(m, 3H, 8-H和Ph-H),4.50(s, 2H, SCH2),3.78~3.74(m, 1H, 1′-H),3.41(t,J=6.2 Hz, 4H, 2×2″-H),3.15(t,J=6.2 Hz, 4H, 2×3″-H),1.38~1.32(m, 4H, 2×2′-H);MS(m/z)计算值592.61[M]+,测定值593[M+H]+; 元素分析(C27H25FN8O5S)计算值C 54.72%,H 4.25%,N 18.91%,测定值C 54.96%,H 4.38%,N 19.14%。
2.2 体外抗肿瘤和抗菌筛选结果 见表1。
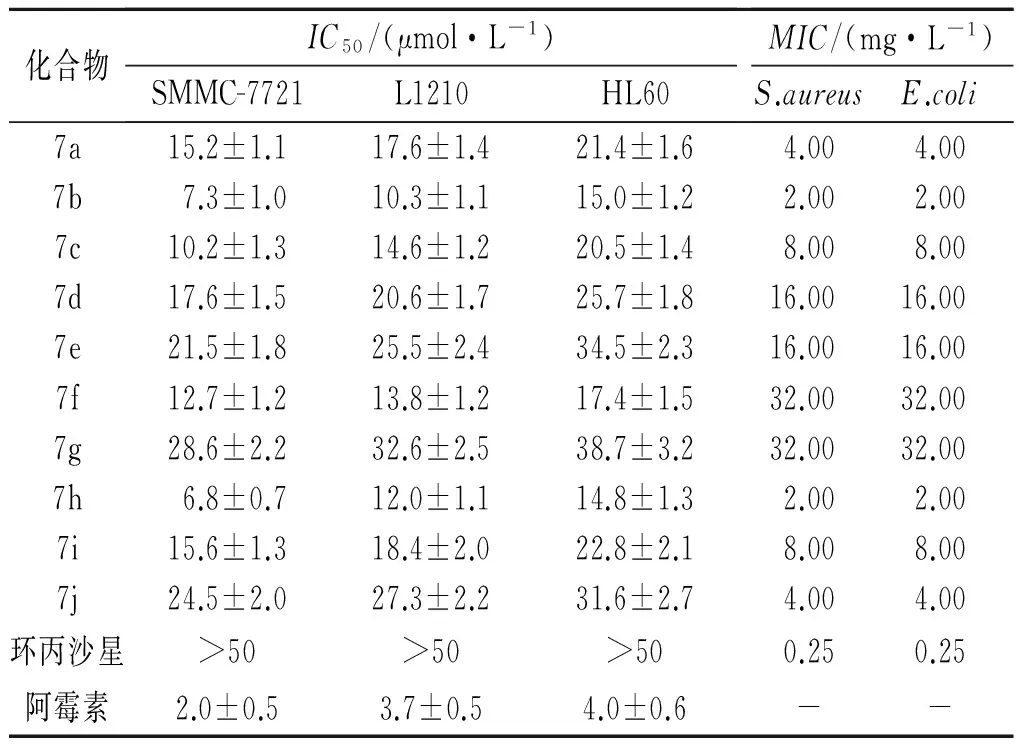
表1 化合物7a~7j对SMMC-7721、L1210和HL60细胞的IC50及对S.aureus和E.coli的MIC(n=3)
3 讨论
环丙沙星C-3羧基不经酯化可与水合肼直接发生肼解反应生成环丙沙星酰肼。酰肼与二硫化碳不需要碱催化可发生缩合生成环丙沙星酰肼二硫代甲酸,接着在碱性水溶液中发生分子内的加成和消除一分子的H2S形成C-3 噁二唑硫醇,它进一步与水合肼反应生成C-3氨基均三唑硫醇,再与氯乙酸发生亲核取代反应生成C-3氨基均三唑硫乙羧酸,最后通过均三唑-4-氨基与苯甲醛或取代的苯甲醛缩合形成亚胺席夫碱可得目标化合物。
体外抗肿瘤活性结果表明,10个C-3均三唑硫乙酸席夫碱目标化合物对3种肿瘤细胞株的IC50均低于原药环丙沙星,然而,它们的MIC(2.0 g/mL)均大于环丙沙星(0.25 g/mL),这表明均三唑杂环作为C-3羧基的等排体可显著提高其抗肿瘤活性,但同时降低其抗菌活性。初步的构效关系表明,当苯环带有酚羟基或氟原子时,其化合物的抗肿瘤活性高于其他取代基化合物的活性,如2-羟基苯基化合物7b 和对氟苯基化合物7h的IC50已达到微摩尔浓度级,其活力与对照阿霉素相当。另外,虽然目标化合物的抗菌活性不及对照原药环丙沙星的活性,但有意义的是,能提高抗肿瘤活性的取代基也能提高其抗菌活性,提示羟基或氟原子可能与靶点形成氢键进而提高其亲和力。为此,氟喹诺酮C-3羧基虽是抗菌活性所必需的,但并非是抗肿瘤活性所必要的药效团,用功能基侧链修饰的唑杂环生物等排体替代有利于提高其抗肿瘤活性,为抗肿瘤氟喹诺酮先导物的发现提供新方法。
[1]JORDAN JB,WHITTINGTON DA,BARTBERGER MD,et al.Fragment-linking approach using(19)F NMR spectroscopy to obtain highly potent and selective inhibitors of β-secretase[J].J Med Chem,2016,59(8):3732
[2]RUGGERI RB, BUCKBINDER L, BAGLEY SW, et al. Discovery of 2-(6-(5-Chloro-2-methoxyphenyl)-4-oxo-2-thioxo-3,4-dihydropyrimidin-1(2H)-yl) acetamide (PF-06282999):a highly selective mechanism-based myeloperoxidase inhibitor for the treatment of cardiovascular diseases[J].J Med Chem,2015,58(21):8513
[3]RENSLO AR. Antimalarial drug discovery:from quinine to the dream of eradication[J].ACS Med Chem Lett,2013,4(12):1126
[5]ALDRED KJ, SCHWANZ HA, LI G, et al.Activity of quinolone CP-115,955 against bacterial and human type Ⅱ topoisomerases is mediated by different interactions[J].Biochemistry,2015,54(5):1278
[6]POMMIER Y.Drugging topoisomerases:lessons and challenges[J].ACS Chem Biol,2013,8(1):82
[7]尚慧杰,高留州,谢玉锁,等. N-甲基环丙沙星酰腙的合成及抗肿瘤活性[J].郑州大学学报(医学版), 2015, 50(5): 597
[8]李珂,张会丽,闻婧,等. 氟喹诺酮C-3噁二唑硫乙酰腙的合成及抗肿瘤活性测定[J].郑州大学学报(医学版),2017,52(1):28
(2016-07-21收稿 责任编辑徐春燕)
Synthesis of fluoroquinolone C-3 s-triazole derivatives modified with sulfanylacetic acid and Schiff-base and their antibacterial and antitumor activities
ZHANGHuili1),LIKe1),HUGuoqiang2),HUANGWenlong3)
1)SchoolofPharmacy,ZhengzhouUniversityofIndustrialTechnology,Zhengzhou451150 2)SchoolofPharmacy,HenanUniversity,Kaifeng,Henan475001 3)CentreofDrugDiscovery,ChinaPharmaceuticalUniversity,Nanjing210009
fluoroquinolone; s-triazole; bioisostere; Schiff-base; sulfanylacetic acid; antibacterial and antitumor activities
Aim: To discover an efficient strategy for a conversion of antibacterial fluoroquinolones into antitumor fluoroquinolones. Methods: Ten novel fluoroquinolone C-3 s-triazole derivatives were designed and synthesized with an s-triazole ring as the C-3 bioisostere modified by both functionalized sulfanylacetic acid and imine Schiff-base side chains from ciprofloxacin, respectively. The structures of the title compounds were characterized by elemental analysis and spectral data, and theinvitroantibacterial activities againstS.aureusandE.coliand antitumor activities against SMMC-7721,L1210,and HL60 cells were evaluated. Results: The title compounds demonstrated poorer antibacterial activity but more significant antitumor activity than the parent, respectively. In particular, compounds bearing a fluorine atom or nitro group attached to benzene ring were comparable to the control doxorubicin with anIC50values of micro-molar concentration, respec tively.Conclusion: It suggests that an azole modified with functionalized side-chain as the bioisosteric replacement of the C-3 carboxylic group is favorable to improvement of antitumor activity.
10.13705/j.issn.1671-6825.2017.02.012
*国家自然科学基金面上资助项目 20872028,21072045
R979.1
