水中NaI/Fe3+催化苯甲醇氧化合成苯甲酰胺
2017-04-07苏培永牛华伟石伟民
于 雪, 周 浩, 申 琦, 苏培永, 牛华伟, 石伟民
(1. 郑州大学 化学与分子工程学院 河南 郑州 450001;2. 河南中烟工业有限责任公司 河南 郑州 450016)
水中NaI/Fe3+催化苯甲醇氧化合成苯甲酰胺
于 雪1, 周 浩2, 申 琦1, 苏培永1, 牛华伟1, 石伟民1
(1. 郑州大学 化学与分子工程学院 河南 郑州 450001;2. 河南中烟工业有限责任公司 河南 郑州 450016)
以NaI/Fe3+为催化剂,水为溶剂,叔丁基过氧化氢为氧化剂,有机胺盐为氮源,由苯甲醇高效合成了苯甲酰胺.通过气相色谱-质谱联用,用内标法简便且准确地检测和分析反应体系中各产物随反应条件的变化,探讨氧化剂、碱性试剂、金属离子等对反应的影响,从而优化出较佳的反应条件.该方法操作简单,反应条件温和,产率高,是一种环境友好的合成方法.
苯甲醇; 催化; 胺盐; 合成; 苯甲酰胺
0 引言
部分药物属于酰胺类化合物,对酰胺的合成研究引起了人们的广泛关注[1-3].酰胺合成的方法主要有羧酸或羧酸类衍化物与胺类物质缩合[4]、酶催化反应[5]、腈类的水解反应[6]、芳基卤的氨基羰基化反应[7]、硫代酸和叠氮的酰胺化反应[8]等.但这些方法都存在一些不足,比如反应需要重金属的参与[9],易污染环境,代价较高昂,反应条件苛刻等.随着对酰胺合成方法的不断探索,发现可以通过有机催化或金属催化胺和醛生成酰胺[10-11].醇与胺反应合成酰胺是一种原子经济性与环境友好反应[12]. 本文以NaI/Fe3+为催化剂,有机胺盐为氮源,水为溶剂,由苯甲醇合成了苯甲酰胺.该方法具有环境友好、原料易得且反应条件温和等优点.
1 实验部分
1.1 试剂与仪器
苯甲醇、环己胺、正丙胺、正丁胺均为分析纯(国药集团化学试剂有限公司);70%(质量分数)叔丁基过氧化氢(TBHP)(北京百灵威科技有限公司);65%~70%(质量分数)乙胺水溶液(阿拉丁化学试剂有限公司).
1H-NMR谱由Bruker DPX 400 MHz型核磁共振仪测定;IR谱由Thermo Nicolet IR 200型红外光谱仪测定,KBr压片;反应液中原料及各种产物的含量由7895A型气质联用色谱仪通过内标法测定.
1.2 苯甲酰胺的合成与表征
将苯甲醇、胺、碱、NaI依次加入到50 mL三口瓶中,搅拌,加入H2O和适量TBHP;加热使体系升温至80 ℃,反应4 h后冷却至室温;二氯甲烷萃取,饱和食盐水洗涤,有机层用无水硫酸干燥,过滤,浓缩.醇与胺或胺盐合成酰胺的反应路线如图1所示.
化合物1(N-丁基苯甲酰胺)的IR(KBr,cm-1): 3 318, 2 958, 2 929, 2 867, 1 640, 1 541, 1 305, 851, 802, 701;1H-NMR (DMSO-d6,δ): 8.44 (1H, s, 氨基), 7.82~7.83 (2H, d,J=4 Hz, 苯基), 7.50~7.54 (1H, m, 苯基), 7.43~7.47 (2H, m, 苯基), 3.23~3.28 (2H, m, 亚甲基), 1.38~1.51 (2H, m, 亚甲基), 1.24~1.32 (2H, m, 亚甲基), 0.89~0.93 (3H, t, 甲基).
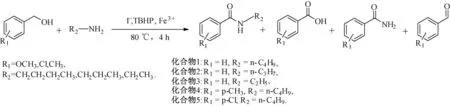
图1 醇与胺或胺盐合成酰胺的反应路线
化合物2(N-丙基苯甲酰胺)的IR(KBr,cm-1): 3 305, 2 928, 2 871, 1 640, 1 540, 1 306, 1 149, 1 024, 801,699;1H-NMR(DMSO-d6,δ): 8.45~8.47 (1H, t, 氨基), 7.83~7.84 (2H, d,J=4 Hz, 苯基), 7.50~7.52 (1H, m, 苯基), 7.44~7.48 (2H, m, 苯基), 3.35 (H2O), 3,21~3,25 (2H, m, 亚甲基), 2.50~2.51 (DMSO-d6), 1.51~1.58 (2H, m, 亚甲基), 0.88~0.91 (3H, t, 甲基).
化合物3(N-乙基苯甲酰胺)的IR(KBr,cm-1): 3 305, 2 974, 2 930, 1 640, 1 539, 1 305, 1 149, 866, 700, 677;1H-NMR ( DMSO-d6,δ): 8.46~8.47 (1H, t, 氨基), 7.83~7.85 (2H, d,J=8 Hz, 苯基), 7.50~7.52 (1H, m, 苯基), 7.44~7.48 (2H, m, 苯基), 3.27~3.32 (2H, m, 亚甲基), 2.50~2.51 (DMSO-d6), 0.89~0.93 (3H, t, 甲基).
化合物4(N-丁基对甲基苯甲酰胺)的IR(KBr,cm-1): 3 322, 2 959, 2 930, 1 639, 1 544, 1 460, 1 308, 1 184, 837, 750;1H-NMR (DMSO-d6,δ): 8.34~8.37 (1H, t, 氨基), 7.74~7.76 (2H, d,J=8 Hz, 苯基), 7.24~7.26 (2H, d,J=8 Hz, 苯基), 3.22~3.27 (2H, m, 亚甲基), 2.51 (3H, s, 甲基), 1.46~1.49 (2H, m, 亚甲基), 1.29~1.34 (2H, m, 亚甲基), 0.88~0.92 (3H, t, 甲基).
化合物5(N-丁基对氯苯甲酰胺)的IR(KBr,cm-1): 3 322, 2 958, 2 931, 1 623, 1 533, 1 474, 1 013, 844, 756;1H-NMR (DMSO-d6,δ): 8.51~8.54 (1H, t, 氨基), 7.84~7.87 (2H, d,J=12 Hz,苯基), 7.52~7.55 (2H, m, 苯基), 3.23~3.28 (2H, m, 亚甲基), 1.47~1.50 (2H, t,亚甲基), 1.30~1.37 (2H, m, 亚甲基), 0.88~0.92 (3H, t, 甲基).
2 结果与讨论
以NaI/Fe3+为催化剂,水为溶剂,TBHP为氧化剂,有机胺盐为氮源,由苯甲醇合成了酰胺类化合物.通过气质联用色谱仪分析反应条件的改变对原料的转化率、中间产物与产物的产率的影响,进而优化反应条件,以期获得较高产率的苯甲酰胺.
2.1 氧化剂对反应的影响
氧化剂(TBHP)的用量对反应的影响见表1.当原料与氧化剂的物质的量之比为1∶1~1∶5时,苯甲醇转化率和N-丁基苯甲酰胺的产率随着氧化剂用量的增加而升高,苯甲醇转化率从84%升高至100%,N-丁基苯甲酰胺的产率从48%升高至75%,同时副产物减少.当原料与氧化剂的物质的量之比为1∶8和1∶10时,随着氧化剂用量的增加,苯甲醇转化率保持在100%,没有变化,而副产物产率增加,N-丁基苯甲酰胺的产率减少.因此,较佳的原料与氧化剂的物质的量之比为1∶5.

表1 氧化剂的用量对反应的影响
反应条件:苄醇(1 mmol),胺(1.5 mmol),碱(2.2 mmol),碘化钠(0.1 mmol),水(8 mL),80 ℃, 4 h.
2.2 碱性试剂种类对反应的影响
碱在胺氧化合成酰胺的反应中起关键作用[13],能够活化底物胺.不同碱性试剂对反应的影响见表2.对于第一主族碱金属的碳酸盐,随着碱性的增加,N-丁基苯甲酰胺的产率从72%降低到67%.当使用 BaCO3为碱性试剂时,N-丁基苯甲酰胺的产率达到75%.因此,选择BaCO3作为由苯甲醇反应合成苯甲酰胺的碱性试剂.

表2 不同碱性试剂对反应的影响
反应条件:苄醇 (1 mmol),胺(1.5 mmol),碱(2 mmol), 碘化钠(10%), TBHP(5 mmol), 水(8 mL), 80 ℃, 4 h.
2.3 碱性试剂用量对反应的影响
碱性试剂(BaCO3)的用量对反应的影响见表3.当苯甲醇与BaCO3的物质的量之比为1∶0~1∶2时,N-丁基苯甲酰胺的产率随着BaCO3用量的增加而升高,从26 %升高到75 %;而苯甲醇与BaCO3的物质的量之比为1∶3和1∶4时,N-丁基苯甲酰胺的产率几乎没有变化.因此,较佳的苯甲醇与BaCO3的物质的量之比为1∶2.
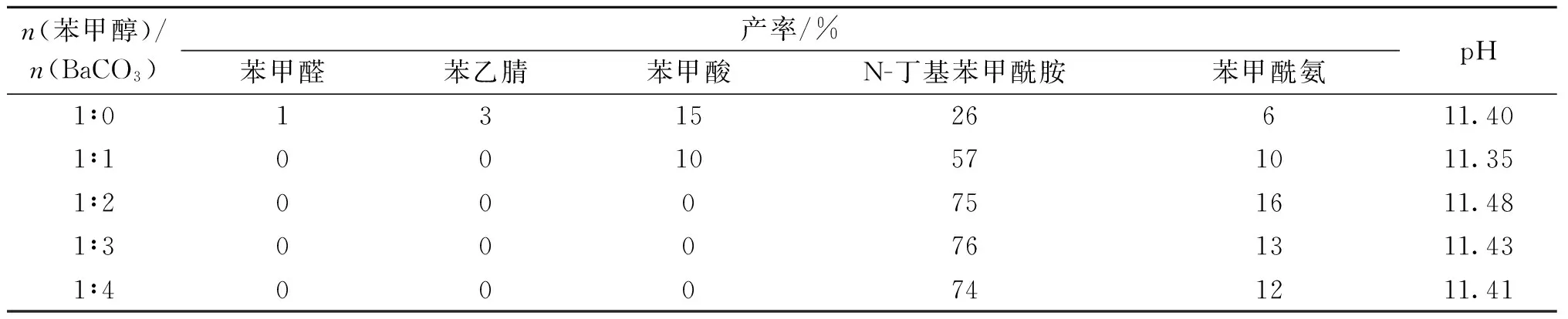
表3 BaCO3用量对反应的影响
反应条件:苄醇(1 mmol),胺 (1.5 mmol), 碘化钠(10%), TBHP(5 mmol), 水(4 mL), 80 ℃, 4 h.
2.4 氮源对反应的影响
丁胺盐酸盐作为氮源来合成苯甲酰胺,其与正丁胺的实验结果对比见表4.两种氮源与苯甲醇的反应,所得到的几种副产物及中间产物的产率不同,但苯甲酰胺的产率相似.鉴于丁胺盐酸盐更适合水相反应体系,而且胺盐作为氮源时副产物较少.因此,丁胺盐酸盐适合作为由苯甲醇反应合成苯甲酰胺的氮源.

表4 氮源对反应的影响
反应条件:苄醇(1 mmol),碱(2 mmol),碘化钠(10%), TBHP(5 mmol), 水(4 mL), 80 ℃, 4 h.
2.5 底物的扩展
试验不同芳基的苄醇和不同烷基胺的盐,相应的反应产率见表5.可以发现,随着底物胺中烷基的碳链增加,酰胺的产率从64 %升高到76 %.在反应条件下,所有底物都能够得到中等以上产率的苯甲酰胺.
2.6 过渡金属离子对反应的影响
在醇与胺反应合成酰胺的体系中,过渡金属离子的加入会促进反应的进行.在反应过程中,金属离子通过电子和质子的转移,高价态和低价态离子与氧化剂生成两种配合物,从而参与到氧化-还原反应的循环[14].一些金属离子对反应的影响见表6.可以看到,不同金属离子对反应的影响具有明显差别.Fe2+、Fe3+、Mn2+和Pd2+的加入,增加了N-丁基苯甲酰胺的产率,其中Fe3+促进效果较为显著,能够使产率达到93 %.然而Cu2+的加入,抑制了N-丁基苯甲酰胺的生成,使产率降低.

表5 反应底物的扩展
反应条件:苄醇(1 mmol),胺 (1.5 mmol), 碳酸钡(2 mmol), 碘化钠(10%), TBHP(5 mmol), 水(4 mL), 80 ℃, 4 h.

表6 金属离子对反应的影响
反应条件:苄醇(1 mmol),碳酸钡(2 mmol),胺(1.5 mmol),碘化钠(10%),TBHP(5 mmol), 水(4 mL),金属离子(20%),80 ℃, 4 h.
3 小结
通过绿色环保的方法氧化苯甲醇,以有机胺盐为氮源,高效合成了苯甲酰胺类化合物,通过气质联用色谱仪研究不同条件对反应的影响,从而优化出较佳的反应条件为:丁胺盐酸盐为氮源,NaI/Fe3+为催化剂,氧化剂TBHP的物质的量为苯甲醇的5倍,碱性试剂BaCO3的物质的量为苯甲醇的2 倍,苯甲醇的转化率为100%,产物N-丁基苯甲酰胺的产率为93%.
[1] ISHIHARA K, OHARA S,YAMAMOTO H. 3,4,5-Trifluorobenzeneboronic acid as an extremely active amidation catalyst[J].J Org Chem,1996,61(13):4196-4197.
[2] GOTOR V.Non-conventional hydrolase chemistry:amide and carbamate bond formation catalyzed by lipases[J]. Bioorg Med Chem,1999,7(10):2189-2197.
[3] PATCHETT A A.Excursions in drug discovery [J].Med Chem,1993,36(15):2051-2058.
[4] HIROYUKI M,RISA F,YUHEI S,et al.Lanthanum(Ⅲ) triflate catalyzed direct amidation of esters[J].Org Lett,2014,16(7):2018-2021.
[5] RANTWIJK F V,HACKING M A,SHELDON R A.Lipase-catalyzed synthesis of carboxylic amides:nitrogen nucleophiles as acyl acceptor [J].Monatsh Chem,2000,131(6):549-569.
[6] TOBIAS J,SHERBOW E L D,RICHARD I S,et al.Investigation of 1,3,5-triaza-7-phosphaadamantane-stabilized silver nanoparticles as catalysts for the hydration of benzonitriles and acetone cyanohy drin [J].ACS Catal,2014,4(9):3096-3104.
[7] CHEN W,LI K B,HU Z Q,et al.Utility of dysprosium as a reductant in coupling reactions of acyl chlorides:the synthesis of amides and diaryl-substituted acetylenes [J].Organometallics,2011,30(7):2026-2030.
[8] KOLAKOWSKI R V,SHANGGUAN N,SAUERS R R,et al.Mechanism of thio acid/azide amidation[J].J Am Chem Soc,2006,128(17):5695-5702.
[9] MUTHAIAH S,GHOSH S C,JEE J E,et al.Direct amide synthesis from either alcohols or aldehydes with amines:activity of Ru(Ⅱ) hydride and Ru(0) complexes [J].J Org Chem,2010,75(9):3002-3006.
[10]ZHU M W,KENICHI F,RYOHEI Y.Aerobic oxidative amidation of aromatic and cinnamic aldehydes with secondary amines by CuI/2-pyridonate catalytic system [J].J Org Chem,2013,77(20):9102-9109.
[11]ZHOU B,DU J J,YANG Y X,et al.Rhodium(Ⅲ)-catalyzed intermolecular direct amidation of aldehyde C—H bonds with N-chloroamines at room temperature [J].Org Lett,2013,15(12):2934-2937.
[12]BANTREIL X,KANFAR N,GEHIN N,et al.Inron-catalyzed benzamide formation:application to the synthesis of moclobemide [J].Tetrahedron,2014,70(34):5093-5099.
[13]RAJENDER R,UMA M, VENKATESHWAR M,et al. Oxidative amidation of aldehydes and alcohols with primary amines catalyzed by KI-TBHP [J]. Eur J Org Chem,2008,21:3619-3622.
[14]WANG N W, LIU R H,CHEN J P, et al. NaNO2-activated, iron-TEMPO catalyst system for aerobic alcohol oxidation under mild conditions [J].Chem Commun,2005,37(42):5322-5324.
(责任编辑:孔 薇)
NaI/Fe3+-catalyzed Oxidation of Benzyl Alcohol to Benzamide
YU Xue1, ZHOU Hao2, SHEN Qi1, SU Peiyong1, NIU Huawei1, SHI Weimin1
(1.CollegeofChemistryandMolecularEngineering,ZhengzhouUniversity,Zhengzhou450001,China;2.HenanZhongYanIndustrialCo.,LTD,Zhengzhou450016,China)
NaI/Fe3+was employed as catalyst to catalyze the oxidization of benzyl alcohol to synthesize amide in water,with amine salt as nitrogen source. Corresponding yields of amide and byproducts were detected by GC-MS expediently.The effects of oxidization reagents, bases, metal ions were studied to find a good reaction condition. This method had the advantages of environment friendly, mild conditions and high yield. A green synthetic route was developed.
benzyl alcohol; catalysis; amine salt; synthesis; benzamide
2016-09-09
国家自然科学基金项目(21575131).
于雪(1993—),女,河南新乡人,硕士研究生,主要从事有机合成研究;通讯作者:周浩(1979—),男,河南许昌人,工程师,主要从事烟草化学研究,E-mail:zhouhlly@163.com.
O625.6
A
1671-6841(2017)01-0092-04
10.13705/j.issn.1671-6841.2016184
