鼻咽癌放疗前后Th17/Treg及相关细胞因子变化及临床意义
2017-04-06王晓梅潘素明杜日昌马占忠周立平钱春燕
王晓梅,潘素明,杜日昌,马占忠,周立平,钱春燕
鼻咽癌放疗前后Th17/Treg及相关细胞因子变化及临床意义
王晓梅,潘素明,杜日昌,马占忠,周立平,钱春燕
目的 探讨鼻咽癌放疗前后辅助性T细胞17(Th17)/调节性T细胞(Treg)及相关细胞因子的变化及临床意义。方法 选取我院2015年2月—2016年2月收治的鼻咽癌50例作为鼻咽癌组,选取同期在我院体检健康的50例作为对照组。比较两组(鼻咽癌组放疗前后、随访3个月时)外周血Th17和Treg所占的占总T细胞百分比及相关细胞因子水平的变化。结果 与对照组比较,鼻咽癌组血清Th17及Treg占总T细胞百分比、白细胞介素(IL)-17、IL-23、IL-10及转化生长因子(TGF)-β1水平显著升高(P<0.05);与放疗前比较,放疗后血清Th17占总T细胞百分比、IL-17及IL-23水平升高(P<0.05),放疗后Treg占总T细胞百分比、随访3个月时Th17及Treg占总T细胞百分比、随访3个月时IL-17及IL-23水平、放疗后及随访3个月时血清TGF-β1及IL-10水平均降低(P<0.05);与放疗后比较,随访3个月时血清Th17及Treg占总T细胞百分比、IL-17、IL-23、IL-10及TGF-β1水平均显著降低(P<0.05)。结论 放疗可加剧鼻咽癌患者Th17/Treg的免疫失衡,期间辅以免疫治疗可改善患者的免疫功能。
鼻咽肿瘤;T淋巴细胞,辅助诱导;Th17细胞;T淋巴细胞,调节性
鼻咽癌是临床常见恶性肿瘤,我国南方地区高发[1]。放疗是鼻咽癌的首选治疗方案,可直接杀死肿瘤细胞,同时可引起机体免疫抑制[2]。T淋巴细胞介导的细胞免疫是机体抗肿瘤免疫的中心环节。相关研究证实,鼻咽癌患者治疗前即存在不同程度的T淋巴细胞亚群功能紊乱,放疗则进一步加剧机体的细胞免疫失衡[3]。辅助性T细胞17(Th17)和调节性T细胞(Treg)是最新发现的T淋巴细胞亚群,在机体正常状态下两者相互制约,保持免疫平衡,维持机体内环境稳态。目前放疗对鼻咽癌患者Th17/Treg免疫平衡的影响尚未明确。本研究探讨鼻咽癌患者放疗前后外周血Th17和Treg占总T细胞百分比及相关细胞因子水平的变化,分析放疗对机体细胞免疫功能的影响,为临床诊断与治疗提供理论依据。
1 资料与方法
1.1 一般资料 选取我院2015年2月—2016年2月收治的鼻咽癌50例作为鼻咽癌组,其中男32例,女18例;年龄24~67(45.7±8.3)岁;临床分期为Ⅰ期7例,Ⅱ期14例,Ⅲ期20例,Ⅳ期9例。纳入标准:①初治鼻咽癌患者;②Karnofsky评分[4]≥70分;③行根治性放疗。排除标准:①近6个月内服用过免疫调节药物;②合并免疫性疾病;③曾接受其他抗肿瘤治疗。选取同期在我院体检健康的50例作为对照组,其中男28例,女22例;年龄21~69(43.6±9.2)岁。两组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
1.2 放疗方法 固定体位并行CT模拟定位扫描,临床靶区(CTV)1为高危区域,CTV2为颈部预防照射区,CTV1和 CTV2分别外扩3 mm为靶区体积(PTV)1和 PTV2。鼻咽癌组均行调强适形放疗(IMRT),PGTVnx总剂量为70~74 Gy,PGTVnd为66~70 Gy,PTV1为60 Gy,PTV2为54 Gy,每周5次,共33次。
1.3 血样采集 鼻咽癌组分别于放疗前、放疗后及治疗结束随访3个月时清晨空腹抽取静脉血5 ml。对照组随机晨起空腹采集静脉血5 ml。
1.4 外周血Th17、Treg检测 采集血样3 ml,肝素抗凝,经淋巴细胞分离液分离外周血单核细胞,用磷酸盐缓冲液调整细胞浓度至2×106/ml,加入适量抗体,室温避光孵育15 min,采用流式细胞仪检测Th17[CD4+白细胞介素(IL)-17]、Treg(CD4+CD25+Treg)占总T淋巴细胞百分比。
1.5 血清Th17、Treg相关细胞因子检测 采集血样2 ml,室温静置2 h,3000 r/min离心10 min,分离血清,采用酶联免疫吸附试验检测血清Th17、Treg相关细胞因子水平,包括IL-17、IL-23、IL-10及转化生长因子(TGF)-β1。

2 结果
2.1 血清Th17、Treg占总T细胞百分比的比较 与对照组比较,鼻咽癌组血清Th17、Treg占总T细胞百分比显著升高(P<0.05);与放疗前比较,放疗后血清Th17占总T细胞百分比升高(P<0.05),放疗后Treg占总T细胞百分比、随访3个月时Th17及Treg占总T细胞百分比降低(P<0.05);与放疗后比较,随访3个月时血清Th17、Treg占总T细胞百分比显著降低(P<0.05),见表1。
2.2 血清Th17、Treg相关细胞因子水平的变化 与对照组比较,鼻咽癌组血清IL-17、IL-23、IL-10及TGF-β1水平显著升高(P<0.05);与放疗前比较,放疗后血清IL-17、IL-23水平升高(P<0.05),放疗后血清IL-10和TGF-β1、随访3个月时IL-17、IL-23、IL-10和TGF-β1水平均降低(P<0.05);与放疗后比较,随访3个月时血清IL-17、IL-23、IL-10及TGF-β1水平显著降低(P<0.05),见表2。
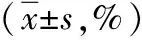
表1 放疗后鼻咽癌组与健康对照组血清Th17、Treg占总T细胞百分比的比较
注:与对照组比较,aP<0.05;与放疗前比较,cP<0.05;与放疗后比较,eP<0.05

表2 鼻咽癌组与健康对照组血清Th17、Treg相关细胞因子水平的变化
注:与对照组比较,aP<0.05;与放疗前比较,cP<0.05;与放疗后比较,eP<0.05
3 讨论
CD4+T淋巴细胞参与机体的细胞免疫反应,在抗肿瘤免疫中发挥重要作用[5]。在不同细胞因子的诱导下,CD4+T淋巴细胞可分化为Th1、Th2、Th17和Treg等细胞亚群。Th1/Th2免疫平衡是经典的免疫学说,以Th2漂移为特征的Th1/Th2免疫失衡被认为是诱发肿瘤的主要机制[6]。近年来,随着对Th17和Treg研究的不断深入,人们对机体抗肿瘤免疫机制有了新的认识。Th17和Treg作为新发现的T淋巴细胞亚群,可直接参与肿瘤细胞的分化和发育,从而参与恶性肿瘤的发生与发展[7]。
Th17通过募集炎性细胞、激活转录因子等多种途径,促进肿瘤细胞的增殖、活化,同时可通过分泌大量的IL-17、IL-23等效应因子,启动STAT3信号转导通路,诱导血管内皮细胞活化,促进新生血管形成,从而加速肿瘤细胞的侵袭和转移[8]。Treg具有强大的免疫抑制功能,其增殖、活化与肿瘤免疫逃逸密切相关,且其相关细胞因子TGF-β1、IL-10等高表达可显著抑制肿瘤特异性免疫反应,降低自然杀伤细胞的杀伤活性,从而抑制免疫细胞介导的免疫防御反应,促进恶性肿瘤的发展[9]。本文结果显示,鼻咽癌患者放疗前外周血Th17及Treg占总T细胞百分比、IL-17、IL-23、TGF-β1及IL-10水平均显著高于对照组,提示鼻咽癌患者存在不同程度的Th17/Treg免疫失衡,与黄继红等[10]研究结论一致。相关研究证实外周血Th17占总T细胞百分比在胃癌、肝癌等多种恶性肿瘤中均升高[11-12]。本研究表明放疗后外周血Th17占总T细胞百分比、IL-17及IL-23水平较放疗前显著升高,提示放疗可促进Th17的活化及其效应因子的分泌,可能与急性放射性损伤有关[13];同时,放疗后外周血Treg占总T细胞百分比、TGF-β1及IL-10水平较放疗前显著降低,提示放疗可抑制Treg的活化及其效应因子分泌,可能与放疗改善肿瘤微环境、减轻肿瘤免疫抑制有关;随访3个月时,鼻咽癌患者外周血Th17及Treg占总T细胞百分比、IL-17、IL-23、TGF-β1及IL-10水平均较放疗后显著降低,提示由放疗所致的Th17/Treg免疫失衡已得到缓解,可能与患者的肿瘤负荷降低、机体免疫力有所恢复及放疗毒性及不良反应逐渐减弱有关。
综上,鼻咽癌患者存在Th17/Treg免疫失衡,放疗可加剧此现象,故放疗期间监测患者免疫功能变化,适当辅以免疫治疗可改善免疫功能。
[1] He Y Q, Xue W Q, Shen G P,etal. Household inhalants exposure and nasopharyngeal carcinoma risk: a large-scale case-control study in Guangdong, China[J].BMC Cancer, 2015,15:1022.
[2] Tian Y M, Tian Y H, Zeng L,etal. Prognostic model for survival of local recurrent nasopharyngeal carcinoma with intensity-modulated radiotherapy[J].Br J Cancer, 2014,110(2):297-303.
[3] 吴伟,刘联斌,周茂华.放化疗对鼻咽癌患者淋巴细胞亚群影响的观察[J].中华肿瘤防治杂志,2013,20(2):129-132.
[4] Chambless L B, Kistka H M, Parker S L,etal. The relative value of postoperative versus preoperative Karnofsky Performance Scale scores as a predictor of survival after surgical resection of glioblastoma multiforme[J].J Neurooncol, 2015,121(2):359-364.
[5] 福军亮,王福生.CD4+杀伤性T细胞在病毒感染和肿瘤性疾病中的研究进展[J].细胞与分子免疫学杂志,2012,28(1):102-104.
[6] 沈洪彦,孙治君.Th1/Th2细胞与肿瘤复发[J].中国普外基础与临床杂志,2006,13(4):490-492.
[7] 郭美姿,陈晓琳,尹震宇.Th17/Treg失衡在消化道肿瘤中的研究进展[J].国际消化病杂志,2013,33(5):341-344.
[8] 蔡曼波,曾益新,邵建永,等.肿瘤微环境中Treg细胞和Th17细胞对鼻咽癌进展和预后的影响[J].湖南师范大学学报(医学版),2016,13(3):1-4.
[9] 汪铁军,谢中华,郑元秀,等.初诊鼻咽癌患者外周血CD4+CD25+Foxp3+调节性T细胞的变化及与TGF-β1的相关性[J].放射免疫学杂志,2013,26(4):474-476.
[10]黄继红,昂杰,牟忠林,等.Treg细胞和Th17细胞在鼻咽癌中相关性的研究[J].海南医学院学报,2013,19(9):1194-1196.
[11]叶妮,张光波,高楠,等.Th17与Foxp3+Treg在胃癌患者外周血中的表达[J].世界华人消化杂志,2012,(36):3689-3694.
[12]张增光,秦鸣放.肝癌患者外周血Treg、Th17百分比及IL-17水平观察[J].山东医药,2015,4(15):37-39.
[13]钱莘.Th17细胞在放射性肺损伤中的作用[J].肿瘤学杂志,2010,16(12):914-917.
Changes and Clinical Significance of Th17/Treg Related Cytokines in Patients with Nasopharyngeal Carcinoma before and after Radiotherapy
WANG Xiao-meia, PAN Su-mingb, DU Ri-changc, MA Zhan-zhongd, ZHOU Li-pinga, QIAN Chun-yan
(a. Department of Gastroenterology, b. Department of Radiotherapy, c. Department of Pathology, d. Department of Clinical Laboratory, Yuebei People's Hospital of Guangdong, Shaoguan, Guangdong 440200, China)
Objective To investigate changes and clinical significance of helper T cell/regulatory T cell (Th17/Treg) and related cytokines in patients with nasopharyngeal carcinoma before and after radiotherapy. Methods A total of 50 patients with nasopharyngeal carcinoma admitted during February 2015 and February 2016 were chosen as nasopharyngeal carcinoma group, and 50 healthy people taking medical examination at the same period were chosen as control group. Changes of Th17 and Treg cell proportions accounting for total T cell, and related cytokine levels were compared between two groups (before and after radiotherapy, and in follow-up for 3 month in nasopharyngeal carcinoma group). Results Compared with those in control group, serum Th17 and Treg cell accounting for total T cell proportions, interleukin (IL)-17, IL-23, IL-10 and transforming growth factor (TGF)-β1 levels were significantly increased in nasopharyngeal carcinoma group (P<0.05). Compared with those before radiotherapy, serum Th17 cell proportion after radiotherapy, serum IL-17 and IL-23 levels were significantly increased after radiotherapy (P<0.05), and Treg cell accounting for total T cell proportion after radiotherapy, Th17 and Treg cell accounting for total T cell proportions in follow-up for 3 months, IL-17 and IL-23 levels in follow-up for 3 months, serum TGF-β1 and IL-10 levels were significantly decreased after radiotherapy and 3 month after radiotherapy (P<0.05). Compared with those after radiotherapy, serum Th17 and Treg cell accounting for total T cell proportions, IL-17, IL-23, IL-10 and TGF-β1 levels were significantly decreased 3 months after radiotherapy (P<0.05). Conclusion Radiotherapy can aggravate Th17/Treg immunodissonance of patients with nasopharyngeal carcinoma, and therefore immunotherapy should be supplemented during radiotherapy to improve immune function.
Nasopharyngeal neoplasms; T-Lymphocytes, helper-inducer; Th17 cells; T-lymphocytes, regulatory
韶关市科技项目(2015CX-K021)
440200 广东 韶关,广东粤北人民医院消化内科(王晓梅、周立平),放疗科(潘素明),病理科(杜日昌),检验科(马占忠、钱春燕)
R739.63
A
1002-3429(2017)03-0078-03
10.3969/j.issn.1002-3429.2017.03.030
2016-12-07 修回时间:2017-01-06)
