以精神症状为首发表现的Fahr病误诊讨论及家系调查
2017-04-06陈莉,钟华
陈 莉,钟 华
以精神症状为首发表现的Fahr病误诊讨论及家系调查
陈 莉,钟 华
目的 探讨以精神症状为首发表现的Fahr病的临床及诊断要点,减少误诊误治。方法 对以精神症状为首发表现的Fahr病的临床资料进行回顾性分析。结果 先证者因睡眠差、生活懒散10年,加重2年入院。曾在外院按颅内多发钙化予对症治疗,症状未见好转。专科查体:语速缓慢,面具脸,反应迟钝,四肢肌张力增高,双上肢运动性震颤且联带动作减少,行动迟缓,双侧指鼻试验、跟膝胫试验欠稳准,轮替试验速度减慢、幅度降低,左侧掌颌反射阳性。头颅MRI示:双侧基底节区、丘脑、脑干、小脑、大脑半球皮层下广泛钙化。进一步追问病史得知,其父亲、爷爷、弟弟均有类似症状,确诊为家族性Fahr病。该病无特殊治疗方法,仅予对症治疗,症状无明显缓解后出院观察。结论 接诊以精神症状为首发表现的患者时,要考虑到Fahr病的可能,及时行基因检测,尽早确诊并早期干预,以避免或减少误诊误治。
Fahr病;误诊;精神分裂症
Fahr病由德国神经病学家Fahr于1930年首次报道并命名[1],国内于1983年由蒋雨平等[2]率先报道,为特发性双侧对称性大脑基底节钙化症,目前病因尚不明确。近年有学者建议该病应更名为原发性家族性脑钙化,指一种罕见的遗传或散发的神经系统疾病,发病率低于1/100万[3-4]。该病临床表现复杂多变,易误诊。我院近期收治家族性Fahr病1例,现报告如下。
1 临床资料
1.1 病例资料 男,46岁,先证者。因睡眠差、生活懒散10年,加重2年入院。10年前无明显诱因出现夜间睡眠差,精神状态欠佳,不愿与人交流,偶可被动接触,但音量极小,常一个人呆立呆坐,生活懒散,做事需人督促,反应迟钝,情感淡漠。2年前反应迟钝加重,精神状态更差,行动迟缓,走路缓慢,面无表情,基本不做家务,亦不与人接触,出现反复挠头等刻板动作。1年半前因右眼发红于外院行头颅CT检查发现双侧基底节区、丘脑、小脑、半卵圆中心及额顶颞枕叶皮层下多发钙化(图1)。查甲状旁腺激素(PTH)78.9 pg/ml(正常参考值12~65 pg/ml),当时诊断为颅内多发钙化,予奥拉西坦、胞磷胆碱钠等治疗,效果不佳,症状逐渐加重,为进一步诊治到我院就诊。既往无特殊病史。查体:生命体征及心肺腹检查未见明显异常。专科查体:意识清楚,言语清晰,语速缓慢,面具脸,定向力、记忆力、计算力正常,反应迟钝,颅神经检查正常,四肢肌张力增高,肌力5级,双上肢运动性震颤且联带动作减少,行动迟缓,步态正常,双侧指鼻试验、跟膝胫试验欠稳准,轮替试验速度减慢、幅度降低,闭目难立征阴性,双侧腱反射(++),左侧掌颌反射阳性,双侧病理征阴性。初步诊断为精神分裂症,予口服帕罗西汀20 mg/d改善情绪、奥氮平5 mg/d控制症状及调节睡眠、中成药改善大脑微循环等治疗,症状改善不明显。查血白细胞6.01×109/L,血红蛋白130 g/L,血小板150×109/L;丙氨酸转氨酶12 U/L,天冬氨酸转氨酶17 U/L;尿素5.06 mmol/L,肌酐77.8 μmol/L,尿酸329.9 μmol/L;钙2.23 mmol/L,磷0.98 mmol/L;三碘甲状腺原氨酸1.49 nmol/L,甲状腺素72.2 nmol/L,游离三碘甲状腺原氨酸3.94 pmol/L,游离甲状腺素12.73 pmol/L,促甲状腺激素2.50 mU/L;PTH 51 pg/ml;降钙素2.43 pg/ml(正常参考值0~8.4 pg/ml)。眼科裂隙灯观察角膜正常,未见K-F环。头颅MRI示:双侧基底节区、丘脑、脑干、小脑、大脑半球皮层下广泛钙化(图2)。甲状腺及甲状旁腺超声未见异常,脑电图正常。蒙特利尔认知功能评估量表MoCA评分21分(中学文化水平),简易智力状态量表评分27分,日常生活能力量表评分100分。进一步追问病史得知,其父亲、爷爷、弟弟均有类似症状,确诊为家族性Fahr病,继续予改善情绪、调节睡眠、控制精神症状及心理暗示等治疗,患者症状无明显缓解后出院。1月后随访,患者以睡眠为主,对所有事情漠不关心,行为懒散加重,步态缓慢,日常生活基本自理,无法工作。3个月后随访,患者诉无欲无求,食欲差,双上肢不自主抖动明显,迈步困难,行走缓慢,日常生活稍困难。目前仍在随访。
1.2 家系调查 该患者家系4代共26人,均无近亲结婚,否认甲状腺、甲状旁腺、肝肾疾病史。先证者的1个同胞弟弟有精神病史,27岁发病,临床表现与患者类似,后因精神障碍走失;其父亲及爷爷均有精神病史,发病年龄分别为25岁及32岁,病情均与先证者类似,已去世;先证者育有1子,19岁,无症状(图3)。
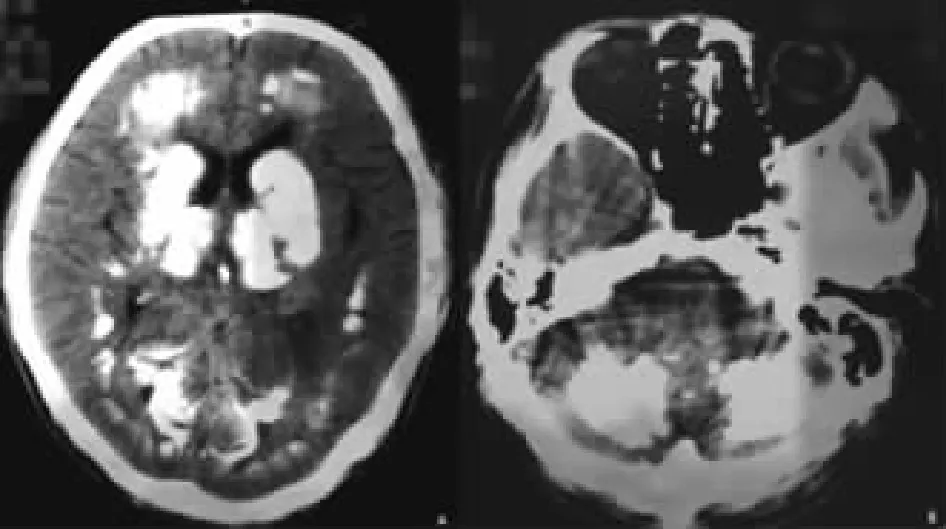
图1 Fahr病患者头颅CT检查示:双侧基底节区、丘脑、小脑、半卵圆中心及额顶颞枕叶皮层下多发钙化灶。

图2 Fahr病患者头颅MRI检查示:双侧基底节区、丘脑、小脑对称性Flair高信号,考虑钙化可能。

图3 Fahr病患者家系图谱
注:Ⅰ~Ⅳ为第一代~第四代;1~10为家庭成员编号
2 讨论
2.1 病因及病理改变 Fahr病又称为特发性基底节钙化或家族性特发性基底节钙化,是一种神经系统退行性疾病,多数具有家族遗传的特点,为常染色体显性遗传,部分为常染色体隐性遗传[4-7]。近年来,SLC20A2被认为是该病最常见的致病基因,占家族遗传性Fahr病的41%[5,8]。本例有家族遗传史,其父亲、爷爷、弟弟均有类似表现,由于经济原因未行基因检测,无法进一步验证,但患者有明确的家族聚集现象,考虑为家族遗传性Fahr病。该病特征性病理改变为双侧基底节区、丘脑、小脑的齿状核及皮层下中枢对称性钙质沉积,病变区广泛对称的终末小动脉和静脉周围钙盐沉着,包括黏多糖类物质、磷、铁、铅及钾等盐类沉着,其化学组成、结构与骨骼、牙齿等部位的生理性钙化相同[9-12]。
2.2 临床特点 Fahr病多于30~60岁起病[3],进展缓慢,男女均可发病。临床表现根据受累部位的不同而表现各异,包括神经症状、精神症状及运动障碍,常见表现为帕金森症状、认知障碍、言语障碍、共济失调、吞咽困难、精神错乱、情绪萎靡、癫痫等[13-14]。Ellie等[15]总结分析了44例Fahr病,发现认知障碍占54.5%,锥体外系症状占50.3%,言语困难占43.2%,小脑体征占34.1%,精神异常占29.5%,锥体束征占13.6%,癫痫占4.5%。本例以精神症状为首发表现,接诊医生未及时发现其合并运动迟缓、肌张力增高等锥体外系症状、小脑共济失调和原始反射体征,误诊为精神疾病,后完善甲状腺素、电解质等实验室检查,且头颅MRI发现颅内多发异常信号,进一步追问病史,得知其存在家族聚集现象,确诊为Fahr病。
2.3 诊断与鉴别诊断 Fahr病的诊断主要依靠影像学检查,表现为双侧基底节区对称性钙化灶,伴脑内广泛分布的钙化灶[12,16]。Fahr病的病情轻重与颅内钙化程度有关,且随着年龄的增长,颅内钙化有进行性加重的趋势[17]。头颅CT是评价脑钙化程度和定位的最佳方法。MRI显示颅内钙化灶的敏感性不如CT。有学者认为MRI显示小脑病灶明显优于CT,其梯度回波可改善对钙化的显示,多数表现为T1、T2低信号[18-19]。因此,将头颅CT与MRI相结合能更加全面显示病变范围,为临床诊断提供客观依据[3]。本文先证者头颅CT检查见基底节区、丘脑、小脑、半卵圆中心、脑叶等多处对称性钙化灶。
Fahr病的诊断标准参考Manyam修改版[20]:①影像学检查见双侧基底节区钙化,可累及颅内其他部位,包括小脑、脑干、半卵圆中心等;②进行性神经功能缺损,包括运动障碍和(或)神经、精神症状;③发病年龄多为30~60岁,也可见于儿童或婴儿;④生化检查正常,无线粒体疾病、代谢性疾病和其他系统疾病的症状和体征;⑤无感染、中毒、外伤等诱因;⑥家族史符合常染色体显性遗传特征。
Fahr病需与以下疾病相鉴别:①原发性甲状旁腺功能减退症(甲旁减):临床表现为手足抽搐、癫痫样发作、智力发育迟缓、精神障碍等症状,颅内多发钙化灶与Fahr病鉴别困难,但实验室检查可见PTH降低,出现低血钙、高血磷,可与之相鉴别。②继发性甲旁减:与原发性甲旁减临床表现相似,有甲状腺手术、颈部创伤及放疗史,血PTH升高。③假性甲旁减:多为PTH抵抗所致,临床表现与原发性甲旁减相似,PTH可升高或正常,属多基因遗传性疾病。④假假性甲旁减:为典型遗传性骨营养不良症,血PTH、钙、磷均正常,无激素抵抗,多属于基因突变。⑤线粒体脑肌病:有阳性家族史,多以卒中样或癫痫起病,MRI可见DWI序列高信号花边征,基因检测或病理检查可确诊。⑥一氧化碳中毒:有一氧化碳接触史,突发意识障碍多见,口唇呈樱桃红,一氧化碳测定阳性等可用于鉴别。⑦结节性硬化症:为室管膜下多发的胶质结节或结节样钙化,沿侧脑室外侧壁分布,为较小的类圆形病灶,多向侧脑室内凸出,临床表现为痴呆、癫痫发作,面部多有皮脂腺瘤。⑧铅中毒:有长期毒物接触史,牙龈呈铅线沉积,毒物筛查可鉴别。
2.4 治疗 若为甲旁减引起的Fahr病,及早治疗,预后相对较好。家族性Fahr病目前尚无根治的方法,主要予改善脑循环及对症处理[21]。有学者提出,将螯合物如青霉胺、抗氧化剂和钙离子拮抗剂联合应用,可改善患者症状,但其疗效尚未证实,有待大样本的临床试验研究[22]。
2.5 误诊原因分析及防范措施 Fahr病临床症状不典型,基层医生缺乏对该病的认识,加之未详细询问病史及家族史,亦未仔细查体,致误诊误治。提示临床应加强专业知识的学习,尤其是提高对少见病的认识,收治有精神症状的患者时,应详细询问家族史,规范神经系统查体,及时行相关医技检查,必要时行分子基因检测,以早期诊断,积极干预,改善预后,避免或减少误诊误治。
[1] Fahr T. Idiopathische verkalkung der hirngefasse[J].Zentrabl Allg Pathol, 1930,50:129-133.
[2] 蒋雨平,秦芝九,印美韵.特发性两侧对称性大脑基底节钙化症[J].中国神经精神疾病杂志,1983,9(2):95-97.
[3] 李睿婷,李涛.特发性基底节钙化的研究进展[J].疑难病杂志,2014,13(8):862-865.
[4] Saleem S, Aslam H M, Anwar M,etal. Fahr's syndrome: literature review of current evidence[J].Orphanet J Rare Dis, 2013,8:156.
[5] Hsu S C, Sears R L, Lemos R R,etal. Mutations in SLC20A2 are a major cause of familial idiopathic basal ganglia calcification[J].Neurogenetics, 2013,14(1):11-22.
[6] Lemos R R, Oliveira D F, Zatz M,etal. Population and computational analysis of the MGEA6 P521A variation as a risk factor for familial idiopathic basal ganglia calcification (Fahr's disease)[J].J Mol Neurosc, 2011,43(3):333-336.
[7] Brunoni A R, Nakata A C, Tung T C,etal. Vitamin D-resistant rickets type Ⅱ-A, basal ganglia calcification, and catatonia: a casual or causal relationship[J].Psychosomatics, 2009,50(4):420-424.
[8] Wang C, Li Y, Shi L,etal. Mutations in SLC20A2 link familial idiopathic basal ganglia calcification with phosphate homeostasis[J].Nat Genet, 2012,44(3):254-256.
[9] 王萍.家族性Fahr病一家系报告并国内11家系分析[J].中国综合临床,2013,29(7):729-731.
[10]Narita K, Murata T, Ito T,etal. A case of diffuse neurofibrillary tangles with calcification[J].Psychiatry Clin Neurosci, 2002,56(1):117-120.
[11]Ahad M A, Bala C, Karim S. Fahr's syndrome[J].Bangladesh Medical Journal Khulna, 2013,45(1-2):33-35.
[12]直玉秋,杨迎伟,曹桂华,等.Fahr病和Fahr综合征的影像学临床研究[J].临床心身疾病杂志,2014,20(3):22-24.
[13]李庭毅,李睿.Fahr病5例临床分析[J].中国实用神经疾病杂志,2015,18(7):129-130.
[14]Saleem S, Aslam H M, Anwar M,etal. Fahr's syndrome: literature review of current evidence[J].Orphanet J Rare Dis, 2013,8:156.
[15]Ellie E, Julien J, Ferrer X. Familial idiopathic striopallidodentate calcification[J].Neurology, 1989,39(3):381-385.
[16]梁远仲,普福顺,罗家滨,等.一家系家族性Fahr病CT表现并文献复习[J].中国临床医学影像杂志,2015,26(6):436-438.
[17]何亮,宋炳伟,甄勇,等.家族性Fahr病一家系报告[J].中国神经精神疾病杂志,2015,41(8):508-509.
[18]赵丽娜,杨丽娟,刘涛,等.特发性基底节钙化病临床分析[J].宁夏医学杂志,2016,38(6):545-547.
[19]Ozerov S S, Semenova Zh B, Zubairaev M S,etal. Concurrence of Fahr's disease with cerebellar tumors[J].Zh Vopr Neirokhir Im N N Burdenko, 2004,(4):34-36.
[20]Manyam B V. What is and what is not Fahr's disease[J].Parkinsonism Relat Disord, 2005,11(2):73-80.
[21]Rastogi R, Beauchamp N J, Ladenson P W. Calcification of the basal ganglia in chronic hypoparathyroidism[J].J Clin Endocrinol Metab, 2003,88(4):1476-1477.
[22]燕丽娜,范学军.伴锥体系损伤的Fahr病1例[J].中国当代医药,2012,19(10):166,168.
408400 重庆,重庆医科大学附属南川人民医院神经内科
钟华,电话:13452069683;E-mail:949535665@qq.com
R742.89
B
1002-3429(2017)03-0037-03
10.3969/j.issn.1002-3429.2017.03.016
2016-12-01 修回时间:2017-01-05)
