婴儿痉挛症患者血清、脑脊液S-100β和胶质纤维酸性蛋白水平观察及其相关性分析
2017-04-04祝善尧葛伟陈贵海
祝善尧,葛伟,陈贵海
(安徽医科大学附属巢湖医院,安徽巢湖238000)
婴儿痉挛症患者血清、脑脊液S-100β和胶质纤维酸性蛋白水平观察及其相关性分析
祝善尧,葛伟,陈贵海
(安徽医科大学附属巢湖医院,安徽巢湖238000)
目的观察婴儿痉挛症患儿血清、脑脊液中星形胶质细胞分子标志物S-100β、胶质纤维酸性蛋白(GFAP)的相关性,并探讨其临床意义。方法选择婴儿痉挛症患者29例为观察组,同期收治的无中枢神经系统疾病的呼吸道感染患儿30例为对照组。采用ELISA法检测观察组、对照组患儿血清及观察组患儿脑脊液中S-100β、GFAP水平。结果观察组、对照组患儿血清S-100β水平分别为(0.80±0.16)、(0.37±0.07)μg/L,GFAP水平分别为(4.12±0.69)、(2.70±0.63)ng/L。观察组患儿血清S-100β和GFAP水平均高于对照组(P均<0.05)。观察组患儿脑脊液S-100β水平为(1.08±0.23)μg/L,GFAP水平为(4.85±0.42)ng/L。观察组患儿血清S-100β水平和脑脊液S-100β水平呈正相关(r=0.883,P<0.05),血清GFAP水平和脑脊液GFAP水平呈正相关(r=0.916,P<0.05)。结论婴儿痉挛症患儿血清S-100β、GFAP水平升高,且与脑脊液S-100β、GFAP水平呈正相关。检测婴儿痉挛症患儿血清S-100β、GFAP水平有助于判断患儿脑脊液S-100β、GFAP水平,进而估计患儿中枢神经系统损伤程度。
S-100β蛋白;胶质纤维酸性蛋白;癫痫;婴儿痉挛症;星形胶质细胞
婴儿痉挛症是小儿癫痫的一个特殊类型,是一种严重的肌阵挛发作,预后不良,表现为全身性肌阵挛性抽搐,上肢伸直、屈曲内收、头和躯体前屈[1]。因为发作时神经异常放电剧烈,且往往反复发作甚至连续发作,神经损伤严重,有可能导致患儿智力发育迟缓、运动发育迟滞[2,3]。S-100β和胶质纤维酸性蛋白(GFAP)均为星形胶质细胞分子标志物[4]。文献报道,癫痫患儿脑脊液S-100β、GFAP水平升高,反映患儿中枢神经系统损伤程度[5]。但是临床上检测脑脊液S-100β、GFAP水平需要进行腰穿,有损伤且患儿家长难以接受。血清S-100β、GFAP水平检测无创、方便且患儿家长容易接受。本研究观察了婴儿痉挛症患儿血清、脑脊液S-100β和GFAP水平变化,并分析患儿血清S-100β、GFAP水平与脑脊液S-100β、GFAP水平的相关性,探讨用血清S-100β、GFAP水平检测间接观察脑脊液S-100β、GFAP水平的可能性。
1 资料与方法
1.1 临床资料 选择2013年6月~2017年3月收治的婴儿痉挛症患儿29例位观察组,其中男15例,女14例,年龄(4.7±2.3)岁。均符合国际抗癫痫联盟制定的癫痫诊断及分类标准[3]。发作次数均不少于3次。排除:①近期脑外伤和神经系统感染者;②有脑梗死、外伤史者;③患有免疫系统疾病或正在接受免疫抑制剂治疗者。另选同期收治的上呼吸道感染患儿30例为对照组,其中男17例,女13例,年龄(5.1±3.1)岁,均排除中枢神经系统疾病。两组患儿性别、年龄相比,P均>0.05。本研究已经医院伦理审查委员会批准,患儿家长均已签署知情同意书。
1.2 血清、脑脊液S-100β、GFAP检测方法 观察组、对照组患儿于入院后24 h内抽取静脉血2 mL,室温静置30 min后置于离心机中,3 000 r/min离心20 min,吸取上层血清,置于-80 ℃环境待测。另外观察组患儿入院后24 h行腰穿抽取脑脊液2 mL,保存于-80℃环境待测。血清、脑脊液中S-100β、GFAP检测采用酶联免疫吸附试验(ELISA),试剂盒购自北京天根生化科技有限公司,操作严格按照说明书进行。
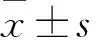
2 结果
2.1 两组血清S-100β和GFAP水平比较 观察组、对照组患儿血清S-100β水平分别为(0.80±0.16)、(0.37±0.07)μg/L,GFAP水平分别为(4.12±0.69)、(2.70±0.63)ng/L。观察组患儿血清S-100β和GFAP水平均高于对照组(P均<0.05)。
2.2 观察组患儿血清、脑脊液S-100β和GFAP水平的相关性 观察组患儿脑脊液S-100β水平为(1.08±0.23)μg/L,GFAP水平为(4.85±0.42)ng/L。直线相关分析结果显示,观察组患儿血清S-100β水平和脑脊液S-100β水平呈正相关(r=0.883,P<0.05),血清GFAP水平和脑脊液GFAP水平呈正相关(r=0.916,P<0.05)。
3 讨论
癫痫是儿童神经系统的常见疾病,婴儿痉挛症是其中一个类型,其发病机制复杂,可造成神经元、神经胶质细胞损伤,最终影响脑功能[6]。癫痫发作后的基本病理变化为神经元选择性丧失、神经元树突棘脱失和胶质细胞增生形成瘢痕。有学者将上述病理改变引起的脑损伤分为三个阶段,微空泡形成、缺血性神经元损伤和细胞溶解。研究显示当神经元处于微空泡形成阶段时,如果采取方法终止发作,此时的神经元损伤是可以逆转的[7]。因此,找到一种安全、可靠的生化指标用来估计脑损伤程度,在此基础上给予合理的治疗,能够最大程度减少脑损伤,改善患者预后。
GFAP是星形胶质细胞的标志蛋白,属细胞骨骼蛋白,分子量为50~52 kD,仅在星形胶质细胞中高度表达,是维持其形态结构的重要蛋白[8]。中枢神经系统损伤后,星形胶质细胞内GFAP表达增强,能够促进周围星形胶质细胞有丝分裂,促使原始祖细胞分化为成熟细胞,并促进纤维蛋白合成[9]。组织病理学研究显示脑挫伤12 h内,星形胶质细胞变得肥大并开始增生,但是GFAP阳性细胞数量减少,随后逐渐增多,7 d后星形胶质细胞形态出现明显变化,边界不清,GFAP阳性细胞大量增加[10]。婴儿痉挛症患儿脑脊液中GFAP水平高于中枢神经系统功能正常的儿童,可能是中枢神经系统损伤后星形胶质细胞内GFAP表达增强的结果。本研究结果显示婴儿痉挛症患儿血清GFAP水平高于无中枢神经系统疾病的呼吸道感染患儿,说明婴儿痉挛症患儿血清GFAP水平的变化与脑脊液GFAP水平的变化是一致的。
S-100蛋白最早发现与牛脑组织中,是一类具有高生物学活性钙结合蛋白[11]。S-100蛋白有两种亚基,S-100α主要表达在纹状肌、心脏和肾脏中,S-100β表达在中枢神经系统中,由星形胶质细胞和少突胶质细胞合成和分泌,具有调节细胞生长、能量代谢的作用,并参与细胞内的信号转导[12]。当胶质细胞受到损伤时,S-100β会从细胞内进入脑脊液或者血液。细胞外S-100β发挥的作用取决于浓度。低浓度时可以营养神经。正常情况下胶质细胞会分泌少量S-100β,修复损伤促进生长[13]。大量的S-100β具有细胞毒性,能够诱导神经元凋亡。大量研究表明脑组织损伤时,S-100β显著增加且与损伤程度和范围密切相关[14]。婴儿痉挛症患儿脑脊液中S-100β水平明显高于中枢神经系统功能正常的儿童,是患儿中枢神经系统损伤的标志物。本研究结果显示婴儿痉挛症患儿血清S-100β水平高于无中枢神经系统疾病的呼吸道感染患儿,说明婴儿痉挛症患儿血清S-100β水平的变化与脑脊液GFAP水平的变化是一致的。
为进一步明确婴儿痉挛症患儿血清S-100β、GFAP水平与脑脊液S-100β、GFAP水平的相关性,本研究对观察组婴儿痉挛症患儿血清S-100β水平和脑脊液S-100β水平、血清GFAP水平和脑脊液GFAP水平的相关性进行了直线相关分析,结果显示,观察组患儿血清S-100β水平和脑脊液S-100β水平呈正相关(r=0.883,P<0.05),血清GFAP水平和脑脊液GFAP水平呈正相关(r=0.916,P<0.05)。提示婴儿痉挛症患儿血清S-100β水平和脑脊液S-100β水平、血清GFAP水平和脑脊液GFAP水平存在很显著的正相关关系。临床中可不必抽取脑脊液,通过检查静脉血清S-100β、GFAP水平即能够判断婴儿痉挛症患者脑损伤的严重程度。因为腰穿具有损伤性,一些家长难以接受,本研究结果具有重要的现实意义,可以提高家长依从性,早期评估患儿中枢神经系统损伤程度,并给与适当干预,改善患儿预后[15,16]。
[1] 刘砚韬,张伶俐,黄亮,等.新型抗癫痫药物治疗儿童癫痫的研究进展[J].中华妇幼临床医学杂志(电子版),2014,10(1):99-104.
[2] 周永,刘民,梁万年,等.癫痫流行病学研究进展[J].中华流行病学杂志,2007,28(1):92-94.
[3] 王文志,吴建中,王德生等.中国五省农村人群癫痫流行病学抽样调查[J].中华医学杂志,2002,82(7):449-452.
[4] 单峤,李培栋,刘泉,等.早发性和晚发性儿童良性枕叶癫痫的临床特点、脑电图改变、治疗及预后比较分析[J].中华神经医学杂志,2013,12(7):696-699.
[5] 高静云,王颖慧,杨莉,等.中国新诊断癫痫儿童首选丙戊酸钠或左乙拉西坦治疗方案的成本效果分析[J].中华实用儿科临床杂志,2013,28(1):42-47.
[6] 袁莉,陈丽丽,阚凤杰,等.癫痫儿童外周血炎性细胞因子和C反应蛋白水平的临床观察[J].中国实验诊断学,2013,17(9):1668-1671.
[7] 王伟秀,陈霞,李荣品,等.癫痫患儿海马急性损伤的MRI表现[J].中国医学影像学杂志,2015,23(8):573-577.
[8] 卢万可,高然.丙戊酸钠对癫痫大鼠脑损伤时GFAP表达的影响[J].中国临床新医学,2016,9(6):472-475.
[9] 陈秀,吴万福,胡长林,等.成年大鼠缺氧性脑损伤后亚临床发作及胶质原纤维酸性蛋白的表达[J].重庆医科大学学报,2007,32(12):1256-1259,1319.
[10] 林卫红,张淑琴,孟红梅,等.星形胶质细胞在实验性癫痫中的作用及意义探讨[J].中风与神经疾病杂志,2004,21(4):317-319.
[11] 赵娟,潭延国.中枢神经系统疾患与S-100β蛋白的关系[J].中国临床康复,2006,10(18):141-144.
[12] 董竞梅,郝艳秋.全身发作性癫痫患儿血浆中CK-BB和S-100β蛋白含量的变化及意义[J].中国实验诊断学,2009,13(1):118.
[13] 周超宁.S-100β蛋白在神经系统疾病中的研究进展[J].医学综述,2011,17(21):3219-3222.
[14] 陈萍,李自如,马翔凌,等.血清NSE和S-100β蛋白在癫痫急性发作患者中的变化及临床价值[J].内蒙古医学杂志,2009,41(7):788-789.
[15] 蔡娜莉,付亚林.NSE和S-100蛋白的检测在判断新生儿脑损伤预后中的临床应用价值[J].中国妇幼保健,2012,27(22):3512-3514.
[16] 甘靖,屈艺,罗蓉,等.婴儿痉挛症治疗进展[J].中华实用儿科临床杂志,2014,29(24):1889-1892.
10.3969/j.issn.1002-266X.2017.35.024
R748
B
1002-266X(2017)35-0072-03
2017-06-25)
安徽省卫计委科技攻关计划项目(08010302123)。
陈贵海(E-mail:chenguihai_1964@medpap360.net)
