肝癌细胞NFAT2基因启动子区甲基化与其mRNA表达的关系
2017-04-02党胜春邹松刘路路崔磊陈吉祥瞿建国顾敏张进
党胜春,邹松,刘路路,崔磊,陈吉祥,瞿建国,顾敏,张进
(1. 江苏大学附属医院 普通外科,江苏 镇江 212001;2. 江苏省镇江市中西医结合医院 肿瘤科,江苏 镇江 212002)
原发性肝癌是一种常见的恶性肿瘤,它对人类的健康造成极大的危害。并且,其患病率有不断上升的趋势[1]。随着临床检验血清AFP的应用和影像技术的发展,越来越多的原发性肝癌能在其早期被发现[2]。与此同时,早期肝癌的治疗也有所进步。但其5年生存率并没有发生显著改善[3]。所以,更深入的研究原发性肝癌,不可或缺。近年,研究者发现,除了基因变异和环境因素,表观遗传学改变也在肿瘤的发生、发展中扮演了重要角色[4]。
DNA甲基化是一种常见的表观遗传学调控,它与肿瘤的发生、发展联系紧密[5],它甚至可以作为肿瘤的一种潜在的生物标志[6]。基因区域的甲基化在肿瘤抑制基因沉默表达中起着重要作用,是基因失活的主要机制之一。从而使肿瘤形成。比如有报道[7-8]称,GPX3、GSTP1等基因在原发性肝癌中高度甲基化。
活化T细胞核因子(nuclear factor of activated T cells,NFAT)最先在T淋巴细胞中发现并因此而命名[9]。近年的研究[10]发现NFAT家族与肿瘤的发生、增殖、迁移及血管形成有相关性。笔者[11]前期的研究已证实,NFAT2基因在肝癌组织较癌旁组织中表达有所降低。但其NFAT2沉默的原因尚未明确,本实验旨在探究其沉默的原因。
1 材料与方法
1.1 研究对象
30例肝癌及癌旁标本均取自我院2010—2015年肝癌患者,癌旁组织为距离癌肿至少3 cm的肝组织。肝癌患者来院前未行放、化疗;行肝癌切除术后将标本迅速置于液氮中保存。术后病理均证实为肝细胞性肝癌,其中男18例,女12例;低分化8例,中分化17例,高分化5例。人肝癌细胞系HuH7、HepG2、Hep3B和人正常肝细胞L02系均从中科院细胞库购买。
1.2 方法
1.2.1基因组DNA的提取本研究提取组织及细胞系基因组DNA使用的是Axygen公司的AxyPrep基因组DNA小量试剂盒。操作步骤严格按照其说明书进行。向标本中加入350 µL PBS和0.8 µL RNase A,漩涡振荡15 s,室温静置1 min,加入150 µL Buffer C-L和8 µL Proteinase K。立即漩涡振荡1 min混合均匀。短暂离心后,将离心管置 56 ℃水浴10 min。加入350 µL Buffer P-D,漩涡振荡30 s混合均匀,12000 r/min离心10 min。将DNA制备管置于2 mL离心管中,将混合液移至制备管中,12000 r/min离心1 min。弃滤液,将制备管置回到原来的2 mL离心管中,加入500 µL Buffer W1,12000 r/min离心1 min。弃滤液,将制备管置回原来的2 mL离心管中,加入700 µL Buffer W2,12000 r/min离心1 min,以同样的方法,用700 µL Buffer W2再洗涤1次。产物溶于150 μL氨基丁三醇-乙二胺四乙酸缓冲液(Tris-EDTA,TE)。经8 g/L琼脂糖凝胶电泳鉴定,7550紫外分光光度仪定量。注意事项:为防止DNA降解,组织标本需在液氮中研磨至粉末后进行DNA提取。
1.2.2基因组总RNA的提取本研究提取组织及细胞系基因组RNA使用的是Axygen公司的AxyPrep基因组RNA小量试剂盒。操作步骤严格按照其说明书进行。向标本中加入400 μL Buffer R-I,用装有21~25号针头的注射器反复抽吸8~10次,转入1.5 mL离心管(试剂盒内提供)中。加入150 μL Buffer R-II,漩涡振荡 15~30 s,12000 r/min 离心5 min。取上清至1.5 mL离心管中,加入250 μL异丙醇,混和均匀。将制备管置于2 mL离心管(试剂盒内提供)中,转移混合液到制备管中,6000 r/min离心1 min。弃滤液,将制备管置回到2 mL离心管中,制备管中加入500 μL Buffer W1A,12000 r/min离心1 min。弃滤液,将制备管置回到2 mL离心管中,制备管中加入700 μL Buffer W2,12000 r/min离心1 min; 以同样的方法再用700 μL Buffer W2洗涤1次。弃滤液,将制备管置回到2 mL离心管中,12000×g离心1 min。将制备管放入一干净的1.5 mL离心管(试剂盒内提供)中,在制备管膜中央加 70~100 μL Buffer TE。室温静置 1 min,12000 r/min离心1 min,洗脱得RNA。经紫外分光光度仪定量。注意事项:为防止RNA降解,组织标本须在液氮中研磨至粉末后进行RNA提取。并且实验中的离心步骤需在4 ℃下进行。
1.2.3DNA亚硫酸氢盐修饰DNA亚硫酸氢盐修饰原理是基于亚硫酸氢盐和氢醌能将DNA链上的C碱基转变成U碱基;而当C碱基被甲基化后,这一转化将不会发生。这样,甲基化与非甲基化的DNA序列经过亚硫酸氢盐修饰后,可通过序列特异的引物区分开来[12]。取1~2 μg基因组DNA,稀释至 30 μL,加入 20 μL 0.5 mol/L NaOH,37 ℃下保温15 min,变性DNA,然后加入新鲜配制的3 mol/L NaHSO3(pH 5.0)520 μL,10 mmol/L氢醌30 μL,混匀后50 ℃下孵育16 h。经过亚硫酸氢钠修饰的DNA以1%琼脂糖透析回收纯化,50 μL 0.6 mol/L NaOH,37 ℃ 10 min后终止反应,乙醇沉淀回收DNA,将其溶解于30 μL无菌双蒸水中,立即用于PCR扩增或于-80 ℃下保存。
1.2.4引物设计根据网站www.urogene.org/cgibin/methprimer/methprimer.cgi设计甲基化引物。MethPrimer(+):GGG GGA GGT GTT TTT TAG TTT TAA A。MethPrimer(-):CAA AAC CAA ATA AAA ACT TAA AAA AAA CTA。qRT-PCR引物由Beacon Designer 8软件进行设计,引物设计在基因CDS区域内。NFAT2(+):TTC GGA ATC AGA GGA TAA。NFAT2(-):AGG CTC ATA ATC ATC AGT。β-actin(+):GGA CCT GAC TGA CTA CCT。β-actin(-):CTT AAT GTC ACG CAC GAT T。
1.2.5PCR扩增选择Takara公司的TaKaRa EpiTaq™ HS (for bisulfite-treated DNA)试剂盒。退火温度60 ℃。延伸时间60 s。
1.2.6qRT-PCR逆转录用Takara公司的PrimeScript RT reagent Kit with gDNA Eraser试剂盒。荧光定量PCR用的是SYBR Premix Ex TaqTMII试剂盒。20 μL反应体系包括1×SYBR Premix Ex Taq II,上下游引物0.4 μmol/L,1×ROX Reference Dye II,50 ng cDNA和7 μL H2O。 反应在ABI7300扩增仪(ABI公司)上进行,扩增条件为95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火/延伸1min,60 ℃收集荧光30 s,共40个循环。熔解曲线程序为 95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,60 ℃ 15 s。熔解曲线揭示PCR产物为单一峰,2%琼脂糖凝胶电泳验证PCR产物长度正确。
1.2.7转化、克隆与测序此步骤使用北京艾德莱生物科技有限公司的Zero Background pTOPOBlunt Simple Cloning Kit,完全依照其产品说明书进行转化,克隆。每份标本挑取10个单克隆,摇菌过夜,将菌液送往南京金斯瑞生物科技有限公司测序。
1.2.8样本的数据分析使用BLAST网站将测序数据与原数据进行对比。依据10个单克隆测序结果来计算每个位点的甲基化百分比。
1.3 统计学处理
所有统计分析均在SPSS 20.0下完成。癌组织与癌旁组织CpG岛甲基化差异采用配对样本比较的Wilconxon符号秩检验。P<0.05为差异有统计学意义。图形制作在GraphPad 5.0和Photoshop CS5软件下完成。
2 结 果
2.1 癌组织与癌旁组织NFAT2基因启动子CpG岛甲基化状态比较
癌旁组织中的CpG岛甲基化密度较低(6%位点检测出了甲基化)。癌组织中的CpG岛甲基化密度较高(82%位点检测出了甲基化)。癌旁组织中甲基化的CpG岛甲基化频率较低(均≤25%)。癌组织中甲基化的CpG岛甲基化频率较高(其中34.15%的位点甲基化频率>50%)。并且从图中可知,癌组织中的第4、6、7、38、40个CpG岛位点更容易发生甲基化(频率均>75%)(图1)。
分别计算所有患者的癌旁组织和癌组织的CpG岛的甲基化频率的算术平均数。癌旁组织CpG岛甲基化频率均数为(21.6±8.3)%,癌组织CpG岛甲基化频率均数为(33.0±13.9)%,差异有统计学意义(P=0.003)(图2)。

图1 1例患者的癌旁及癌组织的启动子中50个CpG位点甲基化频率示意图(蓝色部分代表甲基化,红色部分代表非甲基化)Figure 1 The frequency of methylation in 50 CpG islands in cancer tissue and adjacent normal tissue from one patient (blue bar representing methylated CpG dinucleotide, and red bar representing unmethylated CpG dinucleotide

图2 癌组织与癌旁组织NFAT2启动子甲基化程度的比较Figure 2 Comparison of the degrees of promoter methylation of NFAT2 between cancer tissue and adjacent normal tissue
2.2 人正常肝细胞与人肝癌细胞系NFAT2基因启动子CpG岛甲基化比较
人正常肝细胞L02的CpG岛甲基化频率均数为(16.2±6.9)%,HuH7细胞系CpG岛甲基化频率均数为(34.8±7.3)%,HepG2细胞系CpG岛甲基化频率均数为(40.4±10.3)%,Hep3B细胞系CpG岛甲基化频率均数为(37.0±10.1)%,各肝癌细胞系的CpG岛甲基化频率均明显高于L02细胞(均P<0.05)(图3)。
2.3 癌组织NFAT2基因启动子CpG岛甲基化与相应mRNA表达水平相关性研究
NFAT2 mRNA在癌组织与癌旁组织中的相对表达量分别为[(0.0006024±0.0002594) vs.(0.001469±0.0001711)],癌组织中NFAT2 mRNA的表达水平明显降低(P<0.05);Spearman相关分析显示,肝癌组织中NFAT2 mRNA水平与其启动子甲基化程度呈明显负相关(r=-0.661,P=0.027)(图4)。

图3 人正常肝细胞系与肝癌细胞系NFAT2启动中甲基化程度的比较Figure 3 Comparison of the degree of promoter methylation of NFAT2 in human normal hepatic cell line to those in HCC cell lines
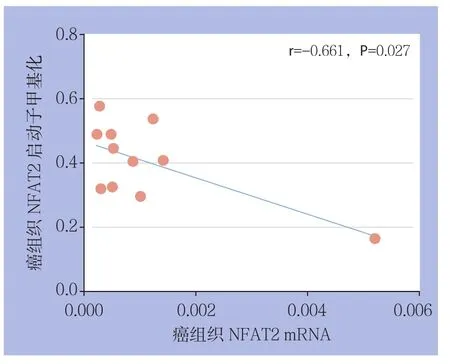
图4 癌组织NFAT2基因启动子CpG岛甲基化与NFAT2 mRNA表达水平的相关性分析Figure 4 Correlation analysis between the promoter methylation of NFAT2 and NFAT2 mRNA expression in HCC tissue
3 讨 论
NFAT在基因的调控中起到了重要作用,从而影响着细胞周期的演进、生长、分化和凋亡[13]。目前有研究[17-19]表明,NFAT家族的中NFAT2与胰腺癌,乳腺癌、结直肠癌和肺癌等肿瘤有着密切的关系,参与了肿瘤的增殖、侵袭、分化,肿瘤细胞的生存和肿瘤血管的形成。NFAT2是胰腺癌发展的基础,并且在黑色素瘤细胞的存活以及结直肠癌细胞的转移中起到了作用[14-16]。在部分淋巴瘤和白血病病例中,NFAT2也被检测到了激活及过度表达。而在肝癌中对于NFAT的研究甚少,笔者前期研究发现NFAT家族基因在肝癌组织较癌旁组织中表达降低,其中NFAT2差异最大,推测NFAT2基因可能在肝癌细胞形成和发展中作为抑癌基因发挥作用[11]。至于什么原因导致NFAT2基因在肝癌中表达减少目前不太清楚,因此本实验主要探究NFAT2启动子甲基化是否与其基因表达下降有关。
本研究通过重亚硫酸盐测序法,对组织及细胞系NFAT2基因启动子区进行测序。实验结果表明,患者组织标本中癌组织较癌旁组织高甲基化,人肝癌细胞系较人正常肝细胞系高甲基化。结合甲基化会使基因表达沉默这一机制,本实验提示NFAT2启动子区域甲基化可能在肝癌NFAT2低表达中扮演重要角色,为了进一步验证,本研究进行了NFAT2的表达与甲基化的相关性分析,发现肝癌中NFA2 mRNA水平与其启动子甲基化水平呈负相关,推测NFAT2在肝癌中可能扮演着抑癌基因的角色,而抑癌基因的沉默促使着肿瘤的发生、发展。至于为何NFAT2在淋巴瘤和白血病中检测到了激活及过度表达,而在肝癌中却是低表达,笔者推测可能是由于NFAT2基因通过改变5′端起始外显子区域的构造,编码NFAT2α和NFAT2β两个亚型的原因[20]。有实验[20-24]证实,T淋巴细胞、B淋巴细胞和肥大细胞通过NFAT2亚型特异性的调控和表达,调节着某些细胞因子。NFAT2α的高表达能抑制T细胞和B细胞的凋亡[20,22]。在伯基特淋巴瘤中,NFAT2α也被证实高表达,这就提示此亚型可能参与肿瘤的形成[25]。而NFAT2β通过上调一些凋亡基因[26],促使细胞的凋亡,扮演着抑癌基因的角色[25]。在肝癌形成过程中,可能正是NFAT2启动子高甲基化导致NFAT2β的低表达,进一步抑制下游凋亡基因表达从而导致肝癌细胞的发生和发展。本研究还提示所选启动子区的第4、6、7、38、40个CpG岛位点更容易发生甲基化(频率均>75%),是否这几个位点的甲基化起到了关键作用,这还需后续的实验进一步证实。至于NFAT2基因发生异常甲基化的机制,可能和DNA甲基转移酶(DNA methyltransferases,DNMT)的功能异常有关。
探明NFAT2基因在肝癌中表达降低的机制,不仅能为以后肿瘤发生机制的研究提供新思路,而且还能为以NFAT2为核心的肝癌早期诊断和靶向治疗提供新途径。
[1] Acharya SK. Epidemiology of hepatocellular carcinoma in India[J].J Clin Exp Hepatol, 2014, 4(Suppl 3):S27–33. doi: 10.1016/j.jceh.2014.05.013.
[2] Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma[J]. Lancet,2012, 379(9822):1245–1255. doi: 10.1016/S0140–6736(11)61347–0.
[3] 周俭, 肖永胜. 肝癌的转化医学研究——从基础到临床[J]. 中国普通外科杂志, 2016, 25(1):1–5. doi: 10.3978/j.issn.1005–6947.2016.01.001.Zhou J, Xiao YS. Translational medical research of hepatocellular carcinoma:from bench to bedside[J]. Chinese Journal of General Surgery, 2016, 25(1):1–5. doi: 10.3978/j.issn.1005–6947.2016.01.001.
[4] Falahi F, Sgro A, Blancafort P. Epigenome engineering in cancer:fairytale or a realistic path to the clinic?[J]. Front Oncol, 2015, 5:22.doi: 10.3389/fonc.2015.00022.
[5] 彭星宇, 陈伟, 周凯, 等. p15、syk基因启动子甲基化与直肠癌关系及预后的研究[J]. 中国普通外科杂志, 2015, 24(3):435–439.doi: 10.3978/j.issn.1005–6947.2015.03.025.Peng XY, Chen W, Zhou K, et al. The study of the relationship between the promoter methylation of the p15, syk gene and the prognosis of rectal cancer patients[J]. Chinese Journal of General Surgery, 2015, 24(3):435–439. doi: 10.3978/j.issn.1005–6947.2015.03.025.
[6] Ng JM, Yu J. Promoter hypermethylation of tumour suppressor genes as potential biomarkers in colorectal cancer[J]. Int J Mol Sci,2015, 16(2):2472–2496. doi: 10.3390/ijms16022472.
[7] Cao S, Yan B, Lu Y, et al. Methylation of promoter and expression silencing of GPX3 gene in hepatocellular carcinoma tissue[J]. Clin Res Hepatol Gastroenterol, 2015, 39(2):198–204. doi: 10.1016/j.clinre.2014.09.003.
[8] Rongrui L, Na H, Zongfang L, et al. Epigenetic mechanism involved in the HBV/HCV-related hepatocellular carcinoma tumorigenesis[J]. Curr Pharm Des, 2014, 20(11):1715–1725.
[9] Shaw JP, Utz PJ, Durand DB, et al. Identification of a putative regulator of early T cell activation genes. Science. 1988. 241: 202–205[J]. J Immunol, 2010, 185(9):4972–4975.
[10] Mancini M, Toker A. NFAT proteins: emerging roles in cancer progression[J]. Nat Rev Cancer, 2009, 9(11):810–820. doi: 10.1038/nrc2735.
[11] 张进, 刘志苏, 刘权焰, 等. 激活的T细胞核因子家族在肝癌与癌旁组织中的差异表达[J]. 中华实验外科杂志, 2012, 29(2):237–239. doi: 10.3760/cma.j.issn.1001–9030.2012.02.024.Zhang J, Liu ZS, Liu QY, et al. Differential expression of nuclear factor of activated T cell gene family member mRNA in hepatocellular carcinoma tissues and adjacent non-tumorous tissues[J]. Chinese Journal of Experimental Surgery, 2012,29(2):237–239. doi: 10.3760/cma.j.issn.1001–9030.2012.02.024.
[12] Herman JG, Graff JR, Myöhänen S, et al. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands[J].Proc Natl Acad Sci U S A, 1996, 93(18):9821–9826.
[13] Lucena PI, Faget DV, Pachulec E, et al. NFAT2 Isoforms Differentially Regulate Gene Expression, Cell Death, and Transformation through Alternative N-Terminal Domains[J]. Mol Cell Biol, 2016, 36(1):119–131. doi: 10.1128/MCB.00501–15.
[14] Levin-Gromiko U, Koshelev V, Kushnir P, et al. Amplified lipid rafts of malignant cells constitute a target for inhibition of aberrantly active NFAT and melanoma tumor growth by the aminobisphosphonate zoledronic acid[J]. Carcinogenesis, 2014,35(11):2555–2566. doi: 10.1093/carcin/bgu178.
[15] Tripathi MK, Deane NG, Zhu J, et al. Nuclear factor of activated T-cell activity is associated with metastatic capacity in colon cancer[J]. Cancer Res, 2014, 74(23):6947–6957. doi: 10.1158/0008–5472.CAN-14–1592.
[16] Buchholz M, Schatz A, Wagner M, et al. Overexpression of c-myc in pancreatic cancer caused by ectopic activation of NFATc1 and the Ca2+/calcineurin signaling pathway[J]. EMBO J, 2006,25(15):3714–3724.
[17] Le Roy C, Deglesne PA, Chevallier N, et al. The degree of BCR and NFAT activation predicts clinical outcomes in chronic lymphocytic leukemia[J]. Blood, 2012, 120(2):356–365. doi: 10.1182/blood-2011–12-397158.
[18] Marafioti T, Pozzobon M, Hansmann ML, et al. The NFATc1 transcription factor is widely expressed in white cells and translocates from the cytoplasm to the nucleus in a subset of human lymphomas[J]. Br J Haematol, 2005, 128(3):333–342.
[19] Medyouf H, Alcalde H, Berthier C, et al. Targeting calcineurin activation as a therapeutic strategy for T-cell acute lymphoblastic leukemia[J]. Nat Med, 2007, 13(6):736–741.
[20] Chuvpilo S, Jankevics E, Tyrsin D, et al. Autoregulation of NFATc1/A expression facilitates effector T cells to escape from rapid apoptosis[J]. Immunity, 2002, 16(6):881–895.
[21] Sherman MA, Powell DR, Weiss DL, et al. NF-ATc isoforms are diあerentially expressed and regulated in murine T and mast cells[J].J Immunol, 1999, 162(5):2820–2828.
[22] Bhattacharyya S, Deb J, Patra AK, et al. NFATc1 affects mouse splenic B cell function by controlling the calcineurin--NFAT signaling network[J]. J Exp Med, 2011, 208(4):823–839. doi:10.1084/jem.20100945.
[23] Hock M, Vaeth M, Rudolf R, et al. NFATc1 induction in peripheral T and B lymphocytes[J]. J Immunol, 2013, 190(5):2345–2353. doi:10.4049/jimmunol.1201591.
[24] Hock MB, Brown MA. Nuclear factor of activated T cells 2 transactivation in mast cells: a novel isoform‐specific transactivation domain confers unique FcepsilonRI responsiveness[J]. J Biol Chem,2003, 278(29):26695–26703.
[25] Lucena PI, Faget DV, Pachulec E, et al. NFAT2 Isoforms Differentially Regulate Gene Expression, Cell Death, and Transformation through Alternative N-Terminal Domains[J]. Mol Cell Biol, 2016, 36(1):119–131. doi: 10.1128/MCB.00501–15.
[26] Robbs BK, Lucena PI, Viola JP. The transcription factor NFAT1 induces apoptosis through cooperation with Ras/Raf/MEK/ERK pathway and upregulation of TNF-alpha expression[J].Biochim Biophys Acta, 2013, 1833(8):2016–2028. doi: 10.1016/j.bbamcr.2013.04.003.
