miR-96的表达对肝细胞癌细胞迁移和侵袭的影响
2017-04-02赵新阳肖朝文郑小林蔡常春
赵新阳,肖朝文,郑小林,蔡常春
(华中科技大学同济医学院附属武汉中心医院 肝胆胰外科,湖北 武汉 430014)
在全球范围内,肝细胞癌(HCC)是种常见的恶性肿瘤,发病率男多于女,据2012年数据统计,有约782500新诊断HCC病例,745500例HCC死亡病例[1]。HCC尤以东亚、东南亚、北非和西非高发,仅中国就占了一半病例。HBV、HCV和黄曲霉毒素都是HCC的常见致病因素。得益于HCC综合治疗的进步,5年生存率已由12%~20%上升至35%~50%。但转移与复发仍是影响HCC预后的主要因素。深入研究HCC的迁移和侵袭机制,对提高HCC诊治水平有重要的意义。小分子核糖核酸(miRNA)是一类非编码RNA,长度约19~22 nt[2],其通过在转录后水平与mRNA结合而靶向下调靶基因的表达[3],广泛参与增殖、凋亡、侵袭、转移等肿瘤生物学过程[4]。miR-96定位于染色体7q32.2[5],在乳腺癌[6]、非小细胞肺癌[7]、肾细胞癌[8]、甲状腺癌[9]、膀胱癌[10]等肿瘤中的作用已见报道,但miR-96对HCC细胞迁移和侵袭的影响,尚未见报道,本研究在体外探讨miR-96对HCC细胞迁移和侵袭的影响,及其可能的机制。
1 材料与方法
1.1 材料
人HCC细胞系HepG2、7721、huh7及正常肝组织细胞系L02购自中国医学科学院,RPMI-1640培养基、胎牛血清及胰蛋白酶购自美国Hyclone公司,TriZol购自美国BD公司,实验所需一抗购自美国BD公司,二抗购自美国Invitrogen公司,miR-96模拟物(miR-96 mimics)及抑制物(miR-96 inhibit)均由广州锐博生物科技公司合成,Lipofectamine 2000 转染试剂盒购自美国Invitrogen公司。miR-96模拟物序列:5′-UUU GGC ACU AGC ACA UUU UUG C-3′,miR-96抑制物序列:5′-GCA AAA AUG UGC UAG UGC CAA A-3′。
1.2 细胞培养、转染及分组
在37 ℃、5% CO2、饱和湿度的条件下,将HepG2、7721、huh7及L02细胞系培养于RPMI-1640培养基中,将处于对数生长期的HepG2细胞分成3组,阴性对照组、miR-96模拟物组及miR-96抑制物组,采用Lipofectamine 2000分别转染miRNA随机序列、miR-96模拟物和miR-96抑制物,转染浓度为20 nmol/L,继续培养24 h行细胞划痕和Transwell实验。
1.3 RNA提取和荧光定量PCR(qRT-PCR)检测
1.3.1miR-96相对表达量测定按TRIZol reagent说明书,从培养细胞中提取总RNA,然后按照TaqMan RNA reverse transcription kit(ABI,USA)说明书,从5 ng的总RNA逆转录合成cDNA。在ABI 7500实时定量PCR仪中,以U6小核RNA作为内参,U6序列正义链:5′-GTG CTC GCT TCG GCA GCA CATA T-3′,反义链:5′-AAA AAT ATG GAA CGC TTC ACG AA-3′;miR-96正义链:5′-TGG CCG ATT TTG GCA CTA GC-3′,反义链:5′-TTT CCC ATA TTG GCA CTG-3′。使用 2-ΔΔCt方法定量,计算 miR-96的相对表达量。
1.3.2PTPN9 mRNA相对表达量检测提取细胞总RNA后,用AMV reverse transcriptase反转录为 cDNA,按 95 ℃5 min,随后 95 ℃30 s、55 ℃30 s、 72 ℃30 s,共40个循环。PTPN9正义链:5′-CCT GCC TTA GAC TGG GAC T-3′,反义链:5′-TTC GCT TTG TTA GCT TCA CT-3′;GAPDH正义链:5′-CGA GCC ACA TCG CTC AGA CA-3′,反义链:5′-GTG GTG AAG ACG CCA GTG GA-3′。以 GAPDH 为内参,使用 2−ΔΔCt方法定量,计算公式:ΔΔCT=(CT PTPN9-CT GAPDH)实验组-(CT PTPN9-CT GAPDH)对照组,计算PTPN9 mRNA的相对表达量。
1.4 细胞划痕实验
将阴性对照组、miR-96模拟物组及miR-96抑制物组的HepG2细胞用RPMI-1640(含有10%胎牛血清)培养在六孔板上,待融合后,用Tips枪头划直线,划痕后0~24 h,用反转的Olympus IX50显微镜通过10×物镜和Image-Pro Plus软件捕获测量划痕面积,计算划痕愈合率,划痕愈合率越高,表示迁移能力越强。
1.5 Transwell细胞侵袭实验
阴性对照组、miR-96模拟物组及miR-96抑制物组的HepG2细胞各取2×103个细胞,种在Transwell小室的碳酸磷脂表面,上室BioCoat TM包被Matrigel基质胶,37 ℃培养24 h。取出上层小室,将膜下面的细胞与1%多聚甲醛混合,用0.2%结晶紫溶液染色15 min。在200倍视野下计算穿膜细胞数,随机取10个视野,计算平均值。实验重复3次,取平均值。
1.6 Western blot
培养24 h后消化细胞,取细胞总蛋白,蛋白变性、上样,每泳道上样量为50 μg蛋白。50 V、100 mA电泳2 h结束后,PVDF膜转膜。脱脂奶粉液封闭2 h。TBS清洗,分别加入PTPN9一抗(1:200)、GAPDH一抗(1:200),二抗浓度1:1000,ECL显影。测量条带的灰度值。目的蛋白的相对数值=目的蛋白灰度值/GAPDH蛋白灰度值。
1.7 统计学处理
采用Graphpad 6.0统计作图软件,计量资料用均数±标准差(±s)表示,两组均数采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 miR-96在HCC细胞及正常肝细胞系中的表达
荧光定量PCR结果示,miR-96在HCC细胞系HepG2、huh7、7721细胞系相对表达量分别为7.1±0.63、4.8±0.31、3.9±0.23,均明显高于正常肝细胞系L02的相对表达量(1.1±0.15),差异均有统计学意义(均P<0.01)(图1)。
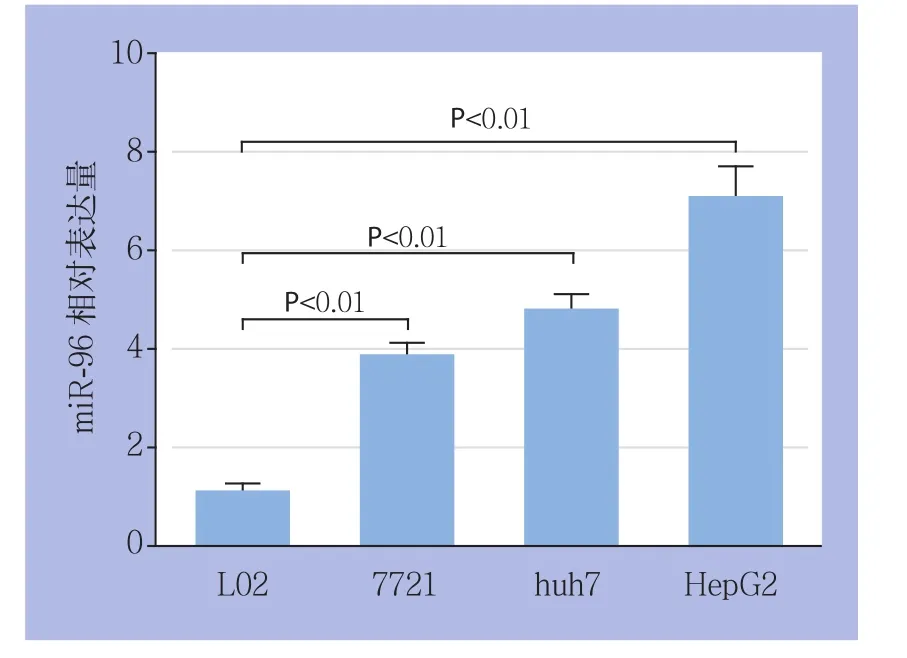
图1 miR-96在HCC和正常肝细胞系中的表达Figure 1 The miR-96 expressions in HCC cell lines and normal hepatic cell line
2.2 转染效率检测
转染HepG2细胞24 h后,设阴性对照组为miR-96的表达量1.0,模拟物组miR-96的相对表达量为6.0±0.3,miR-96抑制物组为0.20±0.09,差异均有统计学意义(均P<0.001)(图2)。
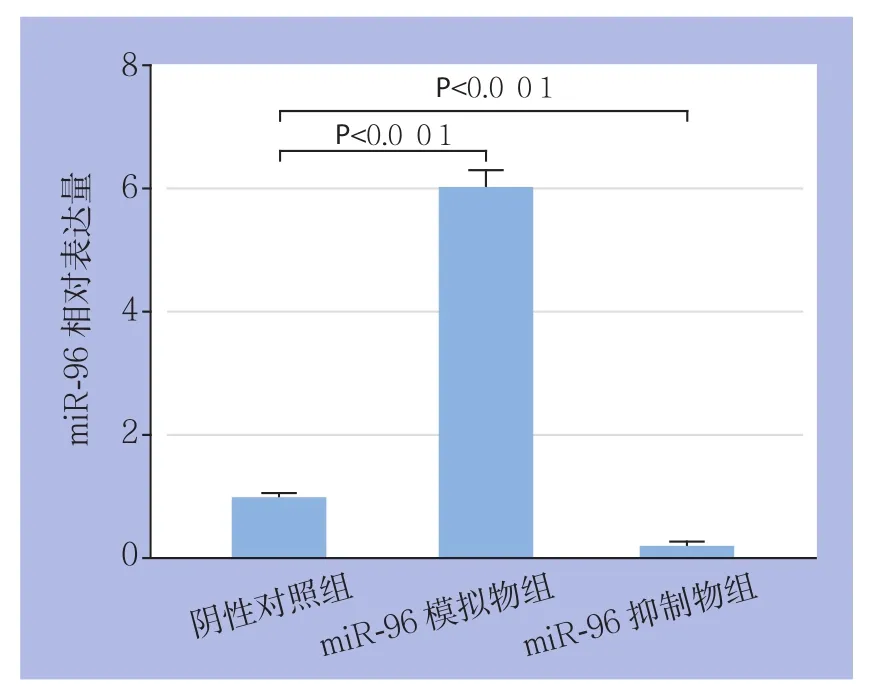
图2 不同转染组HepG2细胞miR-96的表达Figure 2 The miR-96 expressions in different transfection groups of HepG2 cells
2.3 miR-96对HCC细胞迁移与侵袭的影响
细胞划痕实验示,阴性对照组细胞划痕愈合率为(53.47±4.39)%,而miR-96模拟物组细胞划痕愈合率为(74.73±5.63)%,miR-96抑制物组细胞划痕愈合率为(24.38±3.74)%,前者划痕愈合率明显高于阴性对照组,后者划痕愈合率明显低于阴性对照组(P<0.05)(图3A-B)。
细胞侵袭实验示,200倍视野下,阴性对照组侵袭细胞数为(329±13)个,而miR-96模拟物组侵袭细胞数为(548±18)个,miR-96抑制物组侵袭细胞数为(179±9)个,前者侵袭细胞数明显多于阴性对照组,后者侵袭细胞数明显少于阴性对照组(P<0.05)(图3C)。

图3 miR-96对HCC细胞迁移与侵袭的影响 A-B:细胞划痕实验结果;C:侵袭实验结果Figure 3 Influences of miR-96 on migration and invasion of HCC cells A–B: Results of wound scratch assay; C: Results of Transwell assay
2.4 miR-96对HCC细胞PTPN9表达的影响
qRT-PCR结果:设阴性对照组PTPN9 mRNA表达量为1.0,miR-96模拟物组PTPN9 mRNA相对表达量为0.32±0.04,miR-96抑制物组PTPN9 mRNA为5.32±0.13,前者明显降低,后者明显升高,差异均有统计学意义(均P<0.05)(图4A)。
Western blot结果:设阴性对照组PTPN9蛋白表达量为1.0,miR-96模拟物组PTPN9蛋白相对表达量为0.36±0.03,miR-96抑制物组PTPN9蛋白相对表达量为3.42±0.24,前者明显降低,后者明显升高,差异均有统计学意义(均P<0.05)(图4B-C)。
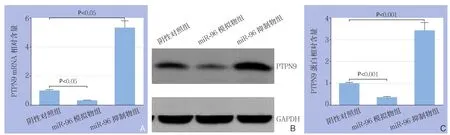
图4 miR-96对HCC细胞PTPN9表达的影响 A:qRT-PCR结果;B-C:Western blot结果Figure 4 Influences of miR-96 on PTPN9 expression in HCC cells A: Results of qRT-PCR; B–C: Results of Western blot
3 讨 论
HCC是种高度恶性的肿瘤,虽然手术仍是治疗HCC的最有效方法,据日本对148161例大宗HCC切除术后随访报道[11]指出,术后5年生存率由1978—1980年间的5.1%上升到2001—2005年间的42.7%,但肝切术后预后仍较差。转移与复发仍是影响HCC预后的主要因素。肿瘤的发生与进展是个涉及到一系列分子突变或异常表达的结果,比如miRNA[12-15]、P16、P53[16]、转化生长因子β[17]等。
miR-96在肿瘤中所起的作用不尽相同。在甲状腺癌细胞中,外源性过表达miR-96,促进了K1和TPC1细胞系增殖和克隆形成能力,并抑制凋亡;反之,下调miR-96表达,则抑制了K1和TPC1细胞系增殖和克隆形成,并促进凋亡。荧光素酶实验示,miR-96可与FOXO13′-UTR区域靶向结合,并下调FOXO1表达[9]。在乳腺癌细胞系中,miR-96促进细胞增殖、迁移和侵袭,并且miR-96可靶向调节PTPN9蛋白的表达,起癌基因的作用[6]。与之相反,在肾癌中,miR-96起抑癌基因的作用,对高侵袭能力的细胞系Caki-1和低侵袭潜能的细胞系786-O转染miR-96抑制物后,侵袭能力增加,而转染miR-96模拟物后侵袭能力降低[8]。Yu等[18]报道miR-96直接靶向结合K-ras癌基因,抑制胰腺癌细胞迁移和侵袭,并减慢肿瘤生长速度。Vishuamitra等[19]报道miR-96抑制渐变性淋巴瘤细胞增殖、克隆形成和迁移能力。表明在不同的肿瘤中,miR-96所起的作用可能完全不同。
蛋白酪氨酸磷酸酶(proteintyrosine phosphatases,PTPs)是细胞发挥生物学功能的关键分子之一,其表达异常常与肿瘤的发生密切相关[20]。PTPN9是PTPs家族中的一员,其通过对ErbB2和信号转导及转录活化因子3(signal transducer and activator of transcription 3,STAT3)脱磷酸化,进而沉默ErbB和STAT3信号通路而发挥抑癌作用[21-23]。在乳腺癌中,PTPN9在癌组织中低表达,且抑制乳腺癌的增殖和侵袭[6]。
在HCC体外实验中,本研究发现miR-96较正常肝脏细胞系L02高表达,通过向HepG2细胞系转染miR-96模拟物,发现划痕愈合率显著高于阴性对照组,侵袭细胞数显著多于阴性对照组;反之,转染miR-96抑制物后,划痕愈合率显著低于阴性对照组,侵袭细胞数显著少于阴性对照组,表明miR-96促进HCC细胞的迁移和侵袭,其促癌基因的作用,这与甲状腺癌、乳腺癌中的结果一致,而与肾癌、胰腺癌及间变性淋巴瘤[19]中的结果相反。
miR-96分子为PTPN9的上游分子,通过荧光素酶实验,Hong等[6]发现miR-96可靶向结合PTPN9,并下调其表达,进而促进乳腺癌的增殖和侵袭。Hu等[24]在HCC中报道PTPN9在HCC组织中低表达,并且PTPN9下调表达与HCC预后差相关,下调PTPN9表达促进HCC细胞系增殖,并抑制其凋亡。本研究结果与其相似,miR-96模拟物组较阴性对照组PTPN9下调表达,反之,转染miR-96抑制物后,PTPN9上调表达,其促进HCC细胞迁移和侵袭的机制可能与下调PTPN9的表达有关。
当然,本研究也存在一定的不足,比如,miR-96在HCC组织中的表达及HCC细胞的增殖和凋亡的影响如何,在动物实验中结果如何,还需进一步研究和探讨。
综上,本研究发现miR-96在HCC细胞系中高表达,且miR-96上调表达可促进HCC细胞迁移和侵袭,miR-96的上调表达可下调PTPN9的表达,miR-96在HCC发生过程中起促癌基因的作用,有可能成为一个新的治疗靶点。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87–108. doi: 10.3322/caac.21262.
[2] Calin GA, Croce CM. MicroRNA-cancer connection: the beginning of a new tale[J]. Cancer Res, 2006, 66(15):7390–7394.
[3] Farazi TA, Hoell JI, Morozov P, et al. MicroRNAs in human cancer[J]. Adv Exp Med Biol, 2013, 774:1–20. doi: 10.1007/978–94–007–5590–1_1.
[4] Iorio MV, Croce CM. MicroRNA dysregulation in cancer:diagnostics, monitoring and therapeutics. A comprehensive review[J]. Embo Mol Med, 2012, 4(3):143–159. doi: 10.1002/emmm.201100209.
[5] Ladeiro Y, Couchy G, Balabaud C, et al. MicroRNA profiling in hepatocellular tumors is associated with clinical features and oncogene/tumor suppressor gene mutations[J]. Hepatology, 2008,47(6):1955–1963. doi: 10.1002/hep.22256.
[6] Hong Y, Liang H, Uzair-ur-Rehman YW, et al. miR-96 promotes cell proliferation, migration and invasion by targeting PTPN9 in breast cancer[J]. Sci Rep, 2016, 6:37421. doi: 10.1038/srep37421.
[7] Guo H, Li Q, Li W, et al. MiR-96 downregulates RECK to promote growth and motility of non-small cell lung cancer cells[J]. Mol Cell Biochem, 2014, 390(1/2):155–160. doi: 10.1007/s11010–014–1966–x.
[8] Yu N, Fu S, Liu Y, et al. miR-96 suppresses renal cell carcinoma invasion via downregulation of Ezrin expression[J]. J Exp Clin Canc Res, 2015, 34:107. doi: 10.1186/s13046–015–0224–8.
[9] Song HM, Luo Y, Li DF, et al. MicroRNA-96 plays an oncogenic role by targeting FOXO1 and regulating AKT/FOXO1/Bim pathway in papillary thyroid carcinoma cells[J]. Int J Clin Exp Med, 2015,8(9):9889–9900.
[10] Wang Y, Luo H, Li Y, et al. hsa-miR-96 up-regulates MAP4K1 and IRS1 and may function as a promising diagnostic marker in human bladder urothelial carcinomas[J]. Mol Med Rep, 2012, 5(1):260–265. doi: 10.3892/mmr.2011.621.
[11] Kudo M, Izumi N, Kokudo N, et al. Improved survival in patients with hepatocellular carcinoma over 30 years in Japan: Analysis of nationwide prospective registry of 148,161 patients[J]. J Clin Oncol,2011, 29:269. (Abstr. #4054)
[12] 徐泰. miRNA-639在乳腺癌中表达及其意义[J]. 中国普通外科杂志, 2014, 23(11):1506–1511. doi:10.7659/j.issn.1005–6947.2014.11.010.Xu T. miRNA-639 expression in breast cancer and its significance[J]. Chinese Journal of General Surgery, 2014,23(11):1506–1511. doi:10.7659/j.issn.1005–6947.2014.11.010.
[13] 宋世铎, 周健, 何宋兵, 等. miRNA-375对胰腺癌细胞Panc-1增殖和凋亡的影响[J]. 中国肿瘤临床, 2013, 40(1):21–24. doi:10.3969/j.issn.1000–8179.2013.01.006.Song SD, Zhou J, He SB, et al. Effects of miRNA-375 on cell proliferation and apoptosis in the pancreatic cancer cell line Panc-1[J]. Chinese Journal of Clinical Oncology, 2013, 40(1):21–24.doi:10.3969/j.issn.1000–8179.2013.01.006.
[14] 施明亮, 陈勇, 刘巍. miR-21 与消化系统肿瘤[J]. 中国肿瘤临床, 2011, 38(24):1604–1607. doi: 10.3969/j.issn.1000–8179.2011.24.033.Shi ML, Chen Y, Liu W. miR-21 and Digestive System Cancers[J].Chinese Journal of Clinical Oncology 2011, 38(24):1604–1607. doi:10.3969/j.issn.1000–8179.2011.24.033.
[15] 张红红, 刘晓丽, 许思娟. 宫颈癌组织中miRNA-34c的表达水平分析及其靶基因PLK4的鉴定[J]. 中国肿瘤临床, 2015,42(22):1077–1080. doi:10.3969/j.issn.1000–8179.2015.22.028.Zhang HH, Liu XL, Xu SJ. Analysis of miRNA-34c expression in cervical cancer tissue and preliminary identification of Polo-like kinase 4 as its target gene[J]. Chinese Journal of Clinical Oncology, 2015, 42(22):1077–1080. doi:10.3969/j.issn.1000–8179.2015.22.028.
[16] 阮永威, 田兴松, 侯连泽. 乳腺癌 p16, p53 基因蛋白和 mRNA 的表达及其意义[J]. 中國普通外科杂志, 2008, 17(5): 497–501.Ruan YW, Tian XS, Hou LZ. The significance of p16 and p53 gene protein and mRNA expression on breast cancer[J]. Chinese Journal of General Surgery, 2008, 17(5):497–501.
[17] 鞠红艳, 白洋, 王策. 转化生长因子β激活酶1在结肠癌中的表达及临床意义[J]. 中国普通外科杂志, 2015, 24(10):1417–1421.doi:10.3978/j.issn.1005–6947.2015.10.014.Ju HY, Bai Y, Wang C. Expression and clinical significance of transforming growth factor -activated kinase 1 in colon cancer[J].Chinese Journal of General Surgery, 2015, 24(10):1417–1421.doi:10.3978/j.issn.1005–6947.2015.10.014.
[18] Yu S, Lu Z, Liu C, et al. miRNA-96 suppresses KRAS and functions as a tumor suppressor gene in pancreatic cancer[J]. Cancer Res,2010, 70(14):6015–6025. doi: 10.1158/0008–5472.CAN–09–4531.
[19] Vishwamitra D, Li Y, Wilson D, et al. MicroRNA 96 is a posttranscriptional suppressor of anaplastic lymphoma kinase expression[J]. Am J Pathol, 2012, 180(5):1772–1780. doi: 10.1016/j.ajpath.2012.01.008.
[20] He RJ, Yu ZH, Zhang RY, et al. Protein tyrosine phosphatases as potential therapeutic targets[J]. Acta Pharmacol Sin, 2014,35(10):1227–1246. doi: 10.1038/aps.2014.80.
[21] Tonks NK. Protein tyrosine phosphatases: from genes, to function,to disease[J]. Nat Rev Mol Cell Biol, 2006, 7(11):833–846.
[22] Turkson J. STAT proteins as novel targets for cancer drug discovery[J]. Expert Opin Ther Tar, 2004, 8(5):409–422.
[23] Hao Q, Samten B, Ji HL, et al. Tyrosine phosphatase PTP-MEG2 negatively regulates vascular endothelial growth factor receptor signaling and function in endothelial cells[J]. Am J Physiol-cell PH,2012, 303(5):C548–553. doi: 10.1152/ajpcell.00415.2011.
[24] Hu B, Yan X, Liu F, et al. Downregulated Expression of PTPN9 Contributes to Human Hepatocellular Carcinoma Growth and Progression[J]. Pathol Oncol Res, 2016, 22(3):555–565. doi:10.1007/s12253–015–0038–1.
