水杨酸调控作物耐盐性生理机制
2017-04-01沙汉景刘化龙王敬国贾琰王新鹏邹德堂赵宏伟
沙汉景,刘化龙,王敬国,贾琰,王新鹏,邹德堂,赵宏伟
(东北农业大学水稻研究所,哈尔滨 150030)
水杨酸调控作物耐盐性生理机制
沙汉景,刘化龙,王敬国,贾琰,王新鹏,邹德堂,赵宏伟*
(东北农业大学水稻研究所,哈尔滨 150030)
盐胁迫严重限制作物生长和产量。水杨酸是一种植物激素,对植物生长发育和抵御逆境胁迫具有重要作用。文章综述植物体内水杨酸合成代谢途径,水杨酸有效性影响因素及调控作物耐盐生理机制,包括诱导抗氧化防御系统,降低膜脂过氧化;促进光合和呼吸作用;调控离子吸收与分布,缓解离子毒害;调控物质代谢,改善营养状况;与其他激素或信号物质间交叉对话。同时提出相关领域研究重点。
水杨酸;盐胁迫;抗氧化系统;代谢;交叉对话
土壤盐渍化是限制作物生长和产量主要逆境之一[1]。盐胁迫对植物影响主要包括渗透胁迫、离子毒害、氧化胁迫和营养失衡四个方面。植物逆境适应机制依赖于对外界刺激的识别、产生并传递信号、基因表达、代谢调节等过程。水杨酸(Salicylicacid,SA)是一种酚类化合物,作为植物激素和信号分子,在植物生长发育和抵御逆境胁迫中具有重要作用,影响植物水分代谢、矿质营养吸收和光合作用,参与调节植物种子萌发、产热、开花、离子跨膜转运等生理过程[2-4]。目前SA在植物抗环境胁迫中作用广受关注,Horváth等研究SA信号诱导植物抗非生物胁迫[2];Ashraf等综述SA生理作用及外源SA施用方式对植物耐盐性影响[3];Hayat等报道不同逆境胁迫下外源SA对植物影响[4];Kang等阐述SA诱导植物抗逆分子机制[5];Jayakannan等阐述SA在离子转运过程中作用[6]。Janda等介绍SA信号途径[7]。本文在此基础上,综合近年研究成果,SA在植物体内合成代谢途径,影响水杨酸有效性因素及其调控作物耐盐性生理机制。
1 水杨酸在植物体内合成与代谢
高等植物中SA合成途径由苯丙氨酸途径和异分支酸途径组成(见图1),其中前者在植物中最为常见[2,6]。
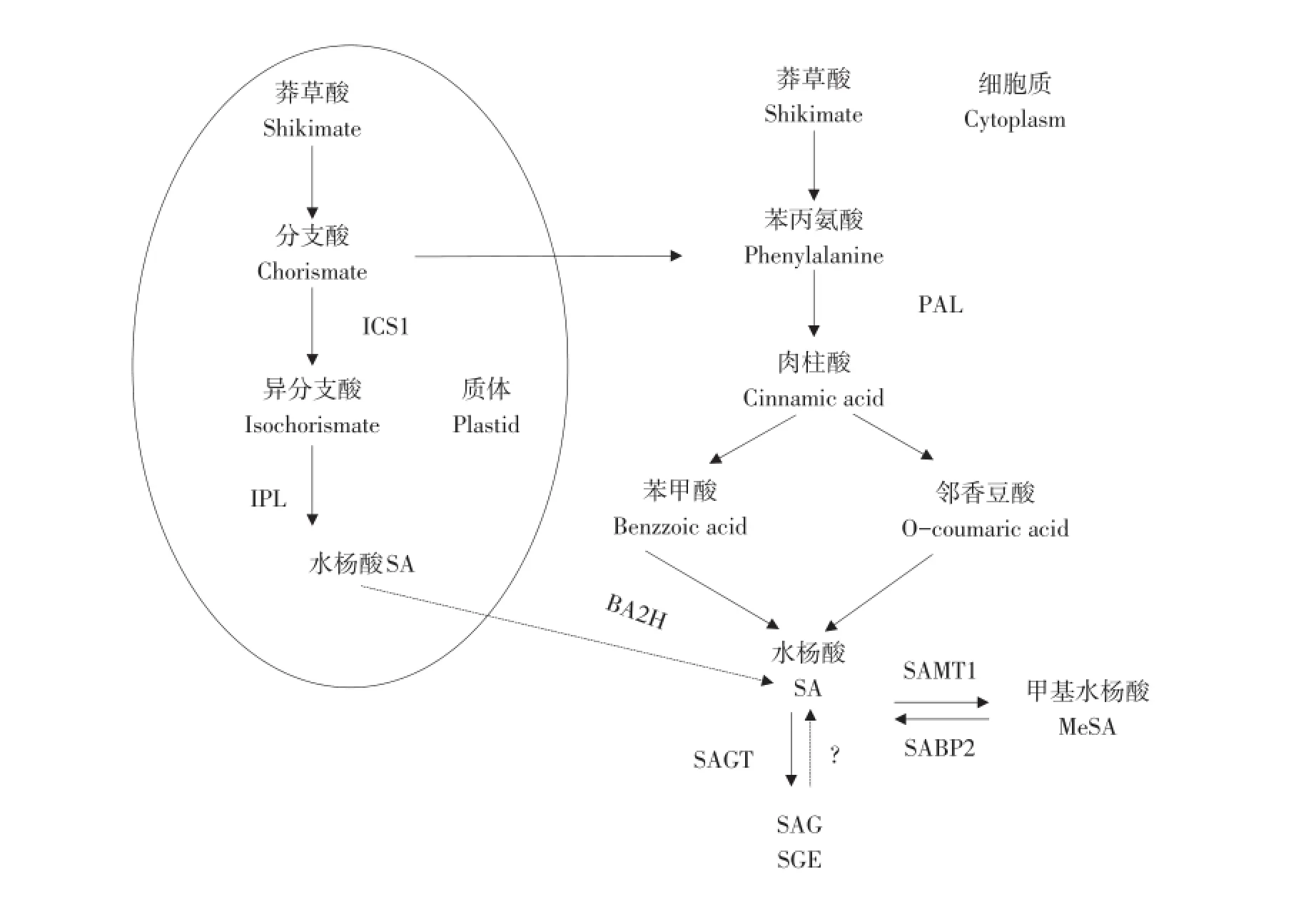
图1 植物体内水杨酸合成与代谢途径Fig.1 Synthesisandmetabolic pathway of SA in p lants
苯丙氨酸途径位于细胞质中,在苯丙氨酸解氨酶(PAL)催化下苯丙氨酸转化为肉桂酸(CA),经由两条途径产生SA。一是CA被羟基化成形成邻-香豆酸,再经β氧化形成SA;二是CA侧链最初被氧化产生苯甲酸,在苯甲酸2-羟化酶(BA2H)作用下邻位羟基化形成SA。此途径中PAL为关键酶,受多种环境胁迫诱导[3]。异分支酸途径发生在叶绿体中,来自三羧酸循环的莽草酸可转化为分支酸,在异分支酸合成酶1(ICS1)催化下形成异分支酸,再由异分支酸丙酮酸裂解酶(IPL)催化生成SA[2,6]。Pál研究发现,水稻中SA含量为5~30μg·g-1FW,而其他植物中含量<1μg·g-1FW[8]。
植物体内SA主要以活性游离态和无活性结合态存在。SA可与糖苷、糖酯、甲基乙基氨基酸等结合形成水杨酸葡萄糖苷(SAG)、水杨酸葡萄糖酯(SGE)以及甲基水杨酸(MeSA)等复合物。在SAGT(SA糖基转移酶)催化下,SA羟基处缀合葡萄糖形成SAG,SA羰基处缀合葡萄糖形成SGE[6]。其中,SA-2-O-β-葡萄糖苷(SAG)是水杨酸在植物体内主要结合态,作为一种贮存形式(贮存在液泡中),调节植物体内SA水平,防止高浓度游离SA对植物产生毒性;MeSA是SA的一种运输形式,无直接调节作用[9]。SA与MeSA间转化主要受SAMT1(SA甲基转移酶1)和SABP2(SA结合蛋白2)控制,前者催化SA生成MeSA,后者催化无活性MeSA生成SA[6]。
2 影响水杨酸有效性因素
水杨酸对作物耐盐性调控具有浓度效应,其有效性依赖作物种类、发育阶段、胁迫强度和水杨酸施用方式等(见表1)。
SA提高作物耐盐性研究在玉米[10-13]、水稻[14-17]、豆类(赤豆[18]、扁豆[19]、绿豆[18,20-22]、大豆[23]、菜豆[24])、马铃薯[25]、小麦[26-30]、大麦[31-32]、棉花[33]、向日葵[34-35]等作物均有报道,其中玉米施用SA有效浓度范围为0.1~10mmol·L-1,水稻为0.1~2.1mmol·L-1,豆类为0.03~1mmol·L-1,马铃薯为0.5mmol·L-1,小麦为0.05~1mmol·L-1,大麦为0.5~2mmol·L-1,棉花为0.5mmol·L-1,向日葵为1.4mmol·L-1。由于作物种类、基因型、发育阶段以及胁迫强度不同,作物胁迫耐受能力及对外源SA吸收利用差异较大。因此,农业生产过程应根据实际情况对SA浓度进一步筛选。
盐胁迫是持续过程,作物各生育时期对盐胁迫敏感性不同,因此施用外源SA时应考虑作物不同生育时期对盐敏感性差异。目前研究多集中在作物萌发期和幼苗期施用SA,但作物营养生长期和开花期施用SA也可提高作物耐盐性[21,23]。在作物生育前期施用SA可促进盐胁迫下种子萌发和幼苗生长,但其有效性持续期尚不明确。Arfan等发现SA促进耐盐春小麦品种生长,增加百粒重、穗粒数和每穗颖花数并提高产量,但对中度盐敏感品种无明显作用[27]。Pirasteh-Anosheh等同样证实,拔节期喷施0.5~2mmol·L-1SA可显著提高盐胁迫下大麦产量[32]。
SA有效浓度与胁迫强度有关,对不同胁迫强度缓解作用不同。Yusuf等报道10μmol·L-1的SA可完全缓解50mmol·L-1NaCl对芥菜毒性作用[36]。Qados等研究表明,1.8mmol·L-1SA可显著缓解中低度盐胁迫(34~68mmol·L-1NaCl)对辣椒不利影响,部分缓解高盐胁迫(102mmol·L-1NaCl)不利影响[37]。由于盐胁迫强度超出植物承受范围,导致不可逆损伤。因此,推测植物在盐胁迫耐受范围内,水杨酸具有较好调控作用,但超出一定范围,调控作用下降甚至加重盐胁迫。
除上述因素外,水杨酸有效性还取决于施用方式,如种子预处理,生根基质和叶面喷施。吴以平等研究表明,SA种子预处理加重盐胁迫对绿豆和赤豆的抑制作用,而SA作为生根基质则可缓解盐胁迫不利影响[18]。由表1可知,大部分作物种子预处理施用SA有效浓度为0.05~1 mmol·L-1;SA作为生根基质有效浓度为0.03~2mmol·L-1;叶面喷施SA有效浓度为0.01~10mmol·L-1。叶面喷施SA有效浓度变幅较大,可能由于叶片面积及对SA吸收利用能力不同,也与作物种类、基因型和发育阶段有关。目前尚无不同处理方式间差异研究。
根据SA施用与胁迫时间不同又可分为:①水杨酸处理先于盐胁迫;②水杨酸与盐胁迫同步;③盐胁迫后施用水杨酸。种子预处理和生根基质中SA通常先于胁迫或与盐胁迫同步进行,而叶面喷施SA通常选择在盐胁迫前或胁迫后进行。从农业生产角度考虑,种子预处理是重要农艺措施,通过提高盐胁迫下种子发芽率和幼苗生长,促进盐渍化土地上植物前期生长;水杨酸作为生根基质研究多数采用水培或营养液培养,使受胁迫植物长期处于“保护与胁迫”共存状态,但由于需要定期更换溶液,成本较高;叶面喷施是常见且易操作方式,但生产中除确定最适浓度外,还应注意喷施用量、喷施次数和周期等问题,部分研究详见表1。

表1 盐胁迫下外源水杨酸对不同种类作物生长及不同生理生化过程调节Tab le1 Modulation ofgrow th and variousphysiologicaland biochem icalprocessesof different crop speciesunder salt stressby salicylic acid
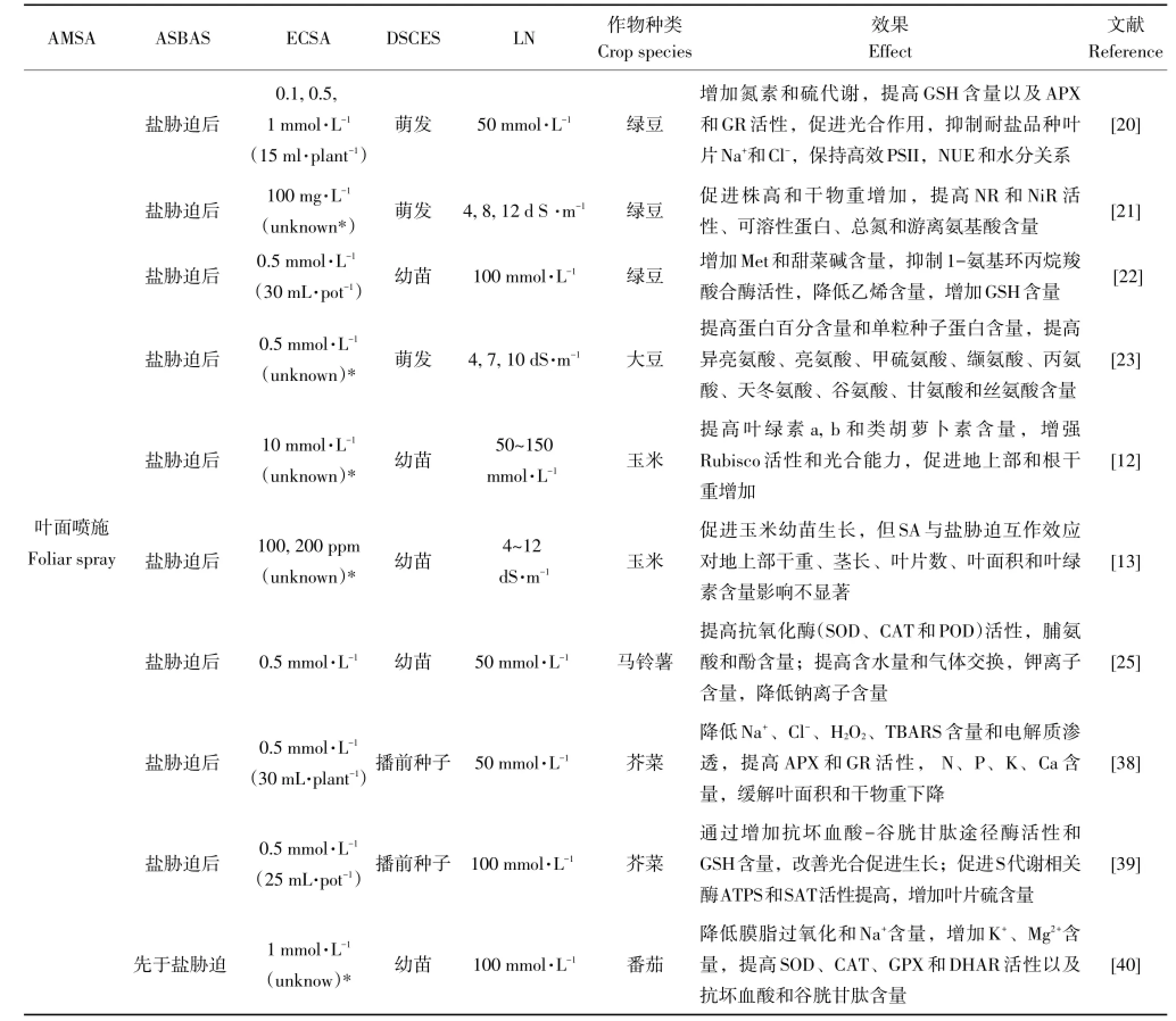
续表
3 水杨酸提高作物耐盐性生理机制
3.1 诱导抗氧化防御系统并缓解膜脂过氧化
盐胁迫下作物体内产生活性氧(ROS),如超氧阴离子(O2-)、过氧化氢(H2O2)和羟基自由基(OH-)等,ROS过度积累将打乱作物体内氧化还原稳态,诱发氧化损伤。植物体内活性氧清除系统主要有两类,抗氧化酶系统和抗坏血酸-谷胱甘肽(AsA-GSH)系统。抗氧化酶系统中超氧化物歧化酶(SOD)可催化O2-生成O2和H2O2,过氧化物酶(POD)和过氧化氢酶(CAT)可催化H2O2生成O2和H2O。AsA-GSH循环中抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)、谷胱甘肽还原酶(GR)、单脱氢抗坏血酸还原酶(MDHAR)和谷胱甘肽还原酶(GR)清除H2O2并维持AsA和GSH氧化还原状态平衡。
SA与活性氧(ROS)关系复杂。Horváth等报道称SA可直接清除活性氧或通过调节抗氧化酶活性清除活性氧,认为SA作用效果取决于SA浓度,即低浓度SA提高抗氧化酶活性,高浓度抑制抗氧化酶活性[2-3]。康国章等推测SA在抗环境胁迫中正负效应与H2O2水平有关,即低浓度SA诱导产生适度H2O2,诱导植物对环境胁迫产生防卫反应,而高浓度SA诱导产生过量H2O2则加剧环境胁迫对植物损伤[41]。SA与H2O2间存在一种“自我反馈放大机制”,即H2O2诱导积累SA,SA促进H2O2积累[6-7]。SA受体具有多种SABPs,如水杨酸甲酯脂酶、CAT、APX和叶绿体碳酸酐酶,其中CAT和APX被认为是SA受体和效应子[7];SA与受体结合后,作为单电子供体底物,抑制CAT和APX活性,积累H2O2[42]。大量研究表明,外源SA可提高SOD和POD活性[16,28,43],但对于CAT影响仍存争议,认为SA降低CAT活性[43]、提高CAT活性[25,36-37]或对CAT无显著影响[44],这可能与作物体内CAT酶量与内源SA水平有关。细胞内氧化还原状态受抗坏血酸、谷胱甘肽水平及其氧化还原形态平衡控制。外源SA提高谷胱甘肽-抗坏血酸循环相关酶活性(APX[20,28,38-39,42]、DHAR[17,39-40,43-44]和GR[20,38-39])、谷胱甘肽过氧化物酶(GPX)和谷胱甘肽-S-转移酶(GST)活性[17,44],使MDHAR活性降低[17]或升高[44],增加AsA[17,38,44]、GSH[16,20,41]含量,提高AsA/DHA和GSH/GSSG[17,20],降低丙二醛含量[16]、膜脂过氧化[28-29,31]和电子渗透率[38]。
3.2 促进光合和呼吸作用
影响植物光合和呼吸作用的主要因素为气孔限制和非气孔限制因素。盐胁迫引起气孔关闭,胞内CO2浓度下降,Rubisco酶等相关酶活性下降[45];此外,盐胁迫破坏叶绿体结构和光合色素,降低叶绿素含量和叶绿素蛋白复合体,净光合速率下降。Khodary研究表明,SA提高盐胁迫下玉米叶绿素a、b和类胡萝卜素含量,增强Rubisco活性和光合能力,促进地上部和根干重增加[12]。Stevens等研究发现,SA可提高盐胁迫下番茄光合速率、呼吸速率和气孔导度(gs)[46]。Noreen报道,SA可增加盐胁迫下向日葵地上部和根鲜干重,提高光合速率、gs和水分利用率,但胞间CO2浓度(Ci)未发生变化。Nazar等研究表明,SA提高盐胁迫下绿豆gs、Ci、叶绿素荧光(Fv/Fm)和净光合速率(Pn),保持高效PSII和光合氮素利用率[20];SA提高盐胁迫下芥菜中Rubisco活性和净光合速率[39]。Poór等研究指出,正常条件下10-3mol·L-1SA降低番茄gs、最大CO2固定效率(Amax)、CO2初始斜率(A/Ci)、光反应曲线(A/PPFD)、Rubisco羧化效率(CE)和光合量子效率(Q),导致植株死亡;而低浓度SA(10-4~10-7mol·L-1)处理3周后番茄植株gs、光合性能和可溶性糖恢复到正常水平;10-4~10-7mol·L-1SA预处理植株在盐胁迫下具有较高Amax、CE和Q[47]。由此可知,SA对盐胁迫下植物光合和呼吸作用调节涉及气孔和非气孔限制因素,与作物种类和SA浓度有关。
3.3 调控离子吸收与分布,缓解离子毒害
盐胁迫下维持适宜K+/Na+有助于提高植物耐盐性[2-4]。EI-Tayeb等报道,外源水杨酸促进盐胁迫下植物体内P含量积累,降低Na+及根中Ca2+含量,增加K+含量[31]。Gunes等报道SA可促进盐胁迫下玉米中氮素、Mg、Fe、Mn和Cu含量积累[11]。He等研究认为,SA可降低盐胁迫下番茄中Na+含量,增加K+、Mg2+含量[40]。Nazar等研究发现,外源SA可抑制耐盐品种叶片中Na+和Cl-积累[20]。Syeed等研究发现,SA可降低盐胁迫下芥菜中Na+和Cl-含量,提高N、P、K、Ca含量[39]。而Pirasteh-Anosheh等研究指出,SA提高大麦耐盐性主要通过调控离子分布,而非离子积累,即提高根中Na+、Cl-比例,降低根中K+比例[32]。Jayakannan等系统综述SA在调控盐胁迫下离子转运中作用,并认为NPR-1介导的SA信号在调控离子转运中起关键作用:①控制钠离子进入根部及之后通过长距离运输至地上部过程;②提高根中H+-ATPase活性;③通过去极化激活外向整流钾离子通道(KOR)和活性氧激活非选择性离子通道,阻止胁迫诱导引起根中K+外渗;④增加地上部K+含量。目前,SA调控离子外排和区隔化机制尚不清楚[6]。
3.4 调控物质代谢,改善营养状况
盐分影响养分运输和分布,形成竞争性吸收,造成植物营养失衡,其中对植物氮代谢过程影响较明显,如离子吸收、氮素同化、氨基酸和蛋白质合成。氮素在植株营养和生殖器官中积累、转化和利用对植物生长发育、产量和品质形成起决定性作用。郑春芳等发现花后盐胁迫和盐渍处理降低小麦花前贮藏氮素转运量和花后氮素输入籽粒量,导致小麦籽粒产量、蛋白质和淀粉产量显著降低;盐胁迫和盐渍处理显著降低小麦籽粒蛋白质积累量及谷/醇蛋白比,显著提高蛋白质组分含量,降低籽粒淀粉积累量、淀粉组分含量及直/支链淀粉比[48]。盐胁迫下施用SA可提高绿豆幼苗NR、NiR活性、氮含量[11,20]和ATP硫酸化酶(ATPS)活性,改善绿豆氮素和硫素代谢[20];提高水稻GS和NADH-GDH活性,降低水稻幼苗根部脯氨酸含量[15]。Farhangi-Abriz等研究发现SA可提高盐胁迫下大豆蛋白质百分含量和单粒种子蛋白含量,提高异亮氨酸、亮氨酸、甲硫氨酸、缬氨酸、丙氨酸、天冬氨酸、谷氨酸、甘氨酸和丝氨酸含量[23]。
3.5 与其他激素或信号物质间交叉对话
在长期进化过程中,植物形成高度完整的感知和响应盐胁迫信号传导途径,协调植物胁迫耐受及生长发育过程。陶宗娅认为,不同条件下SA参与的信号传导途径及代谢调节机理可能不同[49]。康国章等从活性氧、Ca2+信使系统、蛋白质磷酸化和去磷酸化及与其他信号转导途径交叉性方面,系统解释水杨酸提高抗环境胁迫机理[41],但并未涉及盐胁迫环境。Asensi-Fabado等研究指出,50 μmol·L-1赤霉素(GA)可改善盐胁迫下拟南芥SA缺失突变体sid2种子萌发[50],暗示GA可抵消SA缺失影响。Shakirova等报道正常条件下SA浸种处理可在短时间内促进ABA和IAA含量显著增加,对细胞分裂素无显著影响;盐胁迫下小麦幼苗短暂积累ABA,降低IAA和细胞分裂素含量;外源SA提高盐胁迫下小麦幼苗IAA和细胞分裂素含量,抑制ABA含量增加,降低盐胁迫对幼苗损伤[26]。表明SA对作物体内激素调节为综合调控过程,且对ABA含量影响与环境有关。Palma等报道,SA处理可抑制盐胁迫下苜蓿根瘤内多胺积累,增加1-氨基环丙烷1-羧酸(ACC)含量,暗示SA激活依赖乙烯过敏响应[43]。而Khan等研究发现,SA通过增加Met含量诱导盐胁迫下绿豆积累甜菜碱,显著抑制1-氨基环丙烷羧酸合酶(ACS)活性,降低乙烯含量[22]。这表明SA与乙烯之间关系并非一成不变。Mostofa等研究表明,NO通过上调抗氧化防御系统和丙酮醛脱毒系统参与H2O2和SA诱导的抗氧化损伤过程。Manaa等指出单独施用SA或钙离子可提高番茄耐盐性,且SA和钙离子同时施用效果更好,说明SA和Ca2+可相互作用减轻盐胁迫[51]。
4 结语与展望
SA作为普遍存在于高等植物体内的信号分子,在抵御非生物逆境领域广受关注。本文阐述影响SA有效性因素(浓度、作物种类、发育阶段、胁迫强度和水杨酸施用方式等),将SA调控调控作物耐盐性生理机制概括为五个方面:①诱导抗氧化防御系统,降低膜脂过氧化;②促进光合和呼吸作用;③调控离子吸收与分布,缓解离子毒害;④调控物质代谢,改善营养状况;⑤与其他激素或信号物质间交叉对话。然而,目前尚未明确SA在不同胁迫强度、植物、生育阶段以及器官内累积与转运规律;外源SA不同处理方式(种子预处理、生根基质和叶面喷施)对内源SA影响;SA处理与盐胁迫先后顺序对耐盐性影响有何不同;叶面喷施SA最佳时期、喷施次数与周期;SA如何调控矿质元素吸收与分配;SA如何调控盐胁迫下作物产量和品质;SA调控物质代谢(碳代谢和氮代谢)分子机制;何种激素受体和调节子参与SA信号传导机制;其他信号分子如H2O2、NO等位于SA信号传导途径上游还是下游。今后研究需深入了解SA调控作物耐盐机理并使其在农业生产中发挥应有作用。
[1]Koca H,BorM,Özdemir F,etal.The effectofsaltstresson lipid peroxidation,antioxidative enzymes and proline contentofsesame cultivars[J].Environmental&Experimental Botany,2007,60(3): 344-351.
[2]Horváth E,SzalaiG,Janda T.Induction ofabiotic stress tolerance by salicylic acid signaling[J].JPlant Growth Regul,2007,26(3): 290-300.
[3]AshrafM,Akram N A,Arteca R N,etal.The physiological,biochemical and molecular roles of brassinosteroidsand salicylic acid in plant processes and salt tolerance[J].Crit Rev Plant Sci, 2010,29(3):162-190.
[4]HayatQ,Hayat S,Irfan M,etal.Effectofexogenous salicylic acid under changing environment:A review[J].Environ Exp Bot,2010,68(1):14-25.
[5]Kang G,LiG,Guo T.Molecularmechanism of salicylic acid-induced abiotic stress tolerance in higher p lants[J].Acta Physiol Plant,2014,36(9):2287-2297.
[6]Jayakannan M,Bose J,Babourina O,etal.Salicylic acid in plant salinity stress signalling and tolerance[J].Plant Growth Regul, 2015,76(1):25-40.
[7]JandaM,Ruelland E.Magicalmystery tour:Salicylic acid signalling[J].Environ Exp Bot,2015,114:117-128.
[8]Pál M,Kovács V,SzalaiG,et al.Salicylic acid and abiotic stress responses in rice[J].JAgron Crop Sci,2014,200(1):1-11.
[9]李亮.水杨酸在黄瓜(Cucumissativus L.)幼苗应答低温胁迫中的作用机制[D].北京:中国农业科学院,2013.
[10]张彩芳.水杨酸和沙引发对糯玉米种子在盐逆境下发芽及生理特性的影响[D].杭州:浙江大学,2007.
[11]Gunes A,Inal A,Alpaslan M,etal.Salicylic acid induced changes on some physiologicalparameters symptomatic foroxidative stress andmineralnutrition inmaize(Zeamays L.)grown under salinity [J].JPlant Physiol,2007,164(6):728-36.
[12]Khodary SE A.Effectof salicylic acid on thegrowth,photosynthesis and carbohydratemetabolism in salt-stressed maize plants[J]. Int JAgr Biol,2004(6):5-8.
[13]Farahbakhsh H,Saiid M S.Effectsof foliar application ofsalicylic acid on vegetative growth ofmaize under saline conditions[J].Afr JPlantSci,2011,5(10):575-578.
[14]徐芬芬,叶利民,孙海玲,等.水杨酸对水稻种子活力及抗盐性的影响[J].广东农业科学,2009(8):38-39.
[15]马敬坤,袁永泽,欧吉权,等.外源水杨酸对水稻(Oryza sativa L.)幼苗根的NaCl胁迫缓解效应[J].武汉大学学报:理学版, 2006,52(4):471-474.
[16]王俊斌,王海凤,刘海学.水杨酸促进盐胁迫条件下水稻种子萌发的机理研究[J].华北农学报,2012,27(4):223-227.
[17]Mostofa M G,Fujita M,Tran LSP.Nitric oxidemediates hydrogen peroxide-and salicylic acid-induced salt tolerance in rice (Oryza sativa L.)seedlings[J].Plant Grow th Regul,2015,77(3): 265-277.
[18]吴以平,董树刚,韩宗晏.水杨酸对NaCl胁迫下绿豆和赤豆萌发生长的影响[J].植物生理学报,2002,38(2):137-138.
[19]Neelam M,PreetiS.Effectof salicylic acid on prolinemetabolism in lentil grown under salinity stress[J].Plant Sci,2009,177(3): 181-189.
[20]Nazar R,IqbalN,Syeed S,etal.Salicylic acid alleviates decreases in photosynthesis under salt stressby enhancing nitrogen and sulfur assimilation and antioxidant metabolism differentially in two mungbean cultivars[J].JPlant Physiol,2011,168(8):807-815.
[21]Akhtar J,Ahmad R,AshrafM Y,etal.Influence ofexogenous application ofsalicylic acid on salt-stressedmungbean(Vigna radiata):growth and nitrogen metabolism[J].Pak JBot,2013,45(1): 119-125.
[22]Khan M IR,Asgher M,Khan N A.Alleviation of salt-induced photosynthesis and growth inhibition by salicylic acid involves glycinebetaine and ethylene in mungbean(Vigna radiata L.)[J]. PlantPhysiol Bioch,2014,80(1):67-74.
[23]Farhangi-Abriz S,Ghassemi-Golezani K.Improving amino acid composition ofsoybean under salt stress by salicylic acid and jasmonic acid[J].JAppl Bot Food Qual,2016,89(1):243-248.
[24]张凤银,陈禅友,胡志辉,等.外源水杨酸对盐胁迫下菜豆种子萌发和幼苗生理特性的影响[J].东北农业大学学报,2013,44 (10):39-43.
[25]Faried H N,Ayyub C M,Am jad M,et al.Salicylic acid confers salt tolerance in potato p lants by improving water relations,gaseous exchange,antioxidant activities and osmoregulation[J].JSci Food Agr,2016,97(6):1868-1875.
[26]Shakirova F M,Sakhabutdinova A R,Bezrukova M V,et al. Changes in hormonalstatusofwheatseedlings induced by salicylic acid and salinity[J].PlantSci,2003,164(3):317-322.
[27]Arfan M,Athar H R,AshrafM.Doesexogenousapplication ofsalicylic acid through the rootingmedium modulate grow th and photosynthetic capacity in two differently adapted spring wheat cultivars under salt stress?[J].J Plant Physiol,2007,164(6):685-694.
[28]冯峰,王育鹏,张震,等.水杨酸通过一氧化氮信号诱导抗氧化防护来提高小麦幼苗根部耐盐性[J].中国农学通报,2008,24 (9):248-252.
[29]Kang G,LiG,Zheng B,etal.Proteomic analysison salicylic acidinduced salt tolerance in common wheat seedlings(Triticum aestivum L.)[J].BBA-Proteins and Proteo,2012,1824(12):1324-1333.
[30]LiG,Peng X,Wei L,etal.Salicylic acid increases the contentsof glutathione and ascorbate and temporally regulates the related gene expression in salt-stressed wheat seedlings[J].Gene,2013, 529(2):321-325.
[31]EI-Tayeb MA.Response of barley grains to the interactive effect of salinity and salicylic acid[J].Plant Growth Regul,2005,45(3):215-224.
[32]Pirasteh-Anosheh H,Emam Y,Rousta M J,et al.Salicylic acid induced salinity tolerance through manipulation of ion distribution rather than ion accumulation[J].JPlantGrowth Regul,2017, 36(1):227-239.
[33]朱伟,袁超,马宗斌,等.水杨酸对盐胁迫下棉花种子萌发和幼苗生长的影响[J].江西农业学报,2009,21(10):17-19.
[34]Noreen S,AshrafM.Alleviation ofadverse effects of salt stress on sunflower(Helianthusannuus L.)by exogenous application of salicylic acid:Growth and photosynthesis[J].Pak JBot,2008,40(4): 1657-1663.
[35]Noreen S,Ashraf M,Hussain M,et al.Exogenous application of salicylic acid enhancesantioxidative capacity in saltstressed sunflower(Helianthusannuus L.)plants[J].Pak JBot,2009,41(1): 473-479.
[36]YusufM,Hasan SA,AliB,etal.Effectof salicylic acid on salinity-induced changes in Brassica juncea[J].J Integr Plant Biol, 2008,50(9):1096-1102.
[37]Qados A M SA.Effects of salicylic acid on growth,yield and chemical contents of pepper(Capsicum Annuum L)plants grown under salt stress conditions[J].Int JAgr Crop Scis,2015,8(2): 107-113.
[38]Syeed S,Anjum N A,Nazar R,et al.Salicylic acid-mediated changes in photosynthesis,nutrients content and antioxidantmetabolism in twomustard(Brassica juncea L.)cultivars differing in salt tolerance[J].Acta PhysiolPlant,2011,33(3):877-886.
[39]Nazar R,Umar S,Khan NA.Exogenous salicylic acid improves photosynthesisand growth through increase in ascorbate-glutathionemetabolism and Sassimilation inmustard under saltstress[J]. PlantSignalBehav,2015,10(3):1-10.
[40]He Y,Zhu Z J.Exogenous salicylic acid alleviates NaCl toxicity and increases antioxidative enzymeactivity in Lycopersicon esculentum[J].Biol Plantarum,2008,52(52):792-795.
[41]康国章,孙谷畴,王正询.水杨酸在植物抗环境胁迫中的作用[J].广西植物,2004,24(2):178-183.
[42]周莹,寿森炎,贾承国,等.水杨酸信号转导及其在植物抵御生物胁迫中的作用[J].自然科学进展,2007,17(3):305-312.
[43]Palma F,López-Gómez M,Tejera N A,et al.Salicylic acid improves the salinity tolerance of Medicago sativa in symbiosiswith Sinorhizobium meliloti by preventing nitrogen fixation inhibition [J].PlantSci,2013,208:75-82.
[44]Hasanuzzaman M,Alam MM,Nahar K,et al.Exogenous salicylic acid alleviates salt stress-induced oxidative damage in Brassica napus by enhancing the antioxidant defense and glyoxalase systems[J].Aust JCrop Sci,2014,8(4):631-639.
[45]Negrão S,Schm-ckel SM,Tester M.Evaluating physiological responses of plants to salinity stress[J].Ann Bot,2017,119(1):1-11.
[46]Stevens J,Senaratna T,Sivasithamparam K.Salicylic acid induces salinity tolerance in tomato(Lycopersicon esculentum cv.Roma): Associated changes in gas exchange,water relations and membrane stabilisation[J].PlantGrowth Regul,2006,49(1):77-83.
[47]Poór P,Gémes K,Horváth F,et al.Salicylic acid treatment via the rootingmedium interfereswith stomatal response,CO2fixation rate and carbohydratemetabolism in tomato,and decreases harmfuleffects of subsequentsalt stress[J].Plant Biology,2011,13(1): 105-114.
[48]郑春芳,姜东,戴廷波,等.花后盐与渍水逆境对小麦籽粒产量及蛋白质和淀粉积累的影响[J].应用生态学报,2009,20(10): 2391-2398.
[49]陶宗娅,邹琦,彭涛,等.水杨酸在小麦幼苗渗透胁迫中的作用[J].西北植物学报,1999,19(2):296-302.
[50]Asensi-FabadoM A,Munné-Bosch S.The aba3-1mutantof Arabidopsis thalianawithstandsmoderatedosesofsaltstressbymodulating leaf growth and salicylic acid levels[J].J Plant Growth Regul,2011,30(4):456-466.
[51]Manaa A,Gharbi E,Mimouni H,et al.Simultaneous app lication of salicylic acid and calcium improves salt tolerance in two con-
Physiological mechanism of salicylic acid regulating salt tolerance ofcrops
SHA Han jing,LIU Hualong,WANG Jingguo,JIA Yan,WANG Xinpeng,ZOU Detang,ZHAOHongwei
(Rice Research Institute, Northeast Agricultural University, Harbin 150030, China)
Salinization was one of the major abiotic stresses in the world limiting crop growth andyield. Phytohormone salicylic acid (SA) played an important role in regulating plant growth, development andagainst stress. This paper reviewed the synthesis and metabolic pathway of SA in plants, factors influencingthe effectiveness of SA, and the physiological mechanism of SA in regulating plant salt tolerance. Thephysiological mechanism that SA alleviated salt stress including five aspects: enhancing antioxidant defensesystem and scavenging reactive oxygen species, improving photosynthesis and respiration, regulating ionuptake and distribution, and mitigating ion toxicity, regulating material metabolism and improving nutritionalstatus, cross-talking with other hormones or signaling molecule. Several questions to be resolved in futurewere put forward.
salicylic acid; salt stress; antioxidant defense system; metabolism; cross-talk
Q945.78
A
1005-9369(2017)03-0080-09
时间2017-3-21 14:04:00[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170321.1404.020.htm l
沙汉景,刘化龙,王敬国,等.水杨酸调控作物耐盐性生理机制[J].东北农业大学学报,2017,48(3):80-88.
Sha Hanjing, Liu Hualong, Wang Jingguo, et al. Physiological mechanism of salicylic acid regulating salt tolerance ofcrops[J]. Journal of Northeast Agricultural University, 2017, 48(3): 80-88. (in Chinese with English abstract)
2017-02-23
国家重点研发计划项目(2016YFD0300104);黑龙江省重大科技招标项目(GA14B102-02)
沙汉景(1986-),男,博士研究生,研究方向为作物逆境生理。E-mail:nkxshahanjing@163.com
*通讯作者:赵宏伟,教授,博士生导师,研究方向为作物高产理论与栽培技术。E-mail:hongweizhao@163.com
