低温处理对葡萄果皮细胞结构的影响
2017-03-31唐国冬杨继红
唐国冬,田 雨,王 倩,杨继红,,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.西北农林科技大学葡萄与葡萄酒(合阳)试验站,陕西 合阳 715300)
低温处理对葡萄果皮细胞结构的影响
唐国冬1,田 雨2,王 倩2,杨继红1,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.西北农林科技大学葡萄与葡萄酒(合阳)试验站,陕西 合阳 715300)
目的:通过研究低温处理对葡萄果皮细胞结构的影响,揭示其影响葡萄酒品质的内在机制。方法:分别对户太八号、赤霞珠葡萄果粒进行4、-8、-20、-32 ℃和液氮低温处理,电子显微镜观察果皮细胞的结构变化,并检测果实酚类物质和香气成分含量。结果:果皮细胞经4 ℃处理后,无明显变化;-8 ℃处理后,出现质壁分离,析出单宁、淀粉等结晶体;-20 ℃处理后,细胞严重变形,胞内物质混乱模糊,细胞膜系统出现裂痕,单宁等后含物增多;-32 ℃和液氮处理后,细胞壁、膜结构破坏更完全。结果表明:低温处理能够使果皮细胞溶出更多的单宁、总酚、总花色苷和香气物质,且在不同温度条件下处理其含量有显著性差异,其中-8、-20、-32 ℃处理后细胞溶出结果最显著;4 ℃、液氮处理不能溶出香气成分。结论:低温处理破坏了细胞结构,加快了酚类物质、芳香物质的溶出,有利于提高葡萄汁的品质。
葡萄;低温处理;果皮细胞;电子显微镜观察;葡萄酒品质
影响葡萄酒质量的酚类物质、芳香物质等重要成分主要存在于葡萄果皮中。酚类物质是构成葡萄固体部分的主要物质之一,多存在于葡萄果皮细胞的细胞壁及下表皮细胞液泡中[1-2],常见的种类有花色素、单宁、黄酮类、酚酸类等。花色素是有益人类健康[3]的物质,一般存在于葡萄表皮细胞的液泡中[4],其浓度是果肉细胞的4~8 倍[5],随细胞破裂迅速进入葡萄汁中[6],直接影响葡萄和葡萄酒的颜色、葡萄酒的感官属性与香味物质[7]。单宁在葡萄酒中具有沉淀蛋白质、稳定色素、抗氧化、抗菌等作用,同时还能防止还原味和光味的产生[8],进一步影响葡萄酒的口感和颜色[9-10]。白藜芦醇、槲皮素等属于类黄酮物质,一般也存在于葡萄果皮中,具有强抗氧化和抗自由基功能,可延缓肿瘤生长达到防治癌症的作用[11],具有良好的防治心血管疾病的功效[12]。葡萄果实的芳香物质主要是酯类、醛类、萜烯类等化合物,决定着葡萄[13]、葡萄酒的香气类型[14],影响葡萄酒的风味和典型性[15],一般存在于果皮细胞[16]及其液泡中[17]。因此,有效提取葡萄果皮中的酚类和芳香类物质是酿造优质葡萄酒的关键。
通过低温胁迫、冷冻损伤机理形成的冻害[18]或冰晶[19]可以破坏果皮细胞的细胞壁和细胞膜系统的结构和功能,使细胞内的物质成分流到胞外,此过程中发生的物理、化学变化还有可能加速酶的反应,使酶更易与底物作用[20]。研究表明,低温处理葡萄果实不但可以提高出汁率,而且几乎不损失葡萄皮的挥发性物质成分[21],还能浸提出更多对葡萄酒品质起决定作用的物质,如香气成分[22]和酚类物质[23-24]。
户太八号和赤霞珠果皮中都含有较多的酚类和香气物质,且在果皮厚度及果皮与果肉分离程度上很相似。光学显微镜下观察户太八号果皮细胞可以从显微结构宏观地观察到细胞层次、整体形态的变化,再通过透射电子显微镜观察相同处理的赤霞珠果皮细胞能够从亚显微结构观察细胞超微结构[25]、细胞形态、层次排列及破损程度等,并检测葡萄汁中的酚类物质和香气成分含量。实验通过分析不同低温处理后葡萄果皮细胞结构和理化指标的变化,明确不同温度处理对葡萄果皮细胞内重要物质溶出程度的影响,以期为低温冷冻处理在葡萄汁及葡萄酒加工中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
葡萄原料:赤霞珠采自河北昌黎华夏酒庄葡萄示范园;户太八号采自陕西户县果树研究所葡萄示范园。
戊二醛(含量50%,电子显微镜专用)、甲基纤维素 上海麦克林生化科技有限公司;黄胶(USP级)阿拉丁试剂有限公司;锇酸(纯度99.8%) 国药集团化学试剂有限公司;无水乙醇、无水丙酮、没食子酸(均为分析纯) 广东省化学试剂工程技术研究开发中心;盐酸(含量35%)、甲醇、碳酸钠、氯化钾、无水乙酸钠(均为分析纯) 广东光华科技股份有限公司;儿茶素(含量≥90%) 南京都莱生物公司。
1.2 仪器与设备
HT7700型透射电子显微镜(配有电子显微镜图像管理软件及涡轮分子泵真空系统) 日本日立高新技术公司;BX52+DP72型生物显微镜(配有专业显微数码CCD DP72摄50C系统) 日本奥林巴斯株式会社;Trace GC ultra-Trace DSQ气相色谱-质谱联用仪(配有TurboMatrix 350热解析仪、DB-Wax色谱柱(30 m×0.25 mm,0.25 μm)及2002版NIST质谱谱库)美国Finnigan公司;CM3050s型冷冻切片机 德国Leica公司;UV-60紫外-可见光分光光度计 美国安捷伦公司;DW-FL362型-40 ℃低温冷冻冰箱 安徽中科美菱公司;4 ℃医用冷藏冰箱 山东澳柯玛公司;HH147U型四通道数显温度计 美国Omega公司;85-2数显恒温磁力搅拌器 杭州仪表电机有限公司;FD-IC-50型低温真空冷冻干燥机 北京博医康实验仪器有限公司。
1.3 方法
1.3.1 样品冷冻处理
拣选成熟度好的葡萄果粒,分为6 组,每组选用200~300 粒,以16 ℃为对照,分别在4、-8、-20、-32 ℃及液氮状态下进行低温处理,当温度分别降至设定温度后,立即取出处理好的葡萄,迅速移至冷藏室解冻至4 ℃,全程记录葡萄果粒中心温度变化情况。
1.3.2 显微镜观察
1.3.2.2 光学显微镜观察
使用冷冻切片机将样品制成超薄切片,用光学显微镜观察细胞及组织的整体形态和结构变化,并拍照记录。
1.3.2.2 透射电子显微镜观察前处理
制样:选取冷冻处理后的葡萄果粒5~6 颗,撕下果皮,用刀片将果皮切成2 mm×3 mm的样品块,分别制作5 个样品小块,并将样品块置于含有2 mL 4%戊二醛的5 mL离心管中,4 ℃条件下保存过夜。
漂洗及锇酸固定:除净样品表面的戊二醛,磷酸盐缓冲液冲洗样品块5 次,每次15 min。加入0.5 mL锇酸,放置1.5~2.0 h,再用磷酸盐缓冲液进行漂洗5 次,步骤同上。
脱水:分别用不同体积分数梯度的乙醇溶液对样品块依次进行脱水操作。30%、50%乙醇溶液分别浸泡15 min脱水,再用70%乙醇溶液脱水,静置过夜后80%、90%乙醇溶液分别依次脱水15 min,再用100%乙醇溶液浸泡30 min,最后用100%丙酮溶液浸泡30 min并平行操作3 次。
渗透:丙酮与黄胶体积比为3∶1、1∶1、1∶3条件下加入2 mL丙酮溶胶进行渗透操作,处理时间依次为1.5、3.0、2.0 h。再以纯黄胶分别渗透2 次,每次24 h。
包埋:将处理后的样品块放入填满胶体的包埋板中,胶块中没有气泡且胶体表面水平。将包埋板分别放置在30 ℃和60 ℃的干燥箱中依次干燥24 h和48 h。然后进行冷冻切片、染色和观察。
1.3.2.3 透射电子显微镜观察
应用透射电子显微镜观察样品细胞内超微结构,进样后调节观察视野及清晰度。对成像效果拍照前,需要调整亮度使整个界面变暗,以保护内部的摄像和成像设备。
1.3.3 葡萄皮中总酚、单宁、总花色苷含量测定
剥取葡萄皮并用液氮冷冻粉碎成粉末,插入内容:在-50 ℃超低温真空冻干机上冻干24 h成干粉。取1 g干粉、20 mL盐酸-甲醇溶液(60%甲醇、0.1%盐酸)于50 mL离心管中30 ℃超声功率40 W提取30 min,4 ℃条件下10 000 r/min离心10 min后收集上清液,重复2 次上述步骤并定容60 mL,整个过程避光操作。甲基纤维素法测定葡萄中单宁含量,结果以儿茶素计(mg/g);福林-肖卡法测定葡萄中总酚含量,结果以没食子酸计(mg/g);pH示差法测定葡萄中总花色苷含量,结果以二甲花翠素葡萄糖苷计(mg/g)。
1.3.4 葡萄皮中香气成分测定
取20 g葡萄剥取葡萄皮,用模拟葡萄汁(用酒石酸调纯净水pH 3.5)定量20 g于小密封瓶中,冰水浴超声波提取20 min,4 ℃、8 000 r/min离心后取10 mL上清液、加入2 g的NaCl、50 μL的2-辛醇内标物和搅拌子于50 mL密封瓶,在磁力搅拌器上振荡1 h后气相色谱-质谱测定样品。
Turbo Matrix 350 ATD分析条件:以He为载气,脱附流速设为45 mL/min,加热阀温度设为245 ℃,脱附管温度为270 ℃,脱附15 min。传输线温度为255 ℃。冷阱捕集温度设为-30 ℃,以40 ℃/min升至255 ℃(二级解吸冷阱温度)。出口分流比为3∶1,进样He流速为1 mL/min。
GC条件:色谱柱DB-WAX(30 m×0.25 mm,0.25 μm)以He为载气,流速设为1 mL/min。柱温升温程序为40 ℃保持3 min,随后以4 ℃/min的速率升至160 ℃,7 ℃/min至230 ℃,在此温度条件下保持8 min。连接杆温度设为230 ℃。
MS条件:全扫描,范围为33~450 u,每秒扫描1 次。以EI+为电离源,离子源温度设为230 ℃,电子能量设为70 eV,灯丝流量设为0.2 mA,检测器电压350 V。
数据图谱分析:实验数据处理由Xcalibur软件系统完成。挥发性物质(含酸类、醇类和酯类物质)的定性:未知化合物经计算机检索同时与 NIST2002谱库相匹配。用峰面积归一法和内标物2-辛醇来定量计算出各化学成分的相对含量。
2 结果与分析
2.1 赤霞珠葡萄冷冻及解冻温度曲线
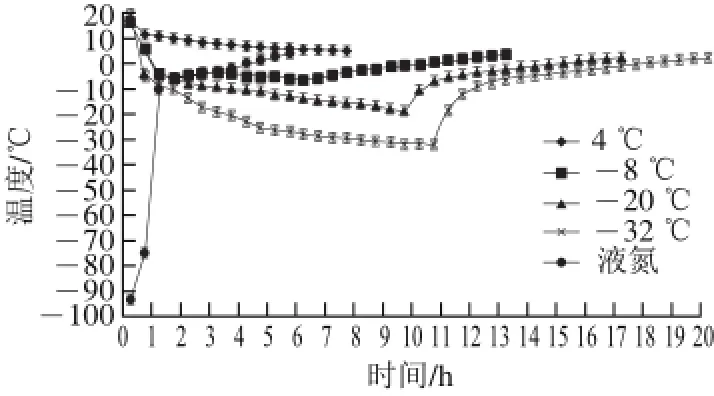
图 1 赤霞珠葡萄冷冻及回温曲线图Fig. 1 Freezing and thawing curves of Cabernet Sauvignon grapes
如图1所示,将常温条件下的赤霞珠果实降温至4、-8、-20、-32 ℃,低温冷冻冰箱设定温度分别为:4、-8、-20、-32 ℃,低温处理时间分别为5.5、6.0、9.5、10.5 h;-8、-20、-32 ℃处理回温至4 ℃时间分别为6.5、7.5、9.5 h;液氮处理是瞬间降温过程,回温到4 ℃时间仅为5.0 h。葡萄初始温度16 ℃与低温冷冻冰箱设定的温度差越大,降温速度越快;当葡萄温度接近设定温度时,降温速度减慢。
2.2 温度对户太八号葡萄果皮细胞结构的影响
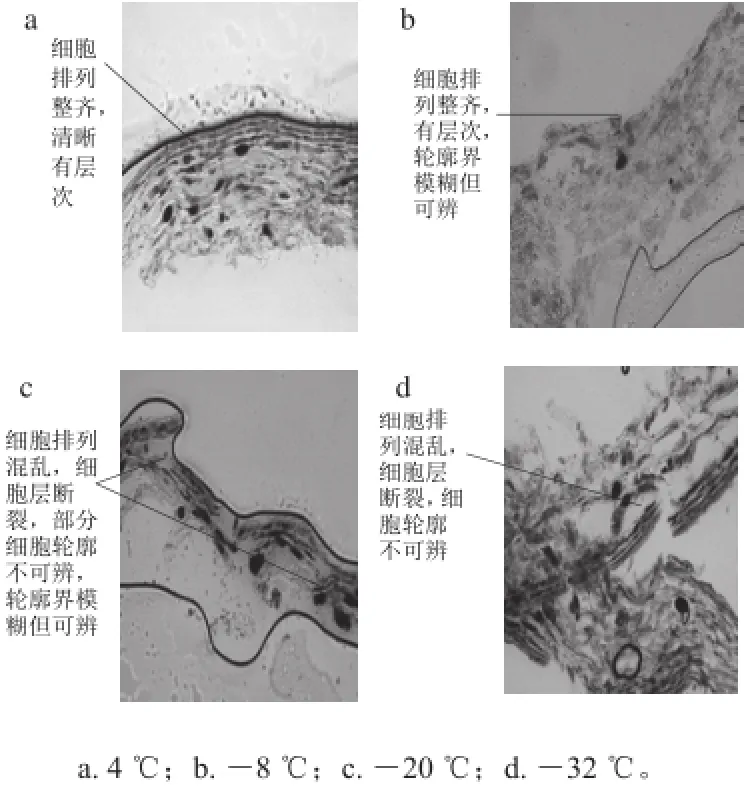
图 2 温度对户太八号葡萄果皮细胞结构的影响(×20)Fig. 2 Observation of the effect of cryogenic treatment on the structure of ‘Hutai No. 8’ grape skin cells under optical microscope (× 20)
图2为光学显微镜放大20 倍(1∶50 nm)下观察冷冻切片处理后的户太八号葡萄果皮细胞结构。4 ℃处理的浆果细胞层次清晰,表皮整齐紧凑,细胞形态完整;-8 ℃处理的浆果细胞层次略微混乱,由于物质外渗使得细胞边界模糊,但细胞形态较为完整;-20 ℃处理的果皮细胞排列出现断层,依旧可以看出细胞的大体形态,部分细胞细胞边界不可辨;-32 ℃处理的浆果表皮细胞更为清晰地显示了细胞层的断裂,表皮结构排列无规则,细胞结构严重受损,细胞边界不可辨。结果表明:处理温度越低,葡萄果皮细胞的断裂程度越大。
2.3 温度对赤霞珠葡萄果皮细胞结构的影响
2.3.1 细胞壁完整性比较

图 3 温度对赤霞珠葡萄果皮细胞结构的影响(×3 000)Fig. 3 Observation of the effect of cryogenic treatment on the structure of Cabernet Sauvignon grape skin cells under transmission electron microscope (×3 000)
如图3a、b所示,16、4 ℃条件下葡萄果皮细胞壁结构完整,没有损伤;-8 ℃条件下细胞壁有轻微变形,没有破损(图3c);-20 ℃(图3d)和-32 ℃(图3e)处理后细胞壁扭曲变形,少数位置出现断裂,无法维持细胞形状;液氮处理(图3f)的样品细胞壁断裂。
2.3.2 质壁分离比较
图3表明,对照组葡萄果皮16 ℃没有质壁分离,4 ℃有轻微质壁分离,-8、-20、-32 ℃、液氮处理后葡萄果皮质壁分离越来越明显,液氮处理质壁分离最显著。
2.3.3 细胞液泡及膜完整性比较
通过电子显微镜观察,16、4 ℃(图3a、b)条件下葡萄果皮细胞液泡完整,没有损伤。-8 ℃(图4a)处理,液泡膜仅个别位置出现少许断裂,但基本维持其形状未改变;-20 ℃(图3d、图4c)处理,液泡膜断裂呈片段状甚至部分消失,液泡受损严重;-32 ℃和液氮处理(图3e、f),液泡膜多处断裂甚至消失,液泡失水严重,细胞明显变形。
2.3.4 细胞器完整性比较
16、4、-8 ℃处理(图3a、b、c)葡萄果皮细胞器完整,没有损伤;-20 ℃(图4c)处理细胞内多种细胞器解体但仍有少许细胞器完整;-32 ℃处理(图3e)未观察到完整的细胞器,但有部分细胞器仍能分辨;液氮处理后细胞器无法分辨,几乎所有细胞内容物消失。
2.3.5 细胞变形性及暴露的后含物比较
16 ℃对照组(图3a)的葡萄浆果细胞具有完整的细胞结构,液泡饱满且细胞质分布均匀,细胞器的形态非常完整清晰;4 ℃处理(图3b)的果皮细胞结构比较完整,细胞壁和细胞膜完好,细胞器形态完整清晰;-8 ℃处理(图4a)已经有较为明显的质壁分离,有明显的物质通过通道,部分位置的细胞膜、胞内膜尤其是液泡膜有较为严重的断裂,细胞壁上未出现较明显的裂痕,细胞器形态依旧保持完整且清晰;-20 ℃处理(图3d)能明显看到更严重的质壁分离,细胞壁和细胞膜断裂增多甚至部分消失;细胞变形严重,失去固有形状,但是仍有部分细胞器(如叶绿体、线粒体)保持完整性;-32 ℃处理(图3e)的果皮细胞内容物几乎混为一团,细胞内没有完整的细胞器,细胞壁上的断裂也更为严重并出现扭曲断裂,质壁分离更为严重,细胞形变加剧;液氮处理(图3f)的果皮细胞内的物质完全混为一团,细胞内没有完整的细胞器或结构,细胞壁扭曲断裂甚至消失,细胞失去形态。
图3表明,16 ℃对照组和4 ℃处理没有观察到结晶后含物;-8 ℃出现了较少的单宁结晶、淀粉螺旋(图4b)及过氧化氢酶体;-20 ℃处理能清晰观察到葡萄果皮细胞中数量较多、体积较大的后含物(图4c),主要是淀粉粒、糊粉粒(贮藏蛋白质)、单宁晶体等,它们在细胞质中混存的范围、间隙变大,还可观察到较多的过氧化物酶体;-32 ℃及液氮处理能够观察到数量多但体积小的后含物。

图 4 透射电子显微镜观察图Fig. 4 Observation under transmission electron microscope
综上可知,温度越低,细胞破坏程度越大,细胞变形性、质壁分离、细胞器及膜结构被破坏的越严重。
2.4 温度对赤霞珠葡萄果皮酚类物质、香气物质含量的影响
检测果皮残留的酚类物质(单宁、总酚、总花色苷)、香气物质含量,并进行显著性分析确定不同温度处理的显著性差异。以16 ℃处理为对照组,酚类物质、香气物质含量越低,表示从葡萄果皮中溶出的含量越高,结果如表1所示。

表 1 不同温度处理后赤霞珠葡萄果皮中残留酚类物质和香气物质含量Table 1 Comparison of tannins, total phenolics, total anthocyanins and fl avor contents of Cabernet Sauvignon grape skins after cryogenic treatment at different temperatures
2.4.1 温度对赤霞珠葡萄果皮酚类物质含量的影响
随处理温度降低单宁含量呈下降趋势,其中-32 ℃处理果皮单宁含量最低,液氮处理介于-20、-32 ℃之间;4、-8 ℃处理之间无显著差异(P>0.05),其他组处理之间差异显著(P<0.05)。随处理温度降低,总酚含量呈下降趋势,液氮组总酚含量最低,-8、-20 ℃处理之间无显著差异(P>0.05),其他组处理之间差异显著(P<0.05)。总花色苷随处理温度降低呈现明显的下降趋势,-32 ℃和液氮组处理的总花色苷含量最低且两者之间无显著差异(P>0.05),其他组处理之间差异显著(P<0.05)。
2.4.2 温度对赤霞珠葡萄果皮香气物质含量的影响
果皮残留的香气物质含量越少,表明溶入葡萄酒中的香气物质含量越高。香气物质测定结果表明,-8、-20、-32 ℃处理的香气物质含量最低,3 个处理间无显著差异,但大小关系为-32 ℃<-8 ℃<-20 ℃;液氮和16 ℃对照组之间无显著差异(P>0.05);4 ℃香气物质含量最高。结果表明:-8、-20、-32 ℃处理能够促进果皮的香气物质溶出,4 ℃处理阻碍了香气物质的溶出,液氮处理无显著效果。
3 结 论
低温处理会破坏葡萄果皮细胞的超微结构,而且处理温度越低,破坏作用越明显。透射电子显微镜观察结果表明:16 ℃和4 ℃处理下细胞完整,细胞器清晰,细胞结构没有受到破坏;-8 ℃处理出现较明显的质壁分离现象且分离强度随温度降低加剧;-20 ℃处理出现细胞壁断裂、细胞器和膜结构破坏、细胞质浓缩成团等现象,-32 ℃和液氮处理细胞破坏效果更明显且伴随细胞质外泄、细胞器分解。-20 ℃处理虽能破坏膜系统,但细胞内部仍有完整的细胞器,如叶绿体、线粒体;相比较而言,-32 ℃、液氮处理可以破坏所有的膜系统,但是叶绿体、线粒体内部含有的叶绿素等物质进入葡萄汁,能够影响葡萄汁或酒的颜色、口感等特性,该影响是否有益还需进一步研究。4 组冷冻处理均能够在细胞内观察到冰晶,证明了冰晶在破坏细胞时有作用效果。透射电子显微镜能清晰看到细胞内外的物质流动和细胞的活动痕迹,也间接证明了冷冻过程中存在低温胁迫作用。
低温处理能够起到促进细胞释放更多的单宁、淀粉等后含物。透射电子显微镜观察结果表明:-8、-20、-32 ℃和液氮处理都发现了单宁、淀粉粒等后含物。-8 ℃观察到淀粉螺旋,但是其他低温组没有观察到,可能是因为处理温度过低,冷冻过程中出现类似马铃薯的“低温糖化”[26]现象使淀粉螺旋断裂分解。-8、-20 ℃处理能观察到稀疏分散的体积较大的单宁、淀粉、糊粉粒等后含物,-32 ℃、液氮处理观察到体积小、数量多且密集的后含物。4 种处理都观察到较多的酶体,可能是一定温度范围内的低温胁迫使某些酶的活性增加[27],从而使后含物暴露。
低温处理不同程度上能够促进葡萄果皮中单宁、总酚、总花色苷及香气类物质的溶出。-8、-20、-32 ℃能够明显促进酚类物质和香气物质的溶出,这与电子显微镜观察到的此温度条件下暴露出较多的单宁等后含物结果一致。果皮溶出的香气成分含量-32 ℃>-8 ℃>-20 ℃处理,这与已检测到的低温处理葡萄酿造的葡萄酒香气物质总量-20 ℃>-8、-32 ℃处理略微不同,但是也能在一定程度上证明-8、-20 ℃处理葡萄可以显著提高葡萄酒的香气质量[28]。4 ℃处理促进少量的酚类物质溶出但对溶出香气物质无积极作用,此温度条件下果皮细胞有较弱的呼吸作用且有轻微质壁分离,果皮细胞酚类物质减少可能与细胞与外界物质交换有关,而香气成分含量增加可能不仅与细胞的运输方式有关,如借助膜蛋白运输[29],也与呼吸作用能够产生部分芳香类化合物[30]有关。液氮处理能够促进酚类物质的溶出,电子显微镜也观察到了细胞内暴露的单宁等后含物,但其对香气物质溶出没有明显的效果。酚类物质多存在于外表皮细胞中[31],香气物质一般存在于果皮的下表皮细胞中,葡萄果粒经液氮处理后迅速脱水皱缩呈不规则球状,这种冷冻浓缩方式极大程度地保留了香气成分[32]。
参考文献:
[1] LUND S T, JOERG B. The molecular basis for wine grape quality: a volatile subject[J]. Science, 2006, 311: 804-805. DOI:10.1126/ science.1118962.
[2] PINELO M, ARNOUS A, MEYER A S. Upgrading of grape skins: significance of plant cell-wall structural components and extraction techniques for phenol release[J]. Trends in Food Science & Technology, 2006, 17(11): 579-590. DOI:10.1016/j.tifs.2006.05.003.
[3] POJER E, MATTIVI F, DAN J, et al. The case for anthocyanin consumption to promote human health: a review[J]. Comprehensive Reviews in Food Science & Food Safety, 2013, 12(5): 483-508. DOI:10.1111/1541-4337.12024.
[4] FALGINELLA L, GASPERO G D, CASTELLARIN S D. Expression of fl avonoid genes in the red grape berry of ‘Alicante Bouschet’ varies with the histological distribution of anthocyanins and their chemical composition.[J]. Planta, 2012, 236: 1037-1051. DOI:10. 1007/ s00425-012-1658-2.
[5] XU Y, SIMON J E, FERRUZZI M G, et al. Quantification of anthocyanidins in the grapes and grape juice products with acid assisted hydrolysis using LC/MS[J]. Journal of Functional Foods, 2012, 4(4): 710-717. DOI:10.1016/j.jff.2012.04.010.
[6] KENNEDY, JAMES A. Grape and wine phenolics: observations and recent fi ndings[J]. Ciencia E Investigación Agraria, 2008, 35(2): 107-120. DOI:10.4067/S0718-16202008000200001.
[7] HE Fei, LIANG Nana, MU Lin, et al. Anthocyanins and their variation in red wines I. monomeric anthocyanins and their color expression[J]. Molecules, 2012, 17(2): 1571-1601. DOI:10.3390/ molecules17021571.
[8] 李华. 葡萄酒中的丹宁[J]. 西北农林科技大学学报(自然科学版), 2002, 30(3): 137-141. DOI:10.3321/j.issn:1671-9387.2002.03.034.
[9] MA Wen, GUO Anque, ZHANG Yulin, et al. A review on astringency and bitterness perception of tannins in wine[J]. Trends in Food Science & Technology, 2014, 40(1): 6-19. DOI:10.1016/j.tifs.2014.08.001.
[10] RINALDI A, ITURMENDI N, JOURDES M, et al. Transfer of tannin characteristics from grape skins or seeds to wine-like solutions and their impact on potential astringency[J]. LWT-Food Science and Technology, 2015, 63(1): 667-676. DOI:10.1016/j.lwt.2015.02.037.
[11] MORRÉ D M, MORRÉ D J. Anticancer activity of grape and grape skin extracts alone and combined with green tea infusions.[J]. Cancer Letters, 2006, 238(2): 202-209. DOI:10.1016/j.canlet.2005.07.011.
[12] 李晓东, 何卿, 郑先波, 等. 葡萄白藜芦醇研究进展[J]. 园艺学报, 2011, 38(1): 171-184.
[13] 李记明. 葡萄酒品种香气研究进展[C]//第四届国际葡萄与葡萄酒学术研讨会. 2005: 151-157.
[14] 张明霞, 吴玉文, 段长青. 葡萄与葡萄酒香气物质研究进展[J]. 中国农业科学, 2008, 41(7): 2098-2104. DOI:10.3864/j.issn.0578-1752.2008.07.030.
[15] FAN W, XU Y, JIANG W, et al. Identification and quantification of impact aroma compounds in 4 nonfloral Vitis vinifera varieties grapes[J]. Journal of Food Science, 2010, 75(1): 81-88. DOI:10.1111/ j.1750-3841.2009.01436.x
[16] CABRITA M J, FREITAS A M C, LAUREANO O, et al. Glycosidic aroma compounds of some Portuguese grape cultivars[J]. Journal of the Science of Food & Agriculture, 2006, 86(6): 922-931. DOI:10.1002/jsfa.2439.
[17] 范文来, 徐岩, 李记明, 等. 应用HS-SPME技术分析葡萄果皮与果肉挥发性香气物质[J]. 食品与发酵工业, 2011, 37(12): 113-118. DOI:10.13995/j.cnki.11-1802/ts.2011.12.012.
[18] 吴凯, 周晓阳. 环境胁迫对植物超微结构的影响[J]. 山东林业科技, 2007(3): 80-83. DOI:10.3969/j.issn.1002-2724.2007.03.034.
[19] 李建霞, 张出兰, 夏晓飞, 等. 植物冰冻切片条件的优化及其与石蜡切片在组织化学应用中的比较[J]. 植物学报, 2013, 48(6): 643-650. DOI:10.3724/SP.J.1259.2013.00643.
[20] WINGER R J, FENERA O. Tenderness and water holding properties of beef muscle inf l uencing by freezing and subsequent storage at -3 or 15 ℃[J]. Journal of Food Science, 1976, 41: 1431-1438. DOI:10.1111/ j.1365-2621.1976.tb01189.x.
[21] TORRES C D, DÍAZ-MAROTO M C, PÉREZ-COELLO M S. Effect of freeze-drying and oven-drying on volatiles and phenolics composition of grape skin[J]. Analytica Chimica Acta, 2010, 660(1/2): 177-182. DOI:10.1016/j.aca.2009.10.005.
[22] TORRES C D, SCHUMACHER R, ALAÑÓN M E, et al. Freeze-dried grape skins by-products to enhance the quality of white wines from neutral grape varieties[J]. Food Research International, 2015, 69(1): 97-105. DOI:10.1016/j.foodres.2014.12.016.
[23] 彭传涛, 贾春雨, 文彦, 等. 苹果酸-乳酸发酵对于干红葡萄酒感官质量的影响[J]. 中国食品学报, 2014, 14(2): 261-268.
[24] 张红娟, 杨继红, 唐福旭, 等. 陕西泾阳赤霞珠葡萄冷冻处理酿酒特性研究[J]. 中国酿造, 2014, 33(6): 58-62. DOI:10.11882/ j.issn.0254-5071.2014.06.014.
[25] 马丹丹, 邓雨青, 周彦, 等. 电镜技术在植物病害研究中的应用[J].生物技术通报, 2016, 32(3): 38-43. DOI:10.13560/j.cnki.biotech. bull.1985.2016.03.007.
[26] 石伟平. 二倍体马铃薯遗传群体的构建和抗低温糖化分析[D]. 武汉: 华中农业大学, 2010: 10-12. DOI:10.7666/d.y1799610.
[27] 周斌, 张金龙, 冯纪年, 等. 短期低温胁迫对核桃抗氧化酶活性的影响[J]. 西北林学院学报, 2015, 30(3): 51-53. DOI:10.3969/ j.issn.1001-7461.2015.03.09.
[28] 李娜娜, 王华, 唐国冬, 等. 低温处理葡萄对爱格丽干白葡萄酒香气成分的影响[J]. 食品科学, 2016, 37(13): 71-76. DOI:10.7506/ spkx1002-6630-201613013.
[29] 郭子涛. 表没食子儿茶素没食子酸酯(EGCG)在Caco-2细胞中的摄取、跨膜转运和外排研究[D]. 上海: 华东师范大学, 2011: 17-18.
[30] 周然. 黄花梨运输振动损伤与冷藏品质变化的试验研究[D]. 上海:上海交通大学, 2007: 35.
[31] LUND S T, BOHLMANN J. The molecular basis for wine grape quality-a volatile subject[J]. Science, 2006, 311: 804-805. DOI:10.1126/science.1118962.
[32] 孙卉卉, 马会勤, 陈尚武. 冰冻浓缩对低糖葡萄汁及葡萄酒品质的影响[J]. 食品科学, 2007, 28(5): 86-89. DOI:10.3321/ j.issn:1002-6630.2007.05.017.
Effect of Cryogenic Treatment on the Structure of Grape Skin Cells
TANG Guodong1, TIAN Yu2, WANG Qian2, YANG Jihong1,2,*
(1. College of Enology, Northwest A&F University, Yangling 712100, China; 2. Grape and Wine Test Station, Northwest A&F University, Heyang 715300, China)
Objective: The effect of cryogenic treatment on the structure of grape skin cells was investigated to reveal the mechanism of wine quality improvement. Methods: Grapes of the cultivars Hutai No. 8 and Cabernet Sauvignon were treated at 4, −8, −20 and −32 ℃ and with liquid nitrogen, respectively, and then examined with an electron microscope. The contents of tannins, total phenols, total anthocyanins and aroma compounds were also determined. Results: Grape skin cells had no signif i cant change after treatment at 4 ℃, but cell plasmolysis and crystals of tannin and starch were observed after treatment at −8 ℃. Serious deformation of cells, clutter of intracellular contents, cracking of the cell membrane and organelles, and exosmosis of cell inclusion were observed in parallel with the increase of ergastic substances and crystals after treatment at−20 ℃. The structures of the cell wall and membrane were destroyed completely after treatments at −32 ℃ and with liquid nitrogen. These data showed that cryogenic treatment especially at −8, −20 and −32 ℃ allowed the extraction of more tannins, total phenols, total anthocyanins and aroma compounds from grape skins, and the contents of these substances were signif i cantly different at different treatment temperatures. However, aroma substances could not be extracted at 4 ℃ and liquid nitrogen. Conclusion: Cryogenic treatment results in cell damage of grape skins and improved exosmosis of phenolics and aromatic compounds, thereby being benef i cial to wine quality.
grape; cryogenic treatment; grape skin cells; electron microscope; wine quality
10.7506/spkx1002-6630-201705031
TS261.2
A
1002-6630(2017)05-0191-06
唐国冬, 田雨, 王倩, 等. 低温处理对葡萄果皮细胞结构的影响[J]. 食品科学, 2017, 38(5): 191-196. DOI:10.7506/ spkx1002-6630-201705031. http://www.spkx.net.cn
TANG Guodong, TIAN Yu, WANG Qian, et al. Effect of cryogenic treatment on the structure of grape skin cells[J]. Food Science, 2017, 38(5): 191-196. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705031. http://www.spkx.net.cn
2016-04-06
陕西省农业科技创新与攻关项目(2015NY019);西北农林科技大学科研专项资金项目(Z109021563)
唐国冬(1989—),男,硕士研究生,主要从事葡萄与葡萄酒工程研究。E-mail:1074743761@qq.com
*通信作者:杨继红(1975—),女,副教授,博士,主要从事葡萄工程学研究。E-mail:yangjihong@nwsuaf.edu.cn
