4 种骨的纳米化加工及其制品的特性
2017-03-31李亚杰熊善柏
李亚杰,熊善柏,尹 涛,*,张 晋,尤 娟,胡 杨
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.国家大宗淡水鱼加工技术研发分中心(武汉),湖北 武汉 430070)
4 种骨的纳米化加工及其制品的特性
李亚杰1,2,熊善柏1,2,尹 涛1,2,*,张 晋1,2,尤 娟1,2,胡 杨1,2
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.国家大宗淡水鱼加工技术研发分中心(武汉),湖北 武汉 430070)
以鱼骨、猪骨、牛骨和鸡骨为原料,采用高能湿法球磨的方法制备纳米骨液,比较研究4 种纳米骨液的特性,以期为纳米骨液的加工和应用提供理论依据。结果显示,4 种骨的化学组成有显著性差异(P<0.05),鱼骨的灰分含量最高,而鸡骨的脂肪和粗蛋白含量最高。高温(120 ℃)预处理后,4 种骨的PO34-官能团的特征吸收峰位置和强度无显著性差异,鱼骨位于1 450~1 700 cm-1波数范围内的蛋白特征吸收峰与其他3 种的显著不同。鱼骨颗粒的平均粒径在1 h球磨后降低至纳米级别(162 nm),在2 h球磨后为135 nm,而猪骨、牛骨和鸡骨的平均粒径分别在2、2 h和5 h球磨后小于200 nm,4 种骨的最小平均粒径依次分别为117、105、89 nm和153 nm。在球磨过程中,骨液的钙释放率呈线性增加,pH值先增加后保持稳定,亮度和白度逐渐增加,游离氨基酸和三氯乙酸可溶性肽含量逐渐增加。与其他3 种骨相比,鱼骨的纳米化粉碎效率和制品的白度最高,为加工纳米骨液相对最适宜的原料。
动物骨;湿法球磨;纳米颗粒;理化性质
历次全国营养调查结果显示,我国居民钙的日常摄入量仅为推荐量的一半,缺钙现象较为普遍[1]。缺钙会导致佝偻、骨质疏松和免疫力下降等疾病,使人体进入亚健康状态[2]。因此,人们(特别是儿童和老人等特殊人群)除了通过从日常饮食中摄入一定量的钙以外,还可能需要通过食用补钙产品等方式补充不足的钙。骨是畜、禽和水产品等制品加工过程中产生的主要固态副产物之一,例如猪、牛、鸡和鱼中骨的含量分别占动物总体质量的12%~20%、15%~20%、8%~17%和8%~10%[3]。骨中富含钙,猪骨、牛骨、鸡骨和鱼骨中总钙的含量分别为150.8、83.1、29.1、197.7 g/kg[4-5]。目前,副产物骨主要加工为饲料,其经济附加值低。直接丢弃这些副产物更会造成环境污染。如何合理加工和利用这些副产物是制约食品加工业发展的瓶颈技术之一,也日益成为科学研究的热点。
骨是理想的天然低价钙源,可加工成高钙食品或者添加剂,用于补充人体所需要的钙。在骨粉和骨泥等制品的加工中,降低骨的粒径不仅可降低或消除其在咀嚼过程中产生的沙砾感,还可以显著提高骨钙的生物利用率[6-8]。Yin Tao等[9]报道了以高能湿法球磨制备纳米鱼骨液的方法,并发现添加纳米鱼骨液到鱼糜凝胶中可有效地起到强化钙和增强鱼糜凝胶强度的作用[10]。纳米鱼骨液为牛奶状乳白色液体[9],可直接加工成补钙制品或者广泛地添加于不同食品原料中,用于补充人体所需的钙。相对于以往的骨制品,纳米骨液可能具有钙生物利用率高、添加后对产品感官品质影响小和具有一定的功能特性等优点。不同骨的化学组成、层级结构和力学特性不同,例如猪骨、牛骨和鸡骨的脂肪含量较高,而鱼骨中的脂肪含量相对较低[4-5];在层级结构中,猪等哺乳动物骨的胶原纤维以有序排列方式形成完整的螺旋结构,而鱼骨的胶原纤维无完整螺旋结构[11];另外,猪骨和牛骨刚性强而韧性较弱,鱼骨却正好相反。原料差异可能会影响骨的纳米化加工难易程度及其产品的特性。但是,目前关于猪骨、牛骨和鸡骨的纳米化产品制备和特性的研究还鲜见报道。因此,本实验以牛骨、猪骨、鸡骨和鱼骨为原料,采用高能湿法球磨的方法制备4 种纳米骨制品,并比较研究4 种纳米骨制品的特性,以期为副产物骨的纳米化加工和应用提供加工参数和理论依据。
1 材料与方法
1.1 材料与试剂
鱼骨为白鲢鱼糜加工过程中经采肉后分离得到的脊骨,由荆州大明水产食品有限公司提供。牛骨、猪骨和鸡骨为剔除肉后的脊骨,采购于华中农业大学农贸市场。4 种骨经冰水漂洗后,-18 ℃冻藏备用。所用化学试剂均为分析纯,购于国药集团化学试剂有限公司。
1.2 仪器与设备
ZM-100型反压高温蒸煮锅 广州标际包装设备有限公司;JL-8型立式绞肉机 北京市华联工业有限公司;MKCA6-2型骨泥机 日本Masuko公司;MINI ZETA 03E湿法高能球磨机 德国耐驰仪器制造有限公司;Zetasizer Nano ZS纳米粒度分析仪、Mastersizer 3000超高速智能粒度分析仪 英国马尔文公司;AA-6300C原子吸收分光光度计 日本岛津公司;VISTAMPX电感耦合等离子体发射光谱仪 美国Varian公司;C R-4 0 0型色差仪 日本柯尼卡-美能达公司;NEXUS-470傅里叶变换红外光谱仪 美国梅特勤公司。
1.3 方法
1.3.1 纳米骨液的制备
工艺流程:冷冻原料骨→常温解冻→加水漂洗除去血污和部分脂肪→高温蒸煮(120 ℃、60 min)→倾倒蒸煮液并再次漂洗→绞肉机粗破碎(筛板孔径3 mm)→骨泥机破碎(2 000 r/min、磨盘间隙0.3 mm)→加水调整骨泥总固形物质量浓度为5 g/100 mL→高能湿法球磨机纳米化粉碎(3 000 r/min、磨球填充率85%、磨球直径0.5 mm)→纳米骨液。
1.3.2 化学组成的测定
1.3.1 节制备的骨泥在105 ℃干燥后,进行化学组成的测定。粗蛋白含量和灰分含量测定分别采用GB 5009.5—2010《食品中蛋白质的测定》中凯氏定氮法和GB 5009.4—2010《食品中灰分的测定》中灰化法;粗脂肪的测定参考何海情[12]的方法,先用6 mol/L盐酸80 ℃条件下水解骨粉,再用乙醚提取脂肪,最后烘干称质量。矿物质组成测定参照Ersoy等[13]的方法,采用电感耦合等离子体发射光谱仪进行测定。
1.3.3 化学结构分析
1.3.1 节制备的骨泥的化学结构分析参考Boutinguiza等[14]的方法。骨泥真空冷冻干燥后粉碎,与溴化钾质量比为1∶100混合均匀并压成半透明薄片,用傅里叶变换红外光谱仪分析,波数扫描范围为400~4 000 cm-1。
1.3.4 粒径的测定
1.3.1 节制备的骨液中颗粒粒径的测定参照Yin Tao等[9]的方法,并略作改动。测试前,加去离子水调整纳米骨液固形物质量浓度为0.1 g/100 mL,加入六偏磷酸钠作为分散剂,调整分散剂的质量浓度为0.2 g/100 mL,接着在功率100 W条件下超声处理10 min。粒径范围位于微米级的样品采用Mastersizer 3000超高速智能粒度分析仪测定,而粒径范围位于纳米级的样品采用Zetasizer Nano纳米粒度分析仪测定。
1.3.5 微观形态的观测
纳米骨颗粒微观形态的观测参照Yin Tao等[9]的方法。纳米骨液加去离子水稀释至质量浓度为10-4g/mL,超声波分散,滴加到表面渡碳的铜网上,室温条件下静置过夜,最后在120 kV电压和亮场条件下用透射电子显微镜观测。
1.3.6 钙释放率的测定
钙释放率的测定参考Zhang Jin等[15]的方法,并略作改动。精确称取10 g骨液,置于37 ℃恒温水浴摇床中,100 r/min振荡提取3 h,接着4 000 r/min离心30 min,取上清液过滤,加去离子水定容和稀释。最后用原子吸收分光光度计测定稀释液中钙含量。钙的释放率为测定的可溶性钙含量与骨液中总钙含量的百分比(%)。
1.3.7 游离氨基酸、三氯乙酸可溶性肽和水溶性蛋白含量的测定
称取10 g骨悬液,4 000 r/min离心30 min,取上清液过滤,加去离子水定容和稀释,采用茚三酮法测定游离氨基酸含量[16],采用福林-酚法测定水溶性蛋白含量[17]。称取5 g骨悬液,加入5 mL 的20%三氯乙酸(trichloroacetic acid,TCA),均质,静置1 h沉淀大分子蛋白,4 000 r/min离心30 min,取上清液过滤,定容和稀释,采用福林-酚法测定上清液中的可溶性肽含量[17]。
1.3.8 色度值的测定
样品置于CM-A128培养皿中,用色度仪测定L*、a*和b*,测试前色度仪用标准白板校正。L*为样品的明度,范围为0~100,0表示黑色,100表示白色;a*为样品的红度,正值时表示偏红,负值时表示偏绿;b*为样品的黄度,正值时表示偏黄,负值时表示偏蓝。W(白度)值的计算公式如下:
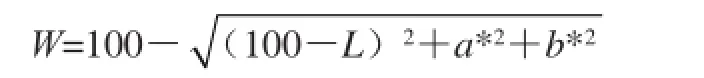
1.4 数据统计处理
所有指标均重复测定3 次。采用Office 2007软件作图,用SAS V8.1 软件进行数据分析。
2 结果与分析
2.1 鱼骨、猪骨、牛骨和鸡骨的化学组成

表 1 4 种骨的基本化学组成(x±s, n=3)Table 1 Proximate compositions of four kinds of bones (x± s, n = 3)
鱼骨、猪骨、牛骨和鸡骨的基本化学组成如表1所示。4 种骨的蛋白质含量为16%~34%,粗脂肪含量为6%~11%,灰分含量为52%~69%。不同骨的粗蛋白、粗脂肪和灰分含量有显著性差异(P<0.05)。其中鱼骨的灰分含量最高,粗蛋白和脂肪含量最低;而鸡骨的灰分含量最低,粗蛋白和脂肪含量最高。畜禽骨的脂肪和蛋白质含量显著高于鱼骨的(P<0.05),这与刘丽莉[4]、马国红[5]等的报道相一致。
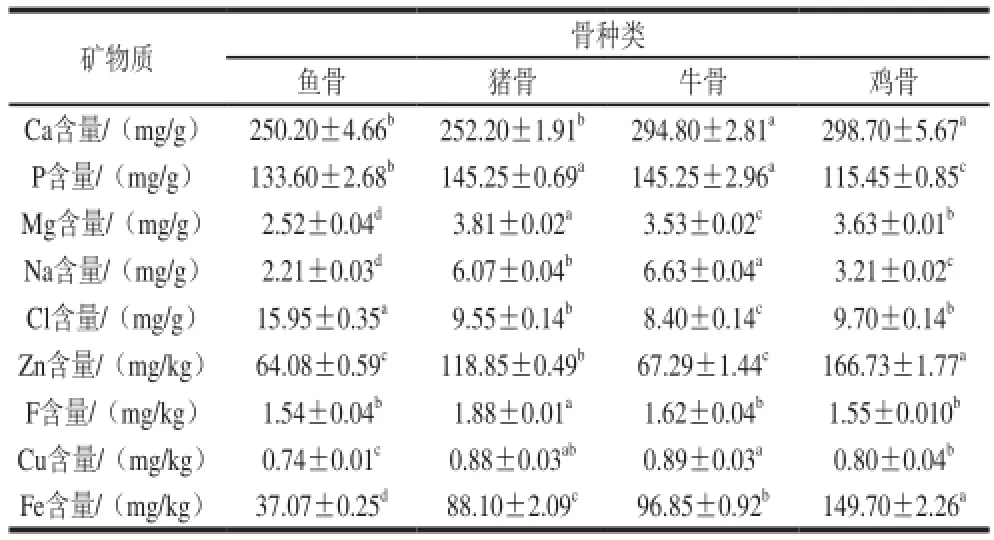
表 2 4 种骨的矿物质组成(x±s, n=3)Table 2 Mineral compositions of four kinds of bones (x± s, n= 3)
由表2可知,4 种骨的矿物元素主要是C a(250~299 mg/g)和P(115~146 mg/g),其次是Mg(2.52~3.81 mg/g)和Na(2.21~6.63 mg/g)。动物骨的无机物质主要是无定形磷酸氢钙(CaHPO4)和晶体型羟磷灰石 (Ca10(PO4)6(OH)2),这两种钙盐表面上又吸附着Ca2+、Mg2+、Na+、Cl-、HCO3-、F-及柠檬酸根等
离子[18],因而Ca、P是动物骨骼中主要无机成分,含量相对较高。除了Ca,4 种动物骨还含有较多的Na、Mg、Zn和Fe元素,这几种元素助于提高人体免疫、维持正常细胞代谢及参与合成血红蛋白等[19]。不同骨的Ca和P含量有显著的差异(P<0.05)。其中鸡骨和牛骨的Ca含量显著高于鱼骨和猪骨(P<0.05),而鸡骨中P含量显著低于其他3 种骨(P<0.05)。
2.2 鱼骨、猪骨、牛骨和鸡骨颗粒的粒径分布和微观形态
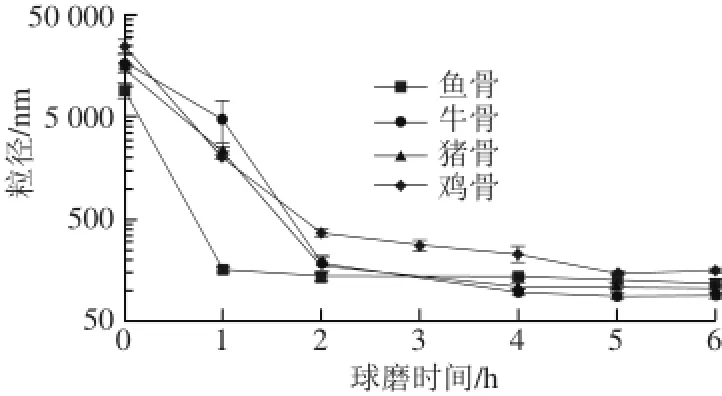
图 1 4 种骨样品的平均粒径与球磨时间的关系Fig. 1 Relationship between average particle size of four bone samples and ball-milling time
高能湿法球磨过程中,不同骨的平均颗粒粒径变化如图1所示。鱼骨、猪骨、牛骨和鸡骨在球磨前的初始平均粒径分别为9、16、17 μm和29 μm。经过1 h的球磨,鱼骨颗粒的平均粒径降低至纳米级别(162 nm),而其他3 种骨的平均粒径仍在微米级别(2~5 μm)。猪骨、牛骨和鸡骨的平均粒径分别在2、2 h和5 h球磨后小于200 nm。鱼骨较猪骨和牛骨更易破碎到纳米级别,鸡骨最难破碎到纳米级别,其主要原因可能与4 种骨中蛋白质含量(表1)和热变性、降解特性有关[15,20-21]。在天然的骨组织中,矿物质嵌入胶原蛋白纤维网络结构中,形成的有机物-无机物复合结构使骨同时具有较高的韧性和硬度,可以有效地抵抗一定外力对骨的破坏。一般而言,胶原蛋白含量高的骨应变能力更强,较难被破碎[22]。骨胶原蛋白在高温条件下发生变性和热降解[23],有序的胶原纤维网络结构被破坏,显著降低骨的破碎难易程度。不同骨胶原蛋白对高温(120 ℃)的耐受度不同,鱼骨胶原蛋白在高温条件下可能更容易发生变性和降解。鱼骨和猪骨的颗粒平均粒径在球磨6 h时达到最小,分别为117 nm和105 nm,牛骨和鸡骨的颗粒平均粒径在球磨5 h时达到最小,分别为89 nm和153 nm。不同纳米骨颗粒的极限粒径大小可能主要是与无机的羟基磷灰石含量有关[14]。图1结果表明,高能湿法球磨可以有效地降低不同来源骨的颗粒到纳米级别,而骨的纳米化破碎难易程度和极限粒径大小受原料特性的影响。

图 2 球磨6 h制备的4 种纳米骨颗粒的粒径分布Fig. 2 Particle size distribution of four nanosized bone particles with 6 h milling

图 3 球磨6 h制备的4 种纳米骨颗粒的的透射电子显微镜图Fig. 3 TEM images of four nanosized bone particles with 6 h milling
图2显示了球磨6 h制备的4 种纳米骨的粒径分布。纳米鱼骨、猪骨和牛骨颗粒的粒径分布较为集中(20~450 nm),纳米鸡骨颗粒的粒径分布较广(20~1 000 nm)。4 种纳米骨颗粒的粒径分布范围可能与原料中胶原蛋白和羟基磷灰石的组成比例有关。纳米骨颗粒近似为圆球形(图3)。根据透射电子显微镜结果估算鱼骨、猪骨、牛骨和鸡骨颗粒在球磨6 h后的平均粒径分别为97、74、93、104 nm,略小于激光粒度仪测定的粒径大小,这是因为激光粒度仪测定的平均粒径为颗粒的水合直径,其值大于颗粒的实际直径[24]。
2.3 鱼骨、猪骨、牛骨和鸡骨纳米骨液的pH值

图 4 4 种骨液样品的pH值与球磨时间的关系Fig. 4 Relationship between pH of four bone samples and milling time
从图4可以看出,未经高能湿法球磨的4 种骨液为弱碱性,pH值之间无显著性差异(P>0.05)。4 种骨液的pH值随着球磨时间的延长而显著增加(P<0.05),猪骨、牛骨和鸡骨液的pH值在球磨2 h后达到最大值(pH 10.0~11.0),鱼骨在球磨5 h后达到最大值(pH 10.0~11.0)。在球磨过程中,猪骨、牛骨和鸡骨液的pH值无显著性差异(P>0.05),而显著高于鱼骨液的pH值(P<0.05)。经过6 h的球磨后,4 种骨液的pH值之间不存在显著性差异(P>0.05)。有文献报道,纳米颗粒表面存在不定性区域,在球磨过程中酸性基团数目减少,颗粒中的金属阳离子(Ca2+、Na2+和Mg2+等)溶解释放,造成pH值的增加[25-26]。Yin Tao等[9]研究发现纳米鱼骨颗粒表面的Ca/P在湿法球磨过程中显著降低,说明以羟基磷灰石形态存在的Ca释放到水中。另一方面,球磨过程中pH值的增加也可能与骨胶原蛋白部分降解生成碱性氨基酸有关。碱性氨基酸中氨基数比羧基数多,溶液表现为碱性,例如0.01 mol/L的赖氨酸水溶液的pH值为9.98左右[27]。鱼骨液的pH值在球磨过程中显著低于其他骨液(P<0.05),这可能与鱼骨液的游离氨基酸含量相对较低有关。关于原料差异对纳米骨液pH值的影响还需要进一步研究。
2.4 鱼骨、猪骨、牛骨和鸡骨纳米骨液的钙释放率
不同球磨时间的4 种纳米骨液的钙释放率如图5所示。未球磨的4 种骨液的钙释放率分别为0.13%(鱼骨)、0.10%(猪骨)、0.08%(牛骨)和0.08%(鸡骨)。骨中钙的释放率极低,其原因是骨中的钙主要是以溶解度低的羟基磷灰石形式存在,而且羟基磷灰石嵌插到胶原蛋白纤维网络的孔隙中难以与水接触[28]。在球磨过程中,4 种骨液的钙离子释放率均随着球磨时间的延长而显著增加(P<0.05),这主要是与骨粒的表面积增加和胶原纤维网络结构的破坏有关[29]。球磨6 h后,纳米鱼骨、猪骨、牛骨和鸡骨液的钙释放率分别为1.99%、2.19%、2.49%和1.81%,与未球磨的骨液相比分别提高了14、22、31、22 倍。鱼骨和其他3 种骨颗粒的粒径分别在球磨1 h和3 h后降速显著变缓(图1),然而4 种骨液的钙释放率随着球磨时间的延长而呈线性逐渐增加,其原因可能是与球磨过程中生产了可溶性的氨基酸/多肽螯合钙有关。添加纳米骨液到食品中,释放的钙离子增加可能会改善部分食品的品质,例如鱼糜制品的质地[10]。关于降低鱼骨颗粒粒径和生成可溶性的氨基酸/多肽螯合钙对纳米骨钙生物利用率的影响还需要进一步研究。
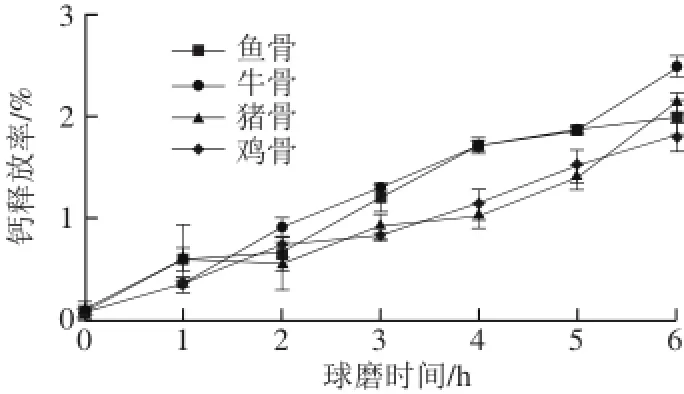
图 5 4 种纳米骨液的钙释放率与球磨时间的关系Fig. 5 Relationship between release rate of calcium from four bone samples and milling time
2.5 鱼骨、猪骨、牛骨和鸡骨骨悬液的色度
4 种纳米骨液的色度参数见表3。随球磨时间的延长,4 种骨液的L*值(明度)和W值(白度)均显著性增加(P<0.05),鱼骨和牛骨液的b*值(黄色)较显著增加(P<0.05),猪骨和鸡骨液的b*值变化较小(P<0.05)。L*值的在球磨过程中逐渐增加可能是与纳米颗粒的粒径降低有关。纳米鱼骨液的L*值和W值最高,其次是纳米猪骨和牛骨液的,鸡骨的最低。鱼骨没有完整的哈佛氏系统,脊髓、血管和神经存在于鱼骨的中央管中,而其他动物的骨中交错贯通着骨陷窝、骨小管及Volksmnan管,他们与骨髓直接相连来输运骨中的代谢物质[30-31]。经过前处理后,存在鱼骨中的血液和代谢物较其他动物骨易去除,因此纳米鱼骨液的W值最高。纳米鱼骨液的L*值和W值最高,添加到鱼肉、面粉和米粉等底色为白色的食品中,对产品的感官品质影响最小。而鸡骨较暗和偏黄,可能会限制其在部分食品中的应用。
表 3 球磨过程中4 种纳米骨悬液的色度Table 3 Color parameters of four bone nanoparticle suspensions with different milling times

表 3 球磨过程中4 种纳米骨悬液的色度Table 3 Color parameters of four bone nanoparticle suspensions with different milling times
注:同行肩标小写字母不同表示有显著性差异(P<0.05);同列肩标大写字母不同表示同一色度参数值不同磨球时间之间有显著性差异(P<0.05)。表4同。
色度球磨时间/h骨种类鱼骨猪骨牛骨鸡骨L*072.66±0.08Ea60.17±0.65Eb54.14±1.12Ec49.29±0.50Dd173.11±0.83Ea65.45±0.34Cb58.02±0.11Dd60.36±0.31Ac276.26±0.54Da64.44±0.08Db58.12±0.13Dd60.13±0.36ABc377.97±0.28Ca65.30±0.13DCb58.86±0.05CDd59.91±0.33ABc480.28±0.09Ba66.85±0.31Cb60.17±0.12BCc59.48±0.61BCc580.83±0.42ABa71.78±1.22Bb61.50±0.20Bc59.12±0.65Cd681.24±0.01Aa74.77±1.96Ab65.02±1.37Ac58.96±0.25Cda*0-1.46±0.01Cd1.10±0.16Ac5.22±0.43Ab6.10±0.15Aa1-1.56±0.20Dc-0.68±0.02Bc1.16±0.71Bb2.40±0.00Ba2-1.23±0.28BCbc-1.49±0.05Dc-0.78±0.33Cb1.01±0.04Ca3-0.98±0.02ABb-1.71±0.01DEc-0.98±0.15Cb0.24±0.06Da4-0.84±0.02Ab-1.77±0.12Ec-1.24±0.15Cb-0.25±0.17DEa5-0.87±0.08Ab-1.25±0.16Cc-1.52±0.04Cd-0.61±0.21Ea6-0.89±0.05Aa-1.22±0.21Ca-0.94±0.54Ca-0.83±0.49Eab*01.66±0.28Bc7.79±0.08Bb8.39±0.16Bb10.12±0.24Ba10.52±0.43Cd7.58±0.34BCc9.45±0.03ABb11.14±0.40Aa21.91±0.83Bd6.82±0.04Dc8.96±0.13Bb10.66±0.18ABa33.12±0.05Ad6.77±0.07Dc9.08±0.55ABb10.42±0.23ABa43.37±0.19Ac6.94±0.25DCb9.15±0.53ABa10.26±0.41Ba53.65±0.32Ac8.50±0.45Ab8.97±0.09Bab10.17±0.47Ba63.85±0.21Ab8.54±0.17Aa10.45±1.56Aa10.24±0.37Ba072.57±0.10Ea59.39±0.65Eb53.08±1.12Ec47.93±0.42Cd173.05±0.83Ea64.62±0.26DCb56.95±0.09Dd58.75±0.19Ac276.14±0.50Da63.76±0.07Db57.17±0.16Dd58.72±0.30Ac377.73±0.28Ca64.6±0.12DCb57.85±0.07Dd58.58±0.26Ac479.97±0.06Ba66.08±0.26Cb59.11±0.23BCc58.2±0.49ABd580.47±0.47ABa70.49±1.05Bb60.44±0.22Bc57.87±0.52Bd680.83±0.05Aa73.33±1.92Ab63.45±0.88Ac57.69±0.17BdW
2.6 4 种骨泥的傅里叶变换红外光谱分析
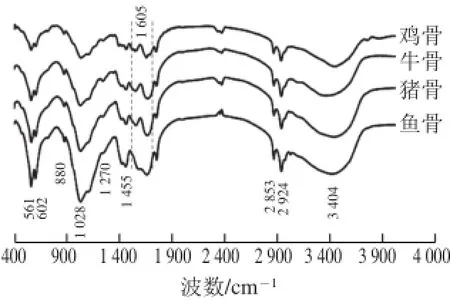
图 6 4 种骨的傅里叶变换红外光谱图Fig. 6 FT-IR spectra of four bone samples
2 920 cm-1和2 850 cm-1处的两个低强度峰为CH2基团伸缩振动峰,它们是骨有机质的骨架振动峰[14]。1 600~1 700 cm-1为酰胺Ⅰ带峰,与胶原蛋白多肽骨架中C=O基团的伸缩振动以及三股螺旋构象的分子内氢键有关,是蛋白质二级结构变化的敏感区[34]。1 540~1 600 cm-1为酰胺Ⅱ带峰,与胶原蛋白的N—H弯曲振动和C—N伸缩振动有关[35]。1 240~1 450 cm-1为酰胺Ⅲ带峰,是胶原蛋白的特征吸收峰,与三股螺旋结构有关[36-37]。在1 450~1 700 cm-1范围内,猪骨、牛骨和鸡骨的波形相似,而与鱼骨的波形显著不同,其原因可能主要是与原料骨胶原蛋白的热稳定性差异相关[38]。鱼骨中的羟脯氨酸和脯氨酸含量较低,胶原蛋白在高温条件下易变性,发生裂解和高级结构的转变[29,38]。
2.7 4 种纳米骨悬液的游离氨基酸、TCA可溶性肽和水溶性蛋白含量
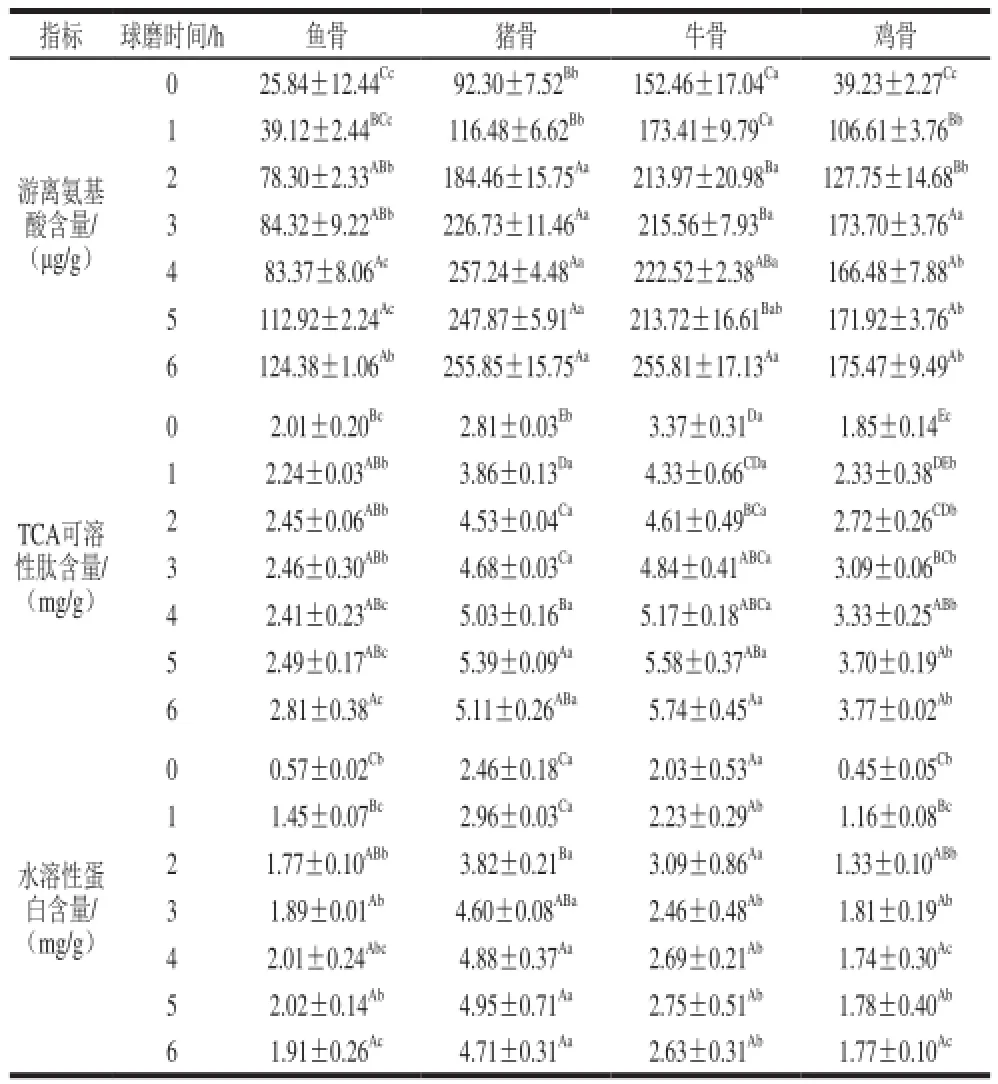
表 4 球磨过程中4 种纳米骨悬液的游离氨基酸、TCA可溶性肽、水溶性蛋白含量Table 4 The contents of free amino acids, TCA peptides and water soluble proteins in four bone nanoparticle suspensions with different milling times
如表4所示,在球磨过程中,4 种骨液的游离氨基酸含量、TCA可溶性肽含量显著增加(P<0.05),鱼骨、猪骨和鸡骨液的水溶性蛋白含量显著增加(P<0.05),而牛骨液增加不显著(P>0.05)。Wu Gangcheng等[39]发现超微粉碎鲢鱼骨粉可以显著提高其蛋白质的溶出率,这与本实验的结论相一致。球磨后,鱼骨液中游离氨基酸和水溶性蛋白含量增加最多,鸡骨的TCA可溶性肽含量增加最多。4 种骨液中游离氨基酸、TCA可溶性肽和水溶性蛋白含量的差异可能与原料骨的组成和蛋白质特性有关。蛋白质在球磨过程中降解生成小肽和氨基酸可能是引起钙释放率在骨颗粒粒径稳定后继续增加的主要原因。有文献报道,氨基酸在碱性介质中,受剧烈的外界条件影响,其两侧的羧基和氨基能与金属离子联结形成螯合物,其稳定常数可高达107~1012[40]。
3 结 论
高能湿法球磨技术可以有效地用于加工纳米骨液。球磨过程中,4 种骨液的钙释放率均显著增加
(P<0.05),其主要原因除了与骨颗粒的粒径降低有关外,还可能与生成氨基酸/肽螯合钙有关。鱼骨、猪骨、牛骨和鸡骨的纳米化加工过程及其制品的特性有显著性差异。鱼骨较其他3 种骨的纳米化破碎效率高,以其制备的纳米骨液的颜色最白。
[1] 范轶欧, 刘爱玲, 何宇纳, 等. 中国成年居民营养素摄入状况的评价[J]. 营养学报, 2012, 34(1): 15-19. DOI:10.13325/j.cnki.acta.nutr. sin.2012.01.009.
[2] 汪学荣, 彭顺清, 吴峰. 钙代谢及生理功能研究进展[J]. 中国食品添加剂, 2005(2): 20-22. DOI:10.3969/j.issn.1001-8123.2005.02.008.
[3] 赵玉红. 骨的综合利用[J]. 肉类工业, 2001(3): 23-24. DOI:10.3969/ j.issn.1008-5467.2001.03.013.
[4] 刘丽莉, 马美湖, 杨协力. 畜禽骨骼开发利用的研究进展[J]. 肉类工业, 2008(9): 50-53. DOI:10.3969/j.issn.1008-5467.2008.09.021.
[5] 马国红, 张延华, 王爱英, 等. 几种常见鱼类鱼鳞、鱼骨成分分析[J]. 山东师范大学学报(自然科学版), 2013, 28(4): 137-139. DOI:10.3969/j.issn.1001-4748.2013.04.032.
[6] 花金东, 徐幸莲, 周光宏, 等. 超细鲜骨粉火腿肠对改善大鼠骨质疏松效果的研究[J]. 南京农业大学学报, 2002, 25(1): 93-96. DOI:10.3321/j.issn:1000-2030.2002.01.023.
[7] 谢雯雯, 尹涛, 张晋, 等. 鱼骨粉粒径对鱼骨粉-鱼蛋白酶解物混合物中钙生物利用率的影响[J]. 食品科学, 2014, 35(7): 211-216. DOI:10.7506/spkx1002-6630-201407042.
[8] 张玉华. 超微细鲜骨粉生物学功能的研究[J]. 食品科学, 2001, 22(4): 78-81. DOI:10.3321/j.issn:1002-6630.2001.04.023.
[9] YIN T, PARK J W, XIONG S B. Physicochemical properties of nano fi sh bone prepared by wet media milling[J]. LWT-Food Science and Technology, 2015, 64(1): 367-373. DOI:10.1016/j.lwt.2015.06.007.
[10] YIN T, PARK J W. Textural and rheological properties of Pacific whiting surimi as affected by nano-scaled fish bone and heating rates[J]. Food Chemistry, 2015, 180: 42-47. DOI:10.1016/ j.foodchem.2015.02.021.
[11] ATKINS A, REZNIKOV N, OFER L, et al. The three-dimensional structure of anosteocytic lamellated bone of fi sh[J]. Acta Biomaterialia, 2014, 13: 311-323. DOI:10.1016/j.actbio.2014.10.025.
[12] 何海情. 酸水解法测豆奶粉脂肪的探讨[J]. 汕头大学学报(自然科学版), 2009, 24(1): 50-55. DOI:10.3969/j.issn.1001-4217.2009.01.009.
[13] ERSOY B, ÖZEREN A. The effect of cooking methods on mineral and vitamin contents of African catfish[J]. Food Chemistry, 2009, 115(2): 419-422. DOI:10.1016/j.foodchem.2008.12.018.
[14] BOUTINGUIZA M, POU J, COMESAÑA R, et al. Biological hydroxyapatite obtained from fish bones[J]. Materials Science and Engineering: C, 2012, 32(3): 478-486. DOI:10.1016/ j.msec.2011.11.021.
[15] ZHANG J, YIN T, XIONG S B, et al. Thermal treatments affect breakage kinetics and calcium release of fish bone particles during high-energy wet ball milling[J]. Journal of Food Engineering, 2016, 183: 74-80. DOI:10.1016/j.jfoodeng.2016.03.027.
[16] 赵新淮, 冯志彪. 蛋白质水解物水解度的测定[J]. 食品科学, 1994, 15(11): 65-67. DOI:10.3321/j.issn:1002-6630.1994.11.023.
[17] 谢笔钧. 食品分析[M]. 北京: 科学出版社, 2009: 182-183.
[18] 蔡蕊. 湿法超细粉碎鸡骨泥品质及加工特性研究[D]. 广州: 华南理工大学, 2012: 6-7.
[19] 马克昌. 骨生理学[M]. 郑州: 郑州大学出版社, 2000: 3-11.
[20] LI Z R, WANG B, CHI C F, et al. Isolation and characterization of acid soluble collagens and pepsin soluble collagens from the skin and bone of Spanish mackerel (Scomberomorous niphonius)[J]. Food Hydrocolloids, 2013, 31(1):103-113. DOI:10.1016/ j.foodhyd.2012.10.001.
[21] LIANG Q, WANG L, SUN W, et al. Isolation and characterization of collagen from the cartilage of Amur sturgeon (Acipenser schrenckii)[J]. Process Biochemistry, 2014, 49(2): 318-323. DOI:10.1016/ j.procbio.2013.12.003.
[22] JI B, GAO H. A study of fracture mechanisms in biological nanocomposites via the virtual internal bond model[J]. Materials Science and Engineering: A, 2004, 366(1): 96-103. DOI:10.1016/ j.msea.2003.08.121.
[23] HASSENKAM T, WEAVER J C, CUTRONI J A. Influence of the degradation of the organic matrix on the microscopic fracture behavior of trabecular bone[J]. Bone, 2004, 35(5): 1013-1022. DOI:10.1016/ j.bone.2004.05.027.
[24] 曾海燕, 曹光群, 杨成, 等. 壳聚糖/三聚磷酸钠凝胶粒子稳定Pickering乳液的研究[J]. 日用化学工业, 2015, 45(6): 306-310. DOI:10.13218/j.cnki.csdc.2015.06.002.
[25] CHARTIER T, SOUCHARD S, BAUMARD J F, et al. Degradation of dispersant during milling[J]. Journal of the European Ceramic Society, 1996, 16(12): 1283-1291. DOI:10.1016/0955-2219(96)00058-1.
[26] PAPIRER E, PERRIN J M, SIFFERT B, et al. The Influence of grinding on the surface properties of α-aluminas[J]. Journal of Colloid and Interface Science, 1993, 156(1): 104-108. DOI:10.1006/ jcis.1993.1087.
[27] 张曙生, 肖玉梅, 赵士铎, 等. 氨基酸等电点与氨基酸水溶液pH的区别[J]. 大学化学, 2005, 20(5): 47-51. DOI:10.3969/ j.issn.1000-8438.2005.05.017.
[28] 邵明栓, 陶敏, 向蔚, 等. 斑点叉尾鮰鱼骨脱脂及其制备CMC活性钙的工艺优化[J]. 食品科学, 2011, 31(20): 111-115. DOI:10.11654/ jaes.2013.04.004.
[29] YIN T, DU H, ZHANG J, et al. Preparation and characterization of ultrafine fish bone powder[J]. Journal of Aquatic Food Product Technology, 2016, 25(7): 1045-1055. DOI:10.1080/10498850.2015.10 10128.
[30] WANG X M, CUI F Z, GE J, et al. Hierarchical structural comparisons of bones from wild-type and liliputdtc232gene-mutated Zebrafish[J]. Journal of Structural Biology, 2004, 145(3): 236-245. DOI:10.1016/ j.jsb.2003.10.028.
[31] AND S W, WAGNER H D. The material bone: structure mechanical function relations[J]. Annual Review of Materials Research, 2003, 28(1): 271-298. DOI:10.1146/annurev.matsci.28.1.271.
[32] BONADIO T G M, SATO F, MEDINA A N, et al. Bioactivity and structural properties of nanostructured bulk composites containing Nb2O5and natural hydroxyapatite[J]. Journal of Applied Physics, 2013, 113(22): 223505. DOI:10.1063/1.4809653.
[33] D’ELÍA N L, GRAVINA A N, RUSO J M, et al. Manipulating the bioactivity of hydroxyapatite nano-rods structured networks: effects on mineral coating morphology and growth kinetic[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2013, 1830(11): 5014-5026. DOI:10.1016/j.bbagen.2013.07.020.
[34] PAYNE K J, VEIS A. Fourier transform IR spectroscopy of collagen and gelatin solutions: deconvolution of the Amide I band for conformational studies[J]. Biopolymers, 1988, 27(11): 1749-1760. DOI:10.1002/bip.360271105.
[35] KRIMM S, BANDEKAR J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins[J]. Advances in Protein Chemistry, 1986, 38(2): 181-364. DOI:10.1016/S0065-3233(08)60528-8.
[36] PLEPIS A M D G, GOISSIS G, DAS-GUPTA D K. Dielectric and pyroelectric characterization of anionic and native collagen[J]. Polymer Engineering and Science, 1996, 36(24): 2932-2938. DOI:10.1002/ pen.10694.
[37] CEBI N, DURAK M Z, TOKER O S, et al. An evaluation of Fourier transforms infrared spectroscopy method for the classification and discrimination of bovine, porcine and fi sh gelatins[J]. Food Chemistry, 2015, 190: 1109-1115. DOI:10.1016/j.foodchem.2015.06.065.
[38] 何兰. 牛骨胶原蛋白的提取及复合海绵的制备研究[D]. 武汉: 华中农业大学, 2012: 39-47.
[39] WU G C, MIN Z, WANG Y Q, et al. Production of silver carp bone powder using superfine grinding technology: suitable production parameters and its properties[J]. Journal of Food Engineering, 2012, 109(4): 730-735. DOI:10.1016/j.jfoodeng.2011.11.013.
[40] 陈睿妍, 黄雨荪. 氨基酸螯合钙的研制[J]. 中国药业, 2004, 13(10): 51-51. DOI:10.3969/j.issn.1006-4931.2004.10.040.
Production and Properties of Four Kinds of Nano-Sized Bone Products
LI Yajie1,2, XIONG Shanbai1,2, YIN Tao1,2,*, ZHANG Jin1,2, YOU Juan1,2, HU Yang1,2
(1. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China; 2. National R & D Branch Center for Conventional Freshwater Fish Processing (Wuhan), Wuhan 430070, China)
Nano-sized bone products were made from fish bone, pig bone, bovine bone and chicken bone using highenergy wet milling, respectively. Their properties were investigated in order to provide a theoretical foundation for the production and application of nano-sized bone products. The proximate compositions of bones of four different animals were signif i cantly different (P < 0.05). Brief l y, ash content was the highest in fi sh bone while crude fat and protein were the highest in chicken bone. After high temperature treatment (120 ℃), the wavenumbers and intensities of the characteristic absorption bands assigned to phosphate group (PO43-) did not signif i cantly change. However, the protein absorption bands at 1 450‒1 700 cm-1were obviously different between fi sh bone and the others. Average particle size of fi sh bone was reduced to nanometer range (162 nm) after 1 h milling, and was 135 nm after 2 h milling, while average particle sizes of pig bone, bovine bone and chicken bone were below 200 nm after 2, 2 and 5 h milling, respectively. The minimum average particle size for fi sh bone, pig bone, bovine bone and chicken bone were 117, 105, 89 and 153 nm, respectively. During the milling process, the release rate of calcium linearly increased, pH increased and then kept steady, lightness and whiteness significantly increased, free amino acid and trichloroacetic acid-soluble peptide contents dramatically increased. Therefore, fi sh bone may be the most suitable material for producing nano-sized bone product with improved breakage eff i ciency and whiteness.
bone; wet milling; nanosized particle; physicochemical properties
10.7506/spkx1002-6630-201705007
TS209
A
1002-6630(2017)05-0038-07
李亚杰, 熊善柏, 尹涛, 等. 4 种骨的纳米化加工及其制品的特性[J]. 食品科学, 2017, 38(5): 38-44. DOI:10.7506/ spkx1002-6630-201705007. http://www.spkx.net.cn
LI Yajie, XIONG Shanbai, YIN Tao, et al. Production and properties of four kinds of nano-sized bone products[J]. Food Science, 2017, 38(5): 38-44. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705007. http://www.spkx.net.cn
2016-06-23
国家自然科学基金青年科学基金项目(31601501);国家现代农业产业技术体系建设专项 (CARS-46-23)
李亚杰(1992—),女,硕士研究生,研究方向为水产品加工及贮藏工程。E-mail:2439331497@qq.com
*通信作者:尹涛(1986—),男,讲师,博士,研究方向为水产品加工及副产物高值化利用。E-mail:yintao@mail.hzau.edu.cn
