维生素C对乳腺癌细胞紫杉醇化疗的增敏作用
2017-03-31贾国丛李阳王尧河常庆龙陈雨婷支慧娟
贾国丛,李阳,王尧河,常庆龙,陈雨婷 ,支慧娟
(1. 郑州大学第三附属医院 乳腺二科,河南 郑州 450052;2. 郑州大学医学科学院,河南 郑州 450052)
乳腺癌是女性常见肿瘤之一[1-2],约占女性全身肿瘤的7%~10%,是30~59岁中国女性发病率第一的恶性肿瘤[3]。化疗是乳腺癌的重要治疗手段之一,但是许多患者在进行化疗时出现了恶心、脱发、感觉异常、骨髓抑制等化疗反应,这些副作用阻碍了临床治疗的进行[4],也同时加大了患者对化疗的恐惧心理。据文献[5]报道,维生素C(VitC)对肿瘤化疗药具有增敏的效应,该效应可以减少紫杉醇(paclitaxel,PTX)的用量以及化疗反应,同时可以提高化疗药物的疗效,该效应在乳腺癌中鲜有报道。本研究采用的实验材料是临床上已经确诊为乳腺癌的癌组织,进行体外培养[6],来研究VitC对PTX的增敏效应,进一步探索临床使用VitC对PTX提高疗效降低毒副作用的可行性。
1 材料与方法
1.1 材料
1.1.1 肿瘤细胞 由郑州大学第三附属医院乳腺二科提供乳腺癌标本。标本收集已征得患者本人及家属同意,符合医学伦理委员会要求。
1.1.2 主要试验药物及试剂 VitC购自上海现代哈森(商丘)药业有限公司;注射用紫杉醇购自上海创诺制药有限公司;DMEM培养基、FBS、胰酶、MTS、PMS均购自美国Gibco公司;Annexin V-FITC购自南京诺唯赞生物科技有限公司;Bax抗体和Bcl-2抗体均购自美国BD公司;免疫印迹试剂盒购于赛默飞世尔科技有限公司。
1.1.3 主要仪器 ELx808吸收光酶标仪购于美国伯腾仪器,MACSQuant流式细胞仪购于广州誉维生物科技仪器有限公司,多色Western blot分析仪购于美国森西科技有限公司。
1.2 实验方法
1.2.1 乳腺癌细胞培养 取术中乳腺癌标本用加有双抗的PBS组织洗液清洗8~10次,用2把手术刀交叉相切将组织切碎,将碎组织移至含有DMEM培养基的胶原蛋白酶III中,放入气浴恒温振荡器中振荡40~60 min,随后将消化的碎组织块倒入200目的滤网中过滤,将过滤液体放入50 mL离心管中,放入离心机,800 r/min离心8 min,弃上清液,加入PBS,反复吹打,1 200 r/min离心5 min,弃上清加入DMEM培养基移至细胞培养瓶。倒置显微镜下观察,用反复贴壁法和低浓度消化法去除成纤维细胞和肌细胞,得到肿瘤细胞。细胞置于5%O2、5% CO2、37 ℃培养箱内进行培养,取对数生长期细胞用于实验。
1.2.2 细胞增殖实验 将处于对数期的细胞以每孔约5 000个细胞铺于96孔板中,每孔100 μL,每组设置6个复孔,设置空白组和对照组。放入细胞培养瓶培养24 h,待细胞贴壁后加药。加药方式如下:⑴ 不同浓度VitC单独24 h;⑵ 不同浓度PTX单独24 h;⑶ 不同浓度的VitC与一定浓度的PTX联合24 h。两种药物单药使用时设置9个等比的浓度梯度,VitC浓度为5、2.5、1.25、0.625、0.312 5、0.156 23、0.078 1、0.039 0、0.019 5 mmol/L,PTX 浓 度 为 19、9.5、4.75、2.375、1.187、0.593、0.296、0.148、0.074 nmol/L, 联合时 PTX浓度为 19、9.5、4.75、2.375、1.187、0.593、0.296、0.148、0.074 nmol/L,VitC浓 度为1 mmol/L。IncuCyte Zoom®设置每2 h拍照1次,72 h后将96孔板取出后每孔加入MTS和PMS(20:1)混合液20 μL。培养箱静置3 h后,酶标仪测定490 nm处每孔的OD值(A490nm)。分别计算出VitC、PTX的IC50。实验重复3次,取3次的平均值为实验结果。肿瘤细胞增殖抑制率=(细胞对照组OD值A490nm-实验对照组OD值A490nm)/(细胞对照组OD值A490nm-空白对照组OD值A490nm)×100%。按照金氏修正公式计算q值,公式为q=E(A+B)/(EA+EB-EA×EB)。E(A+B)为两种药物联合使用的效应,EA为A药单用的效应EB为B药单用的效应。分子为实测合并效应,分母为预测合并效应。如果q值为0.85~1.15之间则表明药效单纯叠加,1.15~20说明药物之间有协同效应,<1.15说明药物之间有拮抗作用。
1.2.3 细胞凋亡实验 取对数期增长的细胞,细胞计数后以每孔1×105细胞铺于12孔板中,待置于5%CO2,37 ℃的培养箱中24 h后分为对照组,高、中、低浓度(2、1、0.5 mmol/L)VitC组,PTX(4 nmol/L)组,PTX(4 nmol/L)联合VitC(2、1、0.5 mmol/L)组,每组3个复孔。待同步细胞周期加药48 h,用不含EDTA的胰酶消化后,1 200 r/min离心5 min收集细胞。按照试剂盒说明书步骤依次加入FITC和PI混匀后避光室温下反应10 min后进行流式细胞仪检测。实验重复3次。
1.2.4 Western blot检测增殖和凋亡相关蛋白 乳腺癌原代细胞培养24 h后等待同步细胞周期,按照实验设计加药:对照组,PTX(4 nmol/L)组,PTX(4 nmol/L)联合VitC(2、1、0.5 mmol/L)组,每组设3个复孔。按照试剂盒说明书提取总蛋白,加入裂解液,12 000 r/min、4 ℃、离心5 min,移取上清液。10%SDS-PAGE凝胶电泳(80 V 25~35 min后调整至120 V电泳1~1.5 h),将蛋白质电转移至NC膜,5%脱脂奶粉室温封闭1 h,PBS冲洗3次。将抗体caspase-3和Bcl-2抗体稀释至0.1 μg/mL后加到NC膜正面,4 ℃冰箱过夜。之后加入1:4 000稀释的红色荧光标记的羊抗兔IgG,室温反应2 h,PBS冲洗3次。以β-actin为内参,Odyssey双色红外荧光成像系统扫描结果并使用Image J软件分析蛋白条带灰度值,以目的蛋白与内参灰度比值来表示目的蛋白的相对表达量。实验重复3次。

图1 乳腺癌细胞原代培养(×40) A:培养48 h;B:培养3 d;C:培养5 d;D:培养7 dFigure1 Primary culture of breast cancer cells (×40) A: Cultured for 48 h; B: Cultured for 72 h; C: Cultured for 3 d; D: Cultured for 7 d
1.3 统计学处理
2 结 果
2.1 细胞培养结果
48 h后观察细胞,细胞贴壁生长,并见有成纤维细胞和肌细胞生长。待72 h后采用差速贴壁法去除成纤维细胞和肌细胞。等细胞长满后传代培养,培养3~7 d传至3代以后。乳腺癌细胞形态不规则,镜下观察细胞形态不一,成纤维细胞呈长梭形易于区分(图1)。
2.2 VitC和PTX单药及联合对乳腺癌细胞增殖抑制作用
由实验结果得出,PTX单独用药对乳腺癌细胞的增殖抑制呈药物浓度依赖性,IC50=8.6 nmol/L;VitC单独用药药物浓度>1.25 mmol/L时对乳腺癌细胞的增殖抑制呈浓度相关性,浓度<1.25 mmol/L抑制率大幅度降低且无浓度相关性,IC50=2.5 mmol/L;VitC和PTX联合用药对乳腺癌细胞增殖抑制呈药物浓度依赖性(图2),IC50=2.8 nmol/L。VitC联合PTX组的增值抑制率均大于同浓度单用PTX组。VitC浓度为1 mmol/L时的有效抑制率为3%,PTX单用药浓度分别为0.004 75 μmol/L、0.002 3 μmol/L、0.001 18 μmol/L时的有效抑制率为55%、45%、29%,VitC浓度为1 mmol/L分别与浓度为0.004 75、0.002 37、0.001 18 μmol/L的PTX联合用药时的增值抑制率为82%、67%、50%,按金氏公式计算q值分别为1.37、1.36、1.52。以上浓度依赖联合实验q值均>1.15,实验结果提示VitC对PTX有增敏效应。

图2 PTX和VitC单药及联合对乳腺癌细胞生长的抑制作用 A:不同浓度的VitC单药;B:不同浓度的PTX单药;C:不同浓度的PTX联合1 mmol/L VitCFigure 2 Inhibitory effects of PTX and VitC alone and combination on growth of breast cancer cells A: Different concentrations of VitC; B: Different concentrations of PTX; C: Different concentrations of PTX plus 1 mmol/L VitC
2.3 VitC联合PTX对乳腺癌细胞凋亡的影响
VitC低浓度(0.5 mmol/L)组与对照组相比较,凋亡率差异无统计学意义(P>0.05),但中(1 mmol/L)、高浓度(2 mmol/L)组凋亡率高于对照组(均P<0.05)。PTX组和VitC联合PTX组与对照组相比较,凋亡率均明显升高,且VitC联合PTX组凋亡率明显高于PTX组(均P<0.05)(表1)(图3)。
2.4 检测增殖和凋亡相关蛋白
PTX单药及联合不同浓度VitC作用后乳腺癌细胞caspase-3和Bcl-2蛋白的表达。乳腺癌细胞经PTX单药及与不同浓度的VitC联合作用,随着VitC浓度的增加凋亡抑制蛋白Bcl-2的表达逐渐降低,凋亡促进蛋白caspase-3的表达逐渐升高。PTX单药、PTX+0.5 mmol/L VitC组、PTX+VitC 1 mmol/L组、PTX+VitC 2 mmol/L组与空白对照组比较蛋白相对表达量差异均有统计学意义(均P<0.05)(图4)。
表1 各组乳腺癌细胞的凋亡率(±s)Table 1 The apoptosis rates of each group of breast cancer cells(±s)

表1 各组乳腺癌细胞的凋亡率(±s)Table 1 The apoptosis rates of each group of breast cancer cells(±s)
组别 凋亡率(%)对照组 10.9±2.9 2 mmol/L VitC组 55.6±4.91)1 mmol/L VitC组 30.5±5.01)0.5 mmol/L VitC组 12.3±3.6 PTX组 22.6±3.51)PTX+2 mmol/L VitC组 79.1±5.61),2)PTX+1 mmol/L VitC组 61.1±4.91),2)PTX+0.5 mmol/L VitC组 34.9±4.71),2)F 89.8 P 0.00

图3 流式细胞仪检测细胞凋亡 A:对照组;B:2 mmol/L VitC组;C:1 mmol/L VitC组;D:0.5 mmol/L VitC组;E:PTX组;F:PTX+2 mmol/L VitC组;G:PTX+1 mmol/L VitC组;H:PTX+0.5 mmol/L VitCFigure 3 Apoptosis detection by flow cytometry A: Control group; B: 2 mmol/L VitC group; C: 1 mmol/L VitC group; D: 0.5 mmol/L VitC group; E: PTX group; F: PTX+2 mmol/L VitC group; G: PTX+1 mmol/L VitC group; H: PTX+0.5 mmol/L VitC group
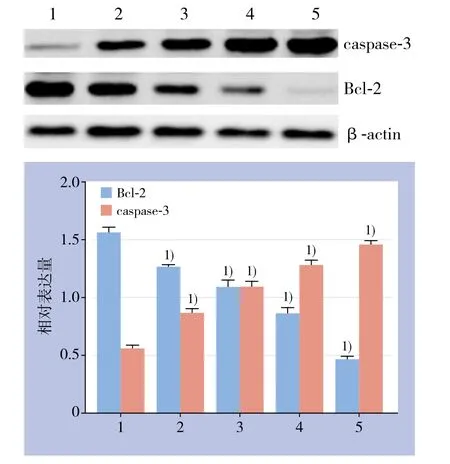
图4 caspase-3和Bcl-2蛋白表达检测 1:对照组;2:PTX单药;3:PTX+0.5 mmol/L VitC组;4:PTX+1 mmol/L VitC组;5:PTX+2 mmol/L VitC组1)与对照组比较,P<0.05Figure 4 Determination of caspase-3 and Bcl-2 protein expressions 1: Control group; 2: PTX alone group;3: PTX+0.5 mmol/L VitC group; 4: PTX+1 mmol/L VitC; 5: PTX+2 mmol/L VitC 1) P<0.05 vs. control group
3 讨 论
PTX作为临床常用化疗药,用于治疗肺癌、乳腺癌、胃癌、卵巢癌、头颈部鳞状细胞癌以及其他的实体肿瘤[7]。但是,PTX化疗的副作用会随着剂量的增加而增加[8]。有文献[9]报道,VitC在与顺铂联合治疗结肠癌时可以显著降低顺铂的毒副作用。在临床当中我们需要找寻一种既能不降低化疗效果又能减少PTX副作用的方法。
VitC在肿瘤治疗当中一直作为辅助药物,所以使用剂量都较低[10]。低剂量的VitC(25~50 μg/mL)并不能诱导凋亡,与此相反,它与干细胞的增殖和维持有关[11-12]。后来,人们发现口服和静脉注射VitC具有不同的药代动力学[13]。早在1979年就有相关文献[14]报道,大剂量(10 g/d)在治疗肿瘤方面是有效的。近期国外有研究[15]报道,VitC联合其他抗肿瘤药物能对肿瘤细胞产生抑制作用。也有相关报道[16],大剂量VitC在动物模型中也具有明显的抗肿瘤作用。鉴于这些研究结果,越来越多的I、II期临床试验评估静脉注射VitC治疗癌症的可行性[17-20]。在本研究中,体外实验得到大剂量VitC可明显诱导乳腺癌肿瘤细胞凋亡的结论。而且,VitC浓度<1.25 mmol/L之后抑制肿瘤增值效应显著下降。这些发现为进一步研究VitC增敏PTX来提高对乳腺癌细胞杀伤作用和降低毒副作用提供了依据。
VitC治疗肿瘤的确切机制还不是很清楚。目前提出了几种假说。VitC抑制了透明质酸酶的活性,防止了胶原蛋白的水解[21],从而加强了胶原蛋白的结构抑制了肿瘤细胞的转移。VitC是驱动双氧加酶反应的辅助因子,包括组蛋白去甲基化酶,缺氧诱导因子脯氨酰羟化酶和胶原脯氨酰羟化酶[22]。由Creagan等[23-24]在美国梅奥诊所所做的临床试验表明口服相同剂量的VitC治疗肿瘤是无效的。VitC通过静脉而不是口服的方法在外周血中达到毫摩尔级别的浓度可以杀死肿瘤细胞而不伤害正常细胞。VitC在肿瘤细胞周围能介导促氧化作用产生过氧化氢(H2O2)从而杀死肿瘤细胞。有文献[25]报道VitC作为一种促氧化剂,可以激活ATM/AMTK信号传导通路,导致卵巢癌细胞中的雷帕霉素蛋白受到抑制并促进了卵巢癌细胞的死亡。
本研究显示,VitC和PTX单独用药时对乳腺癌细胞有增殖抑制和诱导凋亡的作用,作用呈浓度依赖性。通过流式细胞仪测得结果显示,联合用药后PTX的促凋亡作用明显增强,均大于单用PTX时的促凋亡作用。Western blot检测VitC对PTX的增敏作用,结果凋亡蛋白caspase-3的表达较PTX单用明显增多,凋亡抑制蛋白Bcl-2明显减少。Ma等[25]有相关研究表明,VitC可以引起SHIN3人卵巢癌细胞的DNA严重损伤,但是加入过氧化氢酶后这种作用可以被逆转。VitC高剂量静脉注射似乎意外的安全并没有较为严重副作用[26]。国内外也有许多学者在研究VitC联合其他的化疗药物治疗肿瘤的相关研究,结果基本一致,VitC联合化疗药物可以减少化疗药物的用量并提高药物的疗效,这些结果是令人鼓舞的。综上所述,VitC联合PTX可以成为治疗乳腺癌低毒高效的药物组合。
[1] Beiki O, Hall P, Ekbom A, et al. Breast cancer incidence and case fatality among 4.7 million women in relation to social and ethnic background: a population-based cohort study[J]. Breast Cancer Res,2012, 14(1): R5.
[2] 夏林玉. 三阴性乳腺癌治疗的新进展[J]. 中国普通外科杂志,2016, 25(5):741–746. doi:10.3978/j.issn.1005–6947.2016.05.020.Xia LY. Treatment of triple-negative breast cancer: resent progress[J]. Chinese Journal of General Surgery, 2016, 25(5):741–746. doi:10.3978/j.issn.1005–6947.2016.05.020.
[3] Chen W, Zheng R, Baade P D, et al. Cancer statistics in China,2015[J]. CA Cancer J Clin, 2016, 66(2):115–132. doi: 10.3322/caac.21338.
[4] 冯万芹, 王瑞林. 十一味参芪胶囊内服和热敏灸法对结直肠癌术后气血两虚证化疗患者的干预[J]. 中国实验方剂学杂志, 2016,22(10):170–174. doi: 10.13422/j.cnki.syfjx.2016100170.Feng WQ, Wang RL. Intervention of Shiyiwei Shenqi Capsules Combined with Thermal Moxibustion Therapy for Patients with Syndrome of Both Qi and Blood Deficiency After Rectal Cancer Surgery[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2016, 22(10):170–174. doi: 10.13422/j.cnki.syfjx.2016100170.
[5] 李新莉, 何栋成, 黄苏君, 等. 维生素C和紫杉醇联合作用对乳腺癌细胞MOF-7增殖、细胞周期和凋亡的影响[J]. 营养学报, 2011,33(1):40–43.Li XL, He DC, Huang SJ, et al. Effect of vitamin c in combination with paclitaxel on growth,cell cycle and apoptosis of breast cancer mcf-7 cells[J]. Acta Nutrimenta Sinica, 2011, 33(1):40–43.
[6] 姜昊声, 曹燕, 吴绍秋, 等. 乳腺癌细胞三维培养模型构建及其药物敏感性研究[J]. 实用癌症杂志, 2016, 31(6):871–874.doi:10.3969/j.issn.1001–5930.2016.06.001.Jiang HS, Cao Y, Wu SQ, et al. Fabrication of Three Dimensional Cell Culture Model of Breast Adenocarcinoma and Detection of Its Drug Resistance[J]. The Practical Journal of Cancer, 2016,31(6):871–874. doi:10.3969/j.issn.1001–5930.2016.06.001.
[7] Wang N, Wang Z, Nie S, et al. Biodegradable polymeric micelles coencapsulating paclitaxel and honokiol: a strategy for breast cancer therapy in vitro and in vivo[J]. Int J Nanomedicine, 2017,12:1499–1514. doi: 10.2147/IJN.S124843.
[8] 刘芳, 江泽飞, 宋三泰, 等. 单药紫杉醇治疗晚期乳腺癌剂量强度与疗效和毒性的关系[J]. 中华肿瘤杂志, 2005, 27(1):56–58.doi:10.3760/j.issn:0253–3766.2005.01.015.Liu F, Jiang ZF, Song ST, et al. Relation of dose intensity and efficacy,toxicity in paclitaxel as a single agent for advanced breast cancer[J]. Chinese Journal of Oncology, 2005, 27(1):56–58.doi:10.3760/j.issn:0253–3766.2005.01.015.
[9] Yun J, Mullarky E, Lu C, et al. Vitamin C selectively kills KRAS and BRAF mutant colorectal cancer cells by targeting GAPDH[J].Science, 2015, 350(6266):1391–1396. doi: 10.1126/science.aaa5004.
[10] Leekha A, Gurjar BS, Tyagi A, et al. Vitamin C in synergism with cisplatin induces cell death in cervical cancer cells through altered redox cycling and p53 upregulation[J]. J Cancer Res Clin Oncol,2016, 142(12):2503–2514.
[11] Wu H, Wu Y, Ai Z, et al. Vitamin C enhances Nanog expression via activation of the JAK/STAT signaling pathway[J]. Stem Cells, 2014,32(1):166–176. doi: 10.1002/stem.1523.
[12] Esteban MA, Wang T, Qin B, et al. Vitamin C enhances the generation of mouse and human induced pluripotent stem cells[J].Cell Stem Cell, 2010, 6(1):71–79. doi: 10.1016/j.stem.2009.12.001.
[13] Padayatty SJ, Sun H, Wang Y, et al. Vitamin C pharmacokinetics:implications for oral and intravenous use[J]. Ann Intern Med, 2004,140(7):533–537.
[14] Cameron E, Pauling L. Supplemental ascorbate in the supportive treatment of cancer: reevaluation of prolongation of survival times in terminal human cancer[J]. Proc Natl Acad Sci U S A, 1978,75(9):4538–4542.
[15] Wu CW, Liu HC, Yu YL, et al. Combined treatment with vitamin C and methotrexate inhibits triple-negative breast cancer cell growth by increasing H2O2 accumulation and activating caspase-3 and p38 pathways[J]. Oncol Rep, 2017, 37(4):2177–2184. doi: 10.3892/or.2017.5439.
[16] Wang G, Yin T, Wang Y. In vitro and in vivo assessment of highdose vitamin C against murine tumors[J]. Exp Ther Med, 2016,12(5):3058–3062.
[17] Stephenson CM, Levin RD, Spector T, et al. Phase I clinical trial to evaluate the safety, tolerability, and pharmacokinetics of highdose intravenous ascorbic acid in patients with advanced cancer[J].Cancer Chemother Pharmacol, 2013, 72(1):139–146. doi: 10.1007/s00280–013–2179–9.
[18] Hoffer LJ, Levine M, Assouline S, et al. Phase I clinical trial of i.v. ascorbic acid in advanced malignancy[J]. Ann Oncol, 2008,19(11):1969–1974. doi: 10.1093/annonc/mdn377.
[19] Monti DA, Mitchell E, Bazzan AJ, et al. Phase I evaluation of intravenous ascorbic acid in combination with gemcitabine and erlotinib in patients with metastatic pancreatic cancer[J]. PLoS One,2012, 7(1):e29794. doi: 10.1371/journal.pone.0029794.
[20] Welsh JL, Wagner BA, van't Erve TJ, et al. Pharmacological ascorbate with gemcitabine for the control of metastatic and nodepositive pancreatic cancer (PACMAN): results from a phase I clinical trial[J]. Cancer Chemother Pharmacol, 2013, 71(3):765–775. doi: 10.1007/s00280–013–2070–8.
[21] Cameron E, Rotman D. Ascorbic acid, cell proliferation, and cancer[J]. Lancet, 1972, 1(7749): 542.
[22] Shi Y. Histone lysine demethylases: emerging roles in development,physiology and disease[J]. Nat Rev Genet, 2007, 8(11): 829–33.
[23] Creagan ET, Moertel CG, O'fallon JR, et al. Failure of high-dose vitamin C (ascorbic acid) therapy to benefit patients with advanced cancer. A controlled trial[J]. N Engl J Med, 1979, 301(13):687–90.
[24] Moertel CG, Fleming TR, Creagan ET, et al. High-dose vitamin C versus placebo in the treatment of patients with advanced cancer who have had no prior chemotherapy. A randomized double-blind comparison[J]. N Engl J Med, 1985, 312(3):137–41.
[25] Ma Y, Chapman J, Levine M, et al. High-dose parenteral ascorbate enhanced chemosensitivity of ovarian cancer and reduced toxicity of chemotherapy[J]. Sci Transl Med, 2014, 6(222): 222ra18. doi:10.1126/scitranslmed.3007154.
[26] Padayatty SJ, Sun AY, Chen Q, et al. Vitamin C: intravenous use by complementary and alternative medicine practitioners and adverse effects[J]. PLoS One, 2010, 5(7):e11414. doi: 10.1371/journal.pone.0011414.
