肿瘤微环境相关因子IL-6、IL-10、CXCR7在甲状腺乳头状癌中的表达及临床意义
2017-03-31孙振华赵志泓蒋华平许立生孙亚军龙卫国王坤
孙振华,赵志泓,蒋华平,许立生,孙亚军,龙卫国,王坤
(江苏大学附属医院 1. 甲乳外科 2. 耳鼻喉科 3. 病理科,江苏 镇江 212000)
甲状腺乳头状癌是临床上最为常见的甲状腺恶性肿瘤,约占甲状腺癌总数的80%以上。并且其发病率近年来仍呈上升趋势[1-3]。研究[4-5]表明,甲状腺癌肿瘤微环境中的基质细胞在肿瘤侵袭和转移的过程中发挥了重要的作用。肿瘤微环境是肿瘤生长的“小环境”,小环境中巨噬细胞、成纤维细胞、淋巴细胞等与肿瘤细胞相互作用,肿瘤生长侵袭得到增强或抑制。肿瘤相关巨噬细胞在微环境中可以发生表型转变,具备促瘤生长的能力[6-8]。而IL-6、IL-10和趋化因子受体7(chemokine receptor 7,CXCR7)与肿瘤微环境密切相关[9-11]。本研究旨在研究IL-6、IL-10和CXCR7在甲状腺乳头状癌及结节性甲状腺肿中的表达及差异,并探讨其在甲状腺乳头状癌中表达的临床意义。
1 资料与方法
1.1 标本
收集江苏大学附属医院甲乳外科2014年1月—2016年12月部分甲状腺乳头状癌患者50例,其中男18例,女32例;年龄21岁~62岁,平均年龄41.2岁;<45岁者19 例,≥45岁者31例;伴淋巴结转移26例,无淋巴结转移24例;患者术前均未行放疗或化疗,术后经病理科切片明确诊断为甲状腺乳头状癌。选取同期本院收治的结节性甲状腺肿患者20例作为对照组,其中男6例,女14例;年龄23岁~68岁,平均年龄43.1岁。
1.2 方法及试剂
应用免疫组织化学Elivision法检测IL-6、IL-10、CXCR7蛋白。兔抗人IL-6多克隆抗体,兔抗人IL-10单克隆抗体,兔抗人CXCR7多克隆抗体购自英国Abcam 公司。使用已知阳性切片作阳性对照,PBS代替一抗作阴性对照。即用型非生物素免疫组化Elivison plus试剂盒购自福州迈新生物技术有限公司,按照试剂盒说明书进行操作。
1.3 免疫组化结果判定
每张切片均选取5个400倍视野,进行阳性细胞百分比和着色强度的计分。阳性细胞百分比按视野内阳性细胞所占总细胞数的比例记分:<5%、
6%~25%、26%~50%、51%~75%、>75%分别得0、1、2、3、4分;依照显色强度:未着色、浅黄色、棕黄色、棕褐色分别得0分、1分、2分、3分;将两项得分相乘得到该视野的最终得分,选取的5个视野得分的平均值为最后得分。最后该切片按照得分为以下4个等级:0~1分为(-),2~4分为(+),5~7分(++),≥8分(+++)。(-)为阴性,(+)、(++)、(+++)为阳性[12]。
1.4 统计学处理
应用SPSS 22.0统计软件分析,计数资料采用χ2检验,P<0.05为统计学有差异。
2 结 果
2.1 IL-6、IL-10、CXCR7蛋白在甲状腺乳头状癌、结节性甲状腺肿中的表达
IL-6蛋白主要在细胞浆中表达,在甲状腺乳头状癌和结节性甲状腺肿中的阳性表达率分别为62.0%、30.0%,两者阳性表达率比较有统计学意义(P<0.05);IL-10蛋白主要在细胞浆中表达,在甲状腺乳头状癌和结节性甲状腺肿中的阳性表达率分别为52.0%、20.0%,两者阳性表达率比较有统计学意义(P<0.05);CXCR7蛋白定位于细胞浆或胞膜,在甲状腺乳头状癌和结节性甲状腺肿中的阳性表达率分别为66.0%、35.0%,两者阳性表达率比较有统计学意义(P<0.05)(图1)(表1)。
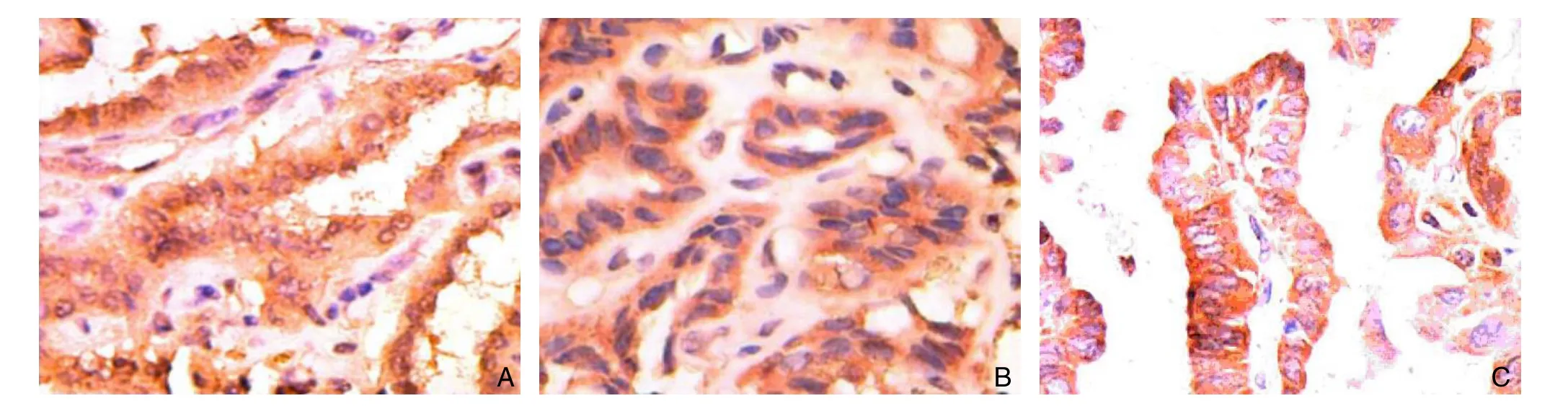
图1 各因子在甲状腺乳头状癌表达(×400) A:IL-6;B:IL-10;C:CXCR7Figure 1 Expressions of each factor in papillary thyroid carcinoma (×400) A: IL-6; B: IL-10; C: CXCR7
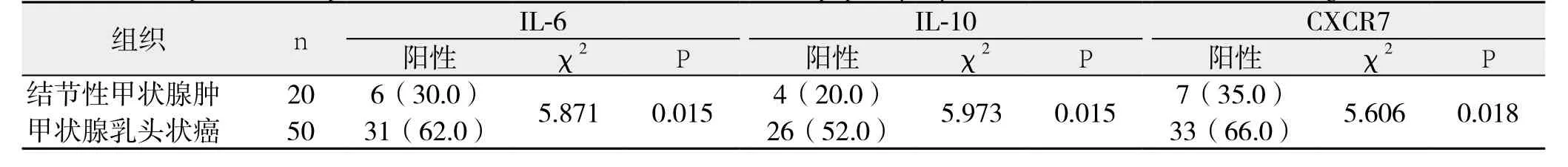
表1 甲状腺乳头状癌、结节性甲状腺肿IL-6、IL-10、CXCR7蛋白表达的比较[n(%)]Table 1 Comparison of expressions of IL-6, IL-10 and CXCR7 between papillary thyroid carcinoma tissue and nodular goiter tissue [n (%)]
2.2 IL-6、IL-10和CXCR7蛋白表达与甲状腺乳头状癌病理特征的关系
IL-6、IL-10蛋白在甲状腺乳头状癌中的表达与患者的性别、年龄、病灶数目及淋巴结转移无关(均P>0.05),而与包膜侵犯有关(P=0.011);CXCR7蛋白在甲状腺乳头状癌中的表达与患者的性别、年龄、病灶数目及包膜侵犯无关(均P>0.05),而与淋巴结转移有关(P=0.022)(图1)(表2)。
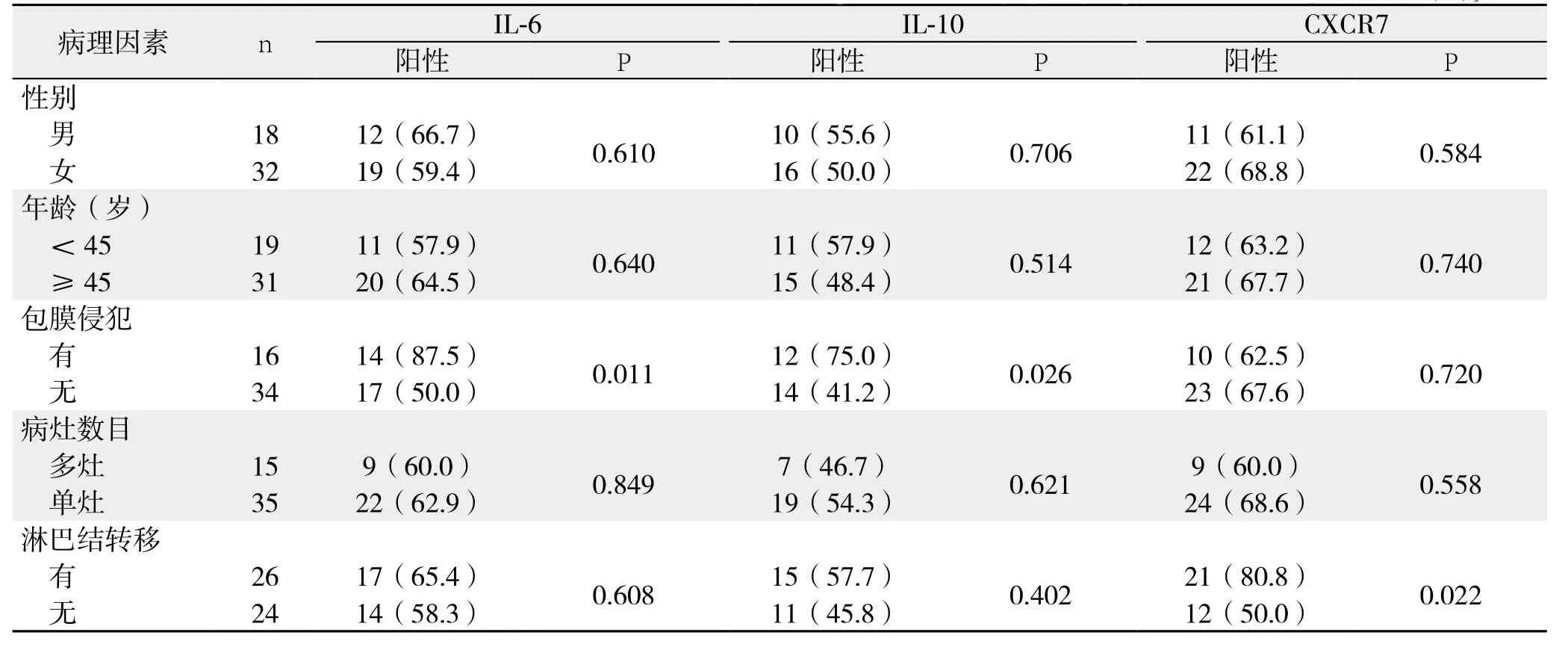
表2 IL-6、IL-10、CXCR7与甲状腺乳头状癌临床病理特征的关系[n(%)]Table 2 Relations of IL-6, IL-10 and CXCR7 with the clinicopathologic variables of papillary thyroid carcinoma patients [n (%)]
3 讨 论
肿瘤微环境最早由Lord提出,是一个由肿瘤细胞、间质细胞、微血管、微淋巴管、组织液、众多细胞因子及少量浸润细胞等组成的综合系统[13-14]。肿瘤细胞与微环境相互影响,一方面肿瘤细胞为了存活,不停地塑造一个适宜的肿瘤预转移微环境,如肿瘤细胞诱导巨噬细胞产生促瘤功能,为肿瘤细胞的进一步侵袭转移提供基础;另一方面肿瘤细胞所处的“小环境”也反过来作用于肿瘤细胞,决定肿瘤的发生发展[15-16]。这种肿瘤细胞与肿瘤微环境之间的“相互对话”,受一些重要的细胞因子调节,这些细胞因子来自肿瘤微环境中的免疫细胞和肿瘤细胞,尽管它们自身并不具备明确的促瘤或抗瘤能力,但却是肿瘤微环境与肿瘤细胞信息交换的桥梁,在肿瘤的演进转归中发挥协同或拮抗效应。在众多细胞因子中,IL-6、IL-10和CXCR7因子的作用已开始受到肿瘤研究学者们的关注。
研究证实,肿瘤微环境诱导巨噬细胞向M2表型分化进而促进肿瘤的发展。M2型巨噬细胞受肿瘤细胞或间质细胞分泌的趋化因子如IL-6、IL-8、IL-10、VEGF等趋化作用,大量聚集在肿瘤组织的缺氧区域[17]。本研究检测IL-6、IL-10和CXCR7蛋白的表达,探讨其在甲状腺乳头状癌发生发展中的作用。研究表明,IL-6、IL-10和CXCR7蛋白在甲状腺乳头状癌中的表达率分别为62.0%、52.0%、66.0%,均高于对照的结节性甲状腺肿组(均P<0.05)。IL-6为淋巴细胞、成纤维细胞、单核细胞、巨噬细胞和部分肿瘤细胞所分泌,是184个氨基酸所组成的分泌性细胞因子,在多种肿瘤中可以检测到异常表达的IL-6。肿瘤微环境中异常表达的IL-6通过诱导血管内皮生长因子的合成,促进血管生成,影响肿瘤细胞的黏附和侵袭,介导肿瘤发生发展的过程,且与肿瘤的耐药性有关[18]。IL-6作为监测癌变的参考指标已受学者重视,Panneer Selvam等[19]报道了唾液中IL-6水平可早期发现口腔癌。
而IL-10也是一种重要的肿瘤微环境影响因子,可由肿瘤细胞自身分泌,也可来源于单核细胞、巨噬细胞和辅助性T细胞,在肿瘤的发生发展过程中起着重要的作用。肿瘤细胞或间质细胞分泌的IL-10能诱导单核细胞分化成肿瘤相关巨噬细胞,从而促进肿瘤的发展。它可能通过抑制树突状细胞成熟、削弱特异性 T细胞免疫应答、促进调节性T细胞生成、抑制巨噬细胞的抗原提呈功能,抑制NK细胞活性等机制,帮助肿瘤逃避机体的免疫攻击,影响CTL对肿瘤抗原的识别,使肿瘤细胞逃避CTL的杀伤作用,抑制肿瘤浸润炎症细胞在肿瘤组织的浸润、分化、成熟及对肿瘤的杀伤作用,促进肿瘤生长[20]。在本研究中,甲状腺乳头状癌中IL-6、IL-10的高表达均与癌灶的包膜侵犯有关,在评估甲状腺乳头状癌侵袭性时可作为参考。肿瘤微环境中的IL-10还能激活STAT3途径,进一步激活细胞外信号调节激酶ERK,进而增强Th2细胞的分化,减弱Th1细胞的分化,影响肿瘤患者机体免疫状态[21]。
CXCR7也影响着肿瘤的微环境。研究表明,CXCR7在肿瘤相关内皮细胞中上调,经由ERK1/2磷酸化促进肿瘤微环境中血管形成[22-23]。CXCR7是一个非典型趋化因子受体家族,其与趋化因子CXCL12形成的生物学轴在肿瘤发生、发展过程中发挥着重要的作用[24]。已经发现CXCR7在乳腺癌细胞系McF-7,宫颈癌细胞系Hela、胶质瘤细胞系T98G、肺癌细胞系A549、前列腺癌细胞系PC3等肿瘤中都有高表达。CXCR7在肿瘤发生发展中作用的发挥主要是通过与β抑制蛋白类相互作用,进而调节CXCL12的生物利用率[25]。在本研究中,CXCR7蛋白在甲状腺乳头状癌中高表达,其表达水平与淋巴结转移明显有关。这一结果表明CXCR7有可能在甲状腺乳头状癌的发生发展过程中扮演了极其重要的作用。
综上所述,肿瘤微环境相关因子IL-6、IL-10、CXCR7蛋白高表达与甲状腺乳头状癌存在关联,其表达水平可作为评估甲状腺乳头状癌恶性侵袭及转移参考的指标。
[1] Wu GY, Fu JB, Lin FS, et al. Endoscopic Central Lymph Node Dissection via Breast Combined with Oral Approach for Papillary Thyroid Carcinoma: A Preliminary Study[J]. World J Surg, 2017,doi: 10.1007/s00268–017–4015–6. [Epub ahead of print]
[2] Miccoli P, Bakkar S. Surgical management of papillary thyroid carcinoma: an overview[J]. Updates Surg, 2017, doi: 10.1007/s13304–017–0449–5. [Epub ahead of print]
[3] 关海霞, 梁楠. 分化型甲状腺癌的动态风险评估——从疾病特点出发的新理念[J]. 中国普通外科杂志, 2016, 25(11):1536–1543.doi:10.3978/j.issn.1005–6947.2016.11.003.Guan HX, Liang N. Dynamic risk stratification of differentiated thyroid cancer: a new concept that arose from the view of disease characteristics[J]. Chinese Journal of General Surgery, 2016,25(11):1536–1543. doi:10.3978/j.issn.1005–6947.2016.11.003.
[4] Hughes NM, Nae A, Barry J, et al. Sonographic differences between conventional and follicular variant papillary thyroid carcinoma[J].Eur Arch Otorhinolaryngol, 2017, doi: 10.1007/s00405–017–4557–0. [Epub ahead of print]
[5] Hong YR, Lee SH, Lim DJ, et al. The stratification of patient risk depending on the size and ratio of metastatic lymph nodes inpapillary thyroid carcinoma[J]. World J Surg Oncol, 2017,15(1):74. doi: 10.1186/s12957–017–1141–4.
[6] Chung HH, Or YZ, Shrestha S, et al. Estrogen reprograms the activity of neutrophils to foster protumoral microenvironment during mammary involution[J]. Sci Rep, 2017, 7:46485. doi:10.1038/srep46485.
[7] Yang J, Jones MS, Ramos RI, et al. Insights into Local Tumor Microenvironment Immune Factors Associated with Regression of Cutaneous Melanoma Metastases by Mycobacterium bovis Bacille Calmette-Guérin[J]. Front Oncol, 2017, 7:61. doi: 10.3389/fonc.2017.00061. eCollection 2017.
[8] Prado-García H, Sánchez-García FJ. Editorial: Immuno-Metabolism in Tumor Microenvironment[J]. Front Immunol, 2017, 8:374. doi:10.3389/fimmu.2017.00374.
[9] Yang G, Shen W, Zhang Y, et al. Accumulation of myeloid-derived suppressor cells (MDSCs) induced by low levels of IL-6 correlates with poor prognosis in bladder cancer[J]. Oncotarget, 2017, doi:10.18632/oncotarget.16386. [Epub ahead of print]
[10] Berti FCB, Pereira APL, Cebinelli GCM, et al. The role of interleukin 10 in human papilloma virus infection and progression to cervical carcinoma[J]. Cytokine Growth Factor Rev, 2017, 34:1–13. doi: 10.1016/j.cytogfr.2017.03.002.
[11] Shi A, Shi H, Dong L, et al. CXCR7 as a chemokine receptor for SDF-1 promotes gastric cancer progression via MAPK pathways[J]. Scand J Gastroenterol, 2017, 52(6–7):745–753. doi:10.1080/00365521.2017.1300681.
[12] Radu TG, Ciurea ME, Mogoantă SŞ, et al. Papillary thyroid cancer stroma - histological and immunohistochemical study[J]. Rom J Morphol Embryol, 2016, 57(2 Suppl):801–809.
[13] Goswami KK, Ghosh T, Ghosh S, et al. Tumor promoting role of anti-tumor macrophages in tumor microenvironment[J]. Cell Immunol, 2017, pii: S0008–8749(17)30061–8. doi: 10.1016/j.cellimm.2017.04.005.
[14] Pantel K, Alix-Panabières C. Tumour microenvironment: informing on minimal residual disease in solid tumours[J]. Nat Rev Clin Oncol, 2017, doi: 10.1038/nrclinonc.2017.53. [Epub ahead of print]
[15] Mori N, Wildes F, Takagi T, et al. The Tumor Microenvironment Modulates Choline and Lipid Metabolism[J]. Front Oncol, 2016,6:262. doi: 10.3389/fonc.2016.00262.
[16] Hendry SA, Farnsworth RH, Solomon B, et al. The Role of the Tumor Vasculature in the Host Immune Response: Implications for Therapeutic Strategies Targeting the Tumor Microenvironment[J].Front Immunol, 2016, 7:621. doi: 10.3389/fimmu.2016.00621.
[17] Jeong SK, Kim JS, Lee CG, et al. Tumor associated macrophages provide the survival resistance of tumor cells to hypoxic microenvironmental condition through IL-6 receptor-mediated signals[J]. Immunobiology, 2017, 222(1):55–65. doi: 10.1016/j.imbio.2015.11.010.
[18] Holte E, Kleveland O, Ueland T, et al. Effect of interleukin-6 inhibition on coronary microvascular and endothelial function in myocardial infarction[J]. Heart, 2017, pii: heartjnl-2016–310875.doi: 10.1136/heartjnl–2016–310875. [Epub ahead of print]
[19] Panneer Selvam N, Sadaksharam J. Salivary interleukin-6 in the detection of oral cancer and precancer[J]. Asia Pac J Clin Oncol,2015, 11(3):236–241. doi: 10.1111/ajco.12330.
[20] Sipak-Szmigiel O, Włodarski P, Ronin-Walknowska E, et al. Serum and peritoneal fluid concentrations of soluble human leukocyte antigen, tumor necrosis factor alpha and interleukin 10 in patients with selected ovarian pathologies[J]. J Ovarian Res, 2017, 10(1):25.doi: 10.1186/s13048–017–0320–9.
[21] Hu D, Wan L, Chen M, et al. Essential role of IL-10/STAT3 in chronic stress-induced immune suppression[J]. Brain Behav Immun, 2014, 36:118–127.
[22] Yamada K, Maishi N, Akiyama K, et al. CXCL12-CXCR7 axis is important for tumor endothelial cell angiogenic property[J]. Int J Cancer, 2015, 137(12):2825–2836. doi: 10.1002/ijc.29655.
[23] Zhao ZW, Fan XX, Song JJ, et al. ShRNA knock-down of CXCR7 inhibits tumour invasion and metastasis in hepatocellular carcinoma after transcatheter arterial chemoembolization[J]. J Cell Mol Med,2017, doi: 10.1111/jcmm.13119. [Epub ahead of print]
[24] Nambara S, Iguchi T, Oki E, et al. Overexpression of CXCR7 Is a Novel Prognostic Indicator in Gastric Cancer[J]. Dig Surg. 2016,[Epub ahead of print]
[25] Gu HQ, Zhang ZB, Zhang JW, et al. The role of the SDF-1/CXCR7 axis on the growth and invasion ability of endometrial cancer cells[J]. Arch Gynecol Obstet, 2017, 295(4):987–995. doi: 10.1007/s00404–017–4308–x.
