IVIM磁共振成像对乳腺非肿块强化病变的诊断价值
2017-03-30张天月汪登斌王丽君罗冉宋萌萌尹秋凤张忠阳
张天月, 汪登斌, 王丽君, 罗冉, 宋萌萌, 尹秋凤, 张忠阳
·乳腺影像学·
IVIM磁共振成像对乳腺非肿块强化病变的诊断价值
张天月, 汪登斌, 王丽君, 罗冉, 宋萌萌, 尹秋凤, 张忠阳
目的:探讨多b值双指数模型体素内不相干运动(IVIM)扩散加权磁共振成像对于乳腺非肿块强化病灶的鉴别诊断价值。方法:前瞻性研究2015年12月-2016年6月本院乳腺MRI检查拟诊为非肿块强化(NME)的患者,术前均行MRI常规序列成像及IVIM序列扫描,追踪所有手术患者的病理结果,最终入组经病理确诊的乳腺良性NME病变 20例(20个病灶)和恶性NME病变27例(30个病灶)。分别测量良恶性病灶组单指数模型DWI的表观扩散系数(ADC)和IVIM相关参数(灌注分数f、假性扩散系数D*和纯扩散系数D),并进行比较;绘制两组ADC 值及IVIM相关参数值的受试者操作特征曲线(ROC),分析两种不同指数模型诊断乳腺非肿块强化的最佳参数、诊断阈值和诊断价值。结果:恶性病灶的ADC值和D值[(1.06±0.27)×10-3mm2/s、(0.85±0.24)10-3mm2/s]均小于良性病灶[(1.32±0.23)×10-3mm2/s、(1.31±0.32)×10-3mm2/s],f值[20.10%(13.38%,40.88%)]大于良性病灶[10.45%(6.28%,22.55%)],差异均有统计学意义(P=0.001,P<0.001,P=0.010),两组间D*值差异无统计学意义(P=0.578)。ROC曲线分析得到D值的曲线下面积(AUC)最大,为0.908,而ADC和f值的AUC分别为0.794和0.717。当ADC取最佳诊断阈值1.15×10-3mm2/s时,诊断敏感度和特异度分别为76.9%和76.5%。当D取最佳诊断阈值1.03×10-3mm2/s时,诊断敏感度和特异度分别为85.0%和73.3%。当f取最佳诊断阈值13.60%时,诊断敏感度和特异度分别为76.7%和70.0%。结论:多b值双指数模型IVIM DWI参数中D、f值有助于乳腺非肿块强化良恶性病变的鉴别,其中D值诊断价值最大。
磁共振成像; 体素内不相干运动; 非肿块强化; 乳腺肿瘤
乳腺癌是女性最常见的恶性肿瘤,美国癌症协会预计2016年新发病例数占女性恶性肿瘤的29%,病死率仅次于肺癌[1]。因此,乳腺癌的准确诊断具有非常重要的临床意义。2013年美国放射学会第5版的乳腺影像报告和数据系统(breast imaging and reporting data system-magnetic resonance imaging,BI-RADS-MRI) 定义非肿块强化(non-mass enhancement,NME)为“不具备肿块特征的强化区域,其范围或很小或很广泛,其内部强化与周围正常乳腺组织强化方式不同”[2]。NME的病理类型广泛,且诊断较肿块更有难度,是乳腺MRI影像诊断的重点及难点之一。已有文献报道乳腺MRI检查的扩散加权成像(diffusion weighted imaging,DWI)其表观扩散系数(aparent diffusion coefficient,ADC)不仅反映了组织内水分子的扩散水平,还受到微循环灌注的影响。因此,有效区分这两种运动成分的体素内不相干运动(intravoxel incoherent motion,IVIM)[3-4]受到广泛关注。目前,IVIM应用于肾癌、肝脏病变、前列腺癌、头颈部肿瘤和胰腺肿瘤有较深入的研究[5-9]。在乳腺方面,IVIM对乳腺疾病测量的可行性和诊断效能、与DWI诊断效能的比较、对局部浸润性乳腺癌的化疗评估和监测的相关研究也已发表[10-14],但对乳腺NME病变的诊断价值尚无定论。
本项前瞻性研究旨在通过对NME病变单指数模型的ADC值和多b值双指数模型IVIM的参数进行比较,探讨IVIM DWI对于乳腺NME病变的诊断价值。
材料与方法
1.研究对象
2015年12月-2016年6月在本院行乳腺MRI检查的患者,检查前均签署知情同意书。入组标准:①乳腺MRI检查拟诊为NME;②MRI检查包括常规序列成像及IVIM序列扫描;③MRI检查前未行临床治疗,检查后行手术或穿刺取得病理结果。符合上述条件的患者共47例,其中良性20例(20个病灶),年龄28~64岁,平均(42.3±10.4)岁;恶性27例(30个病灶),年龄29~85岁,平均(56.0±12.9)岁。
2.检查方法
患者均取俯卧位,双乳下垂,采用Philips Ingenia 3.0T超导型磁共振和乳腺专用相控阵列表面线圈行双侧乳腺横轴面扫描。扫描序列包括:①常规三平面定位及校正;②横轴面T2WI-SPAIR序列,TR 5000 ms,TE 65 ms,层厚4 mm,间隔0 mm,矩阵400×382,视野32 cm×37 cm,激励次数1,层数40。③横轴面IVIM,b值选取0、10、20、50、100、200、500、800 s/mm2,TR 5098 ms,TE 69 ms,层厚4 mm,间隔1 mm,矩阵140×93,FOV 35 cm×24 cm,激励次数1,层数32。④定量DCE-MRI扫描,采用专有的乳腺容积成像序列dyn_eTHRIVE,横轴面扫描,TR 4.1 ms,TE 2.1 ms,层厚1 mm,间隔0 mm,矩阵336×405,FOV 28 cm×34 cm,激励次数1,层数150。增强对比剂采用GT-DTPA 0.1 mmol/kg,高压注射器开始注药后立即进行扫描,连续扫描5期。
3.图像分析
由两名经验丰富的乳腺影像诊断医师分别盲法阅片,有异议时两人讨论达成一致结论。依据BI-RADS-MRI做出诊断。在Philips Ingenia 3.0T Intelligence Portal工作站,将单指数DWI和双指数IVIM DWI 图像分别导入工作站工具包中的ADC和MADC软件进行后处理。结合后期生成的伪彩图,在DWI原始图像上手工放置兴趣区(region of interest,ROI)。ROI的选取原则:将ROI放置于病灶最大平面上,选取DWI高信号处,尽量避开病变坏死或囊变区,ROI范围小于病灶范围,在病灶边界之内。软件通过进行单指数和双指数模型计算分别生成ADC、D、D*及f伪彩图,并得到ROI相应参数的数值,所有数据均测量3次取平均值。
4.统计学方法
采用SPSS 19.0和MedCalc统计软件进行数据处理分析,以P<0.05为差异具有统计学意义。将所有病例按病理结果分为良性和恶性两组,符合正态分布的计量资料以均数±标准差表示,非正态分布者以中位数(P25,P75)表示。比较两组间的ADC值、D值、D*值、f值的差异,经Kolmogorov-Smirnov检验分析符合正态分布者行两独立样本t检验(Studentt检验),非正态分布者行非参数检验(Mann-Whitney U检验)。绘制受试者操作特性曲线(receiver operating characteristic curve,ROC),取得各参数的曲线下面积(area under the curve,AUC)、敏感度、特异度,找到诊断NME病变的最佳参数及其诊断阈值。应用MedCalc统计软件对各参数的AUC进行Z检验,比较各参数的诊断价值。
结 果
1.病理结果
47例病例共有50个病灶(其中3例为双侧乳腺癌),其中良性病灶20个(20例),恶性病灶30个(27例)。良性病灶包括:乳腺病9个,大汗腺腺病1个,纤维腺瘤2个,导管内乳头状瘤6个(1个伴硬化性腺病),炎性病变2个。恶性病灶包括:导管原位癌15个(1例伴放射状瘢痕及硬化性腺病),导管内乳头状癌1个,浸润性乳腺癌12个(非特殊型浸润性癌10个,浸润性微乳头状癌1个,浸润性实性乳头状癌1个),胃印戒细胞癌乳腺转移病灶2个(1例病例双侧乳腺转移)。
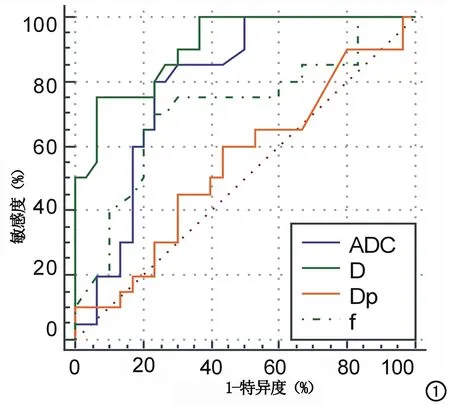
图1 乳腺良恶性NME病变的单指数DWI模型参数ADC值和IVIM模型参数D值、f值、D*值的ROC曲线,AUC分别为0.794、0.908、0.717、0.547(Dp 即D*)。
2.良恶性NME病变的相关参数
恶性病灶的ADC值[(1.06±0.27)×10-3mm2/s]、D值[(0.85±0.24)×10-3mm2/s]均小于良性病灶[(1.32±0.23)×10-3mm2/s、(1.31±0.32)×10-3mm2/s],两组差异有统计学意义(t=3.680,P=0.001;t=5.607,P<0.001)。恶性病灶的f值[20.10%(13.38%,40.88%)]大于良性病灶[10.45%(6.28%,22.55%)],两组差异有统计学意义(Z=-2.575,P=0.010)。恶性病灶的D*值[8.08(5.00,42.32)×10-3mm2/s]小于良性病灶[13.13(5.00,45.74)×10-3mm2/s],但两组间D*值差异无统计学意义(Z=-0.556,P=0.578),见表1。
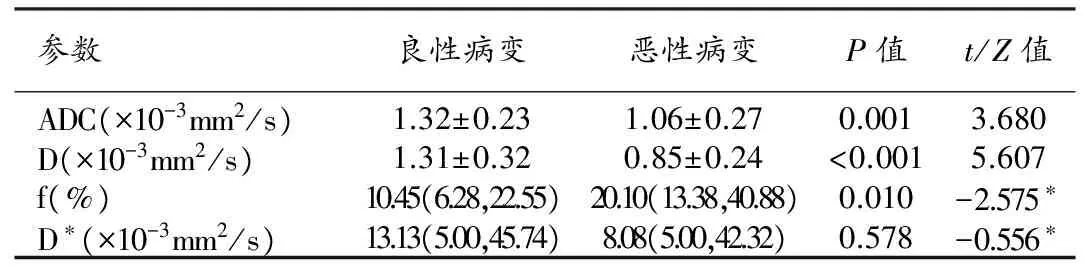
表1 良、恶性NME病变的ADC值、D值、D*值及f值比较
注:*为Z值。
3.单指数DWI模型、双指数IVIM模型参数对乳腺NME病变的诊断效能
对于单指数DWI模型的参数ADC值及双指数IVIM模型的参数D、f、D*值,以病理结果作为金标准,绘制ROC曲线,所得各参数的AUC分别为0.794、0.908、0.717、0.547(图1)。根据Youden指数确定ADC值、D值、f值、D*值的最佳诊断界值分别为1.15×10-3mm2/s、1.03×10-3mm2/s、13.60%、10.26×10-3mm2/s,相对应的诊断敏感度、特异度见表2。D值的敏感度高于ADC值(图2、3),D值具有较高的诊断价值,ADC、f值的诊断价值中等,D*值的诊断价值较低。D值的AUC与ADC值、f值、D*值的AUC相比,差异均有统计学意义(Z=2.433,P=0.015;Z=2.468,P=0.014;Z=4.137,P<0.001)。
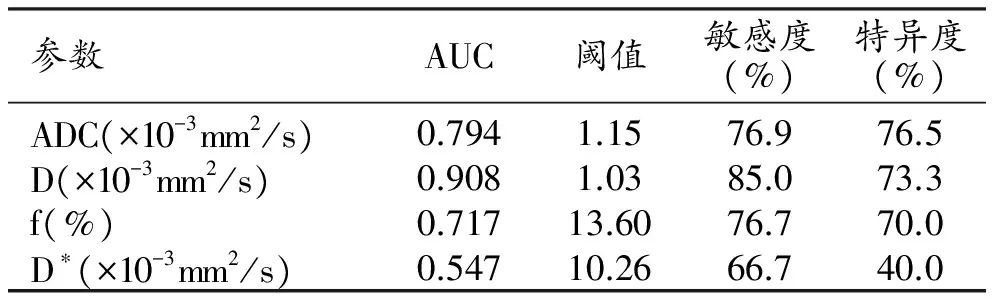
表2 2种模型对乳腺良恶性NME病变的诊断价值
讨 论
DWI通过检测水分子的布朗运动水平来反映活体组织的功能状态[23]。采用单指数模型算法得到参数ADC,来反映细胞微环境内水分子的扩散能力。但多数研究发现使用多个b值时乳腺腺体组织的信号强度并不遵循单指数模型[6,11,13,15-17],ADC值除了组织内水分子的扩散,还受到微循环灌注成分的影响。1986年由Le等[3-4]首次提出IVIM,采用多b值双指数模型来描述信号强度与b值间的关系,去除了微循环灌注对扩散信号的影响。IVIM相关参数包括:D为纯扩散系数,代表体素内相对真实的水分子扩散运动;D*为假性扩散系数,代表体素内微循环灌注相关扩散运动;f为灌注分数,代表了体素内织内微循环灌注相关扩散在总体扩散中所占的比率。
本研究得出恶性NME病变的ADC值、D值均比良性NME病变明显减小,良恶性NME病变的D值均比ADC值略小。D值是通过多b值IVIM模型计算得出的组织扩散系数,较既往单指数DWI模型得出的ADC值排除了微循环灌注的影响,本研究结果表明NME病变的ADC值受微循环灌注影响,单指数DWI模型得出的ADC值被高估。本研究比较分析了ADC值及IVIM各参数(D值、f值、D*值)对NME病变的诊断价值,得到D值的AUC明显比其他参数的AUC大,且差异均具有统计学意义,说明D值对于NME病变的诊断具有更高的价值。当b值越大时,水分子的非高斯扩散运动越明显[18-19],单指数DWI模型的参数ADC值更容易受组织微循环灌注的影响,双指数IVIM模型的参数D值比ADC值更好地排除了细胞结构的影响和微循环灌注效应[12]。当D取最佳诊断阈值1.02×10-3mm2/s时,其诊断特异度为85.0%,分别大于ADC取最佳诊断阈值1.16×10-3mm2/s和f取最佳诊断阈值13.60%时的诊断特异度(80.0%和76.7%),与文献报道结果相符[12-13],说明D值比ADC值更有利于良恶性NME病变的鉴别。
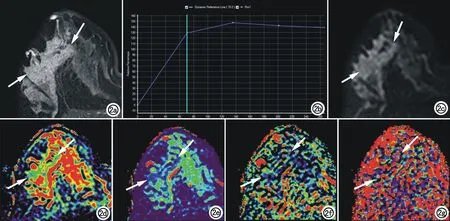
图2 女,43岁,右乳外上象限高级别导管内癌伴微浸润。a) 横轴面T1WI增强示右乳外上区域性异常强化灶(箭); b) TIC示早期快速强化,延迟期呈平台型; c) 横轴面DWI示右乳外上区域性高信号灶(箭); d) ADCmap图示病灶(箭)ADC值为1.13×10-3mm2/s; e) Dmap图示病灶(箭)D值为0.87×10-3mm2/s; f) fmap图示病灶(箭)f值为17.7%; g)图示病灶D*值为15.08×10-3mm2/s。
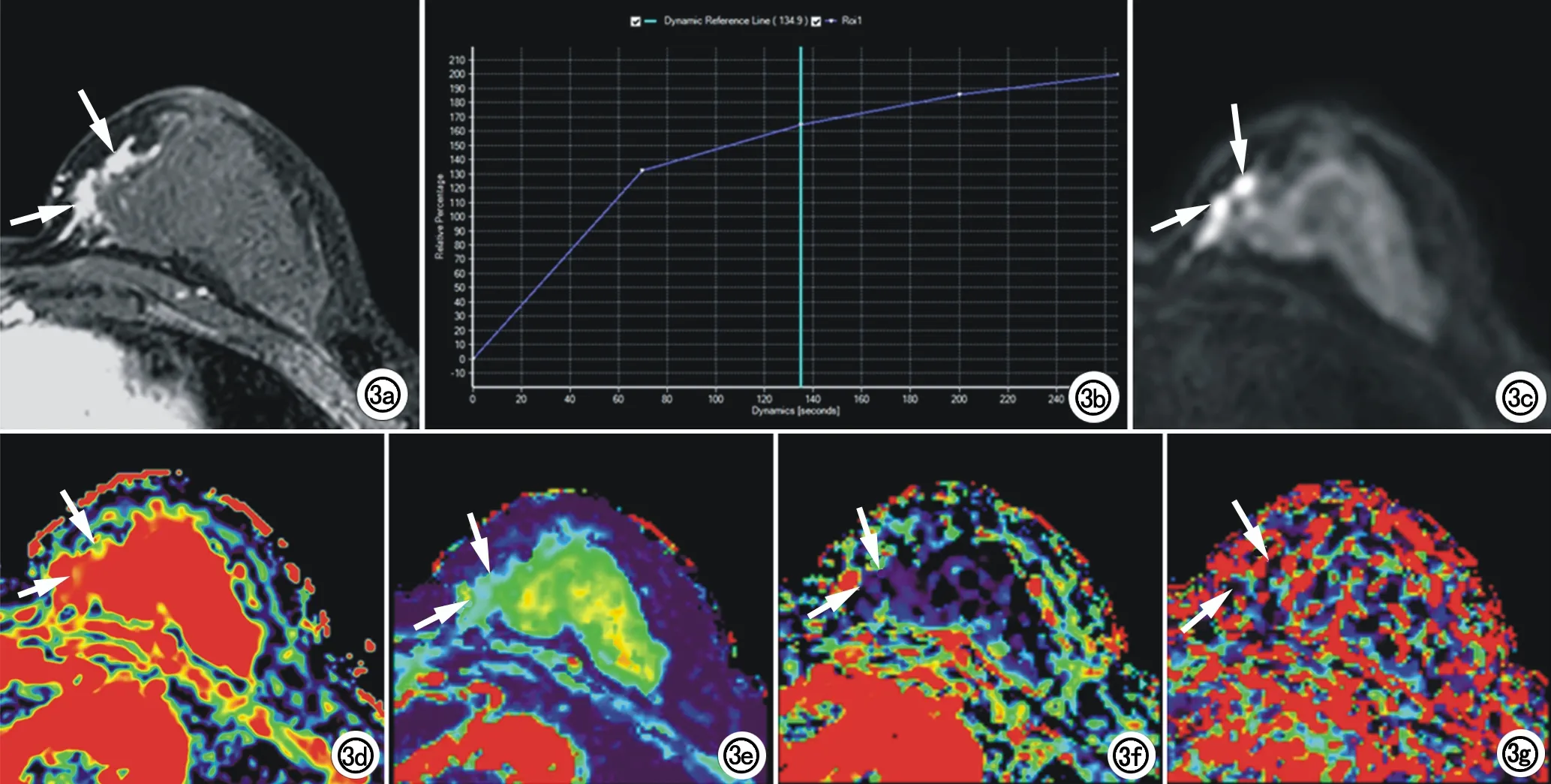
图3 女,45岁,左乳内侧导管内乳头状瘤。a) 横轴面T1WI增强示左乳内侧节段性异常强化灶(箭); b) TIC示早期快速强化,延迟期呈上升型; c) 横轴面DWI示左乳内侧节段性高信号灶(箭); d) ADCmap图示病灶(箭)ADC值为1.05×10-3mm2/s; e) Dmap图示病灶(箭)D值为1.41×10-3mm2/s; f) fmap图示病灶(箭)f值为7.90%; g)图示病灶(箭)D*值为39.49×10-3mm2/s。
灌注相关参数f与D值呈负相关,f越大,表明病灶的细胞结构越复杂,微循环灌注效应越多,组织内相对真实的水分子扩散所占比率越少[7]。本研究得出恶性NME病变的f值比良性NME病变明显增大,与大部分文献报道结果相同[7,11-12],但f值的诊断效能不及ADC值及D值。笔者分析f值的诊断效能较低的原因如下:多数学者认为[11,20-21],不同b值的选择对计算得出的IVIM参数值会产生差异和偏倚,f值对b值的变化尤为敏感。有文献报道[6],当b值>750s/mm2时,肿瘤内f值会随b值的升高而升高,但当b值更大时,受非高斯扩散效应,f值反而变小,难以与正常腺体组织区分。并且,乳腺病变的形态也会影响IVIM相关参数的结果。
D*值与毛细血管段的长度和平均血流速度相关[4],本研究得出恶性NME病变的D*值较良性NME病减小,与恶性NME病灶微血管内相对较低的血流速度有关,但良恶性NME病变的D*值无统计学差异,与大多数文献报道一致[11-13,15,24]。笔者认为这可能与不同病理类型的病变内部微血管结构的差异有关。有文献报道D*值测量的可重复性较差[16],这也可能是导致本研究得出良恶性NME病变的D*值差异无统计学意义的因素之一。并且,文献报道当低b值(0~200s/mm2)取样样本越多,D*值计算越准确[11,17],因而本研究中b值的选择也给D*值的结果带来一定影响。
本研究结果中有两例高危良性NME病变(不典型增生)的D值、f值均与恶性NME病变的D值、f值相似,增加了D值、f值诊断效能的假阳性率,Bokacheva[11]的研究也有类似发现,这是否提示IVIM相关参数有助于从良性NME病变中区分高危良性NME病变的可能,仍需进一步研究。
本研究在以下方面尚存在一定的不足:①本研究纳入的样本量有限,乳腺良恶性NME病变的病理类型较局限,同时良性比恶性病变组样本量少,有一定的组间样本量差异,需进一步扩大样本量;②手工放置ROI具有一定的主观性,且NME病变不具备肿块的形态学特征,测量的主观性比肿块性病变大;③目前国内外对乳腺IVIM DWI检查所适用的b值尚无具体确定标准。据文献报道,当低b值(0~200s/mm2)取样样本越多,血管微循环相关扩张效应的评估越好[11],当b值越高时(b>1000s/mm2),非高斯扩散效应对测量参数的影响越大[6,22]。因此,b值的大小和数量会影响IVIM相关参数的计算结果。多数研究选择多个b值(≥9个)提高计算拟合的精确性[11-13],但会延长患者检查时间,增加不适感。本研究选取8个b值进行扫描(其中0~200s/mm2选取6个b值,>200s/mm2选取2个b值、最高b值为800s/mm2),b值数量相对较少。
综上所述,多b值双指数模型IVIM DWI参数中D、f值有助于乳腺NME良恶性病变的鉴别,其中D值诊断价值最大,优于传统ADC值。
[1] Siegel RL,Miller KD,Jemal A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7-30.
[2] American College of Radiology.ACR BI-RADS:magnetic resonance imaging.In:ACR breast imaging reporting and data system,breast imaging atalas[M].Reston,Va:American College of Radiology,2013:56-71.
[3] Le BD,Breton E,Lallemand D,et al.MR imaging of intravoxel incoherent motions:application to diffusion and perfusion in neurologic disorders[J].Radiology,1986,161(2):401-407.
[4] Le BD,Breton E,Lallemand D,et al.Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging[J].Radiology,1988,168(2):497-505.
[5] 丛欣莹,陈雁,张瑾,等.体素内不相干运动扩散加权成像在肾细胞癌诊断中的应用[J].中华肿瘤学杂志,2016,38(6):434-439.
[6] Pang Y,Turkbey B,Bernardo M,et al.Intravoxel incoherent motion MR imaging for prostate cancer:an evaluation of perfusion fraction and diffusion coefficient derived from different b-value combinations[J].Magn Reson Med,2013,69(2):553-562.
[7] Sumi M,Van CM,Sumi T,et al.Salivary gland tumors:use of intravoxel incoherent motion MR imaging for assessment of diffusion and perfusion for the differentiation of benign from malignant tumors[J].Radiology,2012,263(3):770-777.
[8] Kim B,Lee SS,Sung YS,et al.Intravoxel incoherent motion diffusion-weighted imaging of the pancreas:characterization of benign and malignant pancreatic pathologies[J].J Magn Reson Imaging,2017,45(1):260-269.
[9] Pieper CC,Sprinkart AM,Meyer C,et al.Evaluation of a simplified intravoxel incoherent motion (ivim) analysis of diffusion-weighted imaging for prediction of tumor size changes and imaging response in breast cancer liver metastases undergoing radioembolization:a retrospective single center analysis[J].Medicine,2016,95(14):e3275.
[10] Sigmund EE,Cho GY,Kim S,et al.Intravoxel incoherent motion imaging of tumor microenvironment in locally advanced breast cancer[J].Magn Reson Med,2011,65(5):1437-1447.
[11] Bokacheva L,Kaplan JB,Giri DD,et al.Intravoxel incoherent motion diffusion-weighted MRI at 3.0T differentiates malignant breast lesions from benign lesions and breast parenchyma[J].J Magn Reson Imaging,2014,40(4):813-823.
[12] Chunling L,Changhong L,Zaiyi L,et al.Intravoxel incoherent motion (IVIM) in evaluation of breast lesions:comparison with conventional DWI[J].Eur J Radiol,2013,82(12):782-789.
[13] Iima M,Yano K,Kataoka M,et al.Quantitative non-Gaussian diffusion and intravoxel incoherent motion magnetic resonance imaging:differentiation of malignant and benign breast lesions[J].Invest Radiol,2015,50(4):205-211.
[14] Che S,Zhao X,Yanghan OU,et al.Role of the intravoxel incoherent motion diffusion weighted imaging in the pre-treatment prediction and early response monitoring to neoadjuvant chemotherapy in locally advanced breast cancer[J].Medicine,2016,95(4):e2420.
[15] 车树楠,崔晓琳,李静,等.MR扩散加权成像体素内不相干运动模型对于乳腺良恶性病变诊断价值的研究[J].磁共振成像,2015(7):506-512.
[16] Andreou A,Koh DM,Collins DJ,et al.Measurement reproducibility of perfusion fraction and pseudodiffusion coefficient derived by intravoxel incoherent motion diffusion-weighted MR imaging in normal liver and metastases[J].Eur Radiol,2013,23(2):428-434.
[17] Cho GY,Moy L,Zhang JL,et al.Comparison of fitting methods and b-value sampling strategies for intravoxel incoherent motion in breast cancer[J].Magn Reson Med,2014,74(4):1077-1085.
[18] Le BD.Intravoxel incoherent motion perfusion MR imaging:a wake-up call[J].Radiology,2008,249(3):748-752.
[19] Le BD.Apparent diffusion coefficient and beyond:what diffusion MR imaging can tell us about tissue structure[J].Radiology,2013,268(2):318-322.
[20] Lemke A,Stieltjes B,Schad LR,et al.Toward an optimal distribution of b values for intravoxel incoherent motion imaging[J].Magn Reson Imaging,2011,29(6):766-776.
[21] Zhang JL,Sigmund EE,Rusinek H,et al.Optimization of b-value sampling for diffusion-weighted imaging of the kidney[J].Magn Reson Med,2012,67(1):89-97.
[22] Kristoffersen A.Estimating non-gaussian diffusion model parameters in the presence of physiological noise and rician signal bias[J].J Magn Reson Imaging,2012,35(1):181-189.
[23] 徐琳,汪登斌.MR扩散加权成像在鉴别乳腺非肿块样强化病变性质方面的价值[J].放射学实践,2014(4):454-456.
[24] 韦素岚,叶枫,余小多,等.体素内不相干运动DWI对肝脏良恶性病变的诊断价值[J].放射学实践,2016,31(4):364-368.
The value of intravoxel incoherent motion model diffusion-weighted MRI in the diagnosis of breast lesions categorized as non-mass enhancement
ZHANG Tian-yue,WANG Deng-bin,WANG Li-jun,et al.
Department of Radiology,Xinhua Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200092,China
Objective:To assess the value of intravoxel incoherent motion diffusion weighted imaging (IVIM-DWI) in the diagnosis of breast lesions categorized as non-mass enhancement (NME).Methods:Forty-seven patients with 50 NME breast lesions who underwent preoperative conventional MRI and IVIM-DWI from December 1st 2015 to June 30th 2016 were recruited in this prospective study.Fifty NME lesions (20 benign and 30 malignant lesions) were analyzed with histopathological outcomes.The ADC values and the IVIM-derived parameters pure diffusion coefficient (D),pseudodiffusion coefficient (D*),and perfusion fraction (f) were calculated separately and compared between the two groups.The diagnostic performance of different parameters was compared using the receiver operating characteristic (ROC) curve.Results:The mean ADC and D values in malignant lesions were (1.06±0.27)×10-3mm2/s and (0.85±0.24 )×10-3mm2/s,respectively,which were significantly lower than those of (1.32±0.23)×10-3mm2/s and (1.31±0.32)×10-3mm2/s in benign lesions.The mean f value in malignant lesions was significantly higher than that in benign lesions [20.10% (13.38%,40.88%) vs 10.45% (6.28%,22.55%),P=0.010].However,there was no significant difference in D*between the benign and malignant groups.The area under the ROCs (AUCs) for D,ADC,and f in distinguishing malignant from benign lesions were 0.908,0.794,and 0.717,respectively.The AUC of D value was the highest and the corresponding diagnostic sensitivity and specificity were 85.0% and 73.3%,respectively,with the threshold of 1.03×10-3mm2/s.The corresponding diagnostic sensitivity and specificity of ADC value were 76.9% and 76.5% while taking the optimal threshold of 1.15×10-3mm2/s.The corresponding diagnostic sensitivity and specificity of f value were 76.7% and 70.0% while taking the optimal threshold of 13.60%.Conclusion:The D and f values derived from the IVIM-DWI model are able to distinguish malignant from benign NME breast lesions.D value can provide the most valuable information.
Magnetic resonance imaging; Intravoxel incoherent motion; Non-mass enhancement; Breast neoplasms
200092 上海,上海交通大学医学院附属新华医院放射科
张天月(1991-),女,安徽人,硕士,主要从事乳腺影像学研究工作。
汪登斌,E-mail:dbwang8@aliyun.com
国家自然科学基金(81371621);上海卫生系统“优秀学科带头人计划”(XBR2013110);上海申康发展中心,临床辅助科室能力(影像学科)建设(SHDC22015022)
R445.2; R737.9
A
1000-0313(2017)03-0242-06
10.13609/j.cnki.1000-0313.2017.03.008
2016-11-17)