铁-氟尿嘧啶配合物抗肿瘤活性研究
2017-03-30杜馨娥周云陈英杰施敏钟文远周轶平
杜馨娥,周云,陈英杰,施敏,钟文远,周轶平*
(1.昆明医科大学药学院,昆明650500;2.云南开放大学化学学院,昆明650223;3.昆明医科大学基础医学院,昆明650500;4.昆明学院化学系,昆明650214)
铁-氟尿嘧啶配合物抗肿瘤活性研究
杜馨娥1,周云2,陈英杰3,施敏1,钟文远4,周轶平1*
(1.昆明医科大学药学院,昆明650500;2.云南开放大学化学学院,昆明650223;3.昆明医科大学基础医学院,昆明650500;4.昆明学院化学系,昆明650214)
目的:探讨铁-氟尿嘧啶配合物的抗肿瘤活性和对人胃癌细胞凋亡的影响。方法:采用MTT法检测配合物及其配体对K562、HCT-116、SGC-7901、MCF-7和HEPG-2细胞的增殖抑制作用;Hoechst 33342/PI双染法和流式细胞术检测对人胃癌细胞凋亡的影响;RT-qPCR检测对Caspase-3、Bax、Bcl-2基因表达的影响。结果:配合物作用5株细胞后的IC50值分别为7.8×10-5、5.4×10-5、3.5×10-5、1.1×10-4和2.2×10-5mol/L,能明显抑制细胞的增殖。配合物以10-5mol/L浓度作用SGC-7901细胞36 h后,凋亡率为9.8%,能明显促进SGC-7901细胞凋亡(P<0.01),作用强于其配体5-Fu和Phen(P<0.01);使凋亡相关基因Caspase-3表达上调至4.9(P<0.01);Bcl-2表达下调至0.2(P<0.01)。结论:铁-氟尿嘧啶配合物具有良好的体外抗肿瘤活性,其发挥抗肿瘤作用可能与诱导肿瘤细胞凋亡有关,而其诱导凋亡的作用可能与Caspase-3基因上调和Bcl-2基因下调有关。
铁-氟尿嘧啶配合物;细胞毒活性;凋亡
20世纪60年代,Rosenberg发现铂类化合物能抑制肿瘤细胞生长,金属铂配合物顺铂抗肿瘤作用的发现及临床应用,开辟了金属配合物抗肿瘤药物研究的新领域,对金属配合物的研究逐步扩展〔1-2〕。国内外在该领域的研究十分活跃,合成出多种新型铂、钌、金、银、铜、稀土、席夫邻菲罗啉(Phenanthroline,Phen)碱金属配合物等,都具有抗肿瘤活性〔3〕。
本文拟通过合成以目前临床抗肿瘤药物分子作为配体的新型配合物,得到具有协同作用的抗肿瘤药物。氟尿嘧啶(fluorouracil,5-Fu)及Phen作为配体与金属铁离子结合形成配合物,既有可能产生多种物质抗肿瘤的协同作用,增强其抗肿瘤作用,同时又有降低毒性的可能性。铁作为大量酶和生理过程中的一种必需辅助因子,可能比非必需金属(如铂)的毒性更小。机体内铁含量减少,可减弱抗体免疫功能,降低机体抗感染和防癌的能力〔4〕。铁离子具有较强的配位能力,能与多种类型的天然产物形成配合物,且生成的配合物大多具有比原天然产物更强的抗肿瘤、抗菌或抗氧化等生物活性〔5〕。5-Fu是临床上常见的抗肿瘤药物,常用于治疗消化道癌、直肠癌、乳腺癌等实体肿瘤,但其严重副作用如腹泻、脱水、腹痛、恶心等限制了它在临床的应用〔6〕。Phen具有芳香体系的性质,自身还有两个可以配位的氮原子,因而可形成稳定的鳌合配体,被广泛用于构筑配合物〔7〕。如果将具有抗肿瘤作用的5-Fu与具有较强配位能力的Phen作为配体,与金属铁离子结合形成配合物,既有可能产生多种物质抗肿瘤的协同作用,增强其抗肿瘤作用,同时又有降低毒性的可能性。由此,我们以铁为中心原子,5-Fu和Phen为配体合成铁-氟尿嘧啶配合物,初步鉴定了其化学结构。有研究报道,铁配合物中的铁离子可以通过参与芬顿反应(即过氧化氢与二价铁离子反应生成了具有较强氧化能力的羟基自由基)来诱导活性氧的产生,活性氧形成的自由基通过损伤细胞膜磷脂、酶或DNA造成对细胞的不可逆损伤,激活线粒体途径来诱导细胞凋亡,从而发挥抗肿瘤作用〔8〕。铁配合物也可以通过直接与DNA作用〔9〕,即插入到碱基对之间破坏DNA的结构,从而表现出一定的细胞毒活性。本研究将对合成的铁-氟尿嘧啶配合物的细胞毒活性及其作用机制进行初步研究,探讨配合物未来成药的可能性,为研发一类抗癌新药奠定基础。
1 材料与方法
1.1样品和试剂[Fe(5-Fu)2(Phen)SO4](批号:2014-12-24,昆明学院化学系钟文远教授提供);铁盐(FeSO4·7H2O)(批号:121207,西陇化工股份有限公司);5-Fu(批号:990420,上海华联制药公司);Phen(批号:980611,上海试剂三厂);顺铂(批号:130802,云南个旧生物药业有限公司);新生牛血清(Gibco公司生产,批号:1128143);RPMI-1640(BI公司生产,批号:0044515);引物见表1(天根公司)。

表1 目的基因的引物序列
1.2细胞株人白血病细胞(K562);人结直肠癌细胞(HCT-116);人胃癌细胞(SGC-7901);人乳腺癌细胞(MCF-7);人肝癌细胞(HEPG-2),以上细胞株均由昆明医科大学药学院提供。
1.3仪器超纯水系统(力康公司生产,NW基础型);电子天平(德国Sartorius公司生产,CPA224S型);电热恒温水浴锅(上海恒科学仪器有限公司生产,HWS12型);恒温干燥箱(德国MMM公司生产,Venticell型);医用冰箱(合肥美菱公司生产,YCD-EL259型);超净工作台(珠海再鑫公司生产,EVL-53型);CO2细胞培养箱(美国SHELLAB公司生产,2406型);全波长酶标仪(美国Mollecular Devices公司生产,Plus 384型);倒置生物显微镜(日本Olympus公司生产,CKX31型);荧光倒置显微成像系统(德国Leica公司生产,DMI3000B型);流式细胞仪(美国BD公司生产,FACSCantoTMII型);实时荧光定量PCR仪(美国Applied biosystems公司生产,7500型);低温高速离心机(Sigma公司生产,3-18KS);普通低速离心机(上海菲恰尔公司生产,TDL-4A型)。
1.4受试样品配制将[Fe(5-Fu)2(Phen)SO4]用DMSO(二甲基亚砜)配成10-1mol/L母液;FeSO4·7H2O、5-Fu、Phen和顺铂用NS(生理盐水)配成10-2mol/L母液,然后均用NS稀释成10-3、10-4、10-5、10-6、10-7mol/L的5个浓度备用;溶剂对照为相应浓度的DMSO。
1.5细胞培养细胞用含10%新生牛血清的RP⁃MI-1640完全培养基,在37℃,5%CO2培养箱中培养,每3~4 d传代1次。
1.6 MTT法检测细胞毒活性取对数生长期的K562、HCT-116、SGC-7901、MCF-7和HEPG-2细胞,按9 000个/孔的数目接种于96孔板,90 μL/孔,各组均设3个复孔。在37℃,5%CO2培养箱中培养24 h后加入各受试样品10 μL,样品终浓度10-8、10-7、10-6、10-5、10-4mol/L;样品作用48 h后,加入MTT(噻唑蓝),10 μL/孔;继续培养4 h后加入三联液(10%十二烷基硫酸钠-5%异丁醇-0.012 mol/L HCl),100 μL/孔;放置过夜后用酶标仪于570 nm,630 nm双波长下检测各孔的OD值,计算增殖抑制率。采用GWBASIC软件计算IC50值及95%置信区间。
1.7 Hoechst 33342/PI双染法检测细胞凋亡以[Fe(5-Fu)2(Phen)SO4]和顺铂作用于SGC-7901细胞后的IC50值为受试浓度。取SGC-7901细胞,调整浓度为1×106个/mL,种入12孔培养板,200 μL/孔,24 h后加入受试样品。样品作用24 h后,弃旧培养基,加入850 μL新培养基,加入Hoechst 33342(100 μg/mL,100 μL/孔),使其终浓度为10 μg/mL;加入PI(100 μg/mL,50 μL/孔)使其终浓度为5 μg/mL。放入培养箱孵育15 min,于荧光显微镜下拍照。
1.8流式细胞术检测细胞凋亡根据[Fe(5-Fu)2(Phen)SO4]、5-Fu、Phen和顺铂作用于SGC-7901细胞后的IC50值,以1/2IC50、IC50、2IC50为低、中、高3个受试浓度,检测样品作用SGC-7901细胞24、36、48 h后的早期凋亡率;同时,检测[Fe(5-Fu)2(Phen)SO4]、5-Fu、Phen和顺铂以同一浓度10-5mol/L作用SGC-7901细胞36 h后的早期凋亡率。取SGC-7901细胞,以1×106个/瓶的数目接种于25 cm2培养瓶,24 h后加入受试样品,样品作用24、36、48 h后收集约5×105~10×105个细胞,1 200 r/min离心5 min。参照Annexin V-FITC试剂盒说明书:离心后加入1 mL预冷PBS洗涤2次,1 200 r/min离心5 min。离心后弃上清,加100 μL Binding Buffer重悬细胞;加5 μL AnnexinV-FITC和5 μL Propidium Iodide混匀;室温、避光反应10 min;加入400 μL Binding Buffer混匀。在1 h内,用流式细胞仪检测凋亡率。
1.9 RT-qPCR检测凋亡相关因子Caspase-3、Bax、Bcl-2的mRNA表达情况取SGC-7901细胞,以6×105个/孔的数目接种于6孔培养板中,24 h后加入受试样品。[Fe(5-Fu)(2Phen)SO4]、5-Fu、Phen和顺铂以10-5mol/L浓度作用12、24、36 h后用Trazol提取总RNA。按FastQuant RT Kit(With gDNase)试剂盒说明书:配制10 μL反应体系去除基因组DNA;配制20 μL反应体系逆转录得到cDNA。参照SuperReal PreMix Plus(SYBR Green)试剂盒说明书:配制20 μL反应体系,用实时荧光定量PCR仪进行荧光定量PCR反应。采用比较循环阈值法(2-△△Ct)分析样本中Caspase-3、Bax和Bcl-2基因的相对表达量。
1.10数据处理实验重复3次,各指标以表示。采用prise软件建立数据库并进行方差分析,组间比较P<0.05为差异有统计学意义。
2 结果
2.1[Fe(5-Fu)2(Phen)SO4]及其配体对5株人癌细胞增殖的影响[Fe(5-Fu)2(Phen)SO4]及其配体以10-8、10-7、10-6、10-5、10-4mol/L浓度作用于5株人癌细胞后,以浓度为横坐标、抑制率为纵坐标绘制量效曲线,见图1,并计算IC50值,见表2。从图1可以看出,在10-8~10-4mol/L浓度范围内,[Fe(5-Fu)2(Phen)SO4]及其配体5-Fu、Phen对K562、HCT-116、SGC-7901、MCF-7和HEPG-2细胞的增殖抑制作用随浓度增加而增强。
表2 及其配体对5株人癌细胞增殖的半数抑制浓度(IC50)
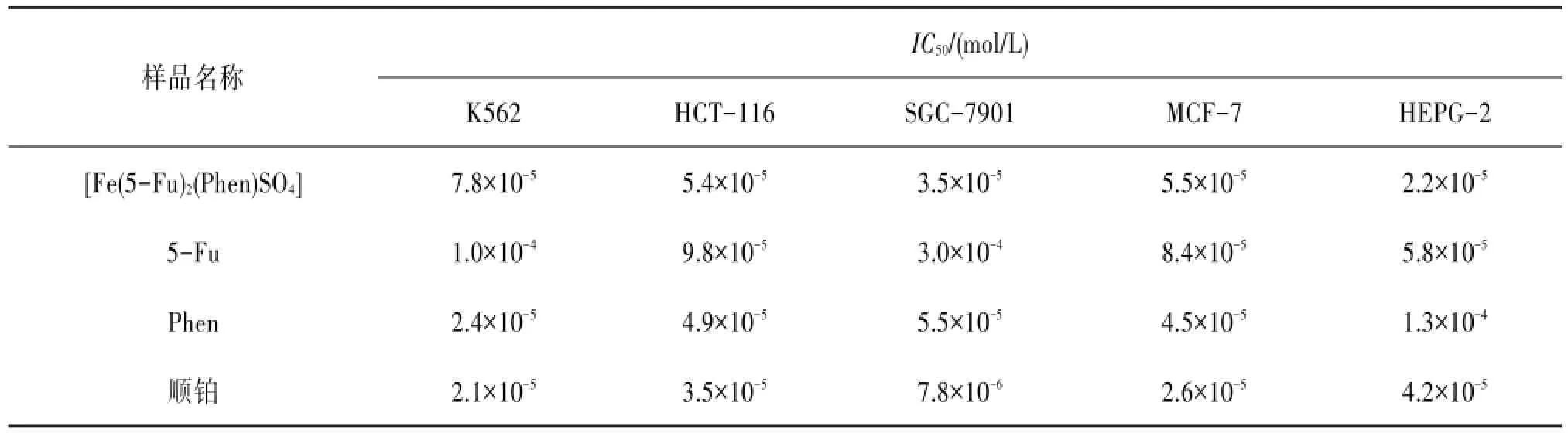
表2 及其配体对5株人癌细胞增殖的半数抑制浓度(IC50)
对于K562细胞,在10-6、10-5、10-4mol/L浓度时,[Fe(5-Fu)2(Phen)SO4]对细胞的抑制率分别为-3%、12%、38%;5-Fu为-3%、5%、33%;Phen为7%、51%、66%;顺铂为1%、13%、95%。见图1A。[Fe(5-Fu)2(Phen)SO4]、5-Fu、Phen和顺铂的IC50分别为7.8×10-5、1.0×10-4、2.4×10-5、2.1×10-5mol/L。
对于HCT-116细胞,在10-6、10-5、10-4mol/L浓度时,[Fe(5-Fu)2(Phen)SO4]对细胞的增殖抑制率分别为-1%、28%、59%;5-Fu为-2%、15%、32%;Phen为3%、43%、52%;顺铂为6%、22%、73%。见图1B。IC50分别为5.4×10-5、9.8×10-5、4.9×10-5、3.5×10-5mol/L。[Fe(5-Fu)2(Phen)SO4]对HCT-116细胞有较强增殖抑制作用,10-4mol/L作用后的抑制率与NS相比差异有统计学意义(P<0.01),其作用强于配体5-Fu和Phen。
对于SGC-7901细胞,在10-6、10-5、10-4mol/L浓度时,[Fe(5-Fu)2(Phen)SO4]作用后的增殖抑制率分别为22%、31%、64%;5-Fu为7%、24%、35%;Phen为-4%、35%、45%;顺铂为3%、75%、97%。见图1C。IC50分别为3.5×10-5、3.0×10-4、5.5×10-5、7.8×10-6mol/L。[Fe(5-Fu)2(Phen)SO4]对SGC-7901细胞有较强增殖抑制作用,10-4mol/L作用后的抑制率与NS相比差异有统计学意义(P<0.01),其作用强于配体5-Fu和Phen。
对于MCF-7细胞,在10-6、10-5、10-4mol/L浓度时,[Fe(5-Fu)2(Phen)SO4]对细胞的增殖抑制率分别为1%、24%、51%;5-Fu为-3%、18%、30%;Phen为-4%、44%、55%;顺铂为-2%、33%、93%。见图1D。IC50分别为5.5×10-5、8.4×10-5、4.5×10-5、2.6×10-5mol/L。[Fe(5-Fu)2(Phen)SO4]对MCF-7细胞的增殖抑制作用较强,10-4mol/L作用后的抑制率与NS相比差异有统计学意义(P<0.01),其作用强于配体5-Fu。

图1 [Fe(5-Fu)2(Phen)SO4]及其配体对5株人癌细胞的增殖抑制作用
对于HEPG-2细胞,在10-6、10-5、10-4mol/L浓度时,[Fe(5-Fu)2(Phen)SO4]对细胞的增殖抑制率分别为19%、41%、67%;5-Fu为0%、28%、45%;Phen为10%、31%、44%;顺铂为0%、32%、66%。见图1E。IC50分别为2.2×10-5、5.8×10-5、1.3×10-4、4.2×10-5mol/L。[Fe(5-Fu)2(Phen)SO4]对HEPG-2细胞有较强增殖抑制作用,10-4mol/L作用后的抑制率与NS相比差异有统计学意义(P<0.01),强于5-Fu和Phen,甚至强于顺铂。
在所测试浓度范围内,FeSO4·7H2O对5株人癌细胞不但没有增殖抑制作用,相反,还有一定的促增殖作用。见图1。以10-5mol/L作用后对HCT-116、SGC-7901细胞的促增殖率达71%和82%。见图1B、图1C。
2.2 Hoechst 33342/PI双染法检测细胞凋亡顺铂、[Fe(5-Fu)2(Phen)SO4]以各自作用于SGC-7901细胞后求出的IC50值7.8×10-6mol/L、3.5×10-5mol/L作用SGC-7901细胞24 h后,用Hoechst 33342/PI双染法检测细胞凋亡。从图2中看出,未经染色处理的NS组细胞形态正常;而顺铂组和[Fe(5-Fu)2(Phen)SO4]组细胞皱缩。经过染色处理后,顺铂组和[Fe(5-Fu)2(Phen)SO4]组有明显亮蓝色凋亡细胞出现(图2E、图2F中箭头处)。见图2。
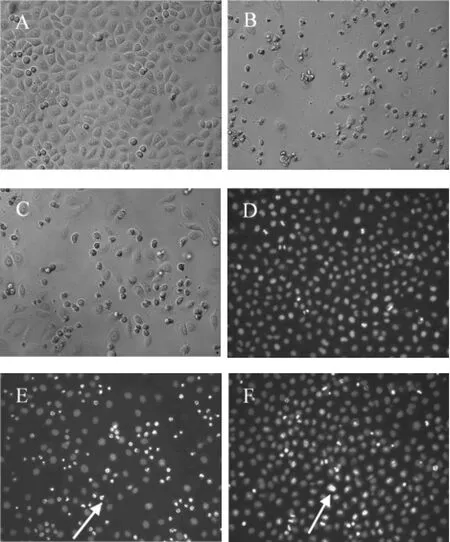
图2 Hoechst33342/PI双染法检测[Fe(5-Fu)2(Phen)SO4]对SGC-7901细胞凋亡的影响(20×10)
2.3[Fe(5-Fu)2(Phen)SO4]及其配体对SGC-7901细胞凋亡的影响[Fe(5-Fu)2(Phen)SO4]以1.75×10-5(1/2IC50)、3.50×10-5(IC50)、7.00×10-5mol/L(2IC50)为低、中、高浓度;5-Fu以1.50×10-4(1/2IC50)、3.00×10-4(IC50)、6.00×10-4mol/L(2IC50)为低、中、高浓度;Phen以2.75×10-5(1/2IC50)、5.50×10-5(IC50)、1.10×10-4mol/L(2IC50)为低、中、高浓度;顺铂以7.80×10-6mol/L(IC50)作用于SGC-7901细胞24、36、48 h后,用流式细胞仪检测凋亡率。见图3~4。
从图4看出,样品作用24 h后,顺铂组早期凋亡率为42.7%。[Fe(5-Fu)2(Phen)SO4]低、中、高浓度组早期凋亡率为5.8%、7.9%、17.3%,与NS组相比,配合物高浓度时明显诱导了细胞凋亡(P<0.01)。5-Fu低、中、高浓度组早期凋亡率为6.5%、33.1%、25.2%,与NS组相比,中、高浓度时明显诱导了细胞凋亡(P<0.01)。Phen低、中、高浓度组早期凋亡率为8.4%、11.5%、16.5%,与NS组相比,高浓度时明显诱导了细胞凋亡(P<0.05)。
作用36 h后,顺铂组早期凋亡率为17.7%。[Fe(5-Fu)2(Phen)SO4]低、中、高浓度作用SGC-7901细胞后,早期凋亡率为26.5%、31.6%、43.8%,与NS组相比,配合物中、高浓度时明显诱导了细胞凋亡(P<0.01)。5-Fu低、中、高浓度组早期凋亡率为30.9%、36.6%、38.6%,与NS组相比,低、中、高浓度均明显诱导了细胞凋亡(P<0.01)。Phen低、中、高浓度组早期凋亡率为30.8%、36.0%、37.2%,与NS组相比,均明显诱导了细胞凋亡(P<0.01)。
作用48 h后,顺铂组早期凋亡率为19.3%。[Fe(5-Fu)2(Phen)SO4]低、中、高浓度组早期凋亡率为14.6%、27.7%、26.7%,与NS组相比,配合物中、高浓度组明显诱导了细胞凋亡(P<0.01)。5-Fu低、中、高浓度组早期凋亡率为24.1%、24.1%、27.0%,与NS组相比,均明显地诱导了细胞凋亡(P<0.01)。
当[Fe(5-Fu)2(Phen)SO4]、5-Fu、Phen和顺铂以10-5mol/L作用SGC-7901细胞36 h后,其早期凋亡率分别为9.8%、2.4%、2.2%和15.8%。与NS组相比,[Fe(5-Fu)2(Phen)SO4]能明显诱导细胞凋亡(P<0.01),且[Fe(5-Fu)2(Phen)SO4]诱导凋亡的作用强于其配体5-Fu和Phen(P<0.01)。见图5。

图3 [Fe(5-Fu)2(Phen)SO4]及其配体作用SGC-7901细胞36 h后对细胞凋亡的影响
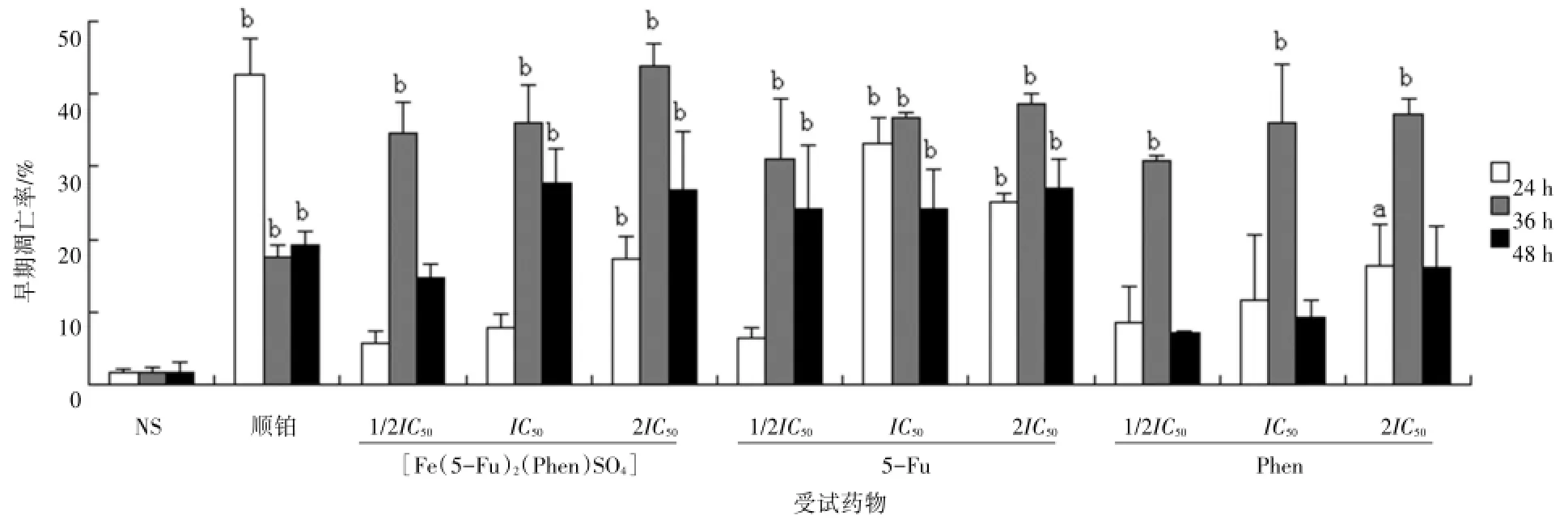
图4 [Fe(5-Fu)2(Phen)SO4]及其配体对SGC-7901细胞凋亡的影响

图5 [Fe(5-Fu)2(Phen)SO4]及其配体以相同浓度作用SGC-7901细胞后对凋亡的影响
2.4[Fe(5-Fu)2(Phen)SO4]及其配体作用于SGC-7901细胞后对凋亡相关因子表达的影响RT-qPCR结果表明,与NS组相比,[Fe(5-Fu)2(Phen)SO4]及其配体以10-5mol/L浓度作用于SGC-7901细胞12、24、36 h后,使Caspase-3、Bax基因的mRNA表达上调,使Bcl-2基因的mRNA表达下调。见图6。
对于Caspase-3基因,与NS组相比,经顺铂、[Fe(5-Fu)2(Phen)SO4]、5-Fu和Phen作用于SGC-7901细胞12 h后,其表达分别上调至1.9、2.4、1.5、1.6;作用24 h后,其表达分别上调至2.7(P<0.05)、3.2(P<0.01)、1.6、2.3(P<0.05);作用36 h后,其表达分别上调至11.1(P<0.01)、4.9(P<0.01)、1.9、4.9(P<0.01)。

图6 [Fe(5-Fu)2(Phen)SO4]作用SGC-7901细胞后对凋亡相关基因表达的影响
对于Bax基因,顺铂、[Fe(5-Fu)2(Phen)SO4]、Phen作用SGC-7901细胞12 h后分别上调至1.2、1.3、1.3,而5-Fu使其表达下调至0.9;作用24 h后,其表达分别上调至2.7、1.7、1.1、1.9;作用36 h后,顺铂、5-Fu、Phen使其表达分别上调至3.3、1.2、2.1,而[Fe(5-Fu)2(Phen)SO4]使其表达下调至0.7。
对于Bcl-2基因,顺铂、[Fe(5-Fu)2(Phen)SO4]、Phen作用SGC-7901细胞12 h后,使其表达分别下调至0.2(P<0.01)、0.5、0.7,而5-Fu使其表达上调至1.1;作用24 h后,顺铂、[Fe(5-Fu)2(Phen)SO4]使其表达下调至0.1(P<0.05)和0.8,而5-Fu、Phen使其表达上调至1.4和1.3;作用36 h后,顺铂、[Fe(5-Fu)2(Phen)SO4]使其表达下调至0.2(P<0.01)和0.3(P<0.05),而5-Fu、Phen使其表达上调至1.1和1.3。
3 讨论
本研究在成功合成[Fe(5-Fu)2(Phen)SO4]的基础上,测定了[Fe(5-Fu)2(Phen)SO4]及其配体对K562、HCT-116、SGC-7901、MCF-7和HEPG-2细胞的细胞毒活性。在10-6、10-5、10-4mol/L浓度时,[Fe(5-Fu)2(Phen)SO4]对5株细胞的细胞毒活性均强于配体5-Fu;对于HCT-116、SGC-7901和HEPG-2细胞,[Fe(5-Fu)2(Phen)SO4]细胞毒活性强于配体Phen;而配体FeSO4·7H2O对5株细胞均表现出促增殖作用,这可能与肿瘤对铁需求较高有关〔10〕。以上说明了配合物的合成,使配体之间产生了协同抗肿瘤作用。
细胞增殖与凋亡的平衡是机体正常生长的关键,肿瘤的发生就是由于细胞异常增殖和凋亡受抑所导致,诱导肿瘤细胞凋亡是抗肿瘤药物发挥作用的重要机制。本研究结果显示:低、中、高浓度[Fe(5-Fu)2(Phen)SO4]及其配体5-Fu和Phen均能诱导SGC-7901细胞凋亡,早期凋亡率从24 h到36 h呈上升趋势,36 h达高峰,36 h到48 h呈下降趋势。随着浓度增加,配合物诱导细胞的早期凋亡率呈上升趋势,显现良好的量效关系。顺铂诱导SGC-7901细胞凋亡的早期凋亡率在作用24 h后达到高峰,36、48 h后呈下降趋势,说明顺铂起效时间早于配合物及其配体。当[Fe(5-Fu)2(Phen)SO4]、5-Fu和Phen以10-5mol/L浓度作用SGC-7901细胞36 h后,[Fe(5-Fu)2(Phen)SO4]诱导凋亡作用明显强于其配体5-Fu和Phen,再次说明配合物的合成,使配体之间产生了协同抗肿瘤作用。
在细胞凋亡信号转导通路中,Caspase家族起着十分重要的作用。Caspase-3是经典的死亡受体途径和线粒体途径的共同下游因子,是哺乳动物细胞凋亡的关键蛋白酶〔11-13〕。而Bcl-2蛋白家族与凋亡密切相关,其中,Bax和Bcl-2分别是Bcl-2家族中的促凋亡和抗凋亡成员之一,在细胞凋亡过程中起调节作用〔14-15〕。本研究结果显示,在10-5mol/L浓度时,随着作用时间延长,顺铂使促凋亡基因Caspase-3和Bax显著上调,使抑凋亡基因Bcl-2显著下调。而[Fe(5-Fu)2(Phen)SO4]及其配体5-Fu和Phen作用细胞后,使促凋亡基因Caspase-3和Bax表达上调;[Fe(5-Fu)2(Phen)SO4]作用细胞后,使抑凋亡基因Bcl-2表达下调,作用36 h后下调明显。5-Fu、Phen对Bcl-2基因表达几乎无下调作用,甚至一定程度上上调其表达。本研究将进一步研究配合物诱导凋亡的具体途径,并且探索配合物对DNA分子的作用情况,以及揭示配合物抗肿瘤作用的具体机制、关键的作用靶点。
〔1〕高传柱,王天帅,陈佳,等.铂类抗肿瘤药物作用机制研究进展〔J〕.昆明理工大学学报(自然科学版),2014,39(4):83-92.
〔2〕JOHNSTONE T C,PARK G Y,LIPPARD S J.Understanding and improving platinum anticancer drugs--phenanthriplat⁃in〔J〕.Anticancer Res,2014,34(1):471-476.
〔3〕MUHAMMAD N,GUO Z.Metal-based anticancer chemo⁃therapeutic agents〔J〕.Curr Opin Chem Biol,2014,19(1):144-153.
〔4〕SCHMITT S M,FREZZA M,DOU Q P.New applications of old metal-binding drugs in the treatment of human can⁃cer〔J〕.Front Biosci(Schol Ed),2012,4(1):375-391.
〔5〕蔡放,江仁望.天然产物的金属铜配合物研究进展〔J〕.亚太传统医药,2011,7(6):163-168.
〔6〕CEILLEY R I.Mechanisms of action of topical 5-fluoroura⁃cil:review and implications for the treatment of dermatolog⁃ical disorders〔J〕.J Dermatolog Treat,2012,23(2):83-89.
〔7〕黄艳菊.由邻菲罗啉衍生物构筑的过渡金属配合物的合成、表征及其对染料的催化降解作用〔D〕.镇江:江苏大学,2012.
〔8〕YU Y,SURYO RAHMANTO Y,HAWKINS C L,et al.The potent and novel thiosemicarbazone chelators di-2-pyri⁃dylketone-4,4-dimethyl-3-thiosemicarbazone and 2-ben⁃zoylpyridine-4,4-dimethyl-3-thiosemicarbazone affectcrucial thiol systems required for ribonucleotide reductase activity〔J〕.Mol Pharmacol,2011,79(6):921-931.
〔9〕MOJŽIŠOVÁ G,MOJŽIŠ J,VAŠKOVÁ J.Organometallic iron complexes as potential cancer therapeutics〔J〕.Acta Biochim Pol,2014,61(4):651-654.
〔10〕CHITAMBAR C R,ANTHOLINE W E.Iron-targeting antitumor activity of gallium compounds and novel in⁃sights into triapine(®)-metal complexes〔J〕.Antioxid Redox Signal,2013,18(8):956-972.
〔11〕岳原亦,张扬,张一奇.Caspase家族与细胞凋亡〔J〕.中国医疗前沿,2011(6):25-26.
〔12〕MORALES-CRUZ M,FIGUEROA C M,GONZÁLEZROBLES T,et al.Activation of caspase-dependent apop⁃tosis by intracellular delivery of Cytochrome c-based nanoparticles〔J〕.J Nanobiotechnology,2014,12:33.
〔13〕CHEN T,CHEN M,CHEN J.Ionizing radiation potenti⁃ates dihydroartemisinin-induced apoptosis of A549 cells via a caspase-8-dependent pathway〔J〕.PLoS ONE,2013,8(3):59827.
〔14〕DUO J,YING G G,WANG G W,et al.Quercetin inhibits human breast cancer cell proliferation and induces apopto⁃sis via Bcl-2 and Bax regulation〔J〕.Mol Med Rep,2012,5(6):1453-1456.
〔15〕SAMARGHANDIAN S,NEZHAD M A,MOHAMMADI G.Role of caspases,Bax and Bcl-2 in chrysin-induced apoptosis in the A549 human lung adenocarcinoma epithe⁃lial cells〔J〕.Anticancer Agents Med Chem,2014,14(6):901-909.
Research on Anti-tumor Activity of Iron-fluorouracil Complex
Du Xin'e1,Zhou Yun2,Chen Yingjie3,Shi Min1,Zhong Wenyuan4,Zhou Yiping1*
(1.Pharmaceutical Science,Kunming Medical University,Kunming 650500,China;2.College of Chemistry,Yunnan Open University, Kunming 650223,China;3 School of Basic Medicine,Kunming Medical University,Kunming 650500,China;4.Department of Chemistry,Kunming University,Kunming 650214,China)
Objective:To explore iron-fluorouracil complex's anti-tumor activity and effect to human gastric carcinoma cells apoptosis.Methods:MTT method was used to detect inhibition rate of the complex on tumor cell lines:K562,HCT-116,SGC-7901, MCF-7 and HEPG-2;Hoechst 33342/PI and flow cytometry(FCM)methods were used to exhibit apoptosis of SGC-7901 cells;RT-qPCR was used to measure the mRNA expression of apoptosis related factors:Caspase-3,BaxandBcl-2.Results:Iron-fluorouracil complex obviously inhibited the proliferation of 5 tumor cell lines.IC50were 7.8×10-5,5.4×10-5,3.5×10-5,1.1×10-4and 2.2×10-5mol/L, respectively.After 36 hours'treatment on SGC-7901 cell with a concentration 10-5mol/L,its apoptosis rate was 9.8%,which could promote SGC-7901 cell apoptosis than its ligands 5-Fu and Phen(P<0.01);the mRNA expression ofCaspase-3gene was up-regulated to 4.9(P<0.01),whileBcl-2was down-regulated to 0.2(P<0.01).Conclusion:The complex showed good anti-tumor activity in vitro,up regulation ofCaspase-3as well as down regulationBcl-2may be one of its mechanisms of action.
iron-fluorouracil complex;cytotoxicity;apoptosis
R96
A
2096-2266(2017)02-0011-09
10.3969/j.issn.2096-2266.2017.02.003
(责任编辑 李杨)
云南省科技厅-昆明医科大学应用基础研究联合专项资助项目(2014FB011);云南省教育厅科学研究基金资助项目(2014Z060)
2016-04-06
2016-06-14
杜馨娥,硕士研究生,主要从事肿瘤药理研究.
*通信作者:周轶平,副教授,博士.
