PTEN和缺氧诱导因子- 1α在食管鳞癌组织中的表达①
2017-03-30窦鹏挥胡春荣马利峰邢宇彤朱晓峰
窦鹏挥,胡春荣,马利峰,邢宇彤,朱晓峰
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
PTEN和缺氧诱导因子- 1α在食管鳞癌组织中的表达①
窦鹏挥,胡春荣,马利峰,邢宇彤,朱晓峰
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
目的:探讨PTEN和缺氧诱导因子-1α(HIF-1α)在食管鳞癌组织中的表达及临床意义。方法:使用免疫组化和RT-PCR的方法对PTEN,HIF-1α在食管癌组织中的表达情况进行定量,并研究其相关性。结果:PTEN和HIF-1α多被发现位于食管鳞癌细胞的细胞质、血管细胞质以及内皮细胞中;PTEN在T0组(0.1928±0.0164)、一期组(0.1608±0.099)、二期组(0.1423±0.073)及三期组(0.1272±0.096)患者中的表达逐步降低,差异显著(P<0.01),HIF-1α表达在T0(0.1320±0.0108)、一期组(0.1667±0.0089)、二期组(0.1985±0.0128)及三期(0.2483±0.0165)患者逐步增高,差异显著(P<0.01),PTEN和HIF-1α表达量之间的差异显著(P<0.01) 。结论:在所有食管鳞癌病例组织中,PTEN与HIF-1α基因的表达与肿瘤的分期相关性显著,说明这两种蛋白的表达情况可能对食管鳞状细胞癌的治疗效果及预后有重要的影响。 在基因靶向治疗、抗癌新药研发等方面,提供新的选择方向和理论基础。
食管鳞癌;PTEN;HIF-1α
食管癌是我国常见的消化道恶性肿瘤之一,虽然其发生机制尚不明确,但已知其受很多相关因素的调控。主要发生在食管黏膜上皮,临床类型中鳞癌系比较常见的[1]。尽管近些年食管癌的疗效已经不断改善,但其预后仍然较差,患者的死亡率也较高,患者的5年生存率低于 17%[2]。在食管鳞癌中,PTEN和HIF- 1α的表达情况以及相关性的研究较少。在本研究中,通过免疫组织化学和RT-PCR研究了食管鳞状细胞癌中PTEN和缺氧诱导因子-1α(HIF-1α)的表达及相关性, 探讨其与食管癌发生发展机制的关系,为食管癌的靶基因治疗、预后等研究提供理论依据。
1 材料与方法
1.1 材料
43例食管鳞癌患者组织标本,均来自我院胸外科2010-10~2013-10经治的病人(所有患者术前均未接受放化疗),年龄39~70岁,平均(51.67±9.91)岁;其中6例Tis(原位癌),13例T1期,10例T2期,9例T3期,5例T4期。15例T0期作为正常对照组, 根据TNM临床分期随机将其分成四组(正常对照组、Ⅰ期、Ⅱ期、Ⅲ期), 四组患者在年龄、 性别、 病变长度等情况无明显差别(P>0. 05) 。S-P试剂(Maixin,中国),抗体系兔多克隆VEGF抗体(abcam,美国)。
1.2 方法
(1)免疫组化SP法步骤:切片逐步脱蜡至水,进行抗原修复,PBS缓冲液洗3min/3次。滴加UltraVBlock,室温孵育5min。缓冲液洗3min/3次。滴加一抗,于37℃孵育2h。PBS缓冲液冲洗5min/2次。滴加增强子,室温孵育15min。PBS缓冲液冲洗5min/2 次。然后滴加HRPPolymer(酶标二抗工作液) , 室温下孵育 20min。PBS缓冲液冲洗 5min/2 次。将DABPlusSubstrate底物滴加到切片上, 孵育10min。蒸馏水洗涤,苏木素复染、常规脱水、透明、封片、拍照。
(2)RT-PCR操作步骤:用RT-PCR检测PTEN、HIF-1α基因的表达:从每个实验材料中提取总RNA。同时,根据上述两个基因设计PCR引物,通过RT-PCR试剂盒检测每个样品中每个基因的转录表达。
1.3 统计学方法
采用SPSS14.0软件比较各组之间的样本平均值,使用独立样本t检验和方差分析ANOVA分析。
2 结果
2.1 食管鳞癌病人组织内PTEN和HIF-1α表达的特点
由棕色颗粒来显示PTENmRNA和HIF-1αmRNA表达水平, 大多位于内皮细胞、血管细胞质和肿瘤细胞的细胞质中,测量食管鳞状细胞癌中PTENmRNA和HIF-1αmRNA的表达,随着病理分期的不同,表达量亦差异性显著,PTEN在T0组(0.1928±0.0164)、一期组(0.1608±0.099) 、 二期组(0.1423±0.073) 及三期组(0.1272±0.096)患者中的表达逐步降低,差异显著(P<0. 01) ,HIF- 1α表达在T0(0.1320±0.0108)、一期组(0.1667±0.0089) 、 二期组(0.1985±0.0128)及三期(0.2483±0.0165)患者逐步增高,差异显著(P<0.01)。见图1, 图2。
2.2PTEN,HIF-1α和食管鳞状细胞癌相关性研究的PTEN的表达与HIF-1α的表达显著相关(r=-0. 36,-0. 68,均P<0.05) 。
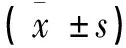
表1 四组患者PTEN/HIF-1α表达情况对比

图1 食管鳞癌及正常组织中PTEN、HIF-1α表达(S-P法,×400)
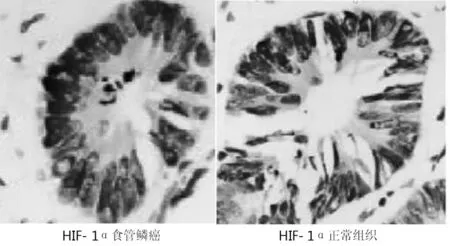
图2 食管鳞癌患者组织内 PTEN、HIF-1α表达量(RT-PCR)
3 讨论
PTEN蛋白是第一个被发现的具有磷酸酯酶活性的抑癌基因,通过其磷酸化作用,去磷酸化某些蛋白激酶或磷脂,使细胞周期的进展受到抑制,介导细胞凋亡,而且调控细胞黏附、迁移、增殖和分化[3]。PTEN发挥抑癌作用的途径包括:PI3K途径、MAPK途径和FAK途径。PTEN基因在多种肿瘤组织中表达缺失,已经被许多研究证实, 如非小细胞肺癌、 乳腺癌、大肠癌、 卵巢癌、 子宫内膜癌、 星形细胞瘤[4~7 ]。 张伟峰等[8]研究表明性别、年龄、肿瘤大小对于PTEN的表达无相关性,但是与肿瘤的分化程度呈正相关;还发现肿瘤的临床分期、浸润深度以及淋巴结转移与PTEN的表达呈负相关。HIF是细胞适应缺氧环境因子的主要调节剂。 缺氧是肿瘤微环境的特征。调控细胞耐受缺氧环境的调控因子对于肿瘤细胞的生长必不可少,并且促进肿瘤细胞的生长和转移。已证实,在多种细胞中广泛存在HIF-1,激活后直接或间接作用于多种下游基因,参与在缺氧环境下细胞的生存、 增殖、 凋亡及多种代谢,促进新生血管的形成,并且与肿瘤耐药等关系密切。在肿瘤组织中,PTEN基因的
缺失促进了癌基因的高表达, 从而加速肿瘤组织生长;HIF-1α可防止肿瘤细胞在生长过程中的凋亡,HIF-1α的高表达使肿瘤细胞耐缺氧的能力得到增强,因此肿瘤细胞可以继续的分化、 增殖,危害人体健康,PTEN的低表达与HIF-1α的高表达共同促进了肿瘤的生长、 转移。HIF-1α的表达和活性受到PTEN调控,通过抑制PI3K-AKT-FARP途径阻断HIF-1α蛋白的表达和转录活性。当PTEN基因发生突变或缺失,HIF-1α蛋白的表达和转录活性受到影响。前列腺癌的血管生成,是由于PTEN功能丧失,诱导表达HIF一1alpha相关; 导入野生型PTEN的前列腺癌细胞株PC3, 不仅HIF-1α蛋白的表达被明显抑制,而且VEGF的活性也被抑制,从而使血管形成也受到抑制[9 ]。
在本次研究中证实,在所有食管鳞癌病例组织中,PTEN与HIF-1α基因的表达与肿瘤的分期相关性显著,说明这两种蛋白的表达情况可能对食管鳞状细胞癌的治疗效果及预后有重要的影响。在基因靶向治疗、抗癌新药研发等方面,提供新的选择方向和理论基础。
[1]蔡平,方丹青,梁建辉,等.胸腔镜辅助下与开放式食管癌根治术的综合临床效果比较[J].中国医疗前沿,2012,7(21):48-49
[2]YUED,FANQ,CHENX,etal.EpigeneticinactivationofSPINT2isassociatedwithtumorsuppressivefunctioninesaphagealsquamouscellcarcinoma[J].ExpCellRes,2014,322(1):149C158
[3]徐丽超,吴英杰.子宫内膜样腺癌中PTEN、MDM2 表达及临床意义[J]. 黑龙江医药科学,2015 , 38(3):119
[4]GoelA,ArnoldCN,NiedzwieckiD,etal.FrequentinactivationofPTENbypromoterhypermethylatoninmicrosatelliteinstability-highsporadiccolorectalcancers[J].CancerRes, 2004,64(9):3014-3021
[5]BaezaN,WellerM,YonekawaY,etal.PTENmethylationandexpressiongloblastomas[J].ActaNenropathol(Berl) ,2003,106(5):479-485
[6]YuJ,ZhangH,GuJ,etal.Methylationprofilesofthirtyfourpromoter-CpGislandsandconcordantmethylationbehavioursofsixteengenesthatmaycontributetocarcinogenesisofastro-cytoma[J].BMCCancer,2004,4(1):65-79
[7]SchondorfT,EbertMP,HoffmannJ,etal.HypermethylationofthePTENGeneinovariancancercelllines[J].CancerLett,2004,207(2):215-220
[8]张伟峰,杨维良,王夫景,等.PTEN基因在胃癌中的表达及其意义[J]. 中华实验外科杂志,2003,20(5):468-469
[9]ZhongH,ChilesK,FeldserD,etal.Modulationofhypoxia-induciblefactor1alphaexpressionbytheepidermalgrowthfactor/phosphatidylinositol3-kinase/PTEN/AKT/FRAPpathwayinhumanprostatecancercells:implicationsfortumorangiogenesisandtherapeutics[J].CancerRes,2000,60(6):1541-1545
佳木斯大学面上项目,编号:S2011-036。
窦鹏挥(1976~)男,黑龙江佳木斯人,硕士,副主任医师。
R
A
1008-0104(2017)01-0067-02
2016-11-18)
