2型糖尿病大鼠阴茎组织GSH与iNOS相关性研究①
2017-03-30胡存利桂士良陈大印杜从林曹会峰
马 龙,胡存利 ,桂士良,陈大印, 程 亮,杜从林, 曹会峰
(佳木斯大学附属第一医院泌尿外科,黑龙江 佳木斯 154003)
2型糖尿病大鼠阴茎组织GSH与iNOS相关性研究①
马 龙,胡存利 ,桂士良,陈大印, 程 亮,杜从林, 曹会峰
(佳木斯大学附属第一医院泌尿外科,黑龙江 佳木斯 154003)
目的:探究2型糖尿病大鼠阴茎组织GSH及iNOS表达变化及其相关性。方法:30只SD健康雄性大鼠,随机抽取20只大鼠作为糖尿病组(DM组),高脂高糖饮食4周后腹腔小剂量注射链脲佐菌素建立2型糖尿病模型,剩余10只多为正常对照组(Control组)。继续喂养4周后行APO试验,测定阴茎海绵体内压;采集阴茎组织,测定GSH含量,用蛋白印迹法、免疫组织化学法检测iNOS的表达及含量。结果:DM组大鼠勃起功能普遍降低;DM组大鼠阴茎组织中GSH含量明显低于Control组(P<0.05);蛋白印迹及免疫组织化学法检测发现DM组大鼠阴茎组织中iNOS含量高于Control组(P<0.05);Pearson相关分析显示,GSH与iNOS表达水平呈负相关(r=-0.796,P<0.05)。结论:糖尿病大鼠阴茎组织中GSH含量下降,iNOS表达升高,并且两者呈负相关,共同参与糖尿病阴茎勃起功能障碍的发病机制。
2型糖尿病;GSH;iNOS
勃起功能障碍(erectiledysfunction,ED)是糖尿病(diabetesmellitus,DM)的常见并发症,并且随着DM的病程延长而逐渐增加;据研究显示,糖尿病性勃起功能障碍(diabetesmellituserectiledysfunction,DMED)的发病率高达57%,10年以上DM病史者,就有50%患者并发ED,但DMED的具体机制并未明确[1,2]。本研究建立2型糖尿病大鼠病理模型,检测大鼠勃起功能变化,同时测定阴茎组织中的GSH和iNOS,探究二者在糖尿病发病过程中的变化、关系以及与DMED发病机制的联系。
1 材料和方法
1.1 材料和试剂
链脲佐菌素(streptorotocin,STZ,Sigma公司),阿扑吗啡(apomorphine,APO,Sigma公司),血糖仪及试纸(三诺生物技术传感股份有限公司),GSH检测试剂盒(上海碧云天生物技术有限公司),兔抗大鼠iNOSIgG(SantaCruzBiotechnology公司),HRP标记的鼠抗兔IgG(SantaCruzBiotechnology公司),BCA蛋白浓度测定试剂盒(增强型)(上海碧云天生物技术有限公司),bio-tek多功能酶标仪(美国Biotek公司),iNOS生物素-链霉卵白素免疫组化检测试剂盒(北京中杉金桥生物技术有限公司),Pclab-UE生物医学信号采集系统。
1.2 实验动物及糖尿病建模
8周龄健康SD雄性大鼠30只(哈尔滨医科大学动物实验中心),体重(233±12)g。所有大鼠充足饮水,室温(26±2)℃,湿度(60±5)%,半天光照,半天黑暗。高脂高糖饲料(配方:5%蔗糖+10%猪油+1.5%胆固醇,由江苏省协同医药生物工程有限公司配制)饮食喂养4周后小剂量腹腔注射链脲佐菌素(40mg/kg)。注射3d后测血糖,未成模者半剂量追加给药。以血糖大于16.7mmol/L为建模成功。
1.3APO实验
暗室适应10min,颈项部皮肤松软处注射APO(浓度40μg/mL),剂量100μg/kg,观察30min内大鼠阴茎勃起次数。以龟头充血及阴茎体增长为勃起1次。每组阴茎勃起者所占百分比为该组阴茎勃起率。
1.4 海绵体内压测定
用10%的水合氯醛(0.35mL/100g)腹腔注射麻醉,仰卧固定在解剖板上。于大鼠下腹部做一正中切口,并小心剥离出阴茎海绵体神经。游离坐骨海绵肌,暴露阴茎脚,用充满肝素的头皮针穿刺阴茎海绵体,测定海绵体内压。设置参数(刺激电压5V,频率15Hz,波幅5ms,持续时间50s)。
1.5 采集标本并测定阴茎组织中GSH含量
大鼠处死后,采集阴茎组织,去掉龟头、白膜,并用PBS液漂洗,去除组织中的血液,液氮下研磨阴茎组织后测定GSH含量。
1.6 蛋白印迹法测定阴茎组织中eNOS含量
阴茎组织称重后,液氮下充分研磨。BCA法测定蛋白浓度。制备浓缩胶、分离胶,上样,电泳,转膜,封闭,一抗(1:500稀释)孵育过夜,二抗(1:5000稀释)孵育,显色曝光,扫描胶片,结果以eNOS/β-actin进行分析。
1.7 免疫组化法定位定量测定阴茎组织中eNOS含量
阴茎组织固定,包埋,石蜡切片,行SP法组织染色,显微镜下观察eNOS的表达分布。
1.8 统计学方法
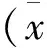
2 结果
2.1 大鼠一般情况
糖尿病组大鼠造模期间因低血糖死亡8只,对照组大鼠未有死亡。12只大鼠血糖持续大于16.7mmol/L,造模成功。成模后大鼠逐渐出现糖尿病典型的“三多一少”症状,随着病情的进展,DM大鼠逐渐表现出毛色干枯萎黄、体重下降、反应迟钝等现象。
2.2 两组大鼠体重、血糖、ICPmax/MAP和阴茎组织GSH水平的比较
实验结果显示,DM组大鼠的体重、血糖明显高于Control组大鼠;DM组大鼠ICPmax/MAP值、GSH含量明显低于Control组。
2.3 蛋白印迹、免疫组化测定阴茎组织中的iNOS
Westernblot法检测阴茎组织iNOS显示,DM组大鼠阴茎组织中iNOS表达较Control组增加(P<0.05);免疫组织化学结果进一步显示iNOS表达明显升高,并主要表达于血管内皮细胞,平滑肌组织细胞亦有表达。见图1。
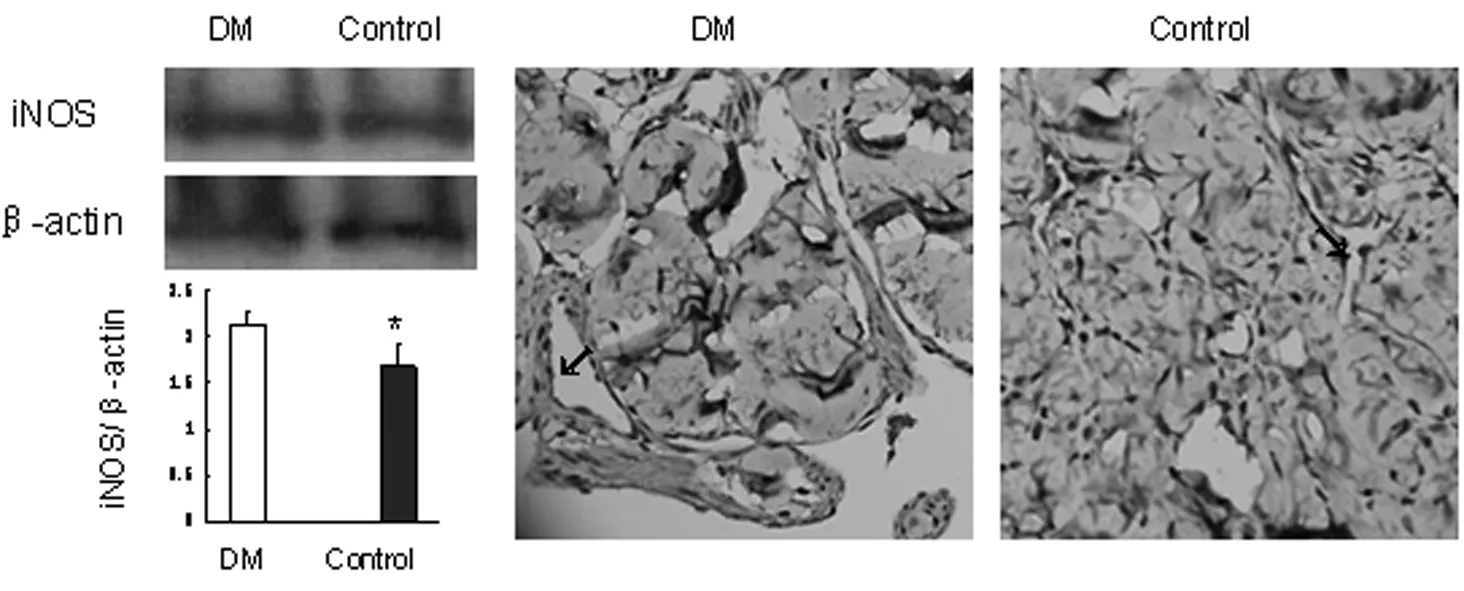
图1 各组应用Western blotting和免疫组化法分析阴茎组织中iNOS含量比较及其分布(×400)
2.4GSH含量与iNOS表达水平的相关性分析
Pearson相关分析结果显示,DM组大鼠阴茎组织GSH含量显著降低;而iNOS累计光密度值(2.13±0.15)明显高于正常大鼠(1.68±0.25)(P<0.05),且GSH含量与iNOS表达水平呈负相关(r= -0.796,P=0.02)。见图2。
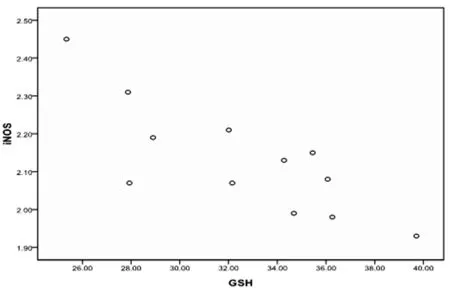
图2 阴茎组织中GSH含量与iNOS表达水平相关性分析及散点图(r= -0.796,P<0.05)
3 讨论
近期流行病学调查显示东南亚国家糖尿病的发病率为37.5%[3],中国人群肥胖和糖尿病的发病率逐年增高,并且日趋年轻化,据统计80%的糖尿病伴有肥胖症。
人体中一氧化氮合酶(NOS)存在三种亚型:神经型一氧化氮合酶(neuronalNOS,nNOS)、内皮型一氧化氮合酶(endothelialNOS,eNOS)和诱导型一氧化氮合酶(inducibleNOS,iNOS)[4]。iNOS是钙离子和钙调蛋白非依赖性酶,其激活不需要Ca2+浓度的升高,正常状况下,细胞不表达iNOS。本研究结果显示,糖尿病组大鼠勃起功能较对照组明显下降,这与之前相关报道相符。糖尿病大鼠阴茎组织中GSH含量与正常组大鼠比较显著下降(P<0.05);而糖尿病大鼠阴茎组织中的iNOS含量较正常对照组明显升高(P<0.05)。二者行相关性分析显示呈负相关(r= -0.796,P<0.05)。长期的高血糖状态,导致机体的炎症反应,诱导iNOS的高表达,有研究显示iNOS在2型糖尿病血管病变中起着重要作用,证实iNOS与胰岛素抵抗(IR)关系密切[5,6]。糖尿病患者,高血糖使还原型尼克酰胺腺嘌呤二核苷酸磷酸(NADPH)大量消耗,导致氧化型谷胱甘肽转换呈还原型谷胱甘肽受阻,GSH生成不足,氧化还原平衡打破,使糖尿病患者体内氧自由基大量积累。而糖尿病慢性炎症使iNOS生成持续增加,致使NO过量,与活性氧产生有细胞毒性的过氧亚硝酸盐,最终导致糖尿病性勃起功能障碍。
业已证实氧化应激是导致糖尿病性勃起功能障碍重要因素,而持续的高血糖和低水平的GSH确是最终导致机体氧化应激罪魁祸首[7]。在众多的抗氧化剂中,还原型谷胱甘肽(reducedglutathione,GSH)是最重要的抗氧化剂,是保持细胞内氧化还原状态和蛋白质功能完整性的重要物质。GSH还与多种生理过程相关,如脱氧核苷酸的合成和调节、白三烯和前列腺素的代谢、半胱氨酸的储存和转运等。研究发现当血糖升高时,活性氧簇(reactiveoxygenspecies,ROS)生成明显增加,同时机体的自由基清除酶和抗氧剂的水平降低,致使O2-过量积累,O2-可以抑制eNOS的活性[8],同时O2-同激活转录因子核因子NFB,使iNOS表达增加[9]。激活后的iNOS持续催化生成NO,其结果是内皮细胞NO大量积累,直至底物耗竭或细胞死亡,最终导致血管内皮损伤[10]。此外NO与ROS反应生成更强的氧化剂过氧亚硝酸阴离子(Peroxynitrite,ONOO-),能够氧化包括糖类、蛋白质、脂类等多种物质,使DNA遭到破坏,导致细胞死亡[11]。
由此可知GSH水平、iNOS的表达共同参与DMED的发病机制,但GSH是否是DMED的始动因素,还有待进一步深入研究。针对升高GSH的水平,并阻断iNOS的持续表达药剂研制,将会是DMED的治疗新途径。
[1]MekhtievTV.Stress,anxiety,depressionanderectiledysfunctioninpatientswithdiabetesmellitus[J].GeorgianMedNews, 2013, (220-221):77-81
[2]张立海,王娇,陈福军,等. 去乙酰化胃肠素联合G-CSF及bFGF促进糖尿病大鼠缺血后知血管新生的研究[J]. 黑龙江医药科学,2015, 38(2):19-22
[3]KharroubiAt,DarwishAM.Diabetesmellitus:Theepidemicofthecentury[J].WorldJDiabetes, 2015, 6(6):850-867
[4]SuzukiE,NishimatsuH,ObaS,etal.Chronickidneydiseaseanderectiledysfunction[J].WorldJNephrol, 2014, 3(4):220-229
[5]SoskiSS,DobutoviBD,SudarEM,etal.RegulationofInducibleNitricOxideSynthase(iNOS)anditsPotentialRoleinInsulinResistance,DiabetesandHeartFailure[J].OpenCardiovascularMedicineJournal, 2011, 5(1): 153-163
[6]RaymondMK,JosephAH,WilliamEK,etal.Obesity,insulinresistance,andskeletalmusclenitricoxidesynthase[J].JApplPhysiol,2012,113(5):758-765
[7]SekharRV,McKaySV,PatelSG,etal.GlutathioneSynthesisisDiminishedinPatientswithUncontrolledDiabetesandRestoredbyDietarySupplementationwithCysteineandGlycine[J].DiabetesCare, 2011, 34(1):162-167
[8]ChenCA,PascaliFD,BasyeA,etal.RedoxModulationofeNOSbyGlutaredoxin-1throughReversibleOxidativePost-translationalModification[J].Biochemistry, 2013, 52(38):1-31
[9]张志慧,曹会峰. 非高脂血症状态下不同月龄大鼠阴茎海绵体内NOS与NF-ΚB表达的相关性研究[J]. 黑龙江医药科学, 2014,37(6):20-23
[10]Jameson,SchlinzigT,KronhnK,etal.PrinciplesofMolecularMedicineNO[M].America:HumanaPress,2013:167-169
[11]TangvarasitichaiS.Oxidativestress,insulinresistance,dyslipidemiaandtype2diabetesmellitus[J].WorldJDiabetes, 2015,6(3):456-480
.
The correlation analysis of GSH and iNOS in penile tissue of type-2 diabetes mellitus
MALong,HUCun-li,GUIShi-liang,CHENDa-yin,CHENGJiang,DUCong-lin,CAOHui-feng
(Department of Urology, the First Hospital Affiliated to Jiamusi University, Jiamusi 154003, China)
Objective: To research the changes of the expressions of GSH and inducible nitric oxide synthase (iNOS) in penile tissue of type-2 diabetes mellitus rats as well as the correlation of the expression levels of GSH and iNOS. Methods: 20 rats were selected randomly from 30 healthy male Sprague Dawley (SD) rats aged 8 weeks into the diabetic model group (DM group), which were raised with high calorie and high sugar diet for 4 weeks. The rest of rats were divided into the control group (Control group). After 4 weeks penile erections, the rats were observed in order to evaluate their erectile function. All rats were killed for measurement of the maximal intracavernous pressure/mean arterial blood pressure(ICPmax/MAP)by electrostmulation. The determination of the GSH in penile tissue were detected. The expression of iNOS in the penile corpus cavernosum was detected by Immunohistochemistry and Western blot. Results: The erectile functions of the rats in DM group declined compared with control group, and the GSH expression level decreased in penile tissue of DM model rats(P<0.05).TheexpressionofiNOSincreasedinpeniletissueofDMrats(P<0.05).PearsoncorrelationanalysisshowedtherewasanegativerelationshipofthedensityofGSHwiththeexpressionlevelofiNOS(r= -0.796,P<0.05). Conclusion: When the expression of GSH decreased, the expression of iNOS goes higher. They are negatively correlated. The negative relationships is an important pathological mechanism in diabetes mellitus induced erectile dysfunction.
type2 diabetes mellitus;GSH; iNOS
1.黑龙江省自然科学基金项目,编号:H2015073;2.黑龙江省教育厅科学研究项目,编号:12521542;3.佳木斯大学科学技术重点项目,编号:2013-005。
马龙(1985~)男,山东临沂人,在读硕士研究生。
曹会峰(1967~)男,黑龙江佳木斯人,硕士,副教授,硕士研究生导师。E-mail: 13845451056@163.com。
R
A
1008-0104(2017)01-0017-03
2015-12-04)
