益生菌联合美沙拉嗪对大鼠溃疡性结肠炎Claudin-1及TLR4的影响①
2017-03-30许海英
许海英,颜 玉,姜 威,陈 刚
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
益生菌联合美沙拉嗪对大鼠溃疡性结肠炎Claudin-1及TLR4的影响①
许海英,颜 玉,姜 威,陈 刚
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
目的:观察益生菌对溃疡性结肠炎大鼠肠组织中Claudin-1及TLR4的影响。方法:将SD大鼠32只随机分为对照组、模型组、美沙拉嗪组、联合治疗组。对照组自由饮水7d,模型组及其他各组给予自由饮用5%的葡聚糖硫酸钠溶液(DSS)7d以制备UC模型。后各组给予相应干预措施,7d后处死各组大鼠,HE染色观察结肠组织改变,应用免疫组化的方法观察各组大鼠肠组织中Claudin-1及TLR4的表达情况。结果:美沙拉嗪组TLR4的阳性细胞表达率低于模型组,而Claudin-1表达则高于模型组,差异有显著性(P<0.05)。联合治疗组Claudin-1及TLR4的阳性细胞表达率与美沙拉嗪组相比,差异有统计学意义(P<0.05),与对照组相比,差异有意义(P< 0.05)。结论:美沙拉嗪联合益生菌有抑制TLR4的表达和促进Claudin-1表达的作用,较单独应用美沙拉嗪效果更佳。
溃疡性结肠炎;益生菌;Claudin-1;TLR4
溃疡性结肠炎(UlcerativeColitis,UC)是一种病因尚不明确的主要限于结肠黏膜与黏膜下层的非特异性炎症性肠病,呈连续性弥漫性分布。主要表现为反复发作的腹泻、黏液脓血便及腹痛症状,病程呈慢性经过,发作与缓解交替,少数症状持续并逐渐加重。以往西方等发达国家和地区发病率相对较高,但随着我国经济发展及饮食结构的变化,近年来该病发病率也在日益增高[1]。TLR4 /NF-kB信号转导通路是目前发现的重要的炎性通路之一,TLR4 /NF-kB信号通路主要经过髓样分化因子88 (myeloiddiffereniationfactor88,MyD88)依赖的信号通路及MyD88非依赖的信号通路激活NF-kB, 转入细胞核中,激活炎症因子引起炎症反应[2]。claudins蛋白为肠黏膜上皮细胞紧密连接的重要组成部分,对维持肠黏膜屏障机械结构完整和正常功能发挥起重要作用。Claudin-1属于紧密连接蛋白claudins家族,是构成紧密连接的主要骨架蛋白之一,Claudin-1蛋白的表达异常可引起黏膜屏障功能紊乱,导致紧密连接功能失调和组织渗透性的增加[3]。有专家发现UC患者肠道中有益菌群和有害菌群比例严重失衡,菌群紊乱在UC的发病过程扮演重要角色[4],近年来,益生菌在UC的治疗中越来越受到视,但其机制尚不明确,本研究通过应用美常安联合美沙拉嗪治疗DSS诱导UC大鼠模型,通过检测Claudin-1及TLR4在结肠黏膜上的表达以探讨其可能的作用机制,为临床应用益生菌治疗UC提供帮助。
1 材料与方法
1.1 试验动物
健康清洁级6~8周龄,雄性SD大鼠32只,体质量200~230g,由佳木斯大学动物实验中心提供。分为对照组、模型组、美沙拉嗪组、联合治疗组。
1.2 材料和仪器
葡聚糖硫酸钠DSS(Sigma公司),美沙拉嗪肠溶片(佳木斯鹿灵制药公司),枯草杆菌二联活菌肠溶胶囊(美常安)(北京韩美公司),Claudin-1、TLR4抗兔抗体(武汉博士德公司)。
1.3 方法
1.3.1 动物模型制备
SD大鼠适应环境一周后,随机抽取8只作为空白对照组,给予自由饮水,对其余大鼠参照Cooper等[5]的方法自由饮用5%的葡聚糖硫酸钠溶液(DSS)7d,以制备溃疡性结肠炎模型,造模后对照组及模型组给予等渗生理盐水1mL/d灌胃,美沙拉嗪组给予美沙拉嗪0.4kg-1·d-1溶于2mL生理盐水中灌胃,联合治疗组给予美沙拉嗪0.4kg-1·d-1溶于2mL生理盐水及美常安0.15kg-1·d-1溶于2mL生理盐水中灌胃,观察大鼠精神状态,饮食、大便情况,体重变化。用药7d后,禁食24h,麻醉处死大鼠,剃毛,75%酒精浸泡5min,剖腹,分离结肠,取结肠病变组织将其连续切成1cm长度的肠段,置于4%多聚甲醛进行组织固定,后组织块常规石蜡包埋,连续切片(4μm),HE染色,光学显微镜下观察组织形态学变化。
1.3.2Claudin-1及TLR4免疫组织化学染色
免疫组织化学法检测结肠组织内Claudin-1及TLR4,具体操作步骤严格按照试剂说明书进行。采用图像分析软件进行免疫组织化学图片分析,并对OD值进行数据分析。
1.4 统计学方法
采用SPSS17.0统计软件进行数据处理。各组资料以表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠一般状态
对照组大鼠精神状态佳,常嬉戏打闹,进食如常,毛发顺滑、光泽,排便正常,体重增加。模型组大鼠精神萎靡、进食量减少,毛发暗淡无光泽、伴有稀便、血便,体重较前下降,美沙拉嗪组大鼠随用药时间的增加精神状态较前恢复,毛发欠光泽,活动及进食增加,未见血便,体重稍有增加。联合治疗组大鼠症状好转,未见血便。
2.2 肉眼观察
对照组大鼠结肠黏膜光滑,未见充血、水肿。模型组大鼠结肠炎症病变部位肠管增粗,肠道与周围组织黏连明显,多发溃疡,充血水肿现象严重,甚至出现腹水。美沙拉嗪组病变部位肠黏膜存在充血、水肿、糜烂及溃疡形成,但较模型组明显好转。联合治疗组肠道病变减轻,部分存在充血、水肿,糜烂、浅溃疡。
2.3HE染色
对照组大鼠结肠黏膜完整,腺体排列整齐、杯状细胞无减少。

图1 模型组大鼠结肠病变主要累及黏膜层及黏膜下层,可见腺体大量破坏,排列极其紊乱,杯状细胞减少,大量的炎性细胞浸润,大量纤维素样渗出(HE×100)
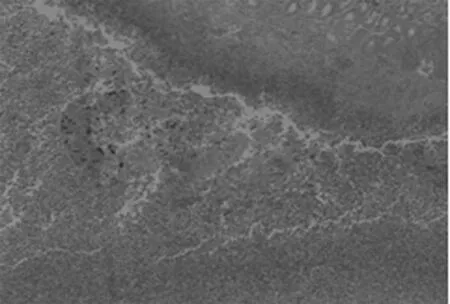
图2 美沙拉嗪组可见黏膜下层炎性细胞浸润程度减轻,腺体排列不齐,少量纤维素样渗出(HE×100)
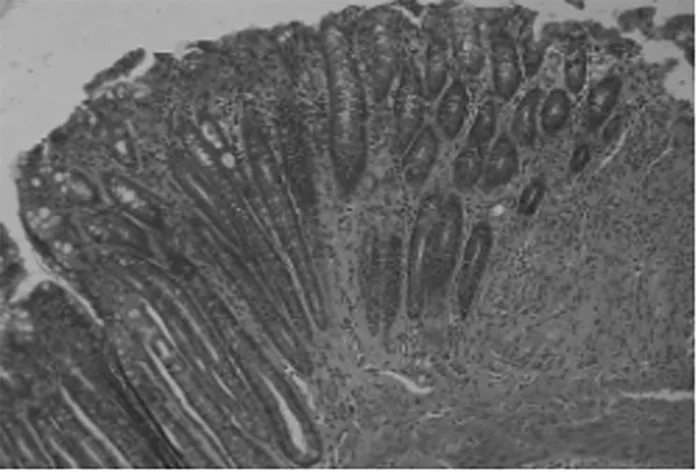
图3 联合治疗组可见少量炎性细胞浸润,黏膜层及黏膜下层仍存有腺体破坏,黏膜下层可见肉芽组织增生(HE×100)
2.4 免疫组织化学染色
Claudin-1主要存在于肠上皮紧密连接的细胞膜上,为棕黄色染色颗粒。对照组大鼠肠道黏膜内可见棕黄色颗粒沉着,模型组大鼠肠道黏膜内很少见到棕黄色颗粒沉着,美沙拉嗪组可见到棕黄色颗粒沉着,但相对正常组较少,联合治疗组可见较多棕黄色颗粒沉着。
TLR4在各组肠道黏膜内均有表达。对照组大鼠肠道黏膜层内可见少许棕色颗粒沉着,与对照组比较,模型组大鼠腺体消失,可见多处棕色颗粒沉着,美沙拉嗪组黏膜里棕色颗粒沉着较多,但比模型组少。联合治疗组黏膜内棕色颗粒可见,但相对较少,黏膜炎症较前减轻。
美沙拉嗪组TLR4的阳性细胞表达率低于模型组,而Claudin-1表达则高于模型组,差异有显著性(P<0.05)。联合治疗组Claudin-1及TLR4的阳性细胞表达率与美沙拉嗪组相比,差异有统计学意义(P<0.05),与对照组相比,差异有意义(P<0.05),见表1。
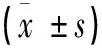
表1 结肠组织免疫组化Claudin-1及TLR4的OD值
注:与对照组比较*P<0.05,与模型组比较#P<0.05,与美沙拉嗪组比较&P<0.05,n为各组大鼠数量,其中模型组大鼠死亡一只。
3 讨论
UC的发病机制尚不明确,可能与遗传、环境及免疫失调等因素有关。近年来研究表明肠道黏膜免疫系统紊乱及黏膜屏障破坏均参与UC的病情发展。TLR4为Toll样受体家族中的成员,其在正常结肠上皮细胞中呈低表达,从而降低对肠道中细菌脂多糖的识别,而在UC的结肠中呈高表达,对细菌脂多糖呈现异常识别[6],后经下游转导通路最终使NF-kB转入核内,释放促炎症因子,介导肠道黏膜的天然免疫反应,进而扩大炎症反应。谭芳等研究表明TLR4mAb抑制了大鼠UC模型TLR4 信号通路下游级联反应对TLR4的正反馈作用,阻止了恶性循环,使TLR4及炎症因子的表达下降,有助于控制肠道炎症[7]。姜威等研究也表明TNBS诱导大鼠UC模型结肠组织的TLR2、TLR4、NF-kBmRNA和蛋白水平较对照组明显升高[8]。肠道黏膜屏障可以抵御内、外源性微生物侵入体内,其中机械屏障起重要作用,claudins蛋白为肠道上皮结构重要组成部分,肠道上皮结构的完整可以维持肠上皮细胞极性和调节肠黏膜屏障的完整性,阻止有害物质侵入机体。Claudin-1为claudins蛋白家族中的一种,其在正常肠道黏膜中呈均匀分布,而在UC中表达则不同程度减少。研究发现在炎性反应性肠病活动期结肠黏膜固有层中,Claudin-1及其mRNA表达显著降低,肠上皮通透性增加[3]。近年来人们对UC肠道内环境的研究越来越受到重视,有研究表明UC患者肠道菌群紊乱,有益菌减少而有害菌群比例上升,因此益生菌作为一种新的治疗UC的方法越来越多的被学者们进行研究。虽然没有确定具体的细菌与IBD的关系 ,但越来越多的证据表明,破坏道细菌和宿主防御机制中的黏膜(生态失调)的动态平衡可能触发这种炎症反应。慢性炎症可导致细菌成分的渗透引起肠道屏障损伤[9]。本实验通过应用美沙拉嗪联合益生菌治疗DSS诱导UC大鼠模型,可有效减少大鼠排便次数,肠道黏膜充血、水肿症状较模型组减轻,肠道组织TLR4表达较对照组表达升高,Claudin-1表达较对照组减少但较单独应用美沙拉嗪有所增加,差异有统计学意义,考虑肠道黏膜屏障功能有所恢复,而联合用药治疗效果更明显。美常安可能通过调节免疫应答反应及修复肠道黏膜屏障来治疗UC,但具体作用机制还需进一步研究及探讨。
[1]冉志华,刘文忠.炎症性肠病[M].北京: 人民卫生出版社,2009
[2]谢晶日,张冰.Toll样受体4与溃疡性结肠炎相关性研究[J]. 中华中医药学刊,2012,30(7):1452-1454
[3]马军宏,于向阳.紧密连接蛋白与肠黏膜屏障损伤研究进[J].中国中西医结合外科杂志,2015,21(1):104
[4]AbdinAA,SaeidEM.AnexperimentalstudyonulcerativecolitisasapotentialtargetforprobiotictherapybyLactobacillusacidophiluswithorwithout"olsalazine"[J].JCrohn's&colitis,2008,2: 296
[5]CooperHS,Murthysn,ShahrS,etal.ClinicopathologicstudyofdextransulfateSodiumexperimentalmurinecolitis[J].LaboratoryInvestigation;aJournalofTechnicalMethodsandPathology,1993,69(2):238-249
[6]SinghJC,CruickshankSM,NewtonDJ,etal.Toll-likereceptor-mediatedresponsesofprimaryintestinalepithelialcellsduringthedevelopmentofcolitis[J].AmJPhysiolGastrointestLiverPhysiol,2005,288:514-524
[7]谭芳,高鸿亮.TLR4mAb对急性溃疡性结肠炎模型大鼠TLR4、TNF-α、IL-1β表达的影响[J]. 现代生物医学进展,2015,15(14):2629-2632
[8]姜威,颜玉. 溃疡性结肠炎Toll样受体表达和NF-kB变化及益生菌的作用研究[J]. 黑龙江医药科学,2013,36(5):34-35
[9]KatalinMüllner,PálMiheller.ProbioticsintheManagementofCrohn'sdiseaseandUlcerativeColitis[J].CurrentPharmaceuticalDesign,2014,20:4556-4560
佳木斯大学研究生科技创新项目,编号:LM2015_019。
许海英(1990~)女,黑龙江大庆人,在读硕士研究生。
颜玉(1963~)女,黑龙江佳木斯人,硕士,主任医师,硕士研究生导师。E-mail:jmsyanyu1963@163.com。
R
A
1008-0104(2017)01-0060-03
2016-03-04)
