COPD患者血清中IL-37水平变化及临床意义①
2017-03-30梁姗姗鲍文华孙云晖
徐 珍,梁姗姗,刘 甡,鲍文华,孙云晖
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
COPD患者血清中IL-37水平变化及临床意义①
徐 珍,梁姗姗,刘 甡,鲍文华,孙云晖
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
目的:检测IL-37在慢性阻塞性肺疾病(chronic obstructive pulmonary diseases ,COPD)患者外周血清中的水平变化,探讨其临床意义。方法:随机收集60例经临床规范治疗恢复到稳定期的AECOPD患者。30例年龄、性别匹配的健康志愿者作为本研究的对照组。血清中的IL-37水平以ELISA方法检测。结果:①与健康对照组相比,AECOPD组血清IL-37、白细胞(WBC)、中性粒细胞百分比(N%)、二氧化碳分压(PaCO2)含量明显增高, 氧分压(PaO2)、FEV1占预计值的百分比(FEV1%pred)含量明显降低,差异有统计学意义(P<0.05)。②与COPD稳定期组相比,AECOPD患者血清IL-37含量明显增高,差异有统计学意义(P<0.05)。③与健康对照组相比,COPD稳定期组IL-37、WBC含量明显增高,PaO2含量明显降低,差异有统计学意义(P<0.05)。④IL-37与FEV1%pred在AECOPD组及COPD稳定期呈现显著的正相关。结论:IL-37可能参与COPD的发生和发展,且检测IL-37有可能成为COPD疗效评估的指标。
慢性阻塞性肺疾病(COPD);IL-37
慢性阻塞性肺疾病(chronicobstructivepulmonarydiseases,COPD)是以不完全可逆的气流受限为特征的慢性疾病[1]。COPD急性加重(acuteexacerbationofchronicobstructivepulmonarydisease,AECOPD)即患者在疾病的发展过程中短期内出现咳嗽、咳黄脓痰或黏液性痰、胸闷气短症状加重 ,伴或不伴发热等炎症明显加重的表现。然而COPD的发病机制尚未完全清楚,故对COPD发病机制的研究显得尤为重要。
白细胞介素-37(IL-37)不仅是一种新型的炎性抑制因子,亦是一种固有炎症反应以及免疫应答的抑制剂[2]。目前多种研究发现IL-37参与炎性反应和免疫类疾病的发病过程,主要是通过抑制促炎性细胞因子、趋化因子等的产生和对基因转录的调节。据报道白介素6(IL-6)[3]、白介素8(IL-8)[4]、白介素18(IL-18)[5]、肿瘤坏死因子-α(TNF-α)、转化生长因子(TGF-β)[6]、树突状细胞(DC)等都参与COPD的发病机制,而IL-37与这几种细胞因子均有联系。在多种疾病中IL-37起到保护作用,但与COPD的关系,目前研究较少。所以,通过检测IL-37及其他相关因子在COPD血清中的水平变化,探讨IL-37在COPD中的作用机制,为评估其疗效提供新的理论依据。
1 资料与方法
1.1 研究对象
1.1.1AECOPD组:选取2014-11~2015-06期间,在佳木斯大学附属第一医院入住呼吸内科的经临床规范化治疗恢复到稳定期的COPD急性加重患者60例,男43例,女17例,平均年龄(61.9±8.6)岁。所有病例均符合2013年中华医学会呼吸病学分会《慢性阻塞性肺疾病诊治指南》的标准。排除标准:(l)近1年内吸烟者;(2)结缔组织病或风湿性疾病者;(3)有严重的其他系统疾病者;(4)不能知情同意者。COPD稳定期组:AECOPD组患者经规范化治疗两周后,主要症状稳定或好转,病情基本恢复到急性加重前的状态。
1.1.2 健康对照组:选取同期来我院行体检的健康成人30例,男18例,女12例,平均年龄(63.83±9.05)岁。两组在年龄、性别等方面差异无统计学意义。入选标准: 非吸烟者,并排除心、肺、肝、肾及其他慢性疾病。所有研究对象均获知情同意。
1.2 方法
1.2.1 标本采集:分别于晨起空腹状态下抽取AECOPD患者治疗前、后及健康对照组的静脉血5mL,3000r/min行15min高速离心后,取上清液置EP管中,于-80℃冰箱保存待测。WBC、N%、PaO2、PaCO2、FEV1%pred分别由佳木斯大学附属第一医院相关科室当日同步测定。
1.2.2 试剂及仪器:IL-37ELISA试剂盒购于上海劲马实验设备有限公司。产品批号:201508。
1.2.3 检测:采用酶联免疫吸附试验(ELISA)法检测AECOPD组、COPD稳定组(治疗前后)120例及健康对照组30例血清IL-37水平,操作步骤严格按照产品说明书进行。
1.3 统计学方法
采用SPSS17.0软件包分析,经检测各组数据均符合正态分布,计量资料以均数±标准差表示。治疗前、后比较采用配对t检验,两组间比较采用两独立样本t检验,两变量间的相关性分析采用Pearson直线相关性分析方法。以P<0.05为差异有统计学意义。
2 结果
2.1 与健康组相比,AECOPD患者血清中IL-37水平明显升高,差异有统计学意义(P<0.05)。而WBC(109/L)、N(%)、PaCO2(mmHg)在AECOPD组的表达水平同样高于健康对照组(P<0.05),PaO2(mmHg)、FEV1%pred在AECOPD组的表达水平低于健康对照组(P<0.05),见表1。
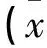
表1 AECOPD组IL-37及其他相关因子水平与健康对照组比较±s)
与健康对照组比较,t(IL-37)=-24.058,*P<0.05。
2.2COPD稳定期组患者血清IL-37较AECOPD组明显降低,差异有统计学意义(P<0.05)。见表2。
2.3COPD稳定期组血清IL-37水平低于健康对照组,差异有统计学意义(P<0.05)。见表3。
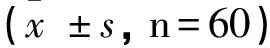
表2 AECOPD组血清IL-37水平与治疗后COPD稳定期组比较
与AECOPD组比较,t(IL-37)=21.33;@P<0.05。

表3 COPD稳定期组IL-37及其他相关因子水平与健康对照组比较
与健康对照组比较,t(IL-37)=-4.652,#P<0.05。
2.4 血清IL-37水平与N%、FEV1%pred的相关性分析。见表4。

表4 血清IL-37水平与N%、FEV1%pred的相关性分析
3 讨论
慢性阻塞性肺疾病(COPD)的发病中心环节为气道炎症、蛋白酶/抗蛋白酶失衡、氧化/抗氧化失衡。激活的炎症细胞可释放多种炎性介质,如IL-6、IL-8、IL-18、TNF-α、TGF-β、DC等。IL-6可以使胶原蛋白聚集、促进成纤维细胞增殖、阻止细胞外基质的分解,最终使COPD患者的气道中形成纤维结缔组织。IL-8参与COPD炎症发生和发展的整个过程,检测IL-8可作为评估疗效及判断预后的重要指标[7]。IL-18是促炎因子,促进T细胞增殖,增强自然杀伤细胞的活性,破坏肺泡,使气道纤维化。TNF-α是一种多功能的细胞因子,增强PMN的趋化性及细胞外蛋白分解作用,使其吞噬杀伤能力增强,增强炎症局部淋巴细胞浸润和增生。TGF-β是促纤维化细胞因子,其可以诱导成纤维细胞释放胶原,促使基质生成和收缩。DC是特异性免疫与固有免疫之间的纽带,体现免疫反应在COPD中的作用。
IL-37具有抑制先天性炎症反应和调节免疫应答的作用。有研究证实,IL-37在人上皮细胞株A549、单核/巨噬细胞株(THP-1)中,IL-37可以促进其表达,达到抑制前炎症细胞因子(IL-6,IL-8,TNF-α)。其胞外作用机制:IL-37与IL-18 的天然拮抗剂即IL-18结合蛋白(IL-18BP) 结合,进而抑制IL-18诱导细胞活化,进而抑制IFN-γ的产生,起到抑制炎症的作用。胞内作用机制:IL-37进入细胞核内与Smad3结合成为功能性复合物,进而影响基因的转录,并抑制Toll样受体(TLR)抑制促炎细胞因子的表达及DC的活化[7]。TLR配基的拮抗剂是IL-37,其可以通过前炎症细胞因子及趋化因子,增强抗炎细胞因子,进而达到抗炎的作用[8]。
在本研究中,IL-37与COPD的炎症过程具有一定的相关性。AECOPD组、COPD稳定组及健康对照组血清IL-37各组间比较差异具有统计学意义。AECOPD组血清IL-37含量明显增高,经过两周规范化治疗后即COPD稳定组血清IL-37水平下降,但仍高于健康对照组,差异有统计学意义。提示IL-37作为一种抗炎细胞因子可能参与COPD的发病过程,AECOPD时机体内炎症感染较重,即致炎性细胞因子升高,反馈性引起抗炎性细胞因子的升高。故AECOPD组血清IL-37呈现出高表达。目前对IL-37在COPD中的作用仅仅是基于外周血ELISA检测同WBC、N%、PaO2、PaCO2、FEV1%pred等炎性相关因子之间的研究,另外进行IL-37同N%、FEV1%pred的相关性分析。结果示IL-37与FEV1%pred在健康对照组呈负相关,相关性甚微。IL-37与FEV1%pred在AECOPD组及COPD稳定组呈显著的正相关,进一步证实了IL-37作为抗炎细胞因子参与了COPD的发病过程。检测血清IL-37的水平变化有可能成为评估COPD疗效的辅助指标。但因此实验样本量少,研究时间短,值得更深入地研讨。
[1]刘永翠,马雪梅.特布他林联合布地奈德雾化吸入治疗COPD急性加重期的临床效果与护理[J].黑龙江医药科学,2010,33(1):52-53
[2]BanchereauJ,PascualV,O'GarraA.FromIL-2toIL-37:theexpandingspectrumofanti-inflammatorycytokines[J].NatImmunol,2012,13(10):925-931
[3]陆晶晶,郑永华,尹琦,等.白介素 6、白介素 17 与慢性阻塞性肺疾病相关性研究[J].临床肺科杂志,2010,15(7):940-941
[4]DamiaAdeD,GimenaJC,FerrerMJ,etal.Astudyofeffectofproinflammatorycytokinesontheepithelialcellsofsmokers,withorwithoutCOPD[J].ArchBronconeumol,2011,47(9):447-453
[5]RovinaN,DimaE,GerassimouC,etal.Interleukin-18ininducedsputum:associationwithlungfunctioninchronicobstructivepulmonarydisease[J].RespirMed,2009,103(7):1056-1062
[6]SoltaniA,SohalSS,ReidD,etal.Vessel-associatedtransforminggrowthfactor-beta1(TGF-β1)isincreasedinthebronchialreticularbasementmembraneinCOPDandnormalsmokers[J].PloSOne,2012,7(6):39736
[7]柴明思,孙云晖.TIPE2与IL-8在慢性阻塞性肺疾病中的表达及临床意义[J].黑龙江医药科学,2013,36(6):34-35
[8]TeteS,TripodiD,RosatiM,etal.IL-37(IL-1F7)thenewestanti-inflammatorycytokinewhichsuppressesimmuneresponsesandinflammation[J].IntJImmunopatholPharmacol,2012,25(1):31-38
2015年佳木斯大学研究生科技创新项目,编号:LM2015_037。
徐珍(1989~)女,山东日照人,在读硕士研究生。
刘甡(1961~)男,黑龙江佳木斯人,硕士,主任医师,硕士研究生导师。E-mail:liushen777@163.com。
R
B
1008-0104(2017)01-00063-02
2016-03-07)
