卵巢浆液性囊腺癌中PDCD4的表达及其与预后的关系①
2017-03-30宋继荣张丹凤
宋继荣,肖 敏,张丹凤
(佳木斯大学附属第一医院妇产科,黑龙江 佳木斯 154003)
卵巢浆液性囊腺癌中PDCD4的表达及其与预后的关系①
宋继荣,肖 敏,张丹凤
(佳木斯大学附属第一医院妇产科,黑龙江 佳木斯 154003)
目的:探讨卵巢浆液性囊腺癌中程序性细胞死亡因子4(PDCD4)的表达,并评估其和预后的关系。方法:佳木斯大学附属第一医院的妇产科收集2008-01~2012-08接受手术治疗,且随访资料完整的50例卵巢浆液性囊腺癌患者的存档蜡块,10例癌旁正常组织标本。采用免疫组化方法检测PDCD4在卵巢癌中的表达,并分析它与预后的关系。用SPSS17.0进行数据处理,对于患者的总生存情况,采用Kaplan-Meier法进行分析;对于影响卵巢癌生存预后的因素,运用Cox比例风险模型分析。结果:①50例卵巢癌患者中PDCD4总体的阳性表达率为42%(21/50),缺失表达率为58% (29 /50),PDCD4在癌旁组织中总的阳性率80%(8/10),差异有统计学意义(χ2=18.963,P=0.000)。②PDCD4的表达与卵巢癌组织分化程度(χ2=5.466,P=0.019)、临床分期(χ2=7.550,P=0.006)均有关,而与年龄无关(χ2=3.120,P=0.077)。③50例卵巢癌中PDCD4阳性表达者其总体生存情况明显优于PDCD4表达阴性者(χ2=22.136,P=0.000)。④在多因素的分析中,PDCD4被证明是影响卵巢癌总生存的独立因素。结论:在卵巢浆液性囊腺癌中,PDCD4是低表达;在总生存情况中,PDCD4 蛋白阳性的表达者优于PDCD4 蛋白阴性者;PDCD4可成为评估卵巢浆液性囊腺癌预后的独立因素。
卵巢浆液性囊腺癌;程序性细胞死亡因子4;预后
卵巢癌是女性常见的生殖道恶性肿瘤之一,而85%~90%的卵巢恶性肿瘤为上皮性癌,在上皮性癌中75%为浆液性囊腺癌。在女性生殖系统肿瘤中,卵巢癌的发病率虽为第三位,但它的死亡率却居第一位[1],严重威胁着女性的健康。现如今,临床中对于其治疗仍然采用手术并联合化疗,但因卵巢癌出现耐药性,术后5年仍是仅有较低的存活率。关于晚期卵巢癌患者,近年有报道表明其5年存活率仅为25%~30%[2]。因此,寻求新的方法提高卵巢癌患者的诊断治疗及预后成为众多学者的研究热点,而随着分子生物学技术的发展,对于肿瘤的发生、进展和凋亡过程,人们有了更深一步的认识,特别是抑癌基因的发现和进一步的研究,为治疗肿瘤提供了新的思路,成为新的治疗靶点。
1995年于小鼠体内发现了PDCD4,它是与细胞凋亡有关的因子,而其抑制肿瘤生长表现为:抑制蛋白转录和翻译过程[3]。近几年来,其在抑制肿瘤细胞生长转化方面引起了人们越来越多的关注,大量研究表明,PDCD4在肿瘤组织中的低表达状态对肿瘤的病理分级及预后判断有重要意义[4,5]。然而,在卵巢癌方面,PDCD4的研究相对较少,目前,关于PDCD4与卵巢癌预后的关系,国内尚未有研究。而本文则利用免疫组化检测PDCD4在卵巢癌中的表达,并分析其与预后的关系。
1 资料与方法
1.1 一般资料
1.1.1 对象及标本
搜集2008-01~2012-08就诊于本院的50例卵巢癌患者,且其手术标本均已证实为卵巢浆液性囊腺癌的存档蜡块,同时选用10例癌旁组织作为对照,年龄36~70岁。患者术前均未接受放化疗,病理得到病理科医师证实。根据FIGO制定的标准进行手术病理分期,在卵巢浆液性囊腺癌患者标本中,Ⅰ期12例,Ⅱ期10例,Ⅲ期18例,Ⅳ期10例。其中11例为高中分化,39例为低分化。
1.1.2 实验用品
器材:超净工作台,恒温箱,显微镜等。试剂:兔抗人PDCD4多克隆抗体(购于北京博奥森生物技术有限公司),显色剂(DAB液)及抗体稀释液等。
1.2 方法
1.2.1 实验方法
操作步骤:通过病理号查找病理科存档的病理蜡块,蜡块常规脱蜡制成4μm厚切片,经过水化、封闭、滴加一抗(兔抗人PDCD4),然后滴加二抗,通过显色剂显色及复染,最终脱水、封片、镜下采图并计数。
1.2.2 结果判定
PDCD4的阳性表达于细胞核和细胞质中均有。在高倍视野下进行计数,评分判定:(l)阳性率:阳性细胞占总细胞数的百分率<5%为0分,5%~<25%为1分,25%~<50%为2分,50%~<75%为3分,75%~100%为4分。(2)染色强度以浅黄色计1分,黄色计2分,深黄色计3分。最终阳性率与染色强度的积分乘积为表达强度,0分为阴性(-),1~3分为弱阳性(+),4~8分为中度阳性(),9~12分为强阳性()。
1.3 随访
用电话方式进行随访,2015年08月为最终截止日期。自进行手术日起直至出现与卵巢癌相关的死亡的时间即为总生存时间。
1.4 统计学方法
采用SPSS17.0统计软件。用χ2检验进行率的比较,而对于等级资料,则采用Spearman等级相关检验。关于患者的总生存情况,用Kaplan-Meier法进行分析,而生存曲线间的差异,则用Log-rank检验进行比较,对于影响卵巢癌生存预后的因素,运用Cox比例风险模型分析。P<0.05为差异有统计学意义。
2 结果
2.1PDCD4的表达情况
在卵巢癌细胞核和胞质中,PDCD4都有阳性表达,在卵巢癌中为42%,癌旁中为80%,差异有统计学意义(χ2=18.963,P=0.000)见表1。
表1 卵巢浆液性囊腺癌及癌旁中PDCD4的表达情况
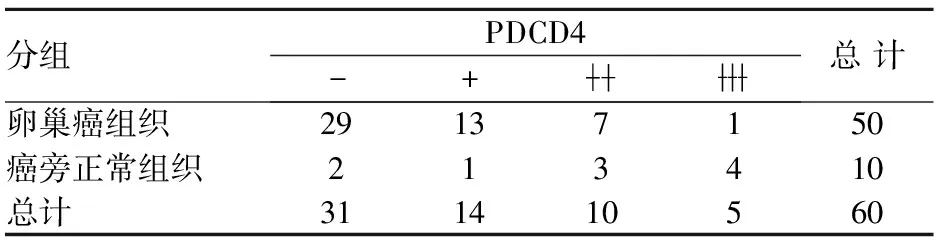
分组PDCD4-+总计卵巢癌组织29137150癌旁正常组织213410总计311410560
2.2PDCD4与卵巢浆液性囊腺癌临床病理的关系
根据免疫组化结果,以及统计学分析,PDCD4表达的高低和组织分化程度(P=0.019)、临床分期(P=0.006)有关,P<0.05。而与年龄无关(P=0.077)见表2。
表2PDCD4与卵浆液性囊腺癌临床病理之间的关系
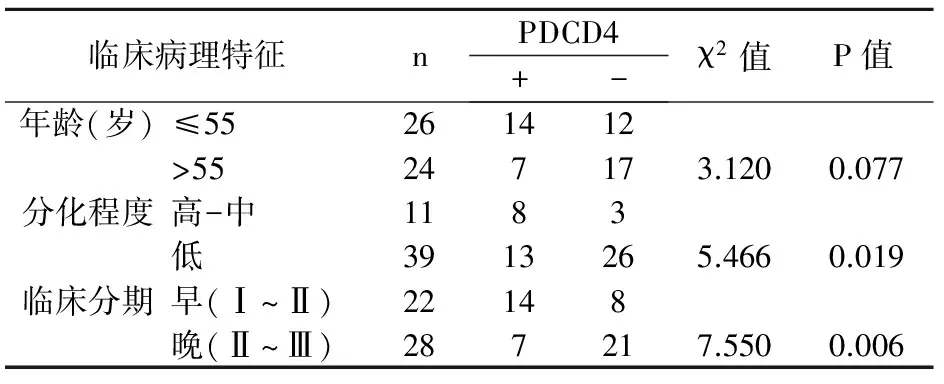
临床病理特征nPDCD4+-χ2值P值年龄(岁)≤55261412>55247173.1200.077分化程度高-中1183低3913265.4660.019临床分期早(Ⅰ~Ⅱ)22148晚(Ⅱ~Ⅲ)287217.5500.006
2.3PDCD4表达与卵巢癌预后的关系
50例乳卵巢癌患者中PDCD4 阳性表达者其总生存率明显优于PDCD4 阴性表达者(χ2=22.136,P=0.000),见图1。
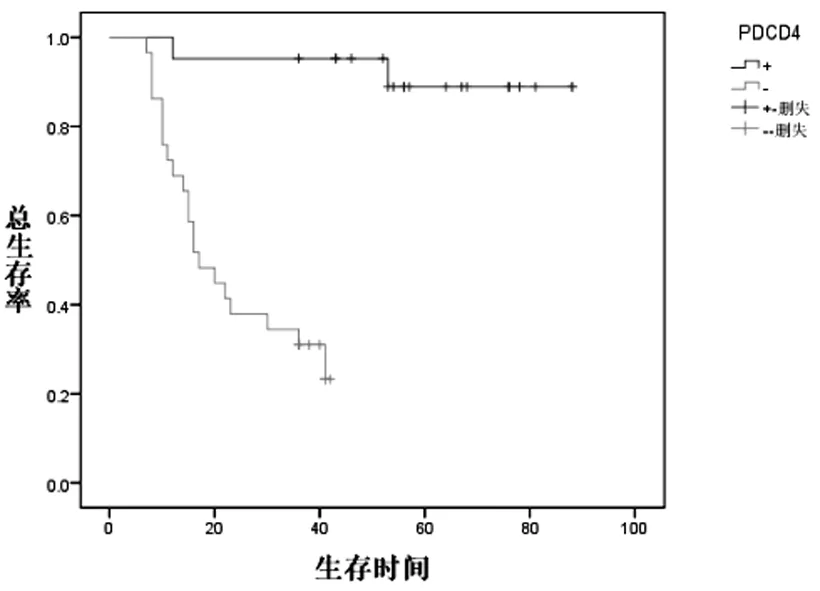
图1 PDCD4表达与总生存情况的关系
2.4 卵巢癌患者总体生存情况相关的多因素分析
在影响卵巢癌总生存情况中,PDCD4可作为独立因素(P=0.000),见表3。
表3 影响卵巢癌患者总体生存情况的多因素分析

因素β值标准误WaldX2自由度P值HR95%CI年龄-0.5590.4321.67610.1950.5720.245-1.333分期0.4900.4351.26810.2601.6320.696-3.829分化-0.4490.7680.34210.5590.6380.142-2.876PDCD4-3.4841.07210.55610.0010.0310.004-0.251
3 讨论
卵巢癌具有发病隐匿、早期的诊断率低、较容易发生转移等特点,因此若患者自觉有临床症状来就诊时,多数已至晚期,如出现广泛转移,根治性手术就难以实施,因此众多学者致力于寻找新的方法治疗卵巢癌。目前,在原有治疗方案的基础上,新的方法为中晚期的卵巢癌提供了新的选择,这些方法包括生物、免疫和分子靶向治疗等[6],同时为改善卵巢癌的预后提供了可能。随着对卵巢癌生物机理的研究,分子靶向治疗进入了人们的视线,且很快得到关注,而了解卵巢癌基因突变,成为分子靶向治疗的基础。伴随着PI3K/AKT/MTOR信号通路的研究,并探讨其在卵巢癌中的重要性,有众多研究者已致力于研究此信号通路的抑制剂,而作为此信号通路下游的PDCD4因子于发现后也被用于多个领域研究。
PDCD4基因是Shibahara等于1995年研究小鼠细胞程序性死亡过程中发现的,后来Cmarik等在小鼠的角蛋白细胞肿瘤转化模型及Jansen等应用小鼠体内皮肤癌模型研究过程中证实PDCD4是肿瘤抑制基因[7]。人类PDCD4基因定位于10q24,cDNA全长约3.5kb,编码区约1.4kb。有研究证实,PDCD4在人类多种组织中均有表达,且大多数正常组织细胞中,PDCD4蛋白主要位于细胞核中。本研究表明,在正常组织中,PDCD4表达于细胞核,而在卵巢癌中,胞核与胞质均有表达,PDCD4此种表达现象在卵巢癌中意义尚不明确。孙玮等[8]发现,在正常组织中,PDCD4位于细胞核中,若细胞周围环境改变,例如:在营养条件不利,或恶性细胞发生增殖时,通过核输出信号,它可以转移到胞浆中。故对PDCD4在卵巢癌细胞中的这种表达现象进一步研究,可能为明确其在卵巢癌发生发展中的作用提供依据。
近期有研究发现,在恶性肿瘤的形成和发展中,有PDCD4参与,且在很多肿瘤组织中,它均呈低水平或缺失。本实验表明,在卵巢浆液性囊腺癌中,PDCD4的表达率明显低于癌旁组织,且随着其分期增高、分化程度降低,PDCD4呈低水平,甚至缺失,提示PDCD4的低表达或缺失在卵巢癌的发生以及发展中发挥重要作用。而许多学者在结肠癌、肾癌、胃癌等的研究中也得到相同的结论。同时也有研究表明,PDCD4的致病机制与CpG岛甲基化、微小RNA磷酸化和泛素化调控有关,然而,在卵巢癌中的致病机制还有待进一步研究。
此后,在乳腺癌、大肠癌、肺癌等多种恶性肿瘤研究中表明,PDCD4的缺失与预后不良有关。但在卵巢癌中国内尚未有此类研究,而本研究发现,PDCD4与卵巢浆液性囊腺癌的预后有关,且可能成为评估其预后的独立因素。韩晓蓉等[9]在关于乳腺癌预后的研究中同样得出,PDCD4可作为独立因素。根据PDCD4的表达判断预后的同时,还可进一步研究增加PDCD4表达的方法,同时也为分子靶向治疗提供一个新的靶点。
[1]佟丽波,杨秀莲,张丹凤,等.KLK7蛋白及E-钙黏蛋白在卵巢癌中的表达及意义[J].黑龙江医药科学,2010, 33(6):3-5
[2]徐驰,温义成,刘健.血清CA-125、CA-153、HCG在卵巢癌联合检查中应用的价值[J].黑龙江医药科学,2013, 36(3):67
[3]Lankat-ButtgereitB,GokeR.ThetumoursuppressorPdcd4recentadvancesintheelucidationoffunctionandregulation[J].BiolCell, 2009, 101(6):309-317
[4]ChenY,KnoselT,KristiansenG,etal.LossofPDCD4expressioninhumanlungcancercorrelateswithtumorprogressionandprognosis[J].JPathol, 2003, 200(5):640-646
[5]FangW,LiX,JiangQ,etal.Transcriptionalpatterns,biomarkersandpathwayscharacterizingnasopharyngealcarcinomaofSouthernChina[J].JTranslMed, 2008, 6:28-32
[6]刘云,杜成,刘文超.卵巢癌治疗新进展[J].现代肿瘤学, 2015, 23(4):553-556
[7]张海员,徐晖,刘佳玮,等.PDCD4在DNA损伤和肿瘤耐药性中的研究进展[J].中华临床杂志,2013, 7(22):10268-10270
[8]孙玮,高飞,张利宁.新的抑癌基因PDCD4最新研究进展[J].药物分析杂志,2007, 27(7):1138-1141
[9]韩晓蓉,吴坤河,郜红艺.不同分子亚型乳腺癌中程序性细胞死亡4的表达及其与预后的关系[J].中国普外基础与临床杂志,2014,21(5):577-582
佳木斯大学科学技术面上项目,编号:13Z1201553。
宋继荣(1969~)女,黑龙江佳木斯人,硕士,主任医师,硕士研究生导师。
肖敏(1989~)女,黑龙江黑河人,在读硕士研究生。E-mail:313505660@qq.com。
R
B
1008-0104(2017)01-0055-03
2015-12-07)
