广西猪繁殖与呼吸综合征病毒流行株的分子流行病学调查及防控策略
2017-03-30韦柳青邰振国张淑云戴丽敏刘媛媛
韦柳青,邰振国,贺 银,张淑云,戴丽敏,刘媛媛
(广西扬翔猪病检测中心,广西 贵港 537100)
广西猪繁殖与呼吸综合征病毒流行株的分子流行病学调查及防控策略
韦柳青,邰振国,贺 银,张淑云,戴丽敏,刘媛媛
(广西扬翔猪病检测中心,广西 贵港 537100)
为了解广西地区猪繁殖与呼吸综合征病毒(PRRSV)流行毒株的遗传变异情况和发展趋势,通过RT-PCR方法,对2015年1-8月份采自广西省各规模猪场的疑似样品进行PRRSV检测,并对阳性病料进行基因测序分析。结果显示:84份疑似样品中有40份检测为阳性,阳性率为47.6%,通过完整的ORF5基因序列遗传进化分析表明,广西地区流行毒株主要为美洲型PRRSV,且均与高致病性PRRSV高度同源。广西省各规模猪场毒株与2015年7月份采自广东肇庆某规模猪场的PRRSV分离毒株间的同源性均较低,经序列对比发现,广东肇庆分离毒株与美洲流行毒株NADC 30高度同源。结果表明,广西地区主要流行毒株为美洲型高致病性PRRSV毒株,且与美洲流行毒株NADC30同源性较低,但广东地区已出现美洲流行毒株NADC30,提示广西地区需加强对PRRSV流行及变异的监测,以及采取有效防控策略的必要性。
猪繁殖与呼吸综合征;NADC30;系统进化分析;防控
1987年,猪繁殖与呼吸综合征(PRRS)首次在美国发现,以母猪流产、早产、死胎和木乃伊胎等、仔猪和育肥猪发生呼吸道疾病为主要特征,是一种急性、高度传染性的疾病,以前曾称为神秘病、蓝耳病等,是危害养猪业最严重的病毒性疾病之一,现已呈世界性分布,给养猪业造成巨大的经济损失。猪只买卖移动、饲养密度过大、饲养管理及卫生条件不良、气候变化等,均可促发该病的流行。我国于1996年首次报道该病毒的存在,随后流行于全国。猪繁殖与呼吸综合征是由猪繁殖与呼吸综合征病毒引起的,该病毒的特点是高频率的突变和病毒重组,导致了病毒显著的进化和不同类型病毒的产生。目前PRRSV主要包括以VR2332毒株为代表的美洲型和以Lelystad virus(LV)为代表的欧洲型,这两种基因型的核苷酸序列大约有40%的差异性,我国大陆流行的病毒株主要为美洲型PRRSV。
PRRSV NADC30是2008年从美国爱荷华州暴发呼吸系统疾病的猪群中分离出来的毒株,毒力较强,猪感染NADC30后快速产生病毒血症,其表现为早期高烧和显著的呼吸系统疾病。在我国,周峰等通过RT-PCR方法,首次从2012-2013年采自河南省各地的疑似病料中检测到与美洲流行毒株NADC30高度同源的病毒株,说明PRRSV NADC30毒株已经传入我国。随后我国多地有PRRSV NADC30毒株流行的报道,2015年该毒株将进一步扩散和蔓延,如果不提前采取有效的防控策略,无疑还会有不少猪场受到感染而引发更为严重的疫情。我国PRRSV的变异种类更加多样化,提示加强对PRRSV流行及变异的监测十分必要。本研究主要对2015年1-8月采自广西各规模猪场的84份PRRSV疑似病料进行RT-PCR检测,并对阳性样品的的ORF5基因进行序列扩增与分析,研究广西地区ORF5基因变异的情况和发展趋势,为PRRS的防控提供参考依据。
1 材料与方法
1.1 样品采集
采集广西省贵港市、河池市、玉林市、南宁市等地各规模猪场疑似PRRSV阳性病猪的脾脏、肺脏、淋巴结等脏器以及发烧猪的血液样品,共84份。
1.2 主要试剂
Taq DNA聚合酶、鼠源反转录酶(M-MLV)、RNA酶抑制剂(Rnase Inhibitor)、Rrizol Reagent及琼脂糖,均购自Invitrogen公司;dNTP、2*Taq PCR Master Mix及DNase/RNase-free去离子水,均购自北京天根公司。

表1 ORF5基因的特异性引物
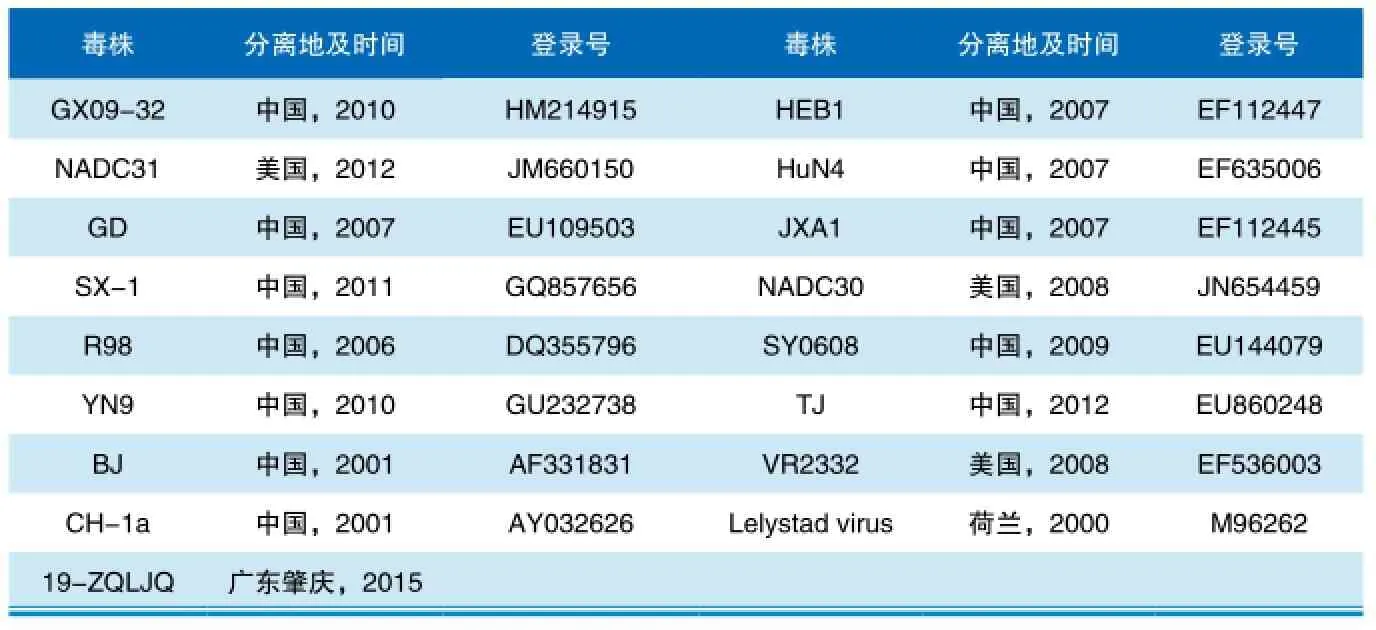
表2 参考毒株

表3 检测到的用于ORF5基因序列分析的18株PRRSV广西毒株

图1 18株PRRSV广西毒株与参考毒株之间的ORF5基因核苷酸序列的遗传进化分析
1.3 引物设计
参考中国标准株CH-1a株和已发表的HUN株全基因序列,应用Oligo 6.0生物软件,在ORF5基因前后保守区设计一对扩增ORF5基因的特异性引物E1/E2(表1),引物由英潍捷基(上海)贸易有限公司合成。
1.4 样品中PRRSV的诊断和ORF5基因的序列分析
对样品进行常规预处理后,参照病毒RNA抽提试剂盒说明书提取样品中的RNA,经RT-PCR扩增后,反应产物用1.5%琼脂糖凝胶电泳进行检测。
利用DNAStar软件中的MegAlign程序对检测到的部分病毒含量较高的阳性样品的PRRSV毒株与参考毒株(表2)进行ORF5基因的序列比对、同源性分析及遗传进化分析。
2 结果
2.1 PRRSV的诊断结果
对2015年1—8月份采自广西各规模猪场的84份PRRSV疑似病料进行PRRSV RT-PCR检测,结果检出PRRSV阳性样品40份,阳性率为47.6%。
2.2 ORF5 基因序列的扩增
选取18份病毒含量较高的阳性样品(表3),再次进行RT-PCR扩增,扩增的基因片段长度为738 bp,PCR扩增产物直接送基因测序公司进行纯化测序。
2.3 ORF5基因的核苷酸序列同源性分析
ORF5基因的核苷酸序列同源性分析显示,18株PRRSV广西毒株之间的ORF5基因序列同源性为93.7%~100%,与JXA1、HuN4、BJ等中国分离的美洲型高致病性参考毒株之间的ORF5基因序列同源性为94.0%~99.7%,与VR2332、R98和CH-1a等美洲型经典毒株之间的ORF5基因序列同源性为84.4%~95.2%,与欧洲型参考毒株Lelystad virus之间的ORF5基因序列同源性仅为61.6%~64.6%。18株广西毒株与广东肇庆毒株19-ZQLJQ之间的ORF5基因序列同源性仅为82.4%~86.1%;而广东肇庆毒株19-ZQLJQ,与美洲型其他参考毒株之间的ORF5基因序列同源性仅为84.4%~86.9%,与美洲型NADC30之间的ORF5基因序列同源性高达95.4%。
2.4 PRRSV ORF5基因序列的遗传进化分析
ORF5基因核苷酸序列的遗传进化分析显示,美洲型PRRSV可以分为3 个亚群(图1),18株PRRSV广西毒株与TJ、HuN4、JXA1等毒株组成亚群1;经典毒株VR2332、CH-1a和R98组成亚群2;广东肇庆毒株19-ZQLJQ与2008年美国毒株NADC30同属于亚群3。广东毒株出现在亚群3中,预示着广东地区已出现了新的PRRSV毒株,应当给予高度关注。
3 讨论
1987年PRRSV首次暴发于美国,1996年首次证实PRRSV在我国存在,由于没有采取有效的防治措施,2006年夏秋季节,高致病性猪蓝耳病在我国南方部分地区开始暴发,现已蔓延全国。自从周峰等通过RT-PCR方法,首次从2012-2013年采自河南省各地的疑似病料中检测到与NADC30高度同源的病毒株以来,NADC30毒株已在很多地区流行,2015年进一步扩散和蔓延。如不加以重视,美洲型毒株NADC30的传入对中国养猪业来说可能又是1次更为沉重的打击。
本研究中采集的病料大多来自于使用高致病性PRRS弱毒活疫苗进行免疫的猪场,也有少部分不接种PRRS疫苗的猪场。通过对猪场的持续检测以及对PRRSV遗传多样性的靶基因-ORF5基因的序列分析,我们发现,猪场使用了PRRS弱毒活疫苗后,不能完全阻止PRRS的发生,虽然疾病的发生与猪场的饲养管理、免疫预防及治疗等措施紧密相关,但也说明了目前市售的疫苗依然不能很好地控制猪蓝耳病的发生,PRRSV还在不断地发生变异。
值得庆幸的是,2015年1—8月监测到的18株PRRSV广西毒株仍然属于美洲型毒株,且均为高致病性毒株。18株PRRSV广西毒株之间的ORF5基因序列同源性较高,与TJ、HuN4、JXA1等中国分离的高致病性毒株亲缘关系较近,同属亚群1,但与广东肇庆毒株19-ZQLJQ之间的ORF5基因序列同源性仅为82.4%~86.1%。而广东肇庆毒株19-ZQLJQ与2008年分离的美洲型NADC30毒株的ORF5基因序列同源性高达95.4%,亲缘关系最近,同属于亚群3,说明与广西毗邻的广东省已出现美洲型毒株NADC30的感染。广东毒株出现在亚群3中,预示着广东地区已出现了新的PRRSV毒株,应当给予高度关注,如果各猪场不做好充足的准备,采取有效的防控策略阻止NADC30毒株的感染,后果将不堪设想。
对于PRRS的防控,中国农业大学杨汉春教授认为,猪场应树立综合防控PRRS的理念,走出过分依赖疫苗的误区,将生物安全控制措施放在首位,积极探索闭群饲养、毒株驯化、多点饲养等方式,建立适合自身猪场的综合防控体系。养猪业发达的国家(如美国)也并非完全依赖于疫苗,而是积极探索行之有效的控制策略。美国的实践经验表明,通过采取严格的生物安全措施,切断PRRSV 的传播途径和消灭传染源是预防猪群感染PRRSV 的最有效措施。据悉,我国生猪产业技术体系的京安综合试验站坚持采用闭群技术控制PRRS,同时采取生物安全控制措施、后备母猪驯化、PRRSV检测和淘汰阳性种猪,经过3年的工作,种猪群达到了PRRSV阴性,猪群生产性能稳定。
关于高致病性PRRSV NADC30毒株的防控,杨汉春教授表示,目前市售疫苗对此毒株究竟有无保护率,尚无明确数据;而兽医病理学博士遇秀玲女士则认为,NADC30毒株和美国的VR2386株具有同源性,JXA1-R株活疫苗对于VR2386毒株具有很好的防控效果,因而我们养猪人士同样可以用JXA1-R株活疫苗来防控高致病性NADC30毒株带来的猪蓝耳病感染。
经本实验室调查发现,通过实验室确诊为PRRSV阳性的猪场,大部分均免疫过PRRS高致病性弱毒疫苗,但却不能阻止PRRS的发生。有的猪场常年发生呼吸系统疾病,在没有经过实验室确诊病原的情况,直接选取一种PRRS疫苗进行免疫;有的猪场在发生呼吸系统疾病后,免疫PRRS疫苗,免疫几个月后觉得没有明显的效果,马上停止免疫,这些猪场在使用疫苗方面均存在一定的盲目性和随意性,对PRRS的防控极为不利,而且还可能引发新的毒株在猪场流行。
猪场任何疾病的发生均与饲养管理水平、环境消毒卫生、饲养密度、免疫预防措施以及发病隔离机制等息息相关,单纯依靠疫苗来控制PRRS难以奏效,必须采取综合防控的措施。如果猪场没有免疫过PRRS疫苗,可将生物安全控制措施放在首位,积极探索闭群饲养、毒株驯化、多点饲养等方式,建立适合自身猪场的综合防控体系。如果猪场一直在免疫PRRS疫苗,可坚持使用,但不能高频次免疫,以免造成疫苗毒株的扩散。使用疫苗前必须先检测本猪场PRRSV毒株的类型,做ORF5基因的序列分析,确定与哪种疫苗毒株的同源性和亲缘关系最接近,才能使用该种疫苗毒株进行免疫。当猪场发生明显的发烧和呼吸系统疾病,怀疑是PRRS时,首先必须采取综合防控措施,控制疾病的传播,同时采样进行实验室检测,并做ORF5基因的序列分析,确定感染的PRRSV毒株的类型,才能确定最终的防控方案。如果猪场感染了NADV30毒株,首先应采取综合防控措施,并适当进行清群,如果猪场一直免疫的是JXA1-R株活疫苗,可继续使用。总之,不管是何种毒株引起的PRRS,其防控原则均为:综合防控措施为主,疫苗为辅,且疫苗需谨慎使用。
2016-06-01)
