BH3类似物促细胞凋亡机制及临床研究进展
2017-03-28张伊佳李学军
张 岳,张伊佳,李学军
(北京大学医学部基础医学院药理学系,北京 100191)
·前沿论坛·
BH3类似物促细胞凋亡机制及临床研究进展
张 岳*,张伊佳*,李学军
(北京大学医学部基础医学院药理学系,北京 100191)
李学军,现任北京大学医学部基础医学院药理学系教授,博士生导师。曾任北京大学基础医学院副院长和药理系主任等。现兼任中国药理学会副理事长,生化与分子药理专业委员会主任委员和世界中联网络药理学会副会长,科技部、北京市科委、国家人事部世纪人才及国家自然科学基金委评审专家。研究方向为分子药理学。研究课题包括药物靶点的确认和新药发现、网络药理学、水通道的生物学研究和新药发现以及抗肿瘤药物、心血管系统药物等药理学研究。已培养硕士、博士研究生40余人,发表SCI收录文章80余篇。获科技部重大专项、国家自然科学基金重大国际合作项目等10余项课题。曾获国家教育部科技进步奖、五洲女子科技奖和中国科协优秀科技工作者等。

靶向细胞凋亡是目前癌症治疗中最具发展前景的治疗方法之一。BCL-2家族的BH3-only蛋白(仅含BCL-2同源结构域BH3)可以通过与家族中促存活蛋白结合,使促存活蛋白失效,从而使促凋亡成员发挥作用,最终导致细胞发生程序性凋亡。BH3类似物即一类可以模仿BH3-only蛋白并诱发细胞凋亡的小分子化合物。BH3类似物的原型ABT-737可以选择性靶向BCL-XL、BCL-2和BCL-W 3个促存活蛋白(但不能作用于髓细胞白血病因子-1蛋白或A1蛋白),而它的衍生物ABT-263(navitoclax)在临床试验中有显著的促凋亡与抗肿瘤效应。现阶段,一些推测为BH3类似物的药物已经进入了临床阶段,但很大一部分仍在进行特征鉴定。本文在概述BH3-only蛋白作用机制的基础上,综述了多种已经广泛认可的BH3类似物及正在研究当中的最新BH3类似物。
抗肿瘤药;BH3类似物;BCL-2蛋白;BH3-only蛋白
促进细胞的程序性死亡是避免肿瘤细胞无限制生长的重要途径,而这也为对抗癌症提供了新的思路。这一思路引发了针对细胞凋亡抗癌症策略的研究,例如抑制恶性肿瘤中存活因子的过度表达。在这些存活因子中,B淋巴细胞瘤-2(B-cell lym⁃phoma-2,BCL-2)家族吸引了众多关注。
BCL-2家族蛋白是目前被广泛认可的与细胞存活和凋亡相关的关键蛋白。其中,BH3-only蛋白(BCL-2 homology domain only proteins,因只含BH3结构域而得名)可以直接拮抗促存活蛋白对促凋亡蛋白的限制作用,从而使促凋亡蛋白发挥促凋亡作用,最终导致细胞凋亡的一类特异蛋白。由于BH3-only蛋白很难通过现有技术直接得到,因此人们想到可以用模拟BH3-only蛋白的小分子化合物来促进细胞发生凋亡,这一类小分子化合物即称为“BH3类似物”。本文主要对目前BH3类似物的种类及相应的促细胞凋亡机制和临床抗肿瘤研究进展进行概述。
1 BCL-2家族蛋白及BH3类似物促进细胞凋亡机制
BCL-2家族蛋白(含有4个BCL-2同源结构域BH1~BH4中的至少1个)是细胞存活与凋亡的关键调节因子,这已在有关科学研究领域达成了广泛共识。BCL-2家族蛋白的主要功能为控制线粒体膜通透性,并可以使细胞色素c等基因性细胞凋亡因子释放入细胞质内,从而级联激活胱天蛋白酶[1]。家族中促存活蛋白,如BCL-2,BCL-XL,BCL-W,髓细胞白血病因子-1(myeloid cell leukemia-1,MCL-1)和A1的功能性活化可以隔绝促凋亡蛋白BAX和BAK,而这2种蛋白正是线粒体膜通透性增加的执行分子。所有的促存活蛋白都可以隔离BAX,但只有BCL-XL和MCL-1可与BAK结合。这些促存活蛋白的抗凋亡作用可以被BH3-only成员拮抗,BH3-only蛋白如NOXA,BAD和BIM通过置换将它们的α-螺旋BH3结构域插入促存活蛋白的疏水凹槽中,导致被隔离的BAX和BAK释放和间接活化。这样的相互作用具有选择性。NOXA只与MCL-1和A1结合,BAD只与BCL-2,BCL-XL和BCL-W结合,而BIM可与全部5种促存活蛋白结合[1]。例如,El⁃gendy等[2]证实,传统的BH3-only蛋白(NOXA)可以通过使促存活蛋白MCL-1失效来诱导细胞产生自噬。除了与促存活蛋白结合,BH3-only蛋白还存在一个直接的活化模式,即特定的“活化剂”BH3-only蛋白(BIM和tBID)结合并活化BAX和BAK。在这个模式中,“活化剂”蛋白被促存活蛋白隔离,而后者与“激活剂”BH3-only蛋白(BAD和NOXA)的互动(通过竞争性置换)引发“活化剂”蛋白的释放[1]。无论在哪一种模式中,BH3-only蛋白与促存活分子的结合都会导致BAX/BAK的活化。
通过以上信息可以界定“BH3类似物”的概念[3],即小分子物质(非肽类物质或者来源于BH3结构域的物质)通过将它们的BH3结构域插入BCL-2促存活蛋白的疏水凹槽中,抑制它们的功能活性,引发细胞凋亡而模仿BH3-only蛋白的作用[3]。在实际应用过程中,BH3类似物的概念已经成为生成抗癌药物不可或缺的重要信息。在已经人工合成的大量化合物中,ABT-737是一个很好的BH3类似物实际应用实例[4],它与BCL-2,BCL-XL和BCL-W有很高的亲和力(纳摩尔级),但不与MCL-1或A1作用;ABT-737及其衍生物ABT-263(navito⁃clax)可在离体条件下引发BAX/BAK-依赖的细胞凋亡,并在动物模型中产生抗癌效果[5-6]。然而,BH3类似物在发展过程中也遇到很大的障碍,目前发现的绝大多数化合物不能完全满足一个标准BH3类似物的主要条件,即由Lessene等[7]提出的“与BCL-2促存活蛋白的高度亲和诱导AX/BAK依赖的细胞凋亡”。由于出现脱靶效应,这些化合物只被推定为BH3类似物。考虑到MCL-1是在一系列恶性肿瘤和药物抗性中出现的一个有争议的促存活因子,识别MCL-1特异的BH3类似物成为当务之急[8-9]。最新研究进展已经发现了多种能与MCL-1有效结合的化合物。从开始时的棉子酚家族化合物及其衍生物(低于纳摩尔级结合),到最新研究发现的BIM SAHB和MIM1(毫摩尔级结合),使人们看到了与MCL-1结合的BH3类似物的发展前景。
2 BH3-only蛋白诱导细胞凋亡机制
BCL-2调节的细胞凋亡通路是由BH3-only蛋白对上游信号做出回应而改变的。一些BH3-only蛋白(主要是BIM,tBID,PUMA)通过直接结合的方式激活BAX/BAK。另外,所有的BH3-only蛋白可以间接激活BAX/BAK,同时抑制BCL-2促存活蛋白[10-11]。激活的BAX/BAK促使线粒体外膜通透性加强,使得细胞溶质向细胞外释放促细胞凋亡因子,如细胞色素c和Smac/DIABLO,这些因子可以激活胱天蛋白酶[12]。但是,目前仍不清楚诱导细胞凋亡的主要途径究竟是BH3-only蛋白与促细胞存活蛋白BCL-2类似蛋白结合还是直接与BAX/BAK结合。目前已知的结论是某些BH3-only蛋白(如BIM,PUMA和tBID)比另一些(如BAD,NOXA和BMF)在促进细胞凋亡的过程中发挥着更重要的作用。值得一提的是,发挥着更重要作用的蛋白可以与所有的BCL-2家族成员结合,而且可以与BAX/ BAK结合,而作用较少的蛋白则更加具有选择性,而且不能与BAX/BAK结合[13]。
BH3-only蛋白的激活机制主要取决于细胞凋亡控制。其中转录激活占主导地位。有资料显示,一些转录后调控机制也发挥着作用,如在某些特定环境中发挥作用的微RNA(microRNA,miRNA)。例如,由DNA损伤导致的抑癌基因p53激活是在翻译后,之后其又通过转录上调PUMA和NOXA的水平[14]。E2F1同样也可以诱导PUMA和NOXA产生[15]。而PUMA及BIM的表达则主要是转录因子FOXO3a对因子撤销(cytokine withdrawal)所做出的反应[16]。
很多翻译后的过程都与调节BH3-only蛋白的活性有关。BIM和BAD的作用可以由于磷酸化而被抑制[14]。BAD的磷酸化导致其在细胞质中被14-3-3蛋白隔离,从而无法发挥促细胞凋亡的作用。细胞外信号调节激酶(extracellular signal-regulat⁃ed kinase,ERK)诱导的BIM磷酸化对激酶的抗细胞凋亡活性产生至关重要的影响[17]。然而最新研究显示,ERK诱导的BIM磷酸化并不能调节所有动物由BH3-only蛋白诱导的细胞凋亡过程。因为BIM和BMF都可以与细胞骨架的成分结合,从而抑制了它们促细胞凋亡的过程[18]。
BH3-only蛋白的表达同样被转录后的miRNA所调节。很多miRNA都与BIM的表达有关,包括小鼠的miR-17~92簇及人类癌细胞系(miR-32,miR-17-5p和miR-106-25)。PUMA也被认为是由miR-483-3p,miR-221及miR-222调控的。对促细胞存活蛋白来说,BCL-2及MCL-1也都主要由特定的miRNA调控,包括miR-29和miR-153。BCL-2的表达还受miR-15,miR-16,miR-195及p53诱导的miR-34调节,BCL-XL的表达受miR-491调控[13]。
3 已鉴定的BH3类似物
早先的一些天然的或人工合成的小分子BCL-2抑制剂,例如三联苯、HA14-1、抗霉素A、BH3-I和白屈菜赤碱的实际临床效果并不尽如人意,主要表现为具有细胞毒性、特异性较低、与BCL-2蛋白疏水腔的亲和度不高及不能引发BAX/BAK依赖的细胞凋亡等。目前,有很多已经进入临床试验阶段的BCL-2促存活蛋白拮抗剂已经开始解决上述问题,并且在某些方面有了一定的突破。
3.1 ABT-737和ABT-263
ABT-737及其可口服的衍生物ABT-263是BH3类似物的原型。这2种化合物曾一度被认为是Lessene等[19]设定的标准下唯一确定的BH3类似物,它们具有其他已知化合物所不具备的特性,比如能和促存活蛋白高度亲和并且不会同时杀死BAX缺陷、BAK缺陷及野生型细胞。除了药物代谢动力学特征,ABT-737和ABT-263的特征有很大程度的重叠。值得注意的是,这2种化合物与BCL-2,BCL-XL和BCL-W结合,而非与MCL-1或A1结合来模拟BH3-only蛋白BAD,因此它们又被称为类BAD BH3类似物。ABT-737和ABT-263仅在MCL-1不表达或微弱表达时才表现出显著的促凋亡和抗肿瘤效应。这2种BH3类似物无法与MCL-1结合是药物抗性产生的主要原因之一,尤其是当肿瘤细胞过度表达MCL-1时。Roberts等[20]记录了临床Ⅰ和Ⅱ期试验中ABT-263在多种癌症治疗中的优异表现。而在实际临床应用中,发现ABT-263的毒性会导致血小板减少症。因此,需要严格控制其使用剂量,但同时也降低了其抑制肿瘤生长的作用[21]。
3.2 奥巴克拉(obatoclax)
奥巴克拉,又称GX15-070,是灵杆菌素的人工合成衍生物,它能与全部5种BCL-2促存活蛋白结合,但亲和度较低(微摩尔级)[22]。事实上,其亲和度与ABT-737对MCL-1的亲和度一样低,且在杀伤BAX/BAK缺陷细胞的同时同样地杀伤野生型细胞。因此,奥巴克拉并不满足一个标准BH3要求的2个条件。相反的,它表现出多种脱靶效应,例如胱天蛋白酶依赖的细胞死亡或细胞自噬,内质网应激反应,进而导致MCL-1/BAK结合的分离;而后者可导致MCL-1/BAK结合的分离[23]。在对多种肿瘤进行的临床Ⅰ和Ⅱ期试验中,单独使用奥巴克拉并没有得到令人信服的结果。即使奥巴克拉的耐受性良好,其临床剂量还是会受到神经毒性的限制,因此并不能很高剂量使用。奥巴克拉在组合治疗中的效果正在进行第Ⅲ阶段临床试验[24]。
3.3 棉子酚家族
棉子酚是一种植物衍生的多酚醛,在发现其推定的泛BH3类似物性质前就长期应用于临床治疗。棉子酚通过结合BCL-2和BCL-XL发挥作用,并与MCL-1有适度的亲和力(低于微摩尔级)[25]。棉子酚可以阻止白细胞介素6促存活蛋白在多发性骨髓瘤癌细胞中的释放,导致Ser70发生脱磷脂和MCL-1水平下调。棉子酚还可以激活磷脂酶A2和RhoA/ROCK1/PTEN以及诱导BIM和BID[26]。而它的(-)对映体被称作AT-101,在体外和动物模型中较棉子酚有更强的促凋亡和抗肿瘤活性[23]。但这一化合物在临床试验中仅表现出有限的效力。棉子酚的派生物在设计时去掉了2个醛基群以降低毒性,apogossypol和apogossypolone(ApoG2)正进行临床前评估,而benzoylsulfonide派生物TW37已经进入临床Ⅰ/Ⅱ阶段试验[27-28]。这些化合物有相似的结合能力(在BCL-W和BCL-B之间有少量差异)和适度的亲和力,诱导具有BAX/BAK缺陷细胞的凋亡,并表现出几项脱靶效应,表明它们只有部分泛BH3类似物的作用。值得注意的是,apo⁃gossypol的衍生物BI-97C1(sabutoclax)与促存活蛋白(包括A1)具有较之前棉子酚衍生物更高的亲和力,并可以引发BAX/BAK缺陷细胞轻微的细胞凋亡和少量脱靶效应[24]。
3.4 其他BH3类似物
Walensky等[29]原计划生成一系列稳定的BCL-2结构域α-螺旋(SAHB)来靶向与BCL-2促存活家族成员结合。这些小分子是源于BCL-2蛋白上BH3结构域当中碳氢化合物-嵌入的肽类,并具有稳定的结构、蛋白酶抗性和细胞通透性。这些化合物中的一个SAHBA以BH3-only蛋白BID为原型,与BCL-2和BCL-XL有适度亲和力,可在体外引发BAX/BAK依赖的细胞凋亡,并在体内引起抗白血病效应。但是,还没有临床数据证明SAHB具有类BAD的效应。有2个推定的泛BH3类似物也在进行临床前鉴定,人工合成杂环化合物S1和基于BIM的BH3结构域的肽类072RB。这2种化合物都具有促凋亡和抗肿瘤作用(体内也有抗肿瘤作用),但不能完全满足BH3类似物的所有要求[30]。
另外,有2个不同的实验室提出了可以人工设计类NOXA(针对重要的抗凋亡蛋白MCL-1)BH3类似物的理念,即BIMS2A是BIM的BH3结构域的变形体[31],而MCL-1 SAHB则直接源于MCL-1的BH3结构域本身[32]。X-射线晶体学分析得出的超微结构不但表明这两种化合物都选择性的与MCL-1的疏水凹槽结合,还揭示了这种结合的肽链决定因素。BIMS2A和MCL-1 SAHB与NOXA一样,都是MCL-1介导的抗细胞凋亡的强效抑制剂,并在血液系统癌细胞系中表现出抗癌症效应。BIMS2A还在动物模型中表现出抗白血病活性(表1)。
最后,Gavathiotis等[33]报道,一种源于BIM的BH3 α-螺旋SAHB可以直接与BAX结合,且它们的相互作用位点与传统的促存活蛋白BCL-2的结合凹槽不同。这些研究表明,BH3类似物概念可以用来设计以直接活化BAX为模式的化合物以模仿“活化剂”BH3-only蛋白。
表1概括了已确定的不同类别BH3类似物的来源、模拟通路及现阶临床试验情况。
4 待进一步鉴定的BH3类似物
4.1 S1及其衍生物
S1最初被认为是一种泛BH3类似物的小分子抑制物,因为它可与BCL-2和MCL-1同时结合(尽管亲和力一般,低于微摩尔级),破坏BCL-2/BAX和MCL-1/BAK复合体,并引起BAX/BAK依赖的细胞凋亡[34]。随后的报导显示,S1并非作为一种BH3类似物存在,而是引发了BH3-only蛋白NOXA(一种MCL-1的特殊抗性配合体),并因此导致BAX的释放。近期数据给出了S1的深入鉴定。一份研究描述了BIM与BCL-2和MCL-1结合并导致BAK释放的动态变化,并指出MCL-1过度表达细胞中S1的作用可能与这一机制相关[35]。另一研究表明,自我吞噬在内质网紧张和BCL-2/BECLIN1结合破坏所致的S1触发细胞死亡中扮演了重要角色[36]。然而,最新的研究显示,S1并不是一个很好的BH3类似物。因为它并不能很好地抑制BCL-2依赖型慢性淋巴细胞性白血病。另外,S1的作用也经常受到活性氧产生及病原诱导的影响,并不能直接反应BCL-2和MCL-1的作用[37]。
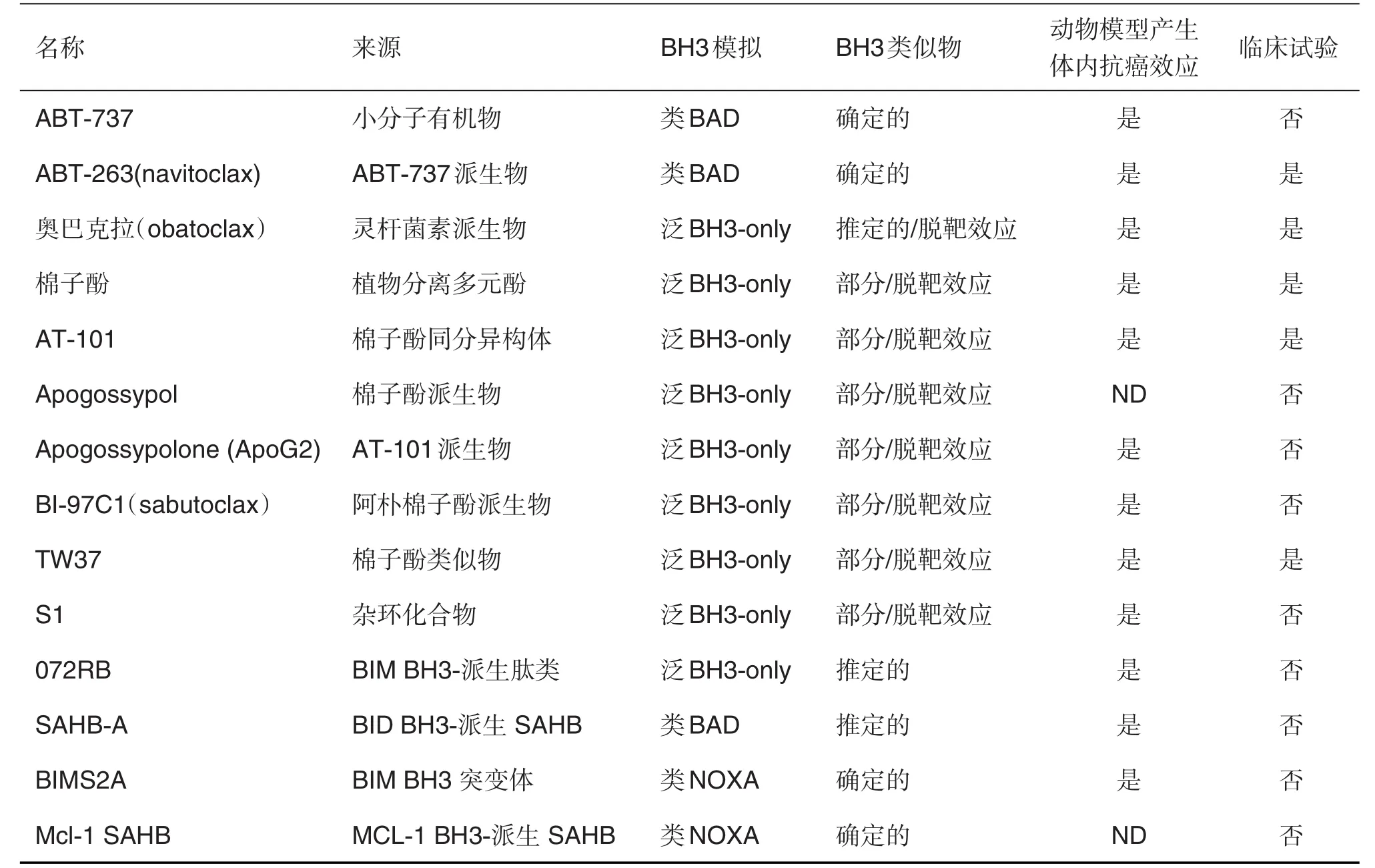
表1 已鉴定的BH3类似物
人们合成了一系列S1衍生物,其中一种具有9~35倍与BCL-2、BCL-XL和MCL-1凹槽亲和能力(10~20 nmol·L-1),并能较亲代S1更好地引发肿瘤细胞系促细胞凋亡的发生[38]。这一S1替代物可能会被认为是真正的泛BH3类似物,因为它保留了亲代S1引发BAX/BAK凋亡的能力。
4.2 ApoG2
ApoG2是一个棉子酚衍生物(缺少2个醛基),也是一个推定的BH3类似物,它可以与BCL-2、BCL-XL和MCL-1适度结合(低于微摩尔级),并在多种肿瘤细胞中引发细胞凋亡。值得注意的是,近期一份研究表明,在ApoG2致凋亡过程中,BAX和BAK是必需的[39],表明这个化合物在BH3模拟中起到一定的作用。这篇研究还表明ApoG2可以引发早期慢性淋巴细胞白血病的细胞凋亡。考虑到多种BCL-2促存活蛋白家族成员(包括MCL-1)的过表达在阻碍细胞凋亡中的重要作用,ApoG2在早期慢性淋巴细胞白血病治疗中的潜在价值得以体现。此外,ApoG2可以引起鼻咽癌过程中的细胞自我吞噬,从而很好地抑制癌细胞生长。
4.3 奥巴克拉
有2项研究对奥巴克拉这个推定的BH3类似物的新特征进行了描述。一篇研究显示,对AKT/ mTOR途径的抑制是奥巴克拉的脱靶效应[40]。另一篇结果则表明,这一化合物可以直接激活BAX[41],支持了Gavathiotis等[33]关于BIM派生的SAHB能够结合并激活BAX的报告。表明虽然奥巴克拉不能以高亲和度与促存活蛋白BCL-2结合,也不能引发BAX/BAK依赖的细胞凋亡,但它可以模拟“活化剂”BH3-only蛋白。而最新的研究表示,奥巴克拉也可以在黑色素瘤[42]和急性淋巴细胞白血病[43]引起一些特定的细胞凋亡,此外,奥巴克拉还可以引发成淋巴细胞性白血病[44]和横纹肌肉瘤细胞的坏死性凋亡[45]。最新的报告也指出,奥巴克拉同样可以引导BIM,BAX和BAK依赖的细胞凋亡,比如粒细胞性白血病[46]。目前,临床上对于奥巴克拉的使用也很局限,临床上尝试了多种单独及联合给药方案,结果奥巴克拉都仅有很低的治疗活性[47]。
4.4 BI-97D6
BI-97D6是棉子酚家族的新化合物。这一ApoG2的(-)阻转异构体可以阻止BH3肽段与BCL-XL,BCL-2,MCL-1和A1的结合,尽管亲和度一般(微摩尔级)。BI-97D6在BCL-2-转基因小鼠模型和癌症异种移植小鼠模型中都表现出体内效应[28]。本课题组观察到BI-97D6对于BAX/BAK缺陷的细胞仅表现出很小的细胞毒性,这表明其主要是通过BAX/BAK途径发挥作用。尽管实际亲和度尚不明确,但BI-97D6可能代表了BH3类似物中一种值得关注的化合物。
4.5 BH3-M6
BH3-M6是一种人工合成的以三联苯为骨架,含有一些用来模拟BH3螺旋关键氨基酸的天然空间构型功能集团的化合物[48]。计算对接研究表明,这种化合物可与BCL-XL,BCL-2和MCL-1结合。在脱细胞和完整的人类肿瘤细胞中的研究显示,BH3-M6可以阻止3种促存活蛋白与BH3-only蛋白BIM、BAD,促凋亡多BH结构域蛋白BAX、BAK的结合。这些作用导致促凋亡蛋白释放,细胞色素c释放,胱天蛋白酶活化,进而诱导凋亡。总之,BH3-M6是一个泛BCL-2家族的抑制剂[48]。然而BH3-M6的结合亲和度尚不确定,其引发的凋亡是BAX依赖的,但不是BAK依赖的。因此,BH3-M6并不满足“高亲和度结合且BAX/BAK依赖的细胞凋亡”这一BH3类似物的主要标准。
4.6 聚喹啉派生物
几种人工合成的聚喹啉派生物(尤其是喹啉的二聚派生物)可与BCL-XL,BCL-2,MCL-1和A1结合,但结合亲和度低(微摩尔级)[49]。这些化合物抑制BIM与促存活蛋白的相互作用,可以在恶性人淋巴样细胞中引发BAX/BAK依赖的细胞凋亡,但健康捐献者的外周血单核细胞无反应。虽然喹啉派生物代表了一类全新的泛BCL-2抑制剂,但受其低亲和度限制无法成为真正的BH3类似物。
4.7 Marinopyrrole A(maritoclax)
有报道称,这一源于一种海产链霉菌的天然产物可与MCL-1结合,但不与BCL-XL结合,它会破坏MCL-1/BIM复合体并引发白血病和淋巴瘤细胞系中MCL-1依赖型的细胞凋亡,但不能使BCL-XL或BCL-2依赖型细胞凋亡[50]。这些效应与蛋白酶体降解MCL-1有关。另外,作者还表示其识别了一种全新的可结合并引发MCL-1降解的选择性MCL-1抑制剂。对于Marinopyrrole A是否一个天然的靶向MCL-1的BH3类似物,仍需通过确定结合亲和度及BAX/BAK途径的参与度来评估。表2概括了待进一步确定的不同类别BH3类似物的来源、靶向、亲和力以及现阶临床试验情况。
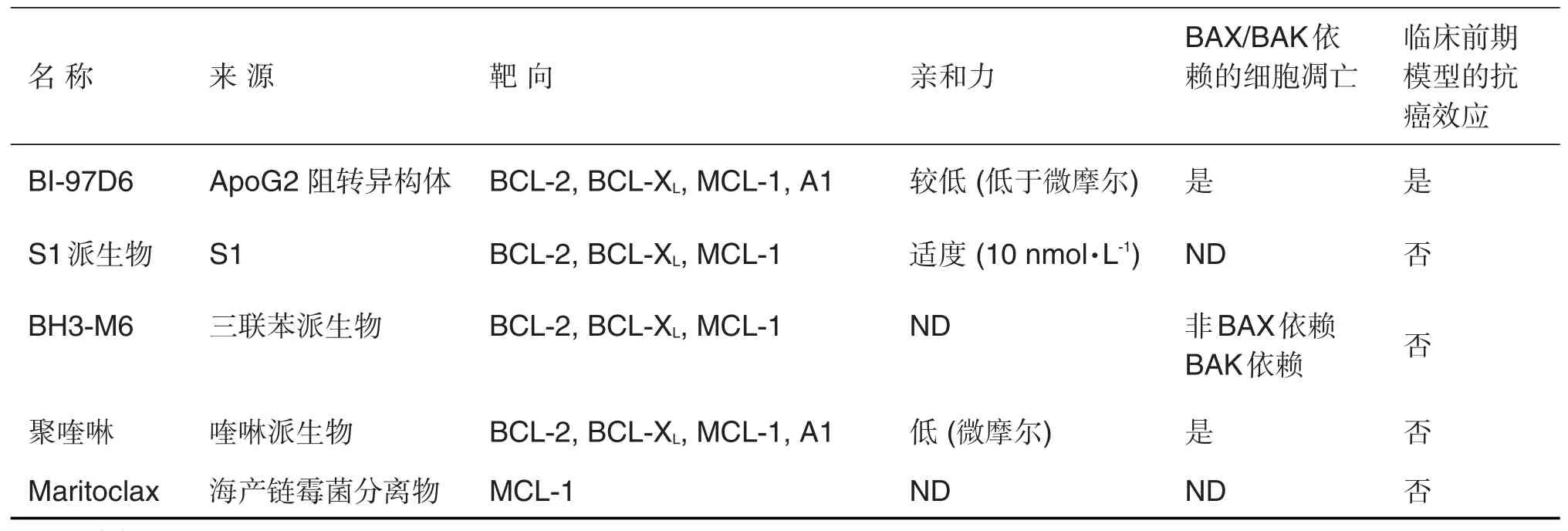
表2 待确定BH3类似物
5 最新发现具备临床实际应用价值的BH3类似物
最近有3个新的BH3类似物和一个明确的BAX活化剂分子被发现,它们的特征概述于表3。
5.1 高特异性BCL-2抑制剂ABT-199
ABT-199是ABT-263的合成派生物,它的研制是为了推动ABT-263的临床应用[51]。剂量限制血小板减少症是使用ABT-263后可在患者身上迅速观察到的不良反应。血小板减少症并非由于血小板生成量的减少,而是BCL-XL活性抑制的正常效应,因为BCL-XL的生理效应就是保护衰老血小板免遭细胞凋亡。在BCL-2小分子复合物的X射线晶体结构的基础上设计出ABT-263派生物,用来避免这一副作用。ABT-199仅与BCL-2高亲和度结合,但不作用于BCL-XL,并能在很多血液系统肿瘤细胞系中引发BAX/BAK依赖的细胞凋亡。除了保护血小板,这一真正的BH3类似物还提高了动物模型中BCL-2依赖的人类恶性血液病的复发。目前临床上使用的ABT-199,主要从BCL-XL/ABT-737复合物的结构中发展而来,从而获得了既能高特异性结合BCL-2又能将毒性降到最低的化合物,大大增加了这一化合物在临床上的可用性[52]。
5.2 BCL-XL和MCL-1拮抗剂BIM SAHB
LaBelle等[53]近期研究鉴定了一个以BIM(能结合5种主要的促存活蛋白BCL-2)的BH3螺旋为模板的SAHB的药理学潜能。BIM SAHB与BCL-XL,BCL-W,MCL-1和A1以纳摩尔级亲和,阻碍BCLXL与BAX,MCL-1与BAK的结合,并直接引发BAX/ BAK依赖的线粒体细胞色素c释放,这显示了真正的泛BH3类似物的特点(表3)。BIM SAHB使线粒体共区域化,激活胱天蛋白酶3和胱天蛋白酶7,重启对ABT-737有抗性的白血病/淋巴癌细胞的细胞死亡(对良性细胞无作用),并在人急性髓性白血病的异种移植动物模型中表现出肿瘤抑制活性。这些体内外的效应依赖于BH3序列。选择性活化骨髓BIM缺乏小鼠的异常淋巴浸润中的细胞死亡,没有明显副作用等特点,使应用这一新的真正的靶向大范围BCL-2促存活蛋白(类BIM活性)的BH3替代物来完成BIM BH3替代策略有良好的治疗前景。
5.3 新的小分子MCL-1特异性抑制剂MIM1
同时,Stewart等[54]对能从结合的MCL-1上取代MCL-1 SAHB的小分子进行了高通量筛选,有超过70000种结构差异的小分子被竞争性荧光偏振结合测定筛选出来。后续进行不同的筛选产生28种化合物,接着进行了基于脂质体和基于细胞的凋亡诱导实验。其中最活泼的分子,即MCL-1抑制剂分子1(MIM1)有一个噻唑核心,并辅以甲基、三乙基亚胺基和苯三酚等取代基。MIM1是一种高特异性MCL-1抑制剂,通过靶向MCL-1的疏水腔阻止MCL-1介导的促凋亡BAX抑制,并在MCL-1依赖的白血病细胞中引发BAX/BAK细胞凋亡,BCL-XL依赖细胞无此反应[55]。随着MIM1的提纯研究,MIM1已经成为新一代MCL-1特异性BH3类似物的原型,并在治疗MCL-1为重要因素的恶性肿瘤中发挥了重要作用。MIM1可以与ABT-737发挥协同作用,在白血病细胞中产生MCL-1依赖型的毒素抑制其生长。另一项最新研究发现了另外一个MCL-1抑制剂A-1210477,其作用和MIM1基本相同,可以与navitoclax协作共同在肿瘤细胞中发挥作用[56]。
5.4 BAX直接活化剂BAM7
Gavathiotis等[33]报道,源于BIM的SAHB能与BAX的一个位点结合并直接引发其活性。通过在电脑中筛选能将SAHB从与其配合的BAX中置换出来的小分子,识别出一种BAX活化剂分子BAM7,它选择性作用于BAX活化位点而非传统的用于结合促存活BCL-2蛋白的BH3结合凹槽。这一化合物(以吡唑啉酮为核心辅以取代基)在BAK缺陷细胞中引发BAX活化和BAX介导的细胞凋亡。这些资料支持了“活化剂”BH3类似物可以人工设计这一概念。
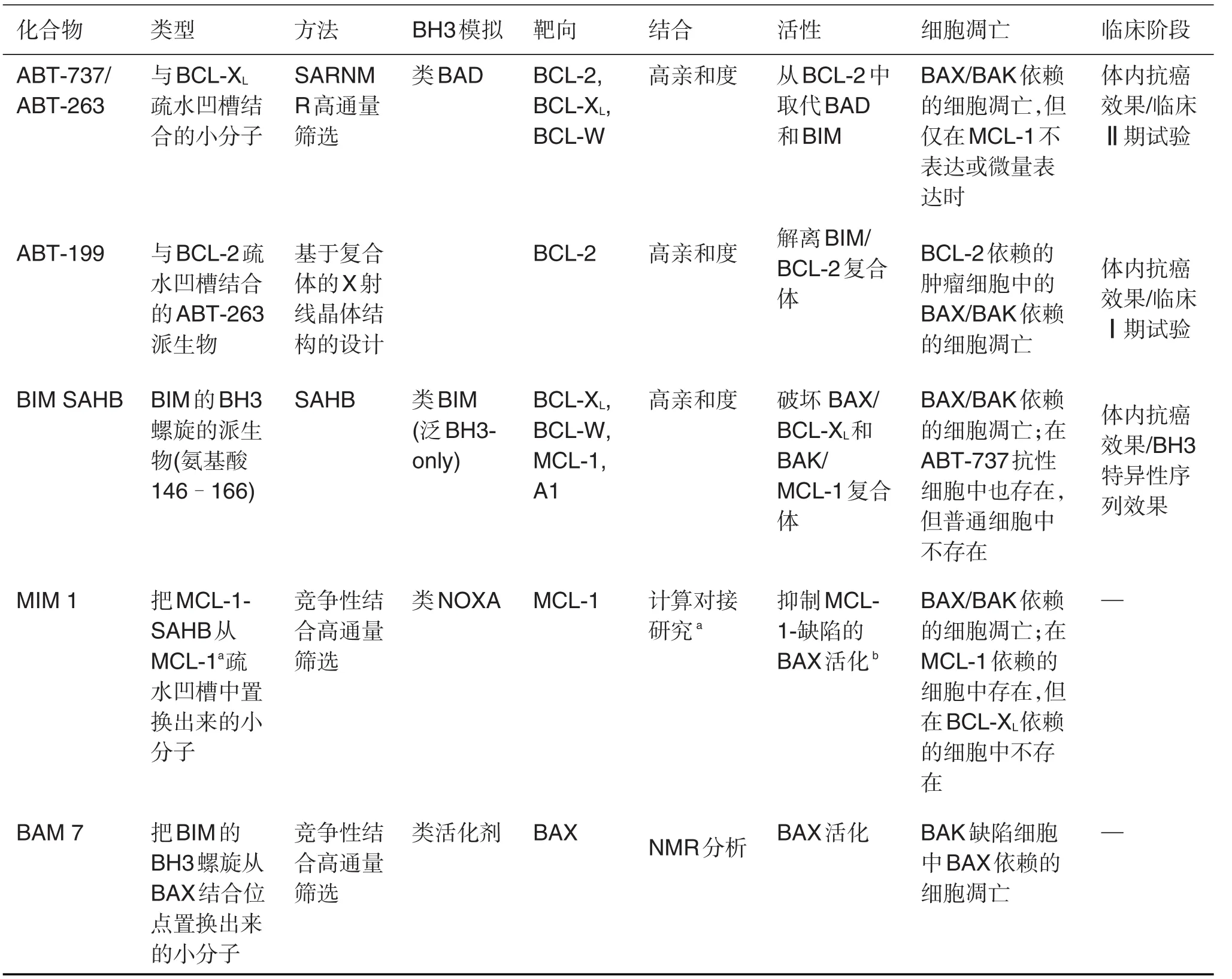
表3 BH3类似物ABT-199,BIM SAHB,MIM 1和BAM7的鉴定及其与ABT-737/ABT-263的对比
6 展望
小分子BAM7通过直接结合活化BAX引起细胞凋亡,推定的BH3类似物奥巴克拉可以直接活化BAX。这些发现表明,即使一个化合物不能满足标准BH3类似物的全部要求,仍可以通过直接活化模式来发挥作用,开通了一条研究发展“活化剂”BH3类似物的道路。
至于促存活蛋白BCL-2活性的抑制剂,最近有8个新的小分子被识别。其中1个针对BCL-2,2个选择性作用于MCL-1,另外5个针对多个抗凋亡蛋白。其中,BI-97D6、BH3-M6、聚喹啉、maritoclax和S1派生物都尚未满足一个标准BH3类似物的要求。除非通过深入研究证明这些化合物可以像标准BH3类似物一样发挥作用,否则为了避免误导性脱靶效应等原因,它们无法得到实际应用。关于BH3模块与BCL-XL和MCL-1的疏水凹槽特异性结合的分子决定因子(包括多肽序列的组织)的研究对于提高候选BH3类似物的亲和度、生物学效率和治疗潜力方面起着重要作用。三种真正的BH3类似物的发现正可谓锦上添花,因为它们代表三种新型BH3类似物。其中,ABT-199是BCL-2特异性的抗性配体,我们正期待着其临床试验的最终结果。另外2个是用SAHB方法鉴定出来的,MIM1对MCL-1呈高度特异性,而BIM SAHB几乎具备一个泛BH3类似物的全部特点。
尽管BH3类似物在实验室研究中取得了很大的进展,在临床试验方面还有很长的路要走。一个突出的问题是无论是单独给药还是联合给药,BH3类似物(例如棉子酚和奥巴克拉)的治疗效果都十分有限。最主要的原因是这些化合物的副作用,为了避免大剂量导致的严重不良反应,临床上不得不减少剂量,这使得治疗效果不尽如人意。令人欣喜的是,近期发现ABT-199几乎没有副作用,这使得BH3类似物的临床试验研究有了进一步的发展。
综上所述,新型BH3类似物成为BH3类似物研究的主要方向,具有广阔的研究前景及应用价值。
[1]Strasser A,Cory S,Adams JM.Deciphering the rules of programmed cell death to improve therapy of cancer and other diseases[J].EMBO J,2011,30(18):3667-3683.
[2]Elgendy M,Sheridan C,Brumatti G,Martin SJ. Oncogenic Ras-induced expression of Noxa and Beclin-1 promotes autophagic cell death and limits clonogenic survival[J].Mol Cell,2011,42(1):23-35.
[3]Baell JB1,Huang DC.Prospects for targeting the Bcl-2 family of proteins to develop novel cytotoxic drugs[J].Biochem Pharmacol,2002,64(5-6):851-863.
[4]OltersdorfT, Elmore SW, ShoemakerAR,Armstrong RC,Augeri DJ,Belli BA,et al.An inhibitor of Bcl-2 family proteins induces regres⁃sion of solid tumours[J].Nature,2005,435(7042):677-681.
[5]Tse C1,Shoemaker AR,Adickes J,Anderson MG,Chen J,Jin S,et al.ABT-263:a potent and orally bioavailable Bcl-2 family inhibitor[J].Cancer Res,2008,68(9):3421-3428.
[6]van Delft MF,Wei AH,Mason KD,Vandenberg CJ,Chen L,Czabotar PE,et al.The BH3 mimetic ABT-737 targets selective Bcl-2 proteins and efficiently induces apoptosis via Bak/Bax if Mcl-1 is neutralized[J].Cancer Cell,2006,10(5):389-399.
[7]Lessene G,Czabotar PE,Colman PM.BCL-2 family antagonists for cancer therapy[J].Nat Rev Drug Discov,2008,7(12):989-1000.
[8] Quinn BA,Dash R,Azab B,Sarkar S,Das SK,Kumar S,et al.Targeting Mcl-1 for the therapy of cancer[J].Expert Opin Investig Drugs,2011,20(10):1397-1411.
[9]Billard C.Development of Noxa-like BH3 mimetics for apoptosis-based therapeutic strategy in chronic lymphocytic leukemia[J].Mol Cancer Res,2012,10(6):673-676.
[10]Czabotar PE,Lessene G,Strasser A,Adams JM. Control of apoptosis by the BCL-2 protein family:implications for physiology and therapy[J].Nat Rev Mol Cell Biol,2014,15(1):49-63.
[11]Leshchiner ES,Braun CR,Bird GH,Walensky LD. Direct activation of full-length proapoptotic BAK[J].Proc Natl Acad Sci USA,2013,110(11):E986-E995.
[12]Llambi F,Moldoveanu T,Tait SW,Bouchier-Hayes L,Temirov J,McCormick LL,et al.A unified model of mammalian BCL-2 protein family interac⁃tions at the mitochondria[J].Mol Cell,2011,44(4):517-531.
[13]Doerflinger M,Glab JA,Puthalakath H.BH3-only proteins:a 20-year stock-take[J].FEBS J,2015,282(6):1006-1016.
[14]Oda E,Ohki R,Murasawa H,Nemoto J,Shibue T,Yamashita T,et al.Noxa,a BH3-only member of the Bcl-2 family and candidate mediator of p53-induced apoptosis[J].Science,2000,288(5468):1053-1058.
[15] Hershko T,Ginsberg D.Up-regulation of Bcl-2 homology 3(BH3)-only proteins by E2F1 medi⁃ates apoptosis[J].J Biol Chem,2004,279(10):8627-8634.
[16]DijkersPF, MedemaRH, LammersJW,Koenderman L,Coffer PJ.Expression of the pro-apoptotic Bcl-2 family member Bim is regulated by the forkhead transcription factor FKHR-L1[J]. Curr Biol,2000,10(19):1201-1204.
[17]Ley R,Hadfield K,Howes E,Cook SJ.Identifica⁃tion of a DEF-type docking domain for extracellular signal-regulated kinases 1/2 that directs phosphor⁃ylation and turnover of the BH3-only protein BimEL[J].J Biol Chem,2005,280(18):17657-17663.
[18]Clybouw C,Merino D,Nebl T,Masson F,Robati M,O′Reilly L,et al.Alternative splicing of Bim and Erk-mediated Bim(EL)phosphorylation are dispens⁃able for hematopoietic homeostasis in vivo[J].Cell Death Differ,2012,19(6):1060-1068.
[19]Lessene G,Czabotar PE,Colman PM.BCL-2 family antagonists for cancer therapy[J].Nat Rev Drug Discov,2008,7(12):989-1000.
[20]Roberts AW,Seymour JF,Brown JR,Wierda WG,Kipps TJ,Khaw SL,et al.Substantial susceptibili⁃ty of chronic lymphocytic leukemia to BCL2 inhibi⁃tion:results of a phase I study of navitoclax in pa⁃tients with relapsed or refractory disease[J].J Clin Oncol,2012,30(5):488-496.
[21]Cleary JM,Lima CM,Hurwitz HI,Montero AJ,Franklin C,Yang J,et al.A phase I clinical trial of navitoclax,a targeted high-affinity Bcl-2 family in⁃hibitor,in combination with gemcitabine in patients with solid tumors[J].Invest New Drugs,2014,32(5):937-945.
[22]Vela L,Marzo I.Bcl-2 family of proteins as drug targets for cancer chemotherapy:the long way of BH3 mimetics from bench to bedside[J].Curr Opin Pharmacol,2015,23:74-81.
[23]Billard C.Design of novel BH3 mimetics for the treatment of chronic lymphocytic leukemia[J]. Leukemia,2012,26(9):2032-2038.
[24]Joudeh J,Claxton D.Obatoclax mesylate:phar⁃macology and potential for therapy of hematological neoplasms[J].Expert Opin Investig Drugs,2012,21(3):363-373.
[25]Kitada S,Leone M,Sareth S,Zhai D,Reed JC,Pellecchia M.Discovery,characterization,and structure-activity relationships studies of proapop⁃toticpolyphenols targeting B-cell lymphocyte/leuke⁃mia-2 proteins[J].J Med Chem,2003,46:4259-4264.
[26]Spijkers-Hagelstein JA,Schneider P,Pinhancos SM,Garrido Castro P,Pieters R,Stam RW.Glucocorti⁃coid sensitisation in mixed lineage leukaemiarearranged acute lymphoblastic leukaemia by the pan-BCL-2 family inhibitors gossypol and AT-101[J].Eur J Cancer,2014,50(9):1665-1674.
[27]Azmi AS,Wang Z,Philip PA,Mohammad RM,Sarkar FH.Emerging Bcl-2 inhibitors for the treat⁃ment of cancer[J].Expert Opin Emerg Drugs,2011,16(1):59-70.
[28]Wei J,Stebbins JL,Kitada S,Dash R,Placzek W,Rega MF,et al.BI-97C1,an optically pure Apo⁃gossypol derivative as pan-active inhibitor of anti⁃apoptotic B-cell lymphoma/leukemia-2(Bcl-2)family proteins[J].J Med Chem,2010,53(10):4166-4176.
[29]Walensky LD,Kung AL,Escher I,Malia TJ,Barbuto S,Wright RD,et al.Activation of apoptosis in vivo by a hydrocarbon-stapled BH3 helix[J]. Science,2004,305(5689):1466-1470.
[30]Ghiotto F,Fais F,Tenca C,Tomati V,Morabito F,Casciaro S,et al.Apoptosis of B-cell chronic lympho⁃cytic leukemia cells induced by a novel BH3 pepti⁃domimetic[J].Cancer Biol Ther,2009,8(3):263-271.
[31]Lee EF,Czabotar PE,van Delft MF,Michalak EM,Boyle MJ,Willis SN,et al.A novel BH3 ligand that selectively targets Mcl-1 reveals that apoptosis can proceed without Mcl-1 degradation[J].J Cell Biol,2008,180(2):341-355.
[32]Stewart ML,Fire E,Keating AE,Walensky LD. The MCL-1 BH3 helix is an exclusive MCL-1 inhibi⁃tor and apoptosis sensitizer[J].Nat Chem Biol,2010,6(8):595-601.
[33]Gavathiotis E,Suzuki M,Davis ML,Pitter K,Bird GH,Katz SG,et al.BAX activation is initiated at a novel interaction site[J].Nature,2008,455(7216):1076-1081.
[34]Zhang Z,Song T,Zhang T,Gao J,Wu G,An L,et al.A novel BH3 mimetic S1 potently induces Bax/Bak-dependent apoptosis by targeting both Bcl-2 and Mcl-1[J].Int J Cancer,2011,128(7):1724-1735.
[35]Song T,Chang X,Zhang Z,Liu Y,Shen X.S1,a novel pan-BH3 mimetic,induces apoptosis in Mcl-1-overexpressing cells through Bak[J].J Pharma⁃col Sci,2012,119(4):330-340.
[36]Zhong JT,Xu Y,Yi HW,Su J,Yu HM,Xiang XY,et al.The BH3 mimetic S1 induces autophagy through ER stress and disruption of Bcl-2/Beclin 1 interaction in human glioma U251 cells[J].Cancer Lett,2012,323(2):180-187.
[37]Soderquist R,Pletnev AA,Danilov AV,Eastman A. The putative BH3 mimetic S1 sensitizes leukemia to ABT-737 by increasing reactive oxygen species,inducing endoplasmic reticulum stress,and upregu⁃lating the BH3-only protein NOXA[J].Apoptosis,2014,19(1):201-209.
[38]Song T,Li X,Chang X,Liang X,Zhao Y,Wu G,et al.3-Thiomorpholin-8-oxo-8H-acenaphtho[1,2-b]pyrrole-9-carbonitrile(S1)derivatives as pan-Bcl-2-inhibitors of Bcl-2,Bcl-xL and Mcl-1[J]. Bioorg Med Chem,2013,21(1):11-20.
[39]Balakrishnan K,Aggarwal S,Wierda W,Gandhi V. Bax and Bak are required for apogossypolone,a BH3-mimetic,induced apoptosis in chronic lym⁃phocyticleukemiacells[J].LeukLymphoma,2013,54(5):1097-1100.
[40]Espona-Fiedler M,Soto-Cerrato V,Hosseini A,Lizcano JM,Guallar V,Quesada R,et al.Identification of dual mTORC1 and mTORC2 inhibitors in melanoma cells:prodigiosin vs.obatoclax[J]. Biochem Pharmacol,2012,15;83(4):489-496.
[41]SmootRL, BlechaczBR,WerneburgNW,Bronk SF,Sinicrope FA,Sirica AE,et al.A Baxmediated mechanism for obatoclax-induced apop⁃tosis of cholangiocarcinoma cells[J].Cancer Res,2010,70(5):1960-1969.
[42] Wroblewski D,Jiang CC,Croft A,Farrelly ML,Zhang XD,Hersey P.OBATOCLAX and ABT-737 induce ER stress responses in human melanoma cells that limit induction of apoptosis[J].PLoS One,2013,8(12):e84073.
[43]Heidari N,Hicks MA,Harada H.GX15-070(oba⁃toclax) overcomes glucocorticoid resistance in acute lymphoblastic leukemia through induction of apoptosis and autophagy[J].Cell Death Dis,2010,1:e76.
[44]Urtishak KA,Edwards AY,Wang LS,Hudome A,Robinson BW,Barrett JS,et al.Potent obatoclax cytotoxicity and activation of triple death mode killing across infant acute lymphoblastic leukemia[J]. Blood,2013,121(14):2689-2703.
[45]Basit F,Cristofanon S,Fulda S.Obatoclax(GX15-070)triggers necroptosis by promoting the assembly of the necrosome on autophagosomal membranes[J].Cell Death Differ,2013,20(9):1161-1173.
[46]Rahmani M,Aust MM,Attkisson E,Williams DC Jr,Ferreira-Gonzalez A,Grant S.Inhibition of Bcl-2 antiapoptotic members by obatoclax potently enhances sorafenib-induced apoptosis in human myeloid leukemia cells through a Bim-dependent process[J].Blood,2012,119(25):6089-6098.
[47]Schimmer AD,Raza A,Carter TH,Claxton D,Erba H,DeAngelo DJ,et al.A multicenter phaseⅠ/Ⅱstudy of obatoclax mesylate administered as a 3-or 24-hour infusion in older patients with previ⁃ously untreated acute myeloid leukemia[J].PLoS One,2014,9(10):e108694.
[48]Kazi A,Sun J,Doi K,Sung SS,Takahashi Y,Yin H,et al.The BH3 alpha-helical mimic BH3-M6 disrupts Bcl-X(L),Bcl-2,and MCL-1 protein-protein interactions with Bax,Bak,Bad,or Bim and in⁃duces apoptosis in a Bax-and Bim-dependent manner[J].J Biol Chem,2011,286(11):9382-9392.
[49]Saugues E,Debaud AL,Anizon F,Bonnefoy N,Moreau P.Synthesis and biological activities of polyquinoline derivatives:new Bcl-2 family protein modulators[J].Eur J Med Chem,2012,57:112-125.
[50]Doi K,Li R,Sung SS,Wu H,Liu Y,Manieri W,et al.Discovery of marinopyrrole A(maritoclax)as a selective Mcl-1 antagonist that overcomes ABT-737 resistance by binding to and targeting Mcl-1 for proteasomal degradation[J].J Biol Chem,2012,287(13):10224-10235.
[51]Davids MS,Letai A.Targeting the B-cell lymphoma/ leukemia 2 familyin cancer[J].J Clin Oncol,2012,30:3127-3135.
[52]Souers AJ,Leverson JD,Boghaert ER,Ackler SL,Catron ND,Chen J,et al.ABT-199,a potent and selective BCL-2 inhibitor,achieves antitumor activi⁃ty while sparing platelets[J].Nat Med,2013,19(2):202-208.
[53]LaBelle JL,Katz SG,Bird GH,Gavathiotis E,Stewart ML,Lawrence C,et al.A stapled BIM peptide overcomes apoptotic resistance in hemato⁃logic cancers[J].J Clin Invest,2012,122(6):2018-2031.
[54]Cohen NA,Stewart ML,Gavathiotis E,Tepper JL,Bruekner SR,Koss B,et al.A competitive stapled peptide screen identifies a selective small mole⁃cule that overcomes MCL-1-dependent leukemia cell survival[J].Chem Biol,2012,19(9):1175-1186.
[55]Kritzer JA.The secret of MIM:a novel,MCL-1-specific small molecule[J].Chem Biol,2012,19(9):1082-1083.
[56]Leverson JD,Zhang H,Chen J,Tahir SK,Phillips DC,Xue J,et al.Potent and selective small-molecule MCL-1 inhibitors demonstrate ontarget cancer cell killing activity as single agents and in combination with ABT-263(navitoclax)[J]. Cell Death Dis,2015,6:e1590.
Mechanism of BH3 mimetics promoting cell apoptosis and its latest clinical research progress
ZHANG Yue*,ZHANG Yi-jia*,LI Xue-jun
(Pharmacology Department,School of Basic Medical Sciences,Peking University, Beijing 100191,China)
Targeting cell apoptosis is currently the most promising therapy for cancer treatment. The BH3-only protein,which is a member of Bcl-2 family,can bind to the pro-survival members of the family and neutralize their functional activities to induce apoptosis(ie,to isolate pro-apoptotic members of the Bcl-2 family).BH3 mimetics,a kind of small molecule compounds,has the ability to mimic the BH3-only protein to induce apoptosis.The prototype of BH3 mimetics is ABT-737,who can selectively targets on BCL-XL,BCL-2 and BCL-W(but not MCL-1 and A1).ABT-263,a derivative of ABT-737,has a better performance of inducing apoptosis and inhibiting the growth of tumor in clinical trials.At this stage,some presumably BH3 mimetics has entered the clinical stage,while a large part of them is still being characterized and tested.Basing on the mechanism of BH3-only protein,this review summarize a variety of BH3 mimetics which have been widely recognized,and show the latest developments of newly diagnosed BH3 mimetics in the field.
anti-cancer drugs;BH3 mimetics;BCL-2 protein;BH3-only protein
LI Xue-jun,E-mail:xjli@bjmu.edu.cn
R966,R979.1
A
1000-3002-(2017)01-0001-11
10.3867/j.issn.1000-3002.2017.01.001
2016-09-28接受日期:2017-01-17)
(本文编辑:齐春会)
国家自然科学基金(81673453);国家自然科学基金(81473235);国家自然科学基金(91129727);教育部111项目(B07001)
张岳,理学学士,主要从事分子药理学研究;张伊佳,医学学士,主要从事分子药理学研究。
李学军,E-mail:xjli@bjmu.edu.cn
*共同第一作者
Foundation item:The project supported by National Natural Science Foundation of China(81673453;National Natural Science Foundation of China(81473235);National Natural Science Foundation of China(91129727);and"111 Program"of Ministry of Education(B07001)
*Co-first author.
