正柴胡饮对对乙酰氨基酚所致小鼠急性肝损伤的保护作用
2017-03-28刘霞飞杨方秀汪玉馨汤道权陆益红
刘霞飞,吴 骁,杨方秀,汪玉馨,汤道权,张 玫,陆益红
(1.徐州医科大学院药物分析教研室,江苏徐州 221004;2.江苏省食品药品监督检验研究院,江苏南京210008;3.中国药科大学药物代谢动力学重点实验室,江苏南京 210009)
正柴胡饮对对乙酰氨基酚所致小鼠急性肝损伤的保护作用
刘霞飞1,2,吴 骁1,2,杨方秀1,2,汪玉馨2,3,汤道权1,张 玫2,陆益红1,2
(1.徐州医科大学院药物分析教研室,江苏徐州 221004;2.江苏省食品药品监督检验研究院,江苏南京210008;3.中国药科大学药物代谢动力学重点实验室,江苏南京 210009)
目的研究正柴胡饮(ZCH)对对乙酰氨基酚(APAP)所致小鼠急性肝损伤的保护作用。方法将ICR小鼠随机分为ZCH单次治疗给药组(0 h ig给予APAP,6 h ig给予ZCH)、ZCH多次治疗给药组(第1天ig给予APAP,第2天~第4天ig给予ZCH)、ZCH多次预防给药组(前3天ig给予ZCH,第4天ig给予APAP)。单次治疗给药组、多次治疗给药组及多次预防给药组均同时设正常对照组和APAP模型组(0 h ig给予APAP),单次治疗给药组同时设ZCH单独给药组(0 h ig给予ZCH)。APAP的给药量为500 mg·kg-1,ZCH的给药量以柴胡生药计约为36 g·kg-1。每组均在末次给药24 h后采集血浆样本,测定血浆中谷丙转氨酶(GPT)和谷草转氨酶(GOT)活性,HE染色观察肝组织病变。利用液相色谱质谱联用技术、SIMCA及SPSS16.0软件进行血浆代谢组学分析。结果与正常对照组相比,模型组血浆GPT和GOT酶活性均显著升高(P<0.01),单独给药组血浆GPT和GOT活性均无显著差异;与模型组相比,单次治疗给药组、多次治疗给药组及多次预防给药组的GPT和GOT活性显著降低(P<0.01),但分别与正常对照组相比仍有显著差异(P<0.01)。病理切片结果显示,正常对照组和单独给药组均未见明显肝损伤。与模型组相比,单次治疗给药组肝损伤面积、多次治疗给药组肝损伤面积和多次预防给药组肝损伤程度明显减轻。偏最小二乘辨别分析法(PLS-DA)散点图表明,单次治疗给药组、多次治疗给药组和多次预防给药组分别远离APAP模型组,而向正常对照组方向移行。代谢谱结果表明,ZCH可调节由APAP引起的内源性物质变化,使其趋于正常,这些内源性物质涉及脂代谢、氨基酸代谢、糖代谢及能量代谢。结论ZCH对由APAP所致的药源性肝损伤具有保护作用,代谢组学可灵敏、准确地预测肝损伤的发生发展,为临床合理用药及阐明其作用机制提供依据。
正柴胡饮;对乙酰氨基酚;药源性肝损伤;代谢组学
对乙酰氨基酚(paracetamol,acetaminophen,APAP)为乙酰苯胺类解热镇痛药,因其对普通感冒或流行性感冒引起的发热及缓解多种疼痛有较好的疗效而成为世界上销量最大的非处方药。其大剂量服用或多种含APAP的药物联合使用都有可能造成APAP过量引发毒性代谢产物大量蓄积而导致药源性肝损伤(drug-induced liver injury,DILI)的发生,严重时可导致死亡[1]。因此,寻找防治或减轻APAP所致的肝损伤的药物已逐渐成为人们关注的主要问题,并取得许多进展[2-4]。
约95%APAP在经Ⅱ相代谢与体内的葡萄糖醛酸等结合成大分子缀合物而排毒;当体内蓄积了大量APAP后,部分APAP在细胞色素P450酶作用下生成毒性中间代谢产物N-乙酰基-对苯醌亚胺(N-acetyl-p-benzoquinone imine,NAPQI),少量NAPQI会和体内的内源性物质谷胱甘肽结合而解毒,但当体内蓄积了大量毒性产物时,体内谷胱甘肽耗竭,过量NAPQI和肝细胞中的大分子蛋白发生不可逆的共价结合而引起肝损伤[5]。Demirbas等[6]研究表明,口服APAP后可引起血清转氨酶升高。近年研究发现,APAP的肝毒性机制和线粒体损伤及氧自由基的产生有关[7],有学者认为是细胞内钙离子超载、脂质过氧化反应介导APAP的肝损伤[8]。因此,重视APAP的肝毒性同时寻找能减轻或治疗其引发的急性肝损伤的物质成为药学工作者关注的一个热点。
柴胡(Radix Bupleuri,RB)以干燥根入药,味辛、苦,性微寒,能解表退热,疏肝解郁,用于感冒发热,胸胁胀痛。含有三萜及其皂苷和挥发油等成分,有解热、镇痛、抗菌、抗炎及抗肝损伤等功效[9]。国内曾有多篇文献报道,用四氯化碳、乙醇及APAP制备小鼠肝损伤模型或肝癌模型,RB水提液或醇提液对肝起到明显的保护作用,并可降低肝癌的发生率和死亡率,但机制不明确[10-14]。
“正柴胡饮(Zheng Chaihu Yin,ZCH)”为明代名医张景岳著《景岳全书》中的解表平散代表方,由RB、陈皮、防风、赤芍药、生姜和甘草所组成,具有发散风寒,解热止痛的功效,主治外感风寒初起、恶寒发热、无汗、头痛、鼻塞、喷嚏、咽痒咳嗽和四肢酸痛等证[15]。当外感风寒发热时,临床常见含APAP的解热镇痛药与ZCH等中成药合用。尽管上述文献报道了RB可减轻APAP引发的实验动物肝损伤,但其作用机制尚不明确。这种中西药配伍是否合理?当过量使用含APAP的解热镇痛药时RB能否起到保肝作用?其作用机制是什么?这些都是亟待解决的问题,中医药防治作用是综合的、整体的和动态的,因此有必要引入整体化及系统化的研究方法对ZCH肝保护作用进行综合评价。
代谢组学是继基因组学和蛋白质组学后发展起来的系统生物学技术的一个重要分支,是研究细胞、组织或器官在受到外界微小扰动后体内内源性物质的动态变化规律,通过体内内源性物质受到外界扰动前后的差异来发现和疾病相关的潜在生物标志物。它弥补了基因组学及蛋白质组学的不足,即基因在体内不一定全部得到表达,而蛋白质在体内也不一定存在活性,基因及蛋白质的变化最终都会影响到体内的小分子内源性物质,通过给药前后分析体内内源性物质的动态变化规律,可为疾病发生机制的阐明奠定基础[16]。近年来,基于液质联用、气质联用、核磁等代谢组学技术的发展,代谢组学已成为探寻中、西药相互作用机制及毒性生物标志物发现的重要方法,通过有监督或无监督的模式识别方法为疾病潜在生物标志物的发掘提供了崭新而可靠的手段,为疾病的预防、早期诊断及治疗提供有效的参考依据。Sun等[17]采用液质联用技术分析大鼠经胃APAP后尿液中和毒性相关的代谢产物并寻找到和氧化应激反应过程相关的生物标志物。
综上所述,本课题拟采用液质联用技术,通过研究APAP肝损伤过程中,ZCH单次、多次治疗给药及多次预防给药后ICR小鼠代谢组学上的变化,揭示与肝损伤相关的内源性物质的种类与程度,从而探明ZCH解毒和保肝的可能作用靶点。为中药的药效作用整体评价以及中西药合用的合理性提供新的方法。
1 材料与方法
1.1 试剂、药物和仪器
HPLC级甲酸购自美国Sigma-Aldrich公司,HPLC级乙腈购自美国Fisher公司,超纯水由本实验室Milli-Q超纯水系统(Millipore,Mil-ford,MA,USA)制得。谷丙转氨酶(glutamic pyruvic transami⁃nase,GPT)及谷草转氨酶(glutamic oxaloacetic transaminase,GOT)试剂盒购自浙江伊利康生物技术有限公司。ZCH水提液的制备:按照10∶10∶8∶4∶15∶7的比例称取RB(产地:甘肃)、陈皮(产地:浙江)、防风(产地:河北)、甘草(产地:内蒙古)、赤芍(产地:安徽)和生姜(产地:山东)生药饮片适量,浸泡30 min,首次加10倍水煎煮1.5 h,第二次加8.5倍水煎煮1.5 h,将所得药汁水提醇沉24 h后,减压浓缩至密度为1.25~1.30,含RB生药3.8 kg·L-1。上述水提液由精华药业有限公司提供(批号为20140305),收率为0.3%。APAP(化学纯,含量≥98%)由国药集团化学试剂有限公司提供。实验时以0.5%羧甲纤维素钠(carboxymethyl cellulose sodium,CMC-Na)制成均匀混悬液。甜菜碱、肌酸和18种氨基酸等对照品由中国食品药品检定研究院提供,肉毒碱和溶血磷脂胆碱等对照品由美国Sigma公司提供。
Agilent 1290超高效液相色谱仪(ultra-perfor⁃mance liquid chromatography,UPLC)(美国安捷伦公司),Bruker Maxis Impact quadrupole-time-offlight mass spectrometry(Q-TOF-MS)(德国布鲁克公司),SIEMENS Dimension Xpand plus全自动生化分析仪(德国西门子公司),湘仪L-550台式低速离心机(湖南湘潭离心机有限公司),Beckman Coulter Allegra 64R台式高速冷冻离心机(美国贝克曼库尔特有限公司),METTLER TOLEDO十万分之一及百万分之一电子天平(瑞士梅特勒-托利多仪器有限公司),自动涡旋混合器ZH-2(天津药典标准仪器厂),Thermo真空离心浓缩挥干仪(美国赛默飞世尔科技公司)。
1.2 动物、分组和处理
ICR小鼠,SPF级,雄性,体质量18~22 g,由扬州大学比较医学中心提供,实验动物生产许可证号:SCXK(苏)2012-0004,动物饲养于江苏省食品药品监督检验研究院屏障系统内,实验动物使用许可证号:SYXK(苏)2012-0042,饲养温度:20℃~26℃;相对湿度:40%~70%,明暗10/14 h,自由通风。给药前禁食12 h,自由饮水。将ICR小鼠随机分为单次治疗给药组(0 h ig给予APAP,6 h ig给予ZCH)、多次治疗给药组(第1天ig给予APAP,第2天~第4天ig给予ZCH)、多次预防给药组(ig给予ZCH 3 d,第4天ig给予APAP)。单次治疗给药组、多次治疗给药组和多次预防给药组均同时设正常对照组和APAP模型组(0 h ig给予APAP),单次治疗给药组同时设ZCH单独给药组(0 h ig给予ZCH)。各组每组10只小鼠。APAP的给药量为500 mg·kg-1,ZCH给药量以RB生药计约为36 g·kg-1。各给药组均于末次给药24 h后于小鼠右眼内眦静脉取血,置于EDTA抗凝管中,3000×g离心10 min,取上清。取肝,用预冷生理盐水洗净吸干,称重,并肉眼观察肝大体变化。
1.3 生化指标测定及HE染色观察肝组织病理变化
全自动生化分析仪测定血浆中GPT和GOT活性,每组随机选取5只动物肝于10%甲醛溶液中固定,常规病理切片,HE染色,镜像观察肝脏组织病理变化。
1.4 代谢组样品制备
实验前,取上述血浆样品低温解冻,各取100 μL解冻后的样本,加入400 μL含0.1%甲酸的甲醇-乙腈溶液(体积1∶1),涡旋3 min,4℃20 000×g离心10 min,取上清液300 μL经真空离心浓缩挥干仪吹干后用150 μL含0.1%甲酸的甲醇-乙腈溶液(体积1∶1)复溶,涡旋3 min,4℃20 000×g离心10 min,取上清液100 μL进样。
1.5 分析条件
1.5.1 色谱条件
Agilent 1290 Infinity超高效液相色谱仪:色谱柱为XBridgeTMAmide(2.1 mm×150 mm,3.5 μm,Waters);流速:0.2 mL·min-1;柱温35℃;流动相A为0.1%甲酸-水溶液,流动相B为0.1%甲酸-乙腈溶液;梯度洗脱程序为2%~35%A 0~14 min;35%~60% A 14~17 min;60%~98%A 17~22 min;98%A 22~25 min;98%~2%A 25~27 min;2%A 27~30 min。进样量:5 μL。
1.5.2 质谱条件
采用电喷雾离子源(ESI),参数设置如下:干燥气温度及流量:180℃,6 L·min-1。毛细管电压:正离子模式:3800 V,负离子模式:3500 V。数据采集范围m/z50~1000,Scan模式进行正负离子全扫描。
1.6 数据处理及统计学分析
将原始数据导入Bruker Profile Analysis软件进行峰查找及峰校正,设置质荷比范围m/z50~1000,质量偏差10 mu,设置修正50%缺失值,即通过50%共有峰寻找内源性代谢产物,在95%置信区间下,最终得到满足上述条件的保留时间、质荷比及峰强度的三维数据。应用SIMCA-P16.0多变量分析软件进行统计学分析,选择偏最小二乘辨别分析法(partial least squares-discriminant analysis,PLS-DA)得到散点分布图(scores plot)及荷载图(loadings plot),选择变量重要程度(variable importance in the projection,VIP)≥1的变量结合t检验(P<0.05)及二级串联质谱分析结果与HMDB及METLIN数据库比对,寻找出潜在生物标志物。用SPSS16.0软件采用单因素方差分析进行组间统计学分析,并进行两两比较,P<0.05,P<0.01认为差异有统计学意义。
2 结果
2.1 ZCH水提液指纹图谱及主要成分鉴定
图1A为ZCH水提液正离子模式下的总离子流图,5种主要活性成分的一级质谱图(图1B~F),通过与标准品质谱图比对,它们分别为RB皂苷a,b1,b2,c和d。
2.2 ZCH对APAP所致急性肝损伤小鼠血浆GPT和GOT活性的影响
2.2.1 单次治疗给药
表1结果显示,与正常对照组相比,模型组血浆中GPT和GOT活性显著升高(P<0.05),说明APAP 500 mg·kg-1能明显引起小鼠肝急性损伤。与正常对照组相比,单独给药组血浆中GPT及GOT活性无明显变化,说明ZCH水提液36 g·kg-1不会引起小鼠肝损伤。与模型组相比,单次治疗给药组血浆中GPT和GOT活性均显著下降(P<0.05,P<0.01),说明ZCH水提液单次治疗能明显缓解APAP引起的急性肝损伤。
2.2.2 多次治疗给药
表2结果显示,与正常对照组相比,模型组血浆中GPT和GOT含量显著升高(P<0.01),说明APAP 500 mg·kg-1能明显引起小鼠肝急性损伤。与模型组相比,多次治疗组血浆中GPT和GOT含量明显下降(P<0.05,P<0.01),说明ZCH水提液多次治疗能缓解由APAP引起的肝毒性。
2.2.3 多次预防给药
表3结果显示,与正常对照组相比,模型组血浆中GPT和GOT含量显著升高(P<0.01),说明APAP 500 mg·kg-1能明显引起小鼠肝急性损伤。与模型组相比,多次预防给药组血浆中GPT和GOT含量明显下降(P<0.05,P<0.01),说明ZCH水提液预防给药可减轻APAP所致肝损伤。
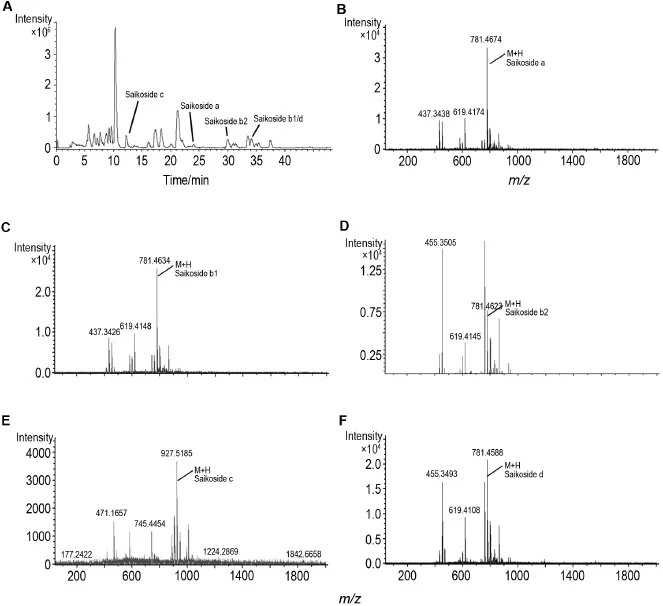
Fig.1 Total ion chromatogram(TIC)fingerprints(A)of water extract of Zheng Chaihu Yin(ZCH)in positive ion mode and mass spectra of saikoside a(B),saikoside b1(C),saikoside b2(D),saikoside c(E)and saikoside d(F).

Tab.1 Effect of ZCH single treatment on plasma GPT and GOT of male ICR mice administered with APAP

Tab.2 Effects of ZCH multiple treatment on plasma GPT and GOT of male ICR mice administered with APAP
2.3 ZCH对APAP所致急性肝损伤小鼠肝组织病理变化的影响
2.3.1 单次治疗
HE染色发现(图2),正常对照组及单独给药组肝组织结构完整,肝细胞围绕中央静脉呈索状排列,肝细胞胞核正常,胞浆贮积较多的糖原,肝细胞未见明显的变性、坏死,肝窦无扩张充血,间充质未见炎细胞浸润,未见纤维组织增生。模型组肝结构紊乱,肝小叶界限不清,主要发生于小叶中心,坏死肝细胞大部分呈溶解状,有的坏死处见较多出血,偶见炎细胞浸润。与模型组相比,单次给药组尽管存在部分肝细胞灶性坏死,呈浓缩状,呈溶解状,或肝细胞见空泡变性,病变处偶见出血,但肝细胞病变程度有明显的减轻。不同组间的肝损伤面积表明,ZCH单次给药和APAP合用能减轻APAP所致的肝细胞病变,对APAP引起的肝毒性具有保护作用。

Tab.3 Effect of ZCH mulitiple pretreatment on plasma GPT and GOT of male ICR mice when administered 3 d prior-dosing with APAP
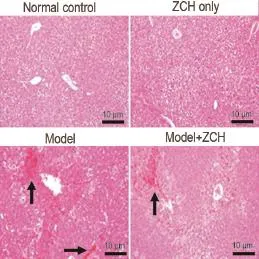
Fig.2 Effect of ZCH single treatment on liver pathology histology of male ICR mice administered with APAP. See Tab.1 for the treatment.The black arrow shows the necrotic hepatocyte.
2.3.2 多次治疗
HE染色发现(图3),在ZCH多次预防给药实验中,正常对照组与模型组结果与图2中一致。与模型组相比,多次治疗给药组存在肝细胞灶性坏死,部分呈浓缩状,呈溶解状,有的肝细胞见空泡变性,但病变程度明显减轻。各组间肝损伤面积结果表明,ZCH多次和APAP治疗给药组缓解了APAP引起的肝细胞病变程度。
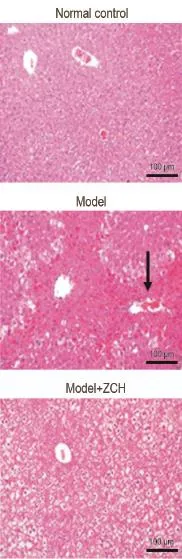
Fig.3 Effect of ZCH mulitple treatment on liver patho⁃histology of male ICR mice administered APAP.See Tab.2 for the treatment.The black arrow shows the necrotic hepatocyte.
2.3.3 多次预防
HE染色发现(图4),正常对照组与模型组结果与图2中一致。与模型组相比,多次预防给药组存在肝细胞灶性坏死,部分呈浓缩状,呈溶解状,或肝细胞见空泡变性,但病变程度明显减轻。各组间肝损伤面积分析表明,ZCH多次预防给药能减轻APAP引起的肝细胞病变。
2.4 ZCH对APAP所致急性肝损伤小鼠血浆代谢组的影响
2.4.1 单次治疗
采用正离子模式对3组血浆样品进行液质联用分析,均得到UPLC-Q-TOF色谱图(图5)。
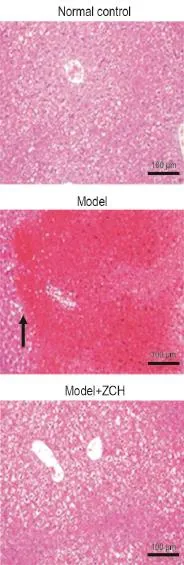
Fig.4 Effect of ZCH multiple pretretament on liver pathohistology of male ICR mice administered with 3 d prior-dosing to APAP.See Tab.3 for the treatment.The black arrow shows the necrotic hepatocyte.
采用UPLC-Q-TOF-MS对血浆样品进行分析,原始数据通过Bruker Profile Analysis软件共找到900多个共有峰,将这些内源性物质的丰度信息导入SIMCA-P软件中作PLS-DA分析。从PLS-DA分析的散点图(图6A,R2X=0.616,R2Y=0.988,Q2=0.966)可见,模型,正常对照及单次治疗给药3组之间呈现良好的区分,单次治疗给药组与模型组之间存在一定的距离,说明肝损伤程度较模型组轻。提示ZCH能改善APAP引起的与肝毒性相关的内源性物质变化,减轻由APAP引起的肝损伤,结果与临床生化指标及组织病理学结果一致。PLS-DA分析的载荷图(图6B)提示离原点越远的点可能是潜在生物标志物。通过色谱峰强度可见,模型组与正常对照组相比、单次治疗给药组与正常对照组相比及单次治疗给药组与模型组相比,棕榈酰组氨酸、棕榈酰肉毒碱、十七酰肉毒碱、硬脂酰肉毒碱、鞘氨醇、磷酸丝氨酸〔phos⁃phatidylserine,PS(40∶1)〕、胆碱、磷脂酰乙醇胺〔phosphatidyl ethanolamine,PE(19∶1)〕、溶血卵磷脂〔Lysophosphatidylcholine,LPC(14∶0)〕、1-磷酸葡萄糖及精氨酸的变化有显著性差异(P<0.05,P<0.01)(图7)。
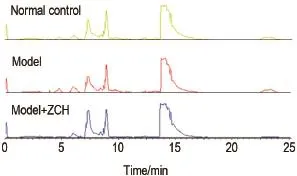
Fig.5 Effect of ZCH single treatment on plasma metabo⁃lomics total ion chromatorgraphys(TIC)profiles of male ICR mice by ultra-performance liquid chromatography/ quadrupole-time-of-flight mass spectrometry(UPLC-Q-TOFMS)in positive mode.See Tab.1 for the treatment.

Fig.6PLS-DA score plots(A)and loadings plots(B)by UPLC-Q-TOF-MS in positive mode of ZCH single treatment on plasma metabolomics of male ICR mice.See Tab.1 for the treatment.
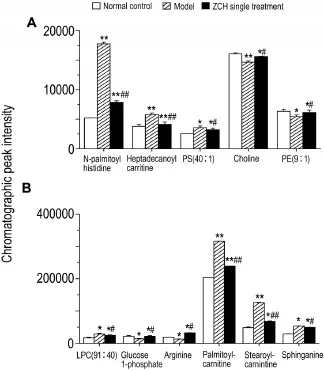
Fig.7Changes in chromatographic peak intensity of endogenous substances related to lipid metabolism,amino acid metabolism and energy metabolism in mouse plasma.See Tab.1 for the treatment.n=10.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
2.4.2 多次治疗
采用正离子模式对3组血浆样品进行液质联用分析,均得到UPLC-Q-TOF色谱图(图8)。
PLS-DA分析的散点图(图9A,R2X=0.739,R2Y= 0.915,Q2=0.556)可见,模型组独立分布在第三象限,正常对照和多次治疗给药组之间有一定的重合区域,表明多次治疗给药组已向正常对照组趋近,有减轻APAP肝损伤的趋势。PLS-DA分析的载荷图(图9B)提示离原点越远的点可能是潜在生物标志物。通过色谱峰强度可见,模型组与正常对照组相比、多次治疗给药组与正常对照组相比及多次治疗给药组与模型组相比,PC和PE及脯氨酸的变化有显著性差异(P<0.05,P<0.01)(图10)。
2.4.3 多次预防
采用正离子模式对3组血浆样品进行液质联用分析,均得到UPLC-Q-TOF色谱图(图11)。
从PLS-DA分析的散点图(图12A,R2X=0.658,R2Y=0.984,Q2=0.961)可见,模型、正常对照及多次预防给药组呈现了良好的区分度。PLS-DA分析的载荷图(图12B)提示离原点越远的点可能是潜在生物标志物。通过色谱峰强度可见,模型组与正常对照组相比、多次预防给药组与正常对照组相比及多次预防给药组与模型组相比,植物鞘氨醇、乙酰胆碱、磷脂酰胆碱(phosphatidylcholine,PC)、PE、肌酸、丙氨酸、1-磷酸葡萄糖及甘油磷酰胆碱的变化有显著性差异(P<0.05,P<0.01)(图13)。
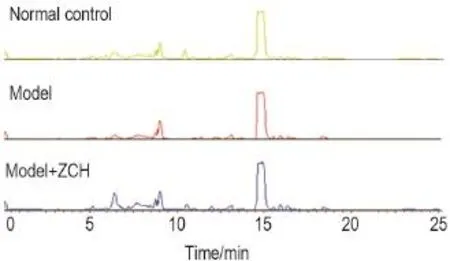
Fig.8 Effect of ZCH multiple treatment on plasma metabolomics TIC profiles of male ICR mice plasma by UPLC-Q-TOF-MS in positive ion mode.See Tab.2 for the treatment.
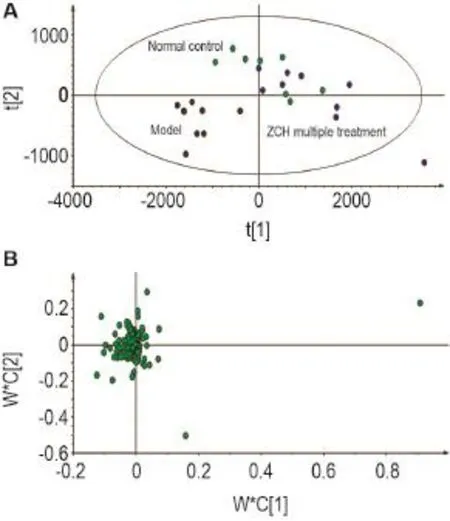
Fig.9 PLS-DA score plots(A)and loadings plots(B)of ZCH multiple treatment on plasma metabolomics of male ICR mice by UPLC-Q-TOF-MS in positive mode.See Tab.2 for the treatment.
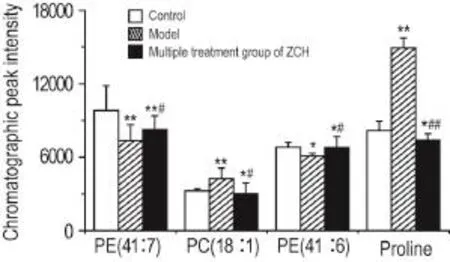
Fig.10Changes in chromatographic peak intensity of endogenous substances related to lipid metabo⁃lism,amino acid metabolism and energy metabolism in mouse plasma.See Tab.2 for the treatment.n=10.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
Fig.11Effect of ZCH multiple pretreatmnet on plasma metabolomics TIC profiles of male ICR mice by UPLC-QTOF-MS in positive ion mode.See Tab.3 for the treatment.
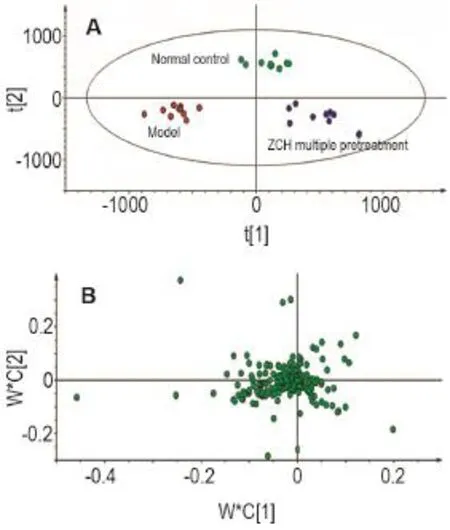
Fig.12 PLS-DA score plot(A)and loadings plot(B)of ZCH multiple pretreatment on plasma of male ICR mice by UPLC-Q-TOF-MS in positive mode.See Tab.3 for treatment.
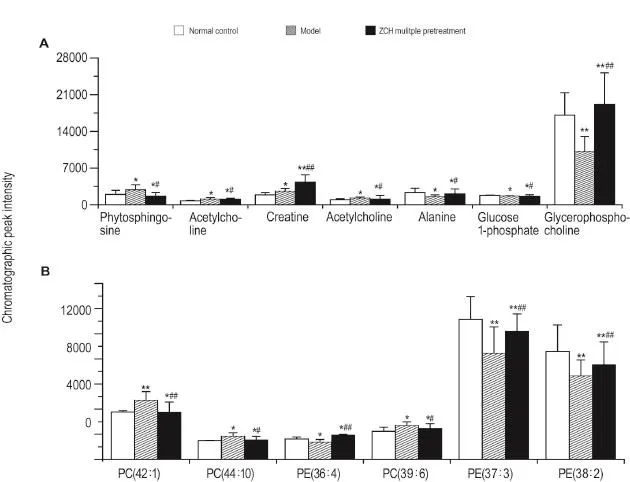
Fig.13 Changes in chromatographic peak intensity of endogenous substances related to lipid metabolism,amino acid metabolism and energy metabolism in mouse plasma.See Tab.3 for the treatment.x±s,n=10.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
3 讨论
ZCH单次及多次与APAP联合用药,从血浆GPT及GOT水平和肝组织病理学变化可见有明显保护APAP肝损伤的作用,通过代谢组学数据的统计分析和研究,从体内近千个内源性代谢物的分析也可发现ZCH有改善APAP所致肝损伤的趋势。血浆代谢组学的研究结果发现,ZCH的保肝作用涉及改善脂质代谢、氨基酸代谢及能量代谢过程。在3种给药方式中,单次治疗给药组、多次预防给药组与正常对照组有显著差异的标志物数量相当,但种类有所不同,多次治疗给药组改善数量最少。相同种类的化合物均涉及PC和PE,ZCH单次与APAP联合用药对肉毒碱类化合物的改善更为显著。
在脂质代谢通路中,APAP模型组中多种PC水平升高表明线粒体膜的损伤及磷脂胆碱体内代谢过程的紊乱,PC峰强度增大与肝坏死及GPT和GOT活性的升高有密切的关系,这与文献[8]报道相符。肝细胞的磷脂酶模型组被APAP激活而水解成PC,PC的蓄积使肝细胞膜溶解,细胞膜溶解后因其通透性增加而引发转氨酶入血,最终引起GPT和GOT的升高。涉及脂肪酸β-氧化过程中的十七酰肉毒碱、棕榈酰肉毒碱及硬脂酰肉毒碱在APAP模型组中的含量明显高于正常对照组。McGill等[18]研究发现,过量服用APAP后,肉毒碱含量上调,与本研究结果一致。但也有文献报道,在肝损伤过程中肉毒碱含量下降[19],推测可能是因为肉毒碱类物质在体内的平衡状态处于一定的范围,其含量过高或过低都极易打破其平衡,导致肝疾病的发生。
在氨基酸代谢环节中,APAP模型组棕榈酰组氨酸含量升高,可能是因为组氨酸是谷氨酸合成的前体物质,谷氨酸可通过氧化脱氨作用生成α-酮戊二酸进入TCA循环,ZCH通过下调棕榈酰组氨酸的含量维持TCA循环的稳态而发挥作用。丙氨酸在体内经血液运输到肝,通过联合脱氨作用释放出氨来合成尿素,这是肝细胞的一种重要的生物学功能,由于APAP模型组丙氨酸含量升高,导致肝内合成尿素受阻,从而引发肝损伤。
1-磷酸葡萄糖是肝细胞线粒体糖酵解过程中的重要原料,肝糖原在糖原磷酸化酶的作用下生成1-磷酸葡萄糖,1-磷酸葡萄糖进而在磷酸葡萄糖变位酶的作用下生成6-磷酸葡萄糖,6-磷酸葡萄糖最终经一系列反应生成丙酮酸完成整个糖酵解过程[20]。ZCH通过上调1-磷酸葡萄糖的含量恢复肝细胞线粒体的功能状态,使糖酵解过程得到恢复,进而减轻肝毒性。
给药组中的胆碱及乙酰胆碱含量与APAP模型组比较呈现下调的趋势。乙酰胆碱作为体内的一种神经递质,能特异性地作用于胆碱受体。郭燕等[21]采用Wistar大鼠诱导肝纤维化模型,研究和络舒肝胶囊对模型组肝乙酰胆碱受体的影响探讨其抗肝纤维化的机制,通过聚合酶联反应结合免疫印迹的方法发现模型组中乙酰胆碱的含量明显高于正常对照组,这与本实验结果相符,其机制可能与其促进肝星状细胞的增殖分化密切相关[22]。胆碱是合成乙酰胆碱的前体,乙酰胆碱可在胆碱酯酶的作用下水解成胆碱,体内模型组乙酰胆碱含量的升高导致了模型组胆碱的含量升高。
本研究表明,代谢组学技术手段与血生化指标及病理切片分析方法相比有明显的优势,通过血浆样本代谢组学分析发现与肝损伤相关的生物标志物,可从整体上阐明ZCH对药源性肝损伤的保护机制,可能为探索药物在体内相互作用靶点提供一条新的研究途径。
致谢:感谢本院谭力老师对本研究的指导,感谢江苏省安评中心白文霞老师对本研究提供的帮助。
[1]Larrey D.Epidemiology and individual susceptibility to adverse drug reactions affecting the liver[J]. Semin Liver Dis,2002,22(2):145-155.
[2]James LP,Mayeux PR,Hinson JA.Acetamino⁃phen-induced hepatotoxicity[J].Drug Metab Dispos,2003,31(12):1499-1506.
[3]Kaplowitz N.Acetaminophen hepatoxicity:what do we know,what don′t we know,and what do we do next?[J].Hepatology,2004,40(1):23-26.
[4]Muldrew KL,James LP,Coop L,Mccullough SS,Hendrickson HP,Hinson JA,et al.Determination of acetaminophen-protein adducts in mouse liver and serum and human serum after hepatotoxic doses ofacetaminophen using high-performance liquid chromatography with electrochemical detection[J]. Drug Metab Dispos,2002,30(4):446-451.
[5]Mcgill MR,Williams CD,Xie Y,Ramachandran A,Jaeschke H.Acetaminophen-induced liver injury in rats and mice:comparison of protein adducts,mitochondrial dysfunction,and oxidative stress in the mechanism of toxicity[J].Toxicol Appl Pharmacol,2012,264(3):387-394.
[6]Demirbas S,Cakir E,Akgul EO,Seyrek M,Cayci T,Kurt YG,et al.Elevated serum neopterin levels in acetaminophen-induced liverinjury[J].Environ Toxicol Pharmacol,2011,31(1):165-170.
[7]Mcgill MR,Sharpe MR,Williams CD,Taha M,Curry SC,Jaeschke H.The mechanism underlying acetaminophen-induced hepatotoxicity in humans and mice involves mitochondrial damage and nuclear DNA fragmentation[J].J Clin Invest,2012,122(4):1574-1583.
[8]Chang EE,Chang YC,Liang CH,Huang CP,Chiang PC.Identifying the rejection mechanism for nanofiltration membranes fouled by humic acid and calcium ions exemplified by acetaminophen,sulfamethoxazole,and triclosan[J].J Hazard Mater,2012,221-222:19-27.
[9]Niu XR.Overview pharmacological effects of Bupleurum[J].ChinaPharm(中国药师),2009,12(9):1310-1312.
[10]Wei H,Wei WG,Liu Q,Meng JG,Wang D. Experimental study of hepatoprotective effect of qinling bupleurum extraction[J].Shaanxi J Tradit Chin Med(陕西中医),2012,33(10):1432-1433.
[11]Hu XJ,Liu XQ.Effects of Xiaochaihu decoction on damage of gut-liver-brain in CCl4/ethanol induced mouse hepatocellular carcinoma[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2012,18(23):207-212.
[12]Wang SC,Wang L,Tian WB,Zhao HP.Effects of Chaihu and Wulingwan on chronic liver lesion in mice[J].J Fourth Mil Med Univ(第四军医大学学报),2002,23(2):133-136.
[13] Shi H,Xie DH.Protecting effect of water extraction portion of herba bupleurl and bupleurum Chinese on mice with acute hepatic injury[J].J Nanjing Univ Tradit Chin Med(南京中医药大学学报),2009,25(6):461-462.
[14]Wang ZY,Nan JX.Protective effect of bupleurum Chinese againstacute liverinjuryinduced by acetaminophen(AAP)in mice[J].China Pharm(中国药师),2008,11(7):747-749.
[15]Fu HY,Yan MZ,Lu CA,He XZ,Zhou AX,Tian JL,et al.Pharmacological studies of Zhengchaihuyin[J].China J Chin Mater Med(中国中药杂志),1986,11(5):303-307.
[16]Wu X,Lu YH,Wang YX,Tang DQ,Fan XL. Research advances in drug-induced liver injury based on systems biology technology[J].Chin Pharm J(中国药学杂志),2014,49(12):1009-1013.
[17]Sun J,Schnackenberg LK,Beger RD.Studies of acetaminophen and metabolites in urine and their correlations with toxicity using metabolomics[J]. Drug Metab Lett,2009,3(3):130-136.
[18]Mcgill MR, Li F,Sharpe MR, Williams CD,Curry SC,Ma X,et al.Circulating acylcarnitines as biomarkers of mitochondrial dysfunction after acet⁃aminophen overdose in mice and humans[J]. Arch Toxicol,2014,88(2):391-401.
[19]Jiao LL,Yang WS,Lin XH,Yang RF,Xu GB. Plasma total carnitine and free carnitine level in healthy adults and patients with liver diseases[J]. Lab Med(检验医学),2007,22(5):528-530.
[20]Wang JY,Zhu SG,Xu CF.Biochemistry(生物化学)[M].3rd ed.Beijing:Higher Education Press,2002:1-11.
[21]Guo Y,Gao X,Yan W,Zhang FW,Tang WX. Effect of heluoshugan capsules on acetylcholine re⁃ceptor in liver tissue fibrosis[J].Chin J Histochem Cytochem(中国组织化学与细胞化学杂志),2007,16(2):154-158.
[22] Yang HH,Tang CL.Effect of cholinergic pathway for inflammation of the liver[J].Int J Digest Dis(国际消化病杂志),2014,34(3):179-181.
Protective effect of Zheng Chaihu Yin on paracetamol induced acute liver injury of mice
LIU Xia-fei1,2,WU Xiao1,2,YANG Fang-xiu1,2,WANG Yu-xin2,3,TANG Dao-quan1,ZHANG Mei2,LU Yi-hong1,2
(1.Department of Pharmacautical Analysis,Xu zhou Medical Vniversity,Xuzhou 221004,China;2.Jiangsu Institute for Food and Drug Control,Nanjing 210008,China;3.China Pharmaceutical University,Nanjing 210008,China)
OBJECTIVETo explore the effect of aqueous extract ofZheng Chaihu Yin(ZCH)on paracetamol(acetaminophen,APAP)-induced hepatotoxicity.METHODSMale ICR mice were dividedinto three scenarios randomly:the single treatment dose of ZCH,multiple treatment or pretreatment dose of ZCH.Each scenario had a up control group and an APAP model group,while single treatment dose of ZCH group had a ZCH group at the same time.The dose of APAP and ZCH was 500 mg·kg-1and 36 g·kg-1,respectively.24 h after the last administration,plasma and liver samples were prepared.Ultra-performance liquid chromatography/quadrupole-time-of-flight mass spectrometry(UPLC-Q-TOF-MS)based metabolomics profiling was used to examine changes in plasma after expo⁃sure to ZCH,APAP or co-exposure to ZCH and APAP.Glutamic pyruvic transaminase(GPT)and glutamic oxaloacetic transaminas(GOT)values were determined by a biochemical auto analyzer in plasma.Histopathologic changes in the liver were observed and the area was calculated after HE staining. The data were analyzed with SPSS16.0 statistical software and the results were compared with the test between the two groups to find biomarkers.Also,SIMCA software was used for partial least squares-discriminant analysis(PLS-DA)pattern recognition.RESULTSCompared to control group,APAP dosing alone caused an increase in plasma transaminases and alterations in multiple metabolic pathways.Compared to APAP group,decrease in plasma transaminases was noted when ZCH was administered after or prior to APAP.Histopathologic results showed that in the single treatment group,multiple treatment group and pretreatment group,ZCH could alleviate the liver damage induced by APAP from(32.3±12.0)%to(14.2±9.9)%,(8.6±7.9)%to(5.2±1.7)%and(32.5±10.0)%to(5.2±6.4)%(P<0.05).Similarly,the PLS-DA of the LC-MS data showed that the groups dosed with APAP alone were the most distinct from controls,while animals dosed with ZCH prior to or after APAP treatment were located near control group.Metabolic spectrum results showed that ZCH could restore the changes in endogenous substances including lipid metabolism,amino acid metabolism,sugar metabolism and energy metabolism induced by APAP to normal.CONCLUSIONZCH water-extraction plays major roles in the regulation of metabolism on APAP-induced liver injury.These studies demonstrate that UPLCQ-TOF-MS-based metabolomic analysis can be sensitively and accurately predict the initiation and progres⁃sion of liver injury and greatly contribute to a better understanding of the hepatoprotective effects of ZCH in a clinical environment.
Zheng Chaihu Yin;paracetamol;drug-induced liver injury;metabolomics
LU Yi-hong,E-mail:yihonglu@163.com,Tel:(025)86633622
R285
A
1000-3002-(2017)01-0101-11
10.3867/j.issn.1000-3002.2017.01.013
2016-01-05接受日期:2016-09-05)
(本文编辑:沈海南 贺云霞)
国家科技重大专项(20152X09303001)
刘霞飞,女,硕士,主要从事体内药物分析及药品安全性研究;陆益红,女,博士,主任药师,主要从事药物分析及药品安全性评价。
陆益红,E-mail:yihonglu@163.com,Tel:(025)86633622
Foundation item:The project supported by National Science and Technology Major Project of China(20152X09303001)
