桑黄黄酮液体发酵培养条件的优化*
2017-03-28张文隽吴亚召杨新文
张文隽,吴亚召,雷 萍**,姜 娟,杨新文,杜 芳
(1.陕西省微生物研究所,陕西 西安 710043;2.洛川县农业机械技术服务中心,陕西 洛川 727400;3.陕西省苹果研究发展中心,陕西 西安 710043)
桑黄黄酮液体发酵培养条件的优化*
张文隽1,吴亚召1,雷 萍1**,姜 娟2,杨新文3,杜 芳1
(1.陕西省微生物研究所,陕西 西安 710043;2.洛川县农业机械技术服务中心,陕西 洛川 727400;3.陕西省苹果研究发展中心,陕西 西安 710043)
采用摇瓶培养方法,通过单因素试验研究发酵培养液初始pH值、装液量、接种量和摇床转速对桑黄(Phellinus linteus)发酵胞内黄酮产量的影响,结果表明,最适初始pH为6.5,装液量为100 mL/300mL,接种量为10%,摇床转速为150 r·min-1。在单因素试验的基础上采用L9(34)正交试验优化桑黄黄酮发酵培养条件,最佳工艺为:发酵液初始pH6.5,300 mL三角瓶装液量为100 mL,种子液接种量为10%,摇床转速150 r·min-1。
桑黄;胞内黄酮;液体发酵;培养条件
桑黄属担子菌亚门(Basidiomycotina) 层菌纲(Hymenomycetes) 多孔菌目(Polyphorales) 多层孔菌科(Hymenochaeyaceae)针层孔菌属(Phellinus),是多年生的珍稀药用真菌[1],因其生长于桑树上而得名。据《药性论》记载,桑黄味微苦,性寒,在我国传统中药中用于治疗血淋、血崩、带下、闭经、脐腹涩痛、脱肛泄血、盗汗、痢疾等症[2]。现代研究发现桑黄具有抗肿瘤、抗氧化、抗纤维化、抗菌、降血脂等功效[3],是国际公认抗癌效果最佳的真菌之一。
桑黄主要活性成分为多糖、黄酮、三萜类等[4]。大量研究表明桑黄中的黄酮类物质,具有很好的抗氧化效果,可有效清除DPPF自由基,抑制脂质的过氧化[5]。但由于近年来对桑黄的无序采集,野生资源日益减少,再加上受其生理生态特殊性和环境条件的制约,人工栽培难度较大,无法获得大量子实体以满足市场需求。有研究表明,桑黄菌丝体活性成分与子实体接近,且菌丝体提取物同样具有抗氧化、抗肿瘤等功效[6]。因此,可以采用现代生物发酵技术获得桑黄菌丝体和代谢产物,以满足生物医药市场需求。本项研究通过单因素和四因素三水平正交试验,以桑黄菌丝体和胞内黄酮为指标优化桑黄黄酮发酵培养条件,以期为大规模生产桑黄黄酮类活性物质提供技术依据。
1 材料与方法
1.1 供试菌株
桑黄菌种来自于陕西省微生物研究所微生物资源中心第三研究室,经分子鉴定为裂蹄木层孔菌(Phellinus linteus)[7]。
1.2 培养基
1.2.1 一级种培养基
采用综合PDA培养基。
1.2.2 种子培养基
葡萄糖 2%、蛋白胨 0.4%、KH2PO40.1%、MgSO40.05%、VB110 mg/100mL,pH自然。
1.2.3 发酵培养基
玉米粉1%、葡萄糖2%、黄豆粉1%、蛋白胨1%、酵母膏0.5%、KH2PO40.2%、MgSO40.05%、VB110 mg/100mL。
1.3 试验方法
1.3.1 一级种制备
按综合PDA培养基配方配制,高压灭菌后制斜面,无菌条件下接种桑黄菌菌种块0.3 cm2,28℃条件下恒温培养至长满斜面,得一级菌种备用。
1.3.2 种子液制备
按种子培养基配方配制,定容后采用300 mL三角瓶分装,装液量为100 mL,接种活化后的桑黄斜面菌种0.5 cm2,摇床转速150 r·min-1,28℃培养4 d。
1.3.3 初始pH值筛选
按发酵培养基配方配制,用稀盐酸或稀氢氧化钠调节培养基pH到5.0、5.5、6.0、6.5、7.0、7.5。装液量100 mL/300mL,种子液接种量10%,置往复式摇床,摇床转速150 r·min-1,28℃培养6 d。
1.3.4 装液量筛选
按发酵培养基配方配制,pH自然。采用300 mL三角瓶分别装液50 mL、80 mL、100 mL、120 mL、150 mL,种子液接种量10%,置往复式摇床,摇床转速150 r·min-1,28℃培养6 d。
1.3.5 接种量筛选
按发酵培养基配方配制,pH自然。采用300 mL三角瓶装液100 mL,种子液接种量分别为6%、8%、10%、12%、15%,置往复式摇床,摇床转速150 r·min-1,28℃培养6 d。
1.3.6 摇床转速筛选
按发酵培养基配方配制,pH自然。采用300 mL三角瓶装液 100mL,种子液接种量分别为10%,置往复式摇床,摇床转速100 r·min-1、120 r·min-1、150 r·min-1、180 r·min-1、210 r·min-1,28℃培养6 d。
1.3.7 正交优化
在单因素筛选的基础上,采用四因素三水平正交试验的方法对桑黄黄酮液体发酵培养条件进行优化。每次试验重复3次,结果取平均值。试验因素及其各水平见表1。
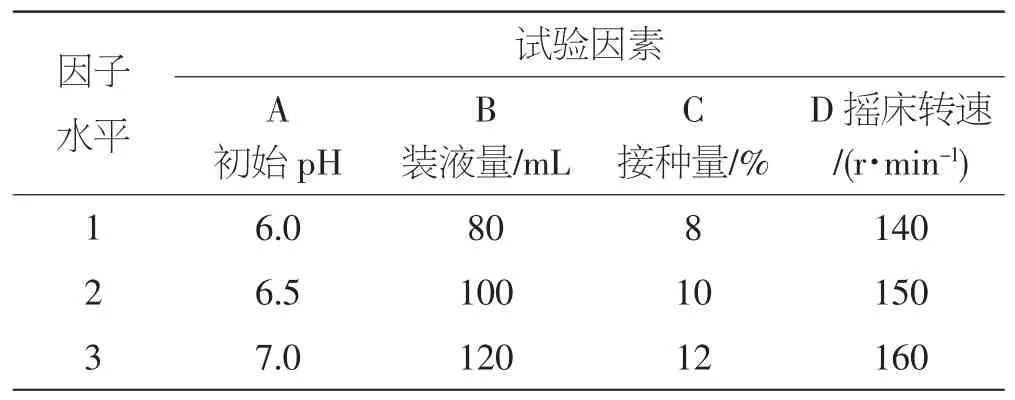
表1 L9(34)正交试验的因素和水平Tab.1 Factors and their levels in L9(34)orthogonal test
1.3.8 菌丝体生物量测定
发酵结束后将发酵液用4层纱布过滤,菌丝体用蒸馏水冲洗3次~5次,于68℃烘干至恒重,称量。
1.3.9 黄酮产量测定
准确称取桑黄菌粉0.5 g,加入15 mL浓度为60%的乙醇,70℃恒温水浴提取2 h,流水冷却,用蒸馏水定容至25 mL,过滤。采用NaNO2-Al(NO3)3比色法,以芦丁为标准品测定黄酮含量[8],并计算黄酮产量(黄酮含量乘以菌丝体产量除以1 000)。
1.4 统计学处理
采用Excel进行统计分析,多组比较,新复极差检验法。
2 结果与分析
2.1 初始pH值筛选试验
不同初始pH值对桑黄黄酮发酵的影响见表2。
培养液pH值的高低直接影响菌丝体生长和代谢产物的生成,通常真菌喜欢在偏酸性环境下生长,而桑黄生长对pH具有较广的适应性。由表2可以看出,不同初始pH对桑黄菌丝体和胞内黄酮的影响具有明显差异,对桑黄菌丝体生物量的影响依次为pH6.5>pH6.0>pH5.5>pH5.0>pH7.0>pH7.5,对胞内黄酮的影响依次为pH6.5>pH6.0>pH7.0>pH5.5>pH7.5>pH5.0。因此,桑黄菌丝体和胞内黄酮形成的最适pH为6.5,此时菌丝体生物量最大为14.60 g·L-1,胞内黄酮产量最大16.26 mg/100mL。

表2 不同初始pH值对桑黄黄酮发酵的影响Tab.2 Effect of various initial pH on Phellinus linteus fermentation
2.2 装液量筛选试验
不同装液量对桑黄黄酮发酵的影响见表3。

表3 不同装液量对桑黄黄酮发酵的影响Tab.3 Effect of various loading volume on Phellinus linteus fermentation
桑黄发酵过程中需要充足的氧气,溶解氧的供应水平直接影响菌丝体生长和代谢产物的合成,装液量是发酵溶氧的一个间接指标。摇瓶发酵时装液量越少,传氧系数越大,但发酵过程中溶液容易蒸发,造成营养不足;装液量越多,传氧系数小,培养基中溶解氧也越少,菌丝体和代谢产物产量减少。由表3可以看出,不同装液量对桑黄菌丝体和胞内黄酮产量影响差异明显,对桑黄菌丝体生物量的影响依次为100 mL>120 mL>150 mL>80 mL>50 mL,对胞内黄酮的影响依次为100 mL>120 mL>80 mL>150 mL>50 mL。因此,桑黄菌丝体和胞内黄酮形成的最适装液量为100 mL/300mL,此时菌丝体生物量最大13.77 g·L-1,胞内黄酮产量最大16.19 mg/ 100mL。
2.3 接种量筛选试验
不同接种量对桑黄黄酮发酵的影响见表4。

表4 不同接种量对桑黄黄酮发酵的影响Tab.4 Effect of various inoculum dose on Phellinus linteus fermentation
接种量的大小决定生产菌种在发酵液中生长繁殖的速度,采用较大的接种量可以缩短菌丝繁殖达到高峰的时间,使产物的形成提前到来,并可减少杂菌的生长机会。但接种量过大会引起溶氧不足,影响产物合成;过小会延长培养时间,降低发酵生产率。由表4可以看出不同接种量对桑黄菌丝体和胞内黄酮产量影响有差异,对桑黄菌丝体生物量的影响依次为10%>8%>12%>6%>15%,对胞内黄酮的影响依次为10%>8%>12%>15%>6%。因此,桑黄菌丝体和胞内黄酮形成的最适接种量为10%,此时菌丝体生物量最大14.12 g·L-1,胞内黄酮产量最大16.35 mg/100mL。
2.4 摇床转速筛选试验
不同摇床转速对桑黄黄酮发酵的影响见表5。
摇床转速不仅影响菌丝体生长,而且影响代谢产物的合成。转速太低,培养液的溶氧率不能满足菌丝体生长和代谢产物生成的需求,转速太高,培养液的通气得到了改善,但过高的震荡速率会产生一定的剪切作用,不利于菌丝和代谢产物的积累。由表5可以看出,不同摇床转速对桑黄菌丝体和胞内黄酮形成的影响差异明显,对桑黄菌丝体生物量的影响依次为180 r·min-1>150 r·min-1>120 r·min-1>210 r·min-1>100 r·min-1,对胞内黄酮的影响依次为150 r·min-1>180 r·min-1>120 r·min-1>210 r·min-1>100 r·min-1。因此,以桑黄菌胞内黄酮为目标产物时,最适摇床转速为150 r·min-1,产量为15.26 mg/100mL;以菌丝体为目标产物时,最适摇床转速为180 r·min-1,菌丝体生物量最大13.97 g·L-1。
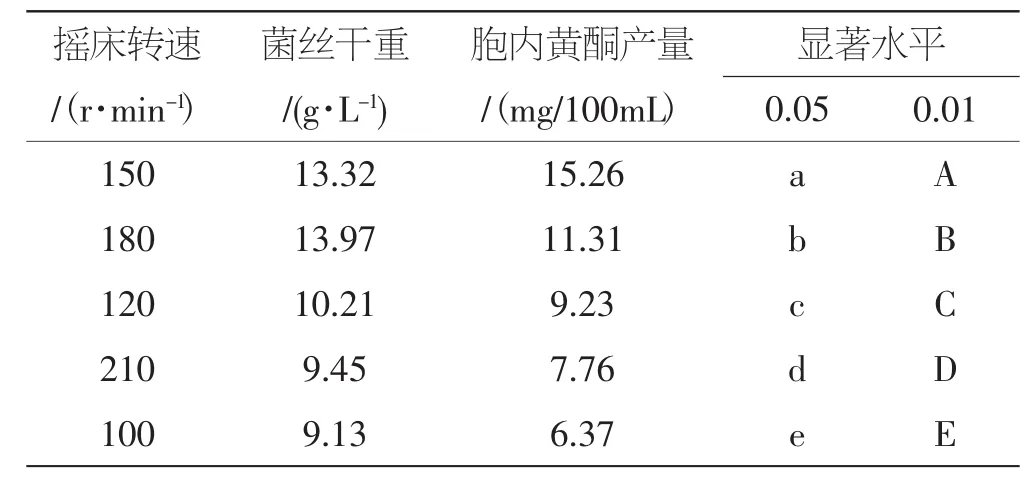
表5 不同摇床转速对桑黄黄酮发酵的影响Tab.5 Effect of various shaking speed on Phellinus linteus fermentation
2.5 正交试验优化结果与直观分析
L9(34)正交试验结果直观分析表见表6。
从表6可以看出各因素对桑黄胞内黄酮产量的影响依次为D>A>B>C,正交试验各因素的最优水平组合为A2B2C2D2,即优化后的桑黄黄酮液体发酵培养条件为:培养基初始pH6.5,300 mL三角瓶装液量为100 mL,种子液接种量为10%,摇床转速150 r·min-1。
3 讨论
通过单因素筛选试验发现,桑黄胞内黄酮液体发酵最适初始pH为6.5,其次为6.0;最适装液量为100 mL/300mL,其次为120 mL/300mL;最适接种量为10%,其次为8%;最适摇床转速为150 r·min-1,其次为180 r·min-1。采用L9(34)正交试验进一步优化后获得桑黄胞内黄酮最适培养条件:培养基初始pH6.5,300 mL三角瓶装液量为100 mL,种子液接种量为10%,摇床转速150 r·min-1。
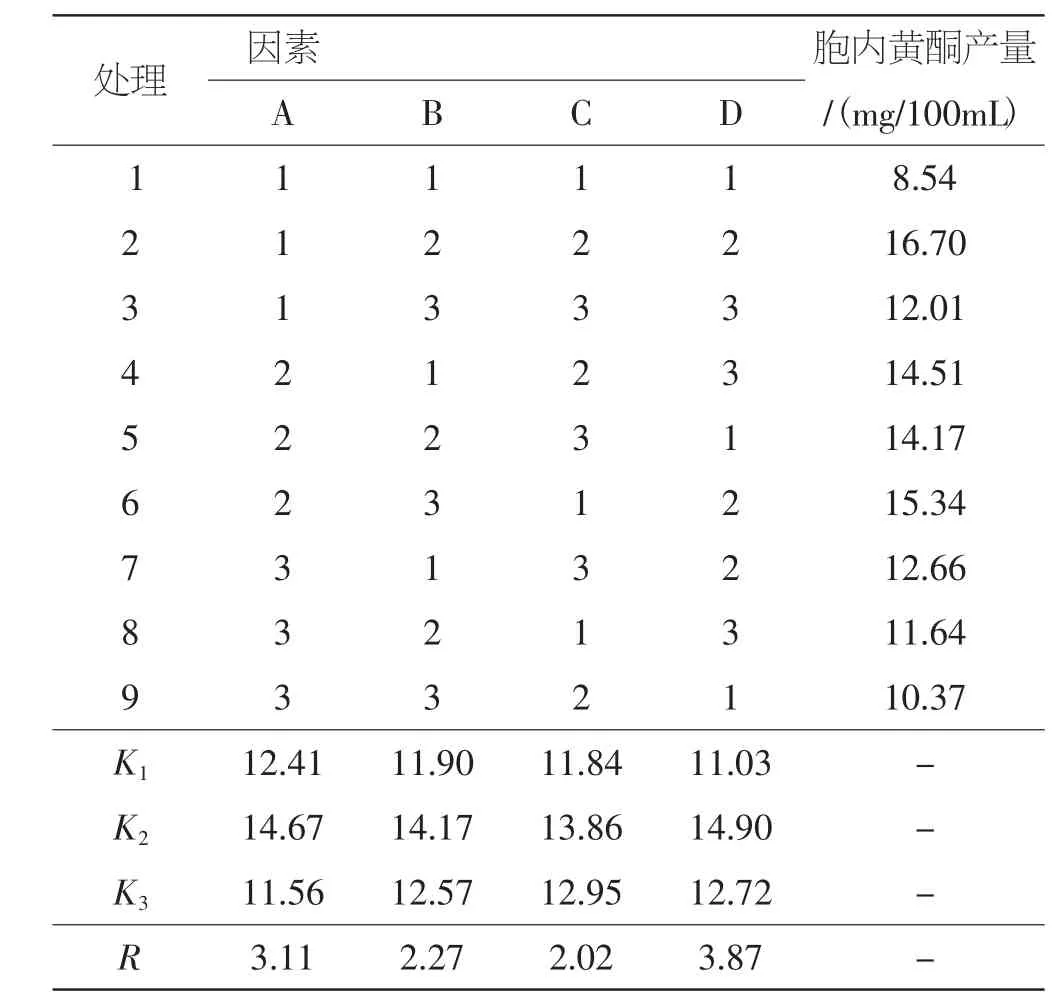
表6 L9(34)正交试验结果直观分析表Tab.6 Intuitive analysis table for the result of L9(34)orthogonal test
[1]刘波.中国药用真菌[M].太原:山西人民出版社,1974:71-73.
[2]江苏新医药学院.中药大辞典[M].上海:上海科学技术出版社,1995.
[3]孙培龙,徐双阳,杨开,等.珍稀药用真菌桑黄的国内外研究进展[J].微生物学通报,2006,33(2):119-122.
[4]郑立军,王清,季俊虬,等.药用真菌桑黄的研究进展[J].现代中药研究与实验,2005,19(3):60-64.
[5]Song YS,Kim SH,Sa JH,et al.Antiangiogenic,antioxidant and xanthine oxidase inhibition activities of the mushroom Phellinus linteus[J].J Ethnopharmacol,2003,88(1):112-116.
[6]Nakamura T,Akiyama Y,Matsugo S,et al.Purification of caffeic acid as antioxidant from submerged culture mycelia of Phellinus linteus(Berk.et Curtis)Teng (Aphyllophoromycetideae)[J].Int JMED Mushroom,2003(5):165-169.
[7]张文隽,吴亚召,雷萍,等.秦巴山区野生桑黄rDNA ITS序列及亲缘关系分析[J].中国食用菌,2015,34(1):50-52.
[8]刘艳芳,杨焱,贾薇,等.药用真菌桑黄总黄酮测定方法研究[J].食用菌学报,2006,13(2):45-48.
Optimization of Culture Conditions for Fermenting Flavones from Phellinus linteus
ZHANG Wen-jun1,WU Ya-zhao1,LEI Ping1,JIANG Juan2,YANG Xin-wen3,DU Fang1
(1.Shaanxi Microbioogy Research Institute,Xi’an 710043,China;2.Luochuan Agicultural Machinery Technical Service Center, Luochuan 727400,China;3.Shaanxi Center of Researching and Developing Apple,Xi’an 710043,China)
Effect of initial pH value of fermentation broth,loading volume,inoculum dose and shaking speed on the yield of intracellular flavone in liquid culture of Phellinus linteus were studied by single factor experiment using shake-flask culture method.The result demonstrated that the optimum initial pH value was 6.5,the optimum loading volume was 100 mL/300mL, the optimum inoculum dose was 10%and the optimum shaking speed was 150 r·min-1.The fermentation condition of intracellular flavone was optimized by using L9(34)orthogonal test on the basis of single factor experiment,and the optimum process was initial pH of 6.5,loading volume of 100 mL/300mL,inoculum dose of 10%and shaking speed of 150 r·min-1.
Phellinus linteus;intracellular flavones;liquid fermentation;culture condition
S646.9
A
1003-8310(2017)02-0052-04
10.13629/j.cnki.53-1054.2017.02.014
陕西省科学院应用基础与产业化项目(2014K-14)。
张文隽(1977-),女,本科,助理研究员,主要从事食(药)用菌资源开发利用研究。E-mail:562758960@qq.com
**通信作者:雷萍(1966-),女,本科,副研究员,主要从事食(药)用菌资源开发利用研究。E-mail:wuleiping2529@126.com
2017-01-28
