羊肚菌生长过程中土壤酶变化规律研究
2017-03-28谢敬宜贺新生
赵 苗,张 能,谢敬宜,贺新生
(西南科技大学生命科学与工程学院,四川 绵阳 621010)
羊肚菌生长过程中土壤酶变化规律研究
赵 苗,张 能,谢敬宜,贺新生*
(西南科技大学生命科学与工程学院,四川 绵阳 621010)
测定羊肚菌生长过程中的土壤酶活性、总碳并分析其变化规律,为羊肚菌人工栽培研究提供理论支持。采用3,5-二硝基水杨酸比色法定期测定土壤蔗糖酶、淀粉酶、纤维素酶活性;高锰酸钾滴定法测定过氧化氢酶活性;仪器分析法测定土壤总碳,并与土壤酶活性进行相关性分析。结果表明,羊肚菌大田播种以后,蔗糖酶与纤维素酶活性均呈现先升高后降低的变化趋势,淀粉酶活性则表现先降低再升高后降低的变化趋势,过氧化氢酶的变化趋势则与淀粉酶恰恰相反,各种酶活性(过氧化氢酶活除外)的变化程度十分接近;土壤酶活性随羊肚菌种植时间的延长而呈现独有的变化规律,其规律不因种植前土壤酶活性水平的高低发生变化。
羊肚菌;土壤酶;总碳;变化规律
土壤酶主要来源于土壤微生物活动分泌、植物根系分泌和植物残体以及土壤动物,能积极参与土壤中营养物质的循环,在土壤养分的循环代谢过程中起着重要作用,是各种生化反应的催化剂[1-3]。土壤酶活性与土壤生物数量[4]、生物多样性密切相关[5]。有关研究表明,土壤酶活性与土壤肥力相关,可以衡量土壤生物学活性,是土壤生态系统功能的关键[6]。过氧化氢酶参与土壤中的氧化还原反应,其活性可以表征土壤腐殖质化强度大小和有机质转化速度,并且与土壤微生物的数量和活性相关[7]。土壤蔗糖酶可以增加土壤中的易溶性营养物质,其活性与有机质的转化和呼吸强度有密切关系[8],并且与土壤有机碳存在显著正相关[9]。纤维素酶则是土壤碳素循环主要参与者之一[10]。
目前为止,羊肚菌是唯一可以开放式种植于大田的珍稀食药用菌[11],2015年~2016年的栽培面积已经达到1 333 hm2以上。但现有栽培技术并不稳定,菌种、土壤、气候、光照等均对羊肚菌的产量产生一定的影响,且无法预测羊肚菌是否出菇。羊肚菌栽培过程中必须把菌种均匀撒播在土壤内,羊肚菌菌丝主要分布在表层0~20(30)cm的耕作层土壤内,吸收土壤、基料、菌种培养料和土表层营养料袋中的营养物质。实际上栽培的羊肚菌是典型的土生真菌,其生长过程与土壤有密切的关系。由于羊肚菌主要在冬季栽培,植物根系及土壤动物皆处于休眠状态,土壤内细菌、真菌和放线菌数量也显著降低[12],在羊肚菌栽培周期内,羊肚菌可能是影响土壤酶活性的最主要因素。由于无法预测羊肚菌是否出菇,选取的样本有很大的不出菇风险,本人也测定到几组未出菇羊肚菌栽培大田的土壤酶活性,但限于羊肚菌品种和土壤类型与本研究不同,不予列出,但可以作为参考,各种酶活性变化趋势均与本研究结果不同。目前尚未有研究报道羊肚菌生长过程内的土壤酶活性的动态变化。本研究测定了羊肚菌常规栽培模式下,羊肚菌生长过程内的几种主要参与碳循环的土壤酶活性的动态变化,并分析其变化规律。这将有利于了解羊肚菌在生长周期内的生长状态,为选择更合适的栽培条件提供理论支持。
1 材料与方法
1.1 样品采集
选取位于绵阳市梓潼县油坪村一队的2块面积近似的相互独立的水稻田A和B,A、B互为对照,均采用羊肚菌的常规栽培模式栽培同一羊肚菌菌种。分别于种植前、种植后20 d、40 d、60 d、80 d(可见少量原基)、100 d(广泛出菇),采用取土器采集0~15 cm土层的样品,每块样地按S型路线随机采集15个以上重复样品。土壤采集后立刻筛去石块、可见植物残体和土壤动物等,在室内避光处自然风干,然后用四分法取适量土壤稍加研磨后速过60目筛,充分混匀并装袋,立即测试分析;再取适量已过60目的样品,进一步过100目筛后用于土壤总碳及其理化性质测定。
采集少量种植后20 d、40 d、60 d后地表土壤,置于培养皿中,用清水轻轻洗涤至能肉眼看见羊肚菌菌丝,发现羊肚菌菌丝密度大致相同。
1.2 土壤酶的测定
采用3,5-二硝基水杨酸比色法定期测定土壤蔗糖酶、淀粉酶、纤维素酶活性,高锰酸钾滴定法测定过氧化氢酶活性。蔗糖酶、淀粉酶、纤维素酶活性测定需设置无机质对照和无土壤对照,并绘制相应的酶标曲线。过氧化氢酶活性测定需设置无土壤对照。
1.2.1 蔗糖酶活性的测定
称取5.000 g风干土壤样品,置于50 mL三角瓶中,加入15 mL8%蔗糖溶液、5 mL的pH5.5的磷酸缓冲液以及5滴甲苯;完全摇匀后,在恒温培养箱中37℃培养24 h。培养完毕后,迅速过滤,吸取1 mL滤液到容量瓶中,加入3 mL的3,5-二硝基水杨酸,沸腾水浴加热5 min,立刻把容量瓶移到自流下冷却3 min,用蒸馏水定容至10 mL,于分光光度计波长508 nm处进行比色。蔗糖酶活性以24 h,1 g干土生成葡萄糖毫克数表示,蔗糖酶活性(H1)公式为:

式中:a为实验组得到的葡萄糖毫克数;b为无机质对照组得到的葡萄糖毫克数;c为无土壤对照组得到的葡萄糖毫克数。
1.2.2 淀粉酶活性的测定
称取5.000 g风干土壤样品,置于50 mL三角瓶中,加入15 mL的pH5.6乙酸-磷酸缓冲液,再加入0.5 mL甲苯,摇匀放置15 min。再加入10 mL的2%淀粉,摇匀,放置于37℃恒温箱中培养24 h。培养结束后,用致密的滤纸进行过滤,取1 mL滤液到容量瓶中,加入2 mL的3,5-二硝基水杨酸,沸腾水浴加热5 min,立刻把容量瓶移到自流下冷却3 min,用蒸馏水定容至10 mL,于分光光度计波长508 nm处进行比色。淀粉酶活性以24 h,1 g干土生成麦芽糖毫克数表示,淀粉活性(H2)公式为:
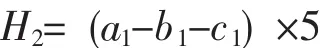
注:a1为实验组得到的麦芽糖毫克数;b1为无机质对照组得到的麦芽糖毫克数;c1为无土壤对照组得到的麦芽糖毫克数。
1.2.3 纤维素酶活性的测定
称取5.000 g风干土壤样品,置于50 mL三角瓶中,加入1%羧甲基纤维素溶液5 mL、pH5.5醋酸盐缓冲液15 mL以及甲苯1 mL,在培养箱中37℃培养72 h(培养过程中分时间段摇瓶2次)。培养结束后,用滤纸过滤,吸取1mL滤液到容量瓶中,加入3 mL的3,5-二硝基水杨酸,沸腾水浴加热 5 min,立刻把容量瓶移到自流下冷却3 min,用蒸馏水定容至10 mL,于分光光度计波长540 nm处进行比色。纤维素酶活性以72 h,1 g干土生成葡萄糖毫克数表示,纤维素活性(H3)公式为:

式中:a2为实验组得到的葡萄糖毫克数;b2为无机质对照组得到的葡萄糖毫克数;c2为无土壤对照组得到的葡萄糖毫克数。
1.2.4 过氧化氢酶活性的测定
称取2.000 g风干土壤样品,置于100 mL三角瓶中,注入蒸馏水40 mL以及0.3%过氧化氢溶液5 mL,震荡20 min后,加入1.5 mol·L-1H2SO45 mL,悬液用慢速型滤纸过滤后,移液器吸取滤液25 mL,用0.02 mol·L-1高锰酸钾溶液滴定,终点为淡粉红色。过氧化氢酶活性以20 min,1 g干土消耗的0.02 mol·L-1KMnO4体积数表示,过氧化氢酶活性(H4)公式为:
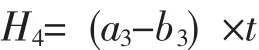
式中:a3为滴定25 mL原始的过氧化氢混合液所消耗的高锰酸钾量;b3为滴定土壤滤液所消耗的高猛酸钾量;t为高锰酸钾滴定度的校正值。
1.3 土壤总碳测定
取适量过100目筛的土壤样品,使用Vario ELCUBE元素分析仪测定土壤总碳含量。
1.4 土壤理化性质测定
采用常规分析法测定土壤基本理化指标:采用重铬酸钾容量法测定有机质含量;采用原子吸收分光光度计法测定速效钾含量;采用碳酸氢钠浸提和钼锑抗比色法测定有效磷含量。

表1 播种前后土壤理化指标Tab.1 Soil physicochemical indic before and after planting
2 结果与分析
2.1 土壤酶的动态变化
2.1.1 土壤蔗糖酶的动态变化
采用3,5-二硝基水杨酸比色法定期测定水稻田A和B内土壤蔗糖酶的活性,发现蔗糖酶活性的变化趋势大致相同,均是先增高后降低,见图1。

图1 水稻田A、B内土壤蔗糖酶活性的变化Fig.1 Variation of invertase activity in soil of rice field A and B
从图1中可以发现,播种前水稻田A的土壤蔗糖酶活性远远高于水稻田B的土壤蔗糖酶活性。播种羊肚菌后,2块水稻田内的土壤蔗糖酶活性随时间延长而升高,播种后20 d内土壤蔗糖酶活性显著升高,水稻田A的土壤蔗糖酶活性较播种前升高了2.6 mg·g-1,水稻田B的土壤蔗糖酶活性较播种前升高了3.3 mg·g-1,可能是羊肚菌菌丝在土壤内生物量快速增加,同时分泌出越来越多的蔗糖酶;在播种60 d左右时,蔗糖酶活性达到峰值,水稻田A的土壤蔗糖酶活性较播种前升高了3.6 mg·g-1,水稻田B的土壤蔗糖酶活性较播种前升高了4.5 mg·g-1;播种60 d后,蔗糖酶活性随时间的升高而降低;播种后100 d时(已出菇)的土壤蔗糖酶活性已低于种植前的土壤酶活性,此时水稻田A的土壤蔗糖酶活性较播种前降低了1.0 mg·g-1,水稻田B的土壤蔗糖酶活性较播种前降低了1.1 mg·g-1。综上表明,羊肚菌大田栽培下土壤蔗糖酶活性的变化趋势基本一致,不因栽培前土壤蔗糖酶活性的高低而发生变化。
2.1.2 土壤淀粉酶的动态变化
水稻田A、B内土壤淀粉酶活性的变化见图2。淀粉酶活性的变化趋势大致相同,皆是先降低后升高再降低。播种前水稻田B的土壤淀粉酶活性高于水稻田A的土壤淀粉酶活性。
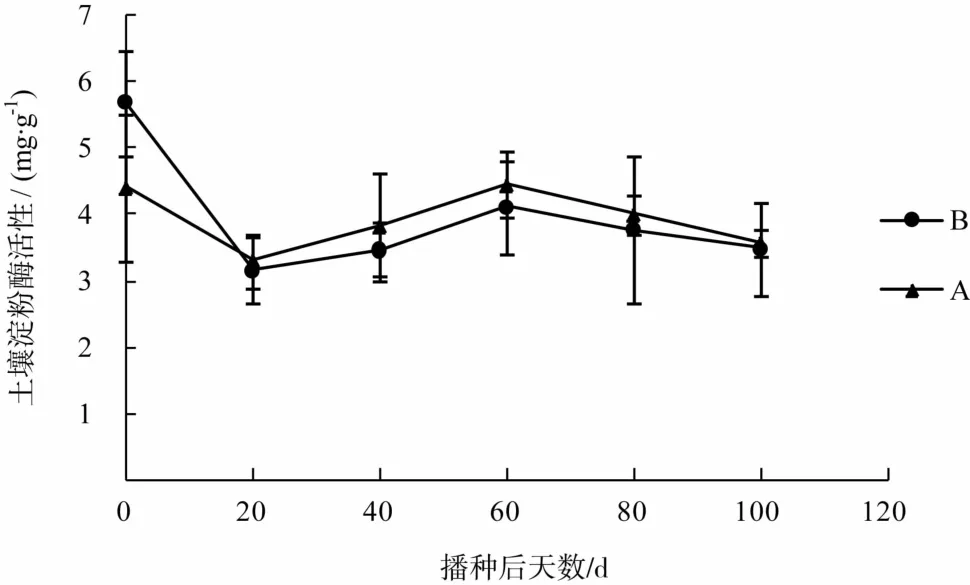
图2 水稻田A、B内土壤淀粉酶活性的变化Fig.2 Variation of amylase activity in soil of rice field A and B
从播种前到播种后20 d,水稻田A和B的土壤淀粉酶活性均显著降低,且其活性降低到非常相近的程度,原因可能是随着温度的降低,土壤内微生物数量(除羊肚菌)减少,从而导致淀粉酶活性降低。播种20 d后,土壤淀粉酶活性开始逐渐升高;到播种60 d左右,淀粉酶活性达到峰值,此时水稻田A的土壤淀粉酶活性较播种后20 d升高了0.95 mg·g-1,水稻田B的土壤淀粉酶活性较播种后20 d升高了1.1 mg·g-1,淀粉酶活性的升高量十分接近,说明播种20 d后,羊肚菌菌丝开始以淀粉为主要碳源来源之一;播种后60 d到播种后100 d,土壤淀粉酶活性逐渐降低,播种后100 d时,水稻田A的土壤淀粉酶活性为3.56 mg·g-1,水稻土B的土壤淀粉酶活性为3.48 mg·g-1,且均低于种植前土壤酶活性。同样地,在两块相互独立的大田栽培相同羊肚菌,其土壤淀粉酶活性的变化规律也趋于一致;尤其是淀粉酶活性在种植后20 d左右回到同样的起点,此后开始基本一致的规律性变化;或许淀粉酶活性的规律性变化可以准确反映羊肚菌在土壤中对碳源的吸收情况。
2.1.3 土壤纤维素酶的动态变化
纤维素酶活性的变化趋势和蔗糖酶活性的变化趋势相同,皆是先升高后降低,见图3。水稻田B的土壤纤维素酶活性略高于水稻田A的土壤纤维素酶活性。

图3 水稻田A、B内土壤纤维素酶活性的变化Fig.3 Variation of cellulase activity in soil of rice field A and B
播种前到播种后60 d左右,土壤纤维素酶活性变化趋于直线,对播种前60 d水稻田A和B的土壤纤维素酶活性做线性回归分析,得到水稻田A的纤维素酶活性变化趋于直线方程y=0.0136x+0.176,水稻田B的纤维素酶活性变化趋于直线方程y= 0.0127x+0.298,可以看出2个方程的斜率十分接近;播种60 d后,纤维素酶活性显著下降;播种100 d后纤维素酶活性达到最低。土壤纤维素酶活性的动态变化同样具有规律性。
2.1.4 土壤过氧化氢酶的动态变化
水稻田A、B内土壤过氧化氢酶活性的变化见图4。过氧化氢酶活性的变化趋势与淀粉酶的变化趋势恰恰相反。水稻田A的土壤过氧化氢酶活性高于水稻田B的土壤过氧化氢酶活性。

图4 水稻田A、B内土壤过氧化氢酶活性的变化Fig.4 Variation of catalase activity in soil of rice field A and B
播种前到播种后20 d左右,土壤过氧化氢酶活性显著升高,此时羊肚菌菌丝在土壤中的生物量显著增加;播种后20 d至播种后60 d左右,过氧化氢酶活性逐渐降低,原因一是羊肚菌菌丝的生物量逐渐达到饱和,二是部分菌丝出现老化现象,特别是土壤表层菌丝衰老明显并发生自溶,致使菌丝活性降低,从而促使菌丝分泌的过氧化氢酶数量减少;播种后80 d至100 d,土壤过氧化氢酶活性逐渐增加,这一时期,菌丝活性复苏,羊肚菌菌丝陆续扭结生成原基,原基继续生长得到羊肚菌子实体,在此过程中,生物氧化还原反应十分活跃。
2.2 土壤总碳的动态变化
使用元素分析仪定期测定水稻田A和B内土壤总碳含量,发现其变化趋势大致为先升高再降低后升高,见图5。水稻田A内土壤总碳高于水稻图B内土壤总碳含量。
播种前至播种后40 d,水稻田A和B土壤总碳均呈显著升高,40 d左右,水稻田A内土壤总碳含量达到峰值;播种40 d后,水稻田A内土壤总碳含量呈直线下降,80 d左右降到低谷,随后含量开始升高;而播种40 d后,水稻田B内土壤总碳仅略微减少,至播种60 d后又开始升高。
2.3 土壤总碳与土壤酶活性的相关关系
利用SPSS软件对不同土壤酶活性数据与土壤总碳进行相关性分析。发现水稻田A内,土壤总碳与蔗糖酶之间呈显著正相关(0.05水平显著);与淀粉酶之间存在某种负相关关系,与纤维素酶和过氧化氢酶之间存在一定的正相关关系,但不显著。在水稻田B内,发现土壤总碳与过氧化氢酶之间呈显著正相关(0.05水平显著);同样与淀粉酶之间存在某种负相关关系,与纤维素酶和蔗糖酶之间存在一定的正相关关系,但不显著。
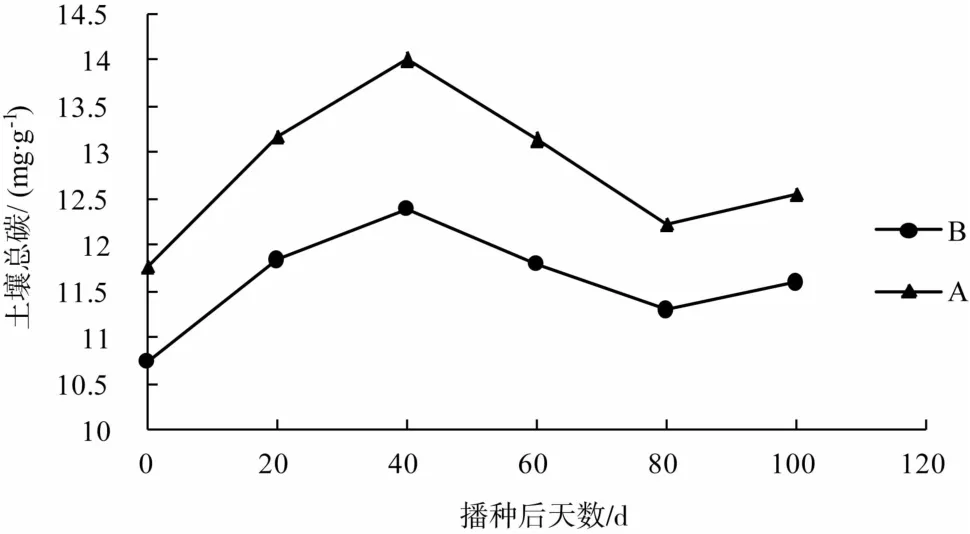
图5 水稻田A、B内土壤总碳的变化Fig.5 Variation of total carbon in soil of rice field A and B
2.4 播种前和播种后100 d土壤理化指标变化
从表1可以看出,播种后100 d时水稻田A土壤有机质含量、速效钾含量低于种植前,而土壤有效磷含量则高于种植前。
3 讨论
许多研究表明,土壤酶活性随季节变化有明显规律[13],不同性质的酶类有些许区别,但均是冬季活性最低,春季上升,夏秋季活性较高[14-16]。而羊肚菌的栽培时间是从秋末至初春,本研究结果表明出菇羊肚菌栽培大田内土壤蔗糖酶、淀粉酶、纤维素酶、过氧化氢酶活性随着种植时间的延长呈现出其独有的规律性的变化,蔗糖酶和纤维素酶活性随时间的延长先升高后降低,淀粉酶活性则是先降低再升高后降低,而过氧化氢酶活性的变化趋势和淀粉酶活性变化趋势恰恰相反。
种植前土壤酶活性水平的高低并不影响羊肚菌种植后土壤酶的变化趋势,各个酶活性随时间的延长,其变化程度也十分接近,且未出菇羊肚菌栽培大田内土壤酶的变化可能与出菇羊肚菌栽培大田的土壤酶变化规律迥然不同,所以测定土壤酶活性可能作为检验羊肚菌生长过程中是否正常的1种手段。综合分析这些土壤酶活性的规律性变化,土壤酶活性的动态变化也许可以反映羊肚菌的不同生长进程。蔗糖作为羊肚菌的最适碳源[17-18]之一。土壤蔗糖酶活性可以反映羊肚菌对碳源的吸收状况,再结合淀粉酶、纤维素酶和过氧化氢酶活性的变化趋势分析,羊肚菌从种植前至播种后20 d左右,羊肚菌菌丝生物量急剧升高;播种后20 d左右,羊肚菌开始将淀粉作为主要碳源之一;播种后60 d左右,各酶活达到峰值,且开始降低,可能是羊肚菌菌丝对碳源的需求开始降低,此时羊肚菌菌丝可能即将完成营养生长阶段;种植后80 d后,土表陆续出现原基,并逐渐分化成子实体,同时对应过氧化氢酶活性逐渐升高。选择合适的时机人工加入养分也许可以缩短羊肚菌的栽培周期,甚至提高产量。
播种后100 d,土壤蔗糖酶活性低于种植前土壤蔗糖酶活性,且有机质含量、速效钾含量也低于种植前,说明羊肚人工栽培可能会降低部分土壤肥力,这与实际生产中连续两年在同一块土地栽培羊肚菌产量略有下降(尤其表现在子实体个头较小)相呼应。而播种后100 d,土壤有效磷含量高于种植前,说明羊肚菌大田栽培同样可能提升部分土壤肥力,实际农作过程中,羊肚菌种植后的大田轮作其他作物,明显发现作物长势较于普通大田更好。羊肚菌人工栽培需要与农作物栽培进行轮作,合理施肥,以保持土壤肥力均衡。
相关性分析表明,羊肚菌常规栽培模式下,土壤总碳与土壤蔗糖酶活性之间呈现很强的正相关性,这与前人的研究结论一致[19-20];水稻田B内杂草数量较多,可能是草本植物根系分泌物对过氧化氢酶活性有较大影响。
[1]Kong H,Lee D.Changes of soil enzyme activities by simulat ed acid and nitrogen deposition[J].Chemistry and Ecology, 1998,142(1):123-131.
[2孙海,张亚玉,宋晓霞.人参土壤养分与土壤酶研究进展[J].中国林副特产,2009(5):87-90.
[3]刘善江,夏雪,陈桂梅,等.土壤酶的研究进展[J].中国农学报,2011,27(21):1-7.
[4]马文文,姚拓,靳鹏,等.荒漠草原2种植物群落土壤微生物及土壤酶特征[J].中国沙漠,2014,34(1):176-183.
[5]郭世华.矿区植被恢复方式和施肥处理对土壤酶活性的影响[D].太原:山西大学,2012.
[6]高彦波,翟鹏辉,谭德远.土壤酶活性与土壤肥力的关系研究进展[J].安徽农业科学,2015(6):100-101.
[7]杨娟娟,魏成熙,吴健伟,等.铅污染土壤有机肥对土壤酶活性的影响[J].贵州农业科学,2009,37(5):99-101.
[8]洪常青,何忠俊,鱼海霞.三江并流区暗棕壤酶活性特征研究[J].云南农业大学学报:自然科学,2013,28(6):857-864.
[9]Frankeberger WT,Johanson JB.Method of measuring invertase activity in soils[J].Plant and Soil,1983,74(3):301-311.
[10]孔爱辉,吴京科.我国土壤水解酶活性研究进展[J].现代农业科技,2012(16):251-253.
[11]Ma TW,Xiao BY,Yang FC.Establishment of cultivating strategy for highly aggregated mycelia of Morchella esculenta in a stirred-tank bioreactor[J].Bioprocess and Biosystems Engineering,2012,35(9):1627-1635.
[12]张猛.土壤管理方式对李园土壤影响研究[D].成都:四川农业大学,2004.
[13]万忠梅,宋长春.土壤酶活性对生态环境的响应研究进展[J].土壤通报,2009(4):951-956.
[14]高雪峰,张功,卢萍.短花针茅草原土壤的酶活性及其生态因子的季节动态变化研究[J].内蒙古师范大学学报:自然科学版,2006,35(2):226-229.
[15]Fennern,Freemanc,Reynoldsb.Observations of asea-sonally shifting thermal optimum in peatland carbon-cycling processes:implications for the global carbon cycle and soil enzyme method-ologies[J].Soil Biology&Biochemistry,2005(37):1814-1821.
[16]张银龙,林鹏.秋茄红树林土壤酶活性时空动态[J].厦门大学学报:自然科学版,1999,38(1):129-136.
[17]邢增涛,孙芳芳,刘景圣.尖顶羊肚菌液体培养条件的研究[J].食用菌学报,2004,11(4):38-43.
[18]刘达玉,王慧超,郑林用,等.武陵山羊肚菌液体培养条件优化研究[J].湖北农业科学,2015,54(2):405-408.
[19]吕国红,周广胜,赵先丽,等.土壤碳氮与土壤酶相关性研究进展[J].辽宁气象,2005(2):6-8.
[20]赵仁竹,汤洁,梁爽,等.吉林西部盐碱田土壤蔗糖酶活性和有机碳分布特征及其相关关系[J].生态环境学报,2015(2):244-249.
Research on Variation of Soil Enzyme in Morchella Growth Process
ZHAO Miao,ZHANG Neng,XIE Jing-Yi,HE Xin-Sheng
(College of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621010,China)
s:The purpose of this study was to determine the soil enzyme activity and the total carbon in Morchella growth process, and analyzed its changing regulation,to provide theoretical support for the research of artificial cultivation of Morchella.3,5-dinitrosalicylic acid colorimetry was used to determine the soil invertase activity,soil amylase activity and soil cellulase activity, the potassium permanganate titrimetric method was used to determine the catalase activity,and the instrumental analysis methods was used to determine the soil total carbon.After sowing Morchella in the field,the results showed that the invertase activity and cellulase activity were reduced after the first increase in the trend,amylase activity showed first decreased and then increased then decreased trend,while,the change trend of catalase and amylase is on the contrary,and the degree of changes of enzyme activity(except catalase activity)were very close.The soil enzyme activity along with the increase of Morchella planting time showed regular changes,and the level of pre-plant soil enzyme activity did not affect the change rule of enzyme activity afte the cultivation of Morchella.
Morchella;soil enzyme;total carbon;change regulation
S646.9
A
1003-8310(2017)02-0041-06
10.13629/j.cnki.53-1054.2017.02.012
赵苗(1991-),男,在读硕士研究生,主要研究方向为食(药)用菌栽培研究。E-mail:907790713@qq.com
*通信作者:贺新生(1965-),男,本科,教授,主要从事大型真菌分类及栽培研究。E-mail:hexinsheng@swust.edu.cn
2017-01-20
